文档内容
高三联考化学
本试卷满分100分,考试用时75分钟。
注意事项:
1. 答题前,考生务必将自己的姓名、考生号、考场号、座位号填写在答题卡上。
2. 回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑。如需
改动,用橡皮擦干净后,再选涂其他答案标号。回答非选择题时,将答案写在答题卡上。写在
本试卷上无效。
3. 考试结束后,将本试卷和答题卡一并交回。
4. 本试卷主要考试内容:高考全部内容。
5. 可能用到的相对原子质量:H1C12N14O16S32Ca40Cr52Fe56
一、选择题:本题共14小题,每小题3分,共42分。在每小题给出的四个选项中,只有一项
是符合题目要求的。
1.苗画、凤凰纸扎、踏虎凿花、土家族打溜子都是著名的非物质文化遗产,下列说法中错误的是
A.苗画制作时,常用到赭石(主要成分为Fe O ),Fe O 属于碱性氧化物
2 3 2 3
B.纸扎工艺中用到的材料有竹篾和木棍等,竹篾的主要成分为纤维素
C.踏虎凿花是用刻刀凿制完成的,碳钢刀是常用的一种刻刀,碳钢属于合金
D.土家族打溜子需要使用鼓,牛皮鼓面的主要成分为蛋白质,牛皮鼓面能耐酸碱腐蚀
2.下列化学用语或图示表达错误的是
ClO−
A. 4的空间结构模型:
p−pπ
B. 键电子云轮廓图:
2p
y
C.氮原子 电子云图:
D.CH CH OH中,碳原子与氧原子之间形成的共价键类型为sp3−sp3σ键
3 2
3.化学与生活息息相关。下列项目与所述化学原理没有关联的是
选项 项目 化学原理
A 用明矾溶液清除铜镜表面的铜锈 明矾溶液显酸性
B 福尔马林用于浸制标本 福尔马林具有氧化性
C 用铝粉和氢氧化钠溶液疏通厨卫管 铝粉与NaOH溶液反应放热并产生H
2
道
D 医疗上进行胃部造影前,BaSO 作 BaSO 不溶于水,不与胃酸反应
4 4
患者服用的“钡餐”
4.下列表述错误的是
A.1s22s22p1→1s22s22p1过程中形成的是发射光谱
x y
B.CO2−空间结构为平面正三角形
3
C.NH+
不能作为配合物的配位体
4
D.NCl 中N−Cl键的键长比CCl 中C−Cl键的键长短
3 4
第 1 页
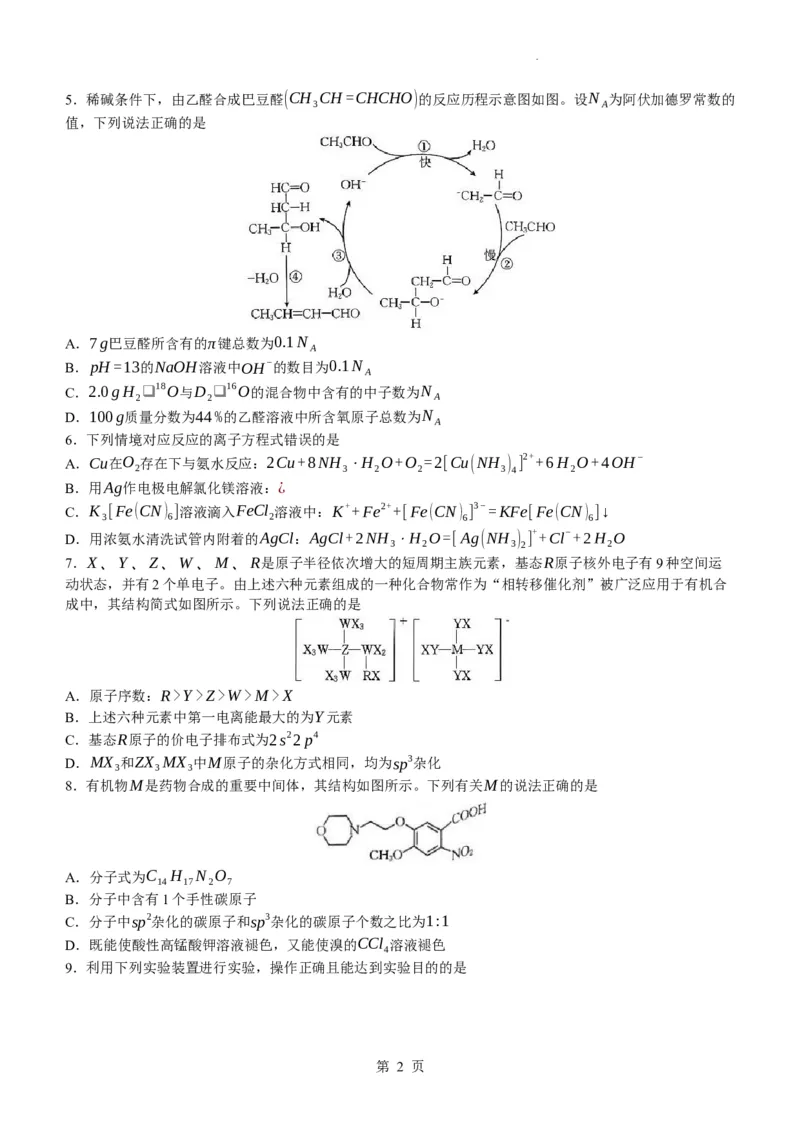
学科网(北京)股份有限公司5.稀碱条件下,由乙醛合成巴豆醛(CH CH=CHCHO)的反应历程示意图如图。设N 为阿伏加德罗常数的
3 A
值,下列说法正确的是
A.7g巴豆醛所含有的π键总数为0.1N
A
B.pH=13的NaOH溶液中OH−的数目为0.1N
A
C.2.0gH ❑ 18O与D ❑ 16O的混合物中含有的中子数为N
2 2 A
D.100g质量分数为44%的乙醛溶液中所含氧原子总数为N
A
6.下列情境对应反应的离子方程式错误的是
A.Cu在O 存在下与氨水反应:2Cu+8NH ⋅H O+O =2[Cu(NH ) ] 2++6H O+4OH−
2 3 2 2 3 4 2
B.用Ag作电极电解氯化镁溶液:¿
C.K [Fe(CN) ]溶液滴入FeCl 溶液中:K++Fe2++[Fe(CN) ] 3−=KFe[Fe(CN) ]↓
3 6 2 6 6
D.用浓氨水清洗试管内附着的AgCl:AgCl+2NH ⋅H O=[Ag(NH ) ] ++Cl−+2H O
3 2 3 2 2
7.X、Y、Z、W、M、R是原子半径依次增大的短周期主族元素,基态R原子核外电子有9种空间运
动状态,并有2个单电子。由上述六种元素组成的一种化合物常作为“相转移催化剂”被广泛应用于有机合
成中,其结构简式如图所示。下列说法正确的是
A.原子序数:R>Y>Z>W>M>X
B.上述六种元素中第一电离能最大的为Y元素
C.基态R原子的价电子排布式为2s22p4
D.MX 和ZX MX 中M原子的杂化方式相同,均为sp3杂化
3 3 3
8.有机物M是药物合成的重要中间体,其结构如图所示。下列有关M的说法正确的是
A.分子式为C H N O
14 17 2 7
B.分子中含有1个手性碳原子
C.分子中sp2杂化的碳原子和sp3杂化的碳原子个数之比为1:1
D.既能使酸性高锰酸钾溶液褪色,又能使溴的CCl 溶液褪色
4
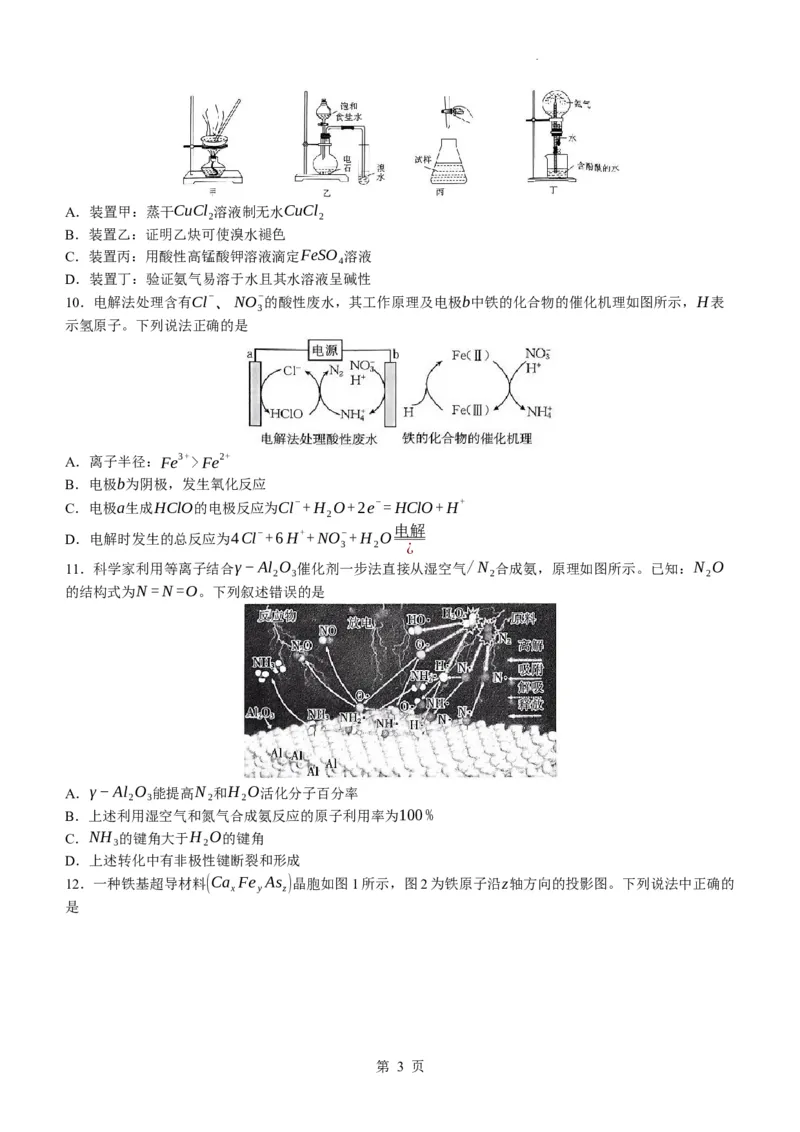
9.利用下列实验装置进行实验,操作正确且能达到实验目的的是
第 2 页
学科网(北京)股份有限公司A.装置甲:蒸干CuCl 溶液制无水CuCl
2 2
B.装置乙:证明乙炔可使溴水褪色
C.装置丙:用酸性高锰酸钾溶液滴定FeSO 溶液
4
D.装置丁:验证氨气易溶于水且其水溶液呈碱性
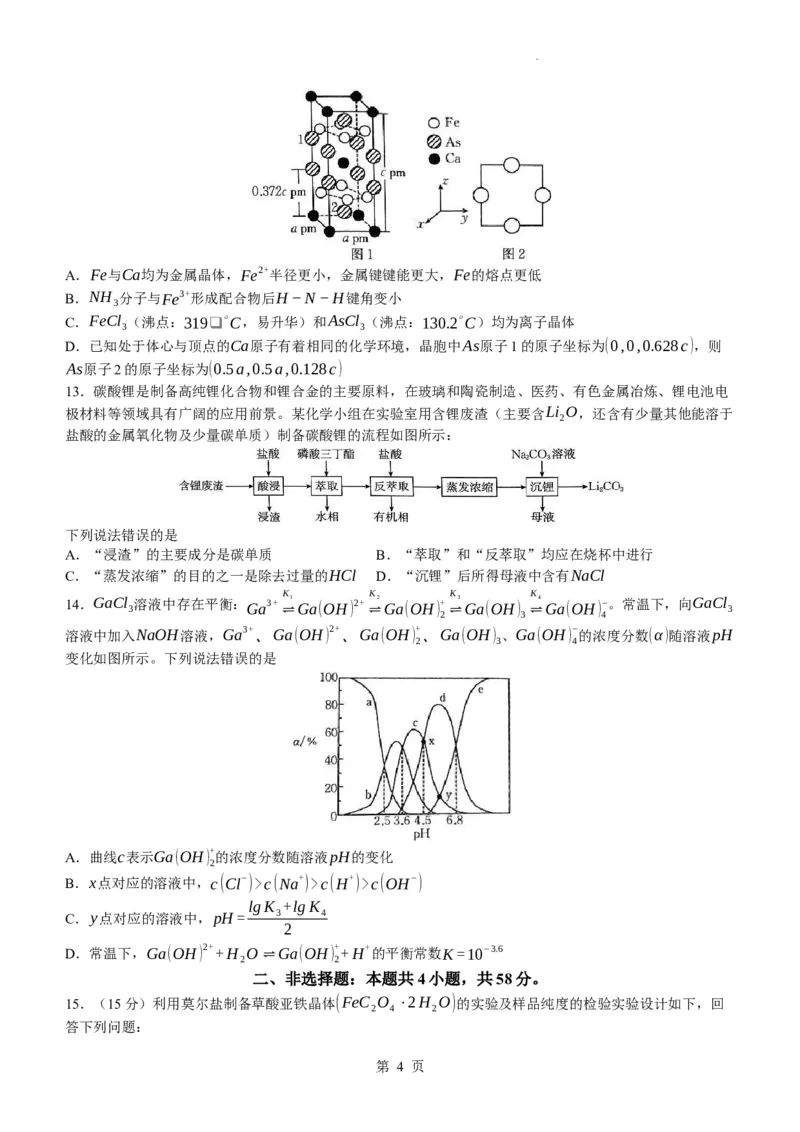
10.电解法处理含有Cl−、NO−的酸性废水,其工作原理及电极b中铁的化合物的催化机理如图所示,H表
3
示氢原子。下列说法正确的是
A.离子半径:Fe3+>Fe2+
B.电极b为阴极,发生氧化反应
C.电极a生成HClO的电极反应为Cl−+H O+2e−=HClO+H+
2
电解
D.电解时发生的总反应为4Cl−+6H++NO−+H O
3 2 ¿
11.科学家利用等离子结合γ−Al O 催化剂一步法直接从湿空气/N 合成氨,原理如图所示。已知:N O
2 3 2 2
的结构式为N=N=O。下列叙述错误的是
A.γ−Al O 能提高N 和H O活化分子百分率
2 3 2 2
B.上述利用湿空气和氮气合成氨反应的原子利用率为100%
C.NH 的键角大于H O的键角
3 2
D.上述转化中有非极性键断裂和形成
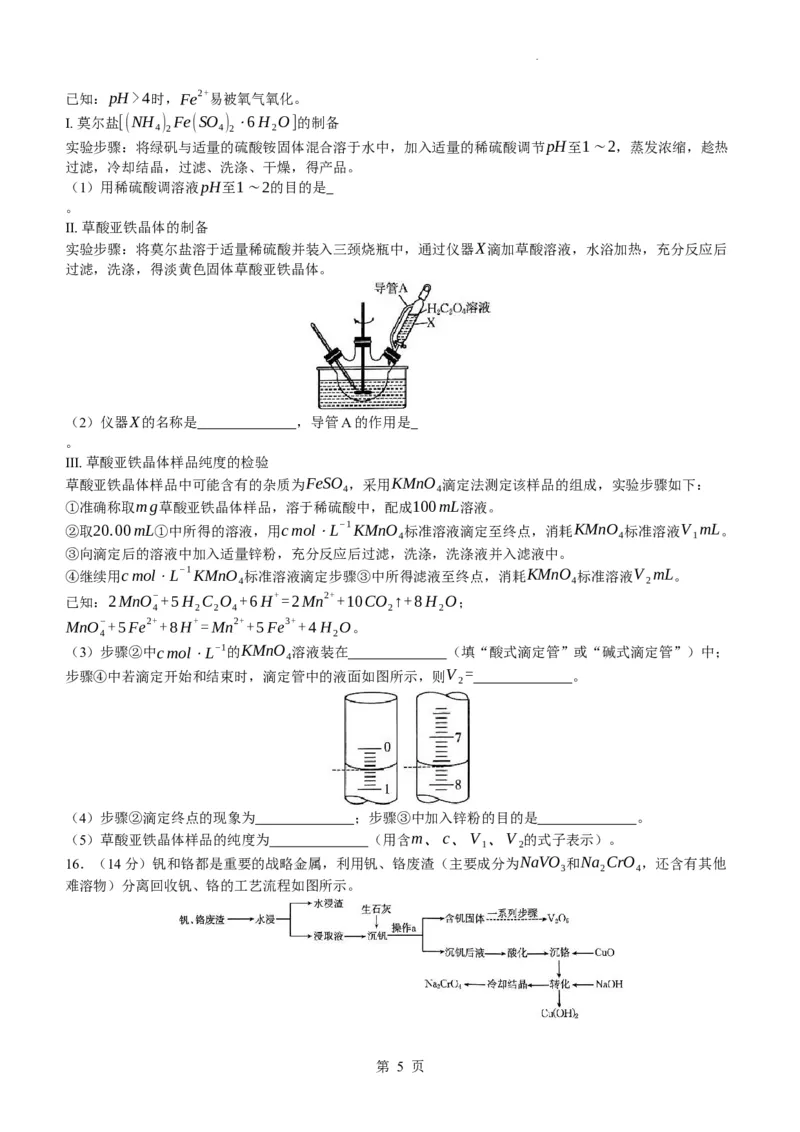
12.一种铁基超导材料(Ca Fe As )晶胞如图1所示,图2为铁原子沿z轴方向的投影图。下列说法中正确的
x y z
是
第 3 页
学科网(北京)股份有限公司A.Fe与Ca均为金属晶体,Fe2+半径更小,金属键键能更大,Fe的熔点更低
B.NH 分子与Fe3+形成配合物后H−N−H键角变小
3
C.FeCl (沸点:319❑∘C,易升华)和AsCl (沸点:130.2∘C)均为离子晶体
3 3
D.已知处于体心与顶点的Ca原子有着相同的化学环境,晶胞中As原子1的原子坐标为(0,0,0.628c),则
As原子2的原子坐标为(0.5a,0.5a,0.128c)
13.碳酸锂是制备高纯锂化合物和锂合金的主要原料,在玻璃和陶瓷制造、医药、有色金属冶炼、锂电池电
极材料等领域具有广阔的应用前景。某化学小组在实验室用含锂废渣(主要含Li O,还含有少量其他能溶于
2
盐酸的金属氧化物及少量碳单质)制备碳酸锂的流程如图所示:
下列说法错误的是
A.“浸渣”的主要成分是碳单质 B.“萃取”和“反萃取”均应在烧杯中进行
C.“蒸发浓缩”的目的之一是除去过量的HCl D.“沉锂”后所得母液中含有NaCl
K K K K
14.GaCl 3 溶液中存在平衡: Ga3+ ⇌ 1 Ga(OH) 2+ ⇌ 2 Ga(OH) + ⇌ 3 Ga(OH) ⇌ 4 Ga(OH) −。常温下,向GaCl 3
2 3 4
溶液中加入NaOH溶液,Ga3+ 、Ga(OH) 2+ 、Ga(OH) + 、Ga(OH) 、Ga(OH) − 的浓度分数(α)随溶液pH
2 3 4
变化如图所示。下列说法错误的是
+
A.曲线c表示Ga(OH) 的浓度分数随溶液pH的变化
2
B.x点对应的溶液中,c(Cl−)>c(Na+)>c(H+)>c(OH−)
lgK +lgK
C.y点对应的溶液中,pH= 3 4
2
D.常温下,Ga(OH) 2++H O⇌Ga(OH) ++H+ 的平衡常数K=10−3.6
2 2
二、非选择题:本题共4小题,共58分。
15.(15分)利用莫尔盐制备草酸亚铁晶体(FeC O ⋅2H O)的实验及样品纯度的检验实验设计如下,回
2 4 2
答下列问题:
第 4 页
学科网(北京)股份有限公司已知:pH>4时,Fe2+易被氧气氧化。
Ⅰ. 莫尔盐[(NH ) Fe(SO ) ⋅6H O]的制备
4 2 4 2 2
实验步骤:将绿矾与适量的硫酸铵固体混合溶于水中,加入适量的稀硫酸调节pH至1∼2,蒸发浓缩,趁热
过滤,冷却结晶,过滤、洗涤、干燥,得产品。
(1)用稀硫酸调溶液pH至1∼2的目的是
。
Ⅱ. 草酸亚铁晶体的制备
实验步骤:将莫尔盐溶于适量稀硫酸并装入三颈烧瓶中,通过仪器X滴加草酸溶液,水浴加热,充分反应后
过滤,洗涤,得淡黄色固体草酸亚铁晶体。
(2)仪器X的名称是 ,导管A的作用是
。
Ⅲ. 草酸亚铁晶体样品纯度的检验
草酸亚铁晶体样品中可能含有的杂质为FeSO ,采用KMnO 滴定法测定该样品的组成,实验步骤如下:
4 4
①准确称取mg草酸亚铁晶体样品,溶于稀硫酸中,配成100mL溶液。
②取20.00mL①中所得的溶液,用cmol⋅L−1KMnO 标准溶液滴定至终点,消耗KMnO 标准溶液V mL。
4 4 1
③向滴定后的溶液中加入适量锌粉,充分反应后过滤,洗涤,洗涤液并入滤液中。
④继续用cmol⋅L−1KMnO 标准溶液滴定步骤③中所得滤液至终点,消耗KMnO 标准溶液V mL。
4 4 2
已知:2MnO−+5H C O +6H+=2Mn2++10CO ↑+8H O;
4 2 2 4 2 2
MnO−+5Fe2++8H+=Mn2++5Fe3++4H O。
4 2
(3)步骤②中cmol⋅L−1的KMnO 溶液装在 (填“酸式滴定管”或“碱式滴定管”)中;
4
步骤④中若滴定开始和结束时,滴定管中的液面如图所示,则V = 。
2
(4)步骤②滴定终点的现象为 ;步骤③中加入锌粉的目的是 。
(5)草酸亚铁晶体样品的纯度为 (用含m、c、V 、V 的式子表示)。
1 2
16.(14分)钒和铬都是重要的战略金属,利用钒、铬废渣(主要成分为NaVO 和Na CrO ,还含有其他
3 2 4
难溶物)分离回收钒、铬的工艺流程如图所示。
第 5 页
学科网(北京)股份有限公司已知:常温下,K (BaCO )=5.1×10−9 ,K (BaCrO )=1.2×10−10 ,K (CuCrO )=3.6×10−6 。
sp 3 sp 4 sp 4
回答下列问题:
(1)基态铬原子价电子轨道表示式为 。
(2)钒、铬废渣“水浸”前,先要进行粉碎处理,为提高浸取效率,还可采取的措施有 (任
写一点)。
(3)“沉钒”的含钒产物为钒酸钙(CaO⋅V O ),该过程中发生反应的化学方程式是
2 5
。
(4)“沉铬”时,铬转化为CuCrO 沉淀,“转化”过程中发生反应的离子方程式为 。
4
(5)向“沉钒后液”中加入足量BaCO ,可将其中的铬转化为BaCrO 沉淀,铬的理论转化率为
3 4
(保留三位有效数字)%。
(6)复合材料氧铬酸钙的立方晶胞如图所示。
①该晶体的化学式为 。
②已知该晶体的密度为ρg⋅cm−3,N 为阿伏加德罗常数的值,则相邻Ca2+与Cr3+之间的最短距离为
A
pm(列出计算式即可)。
17.(14分)有机物G是一种用于治疗肺动脉高压的药物,其一种合成路线如下:
回答下列问题:
(1)有机物D分子中含有的官能团的名称为 。
(2)F分子中N原子的杂化方式为 。
(3)C的分子式为C H O,其结构简式为 。
13 10
(4)有机物H是D的同分异构体,同时满足下列条件的H的结构有 种,写出其中核磁共振氢
谱峰面积之比为1:2:2:2:2:2:2:1的结构简式: 。
①除苯环外,不含其他环状结构;
②能发生银镜反应,不能与FeCl 发生显色反应;
3
③在碱性条件下水解生成碳原子数相等的两种有机物,所得产物经酸化后,一种产物既能发生银镜反应,又
能与FeCl 发生显色反应,另一种产物分子的苯环上仅有一个侧链。
3
CH CH=CH 、CH OH
3 2 3
(5)设计以 和 为原料制备化合物 的合成路
线。(无机试剂和有机溶剂任用,合成路线示例见本题题干)
18.(15分)2023年7月全球首枚液氧甲烷火箭——朱雀二号在酒泉卫星发射中心发射成功。根据所学知
识,回答下列问题:
第 6 页
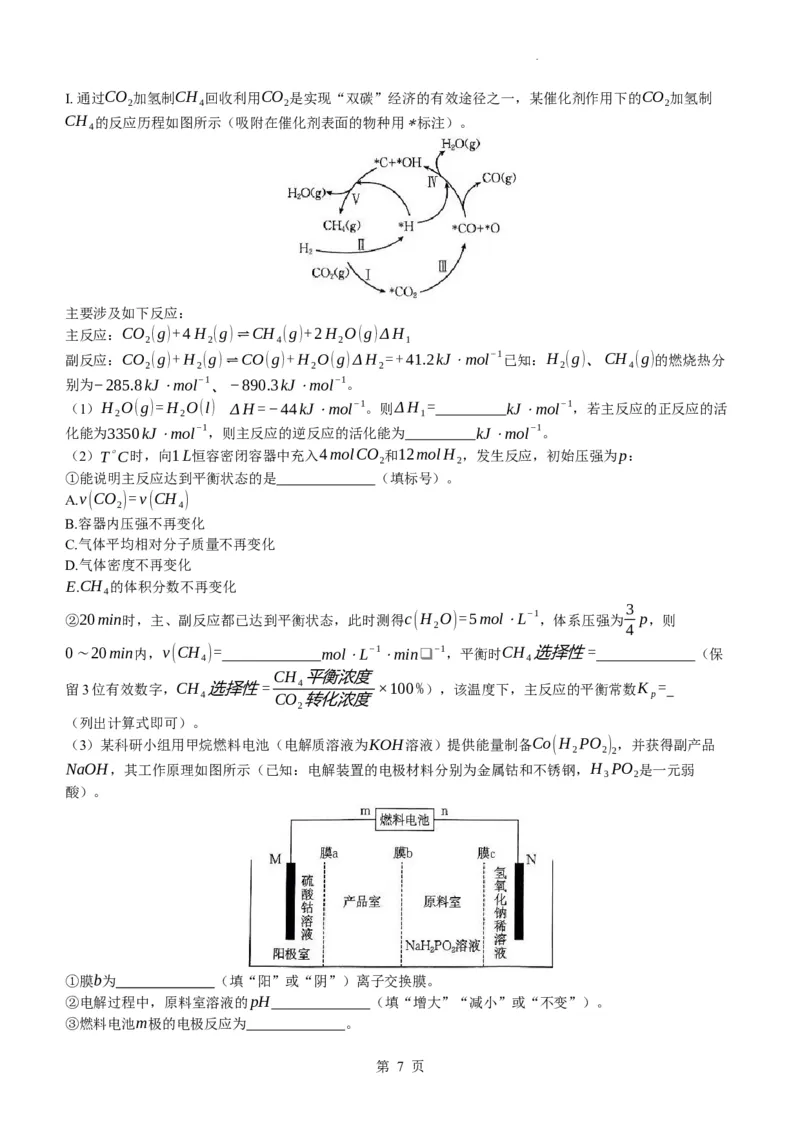
学科网(北京)股份有限公司Ⅰ. 通过CO 加氢制CH 回收利用CO 是实现“双碳”经济的有效途径之一,某催化剂作用下的CO 加氢制
2 4 2 2
CH 的反应历程如图所示(吸附在催化剂表面的物种用∗标注)。
4
主要涉及如下反应:
主反应:CO (g)+4H (g)⇌CH (g)+2H O(g)ΔH
2 2 4 2 1
副反应:CO (g)+H (g)⇌CO(g)+H O(g)ΔH =+41.2kJ⋅mol−1 已知:H (g)、CH (g)的燃烧热分
2 2 2 2 2 4
别为−285.8kJ⋅mol−1、−890.3kJ⋅mol−1。
(1)H O(g)=H O(l) ΔH=−44kJ⋅mol−1。则ΔH = kJ⋅mol−1,若主反应的正反应的活
2 2 1
化能为3350kJ⋅mol−1,则主反应的逆反应的活化能为 kJ⋅mol−1。
(2)T∘C时,向1L恒容密闭容器中充入4molCO 和12molH ,发生反应,初始压强为p:
2 2
①能说明主反应达到平衡状态的是 (填标号)。
A.v(CO )=v(CH )
2 4
B.容器内压强不再变化
C.气体平均相对分子质量不再变化
D.气体密度不再变化
E.CH 的体积分数不再变化
4
3
②20min时,主、副反应都已达到平衡状态,此时测得c(H O)=5mol⋅L−1 ,体系压强为 p,则
2 4
0∼20min内,v(CH )= mol⋅L−1 ⋅min❑ −1,平衡时CH 选择性= (保
4 4
CH 平衡浓度
留3位有效数字,CH 选择性= 4 ×100%),该温度下,主反应的平衡常数K =
4 CO 转化浓度 p
2
(列出计算式即可)。
(3)某科研小组用甲烷燃料电池(电解质溶液为KOH溶液)提供能量制备Co(H PO ) ,并获得副产品
2 2 2
NaOH,其工作原理如图所示(已知:电解装置的电极材料分别为金属钴和不锈钢,H PO 是一元弱
3 2
酸)。
①膜b为 (填“阳”或“阴”)离子交换膜。
②电解过程中,原料室溶液的pH (填“增大”“减小”或“不变”)。
③燃料电池m极的电极反应为 。
第 7 页
学科网(北京)股份有限公司