文档内容
2025 年秋期六校第一次联考
高二年级化学试题
(考试时间:75分钟 试卷满分:100分)
注意事项:
1.答题前,考生务必将自己的姓名、准考证号、考场号填写在答题卡上。
2.回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑。如需改
动,用橡皮擦干净后,再选涂其它答案标号。回答非选择题时,将答案写在答题卡上,
写在本试卷上无效。
3.考试结束后,将本试卷和答题卡一并交回。
可能用到的相对原子质量:H:1 0:16 Mg:24 Al:27 S:32 Cu:64 Zn:65 Ag:108 Pb:207
一、选择题(本题共14小题,每题3分,共42分。在每小题给出的四个选项中,只有一项是
符合题目要求的)
1.“民以食为天”,下列南阳特色食物中关于化学知识的叙述,不正确的是
A.唐河凉粉美味可口,凉姜水、蒜泥、食醋、辣椒油等都是必备佐料,辣椒油与铁制容器接触
比食醋与铁制容器接触更易导致容器的腐蚀
B.方城烩面汤香面滑,制作面片时,“和面”步骤中用一定比例的盐水来和面,一遍一遍地揉
面,上述盐水的主要成分 NaCl是电解质
C.桐柏豆筋风味独特,采用的是百年传统工艺制成,制作豆筋时,“地锅熬煮”过程中涉及放
热反应
D.内乡卷煎皮薄馅匀,做法是把面擀成薄皮把馅匀摊其上,卷成筒状,从两端挤压使面皮起
皱,上笼蒸熟。其面皮的主要成分淀粉是混合物
2.化学反应往往伴随着能量的变化,下列反应中,属于非氧化还原反应
且反应前后能量变化符合右图的是
A.常温下氢氧化钠溶液与稀盐酸反应
B.高温下铝与氧化铁粉末反应
C.高温下焦炭与二氧化碳反应
D.常温下氯化铵晶体与氢氧化钡晶体反应
1
3.已知: (1)H (g)+ O (g)=H O(g)ΔH=akJ/mol
2 2 2 2
(2)2H (g)+O (g)=2H O(g)△H=b kJ/ mol
2 2 2
1
(3)H (g)+ O (g)=H O(1) ΔH=c kJ/ mol
2 2 2 2
下列关系式中正确的是
A. ac C.2a+b=0 D. a-c=0
4.设NA为阿伏加德罗常数的值,下列说法正确的是
A.电解精炼铜的实验中,阳极质量减少6.4g,则电路中通过的电子数目是0.2N
A
B.某纯净铁发生析氢腐蚀时,正极产生标况下67.2L气体,则被氧化的铁原子数目为2N
A
C.铅酸蓄电池负极增重96g时,电路中转移的电子数为2N
A
D.3mol H₂与足量N₂充分反应,生成NH₃分子的数目为2N
A
高二年级化学试题 第 1页(共6页)5.有M、N、P、Q四种金属,已知:①M与N的盐溶液可以发生离子反应 M+N2+=N+M2+;②
M、P放入稀硫酸中,P表面有大量气泡产生,M表面无明显现象;③N、Q用导线连接后放
入Q 的硫酸盐溶液中,电极反应为 Q2++2e−=Q,N−2e−=N2+ 。则四种金属的还原性由强
到弱的顺序是
A. Q、P、M、N B. Q、N、M、P C. P、N、M、Q D. P、M、N、Q
6.某兴趣小组的同学用如图所示装置研究有关电化学的问题。当闭合该装置的电键时,观察
到电流表的指针发生了偏转。下列有关判断正确的是
A.甲池为原电池,乙池中A(石墨)电极上发生还原反应析出银单质
B.电池工作一段时间后,甲池的pH会增大(忽略溶液体积变化)
C.若将 CuCl₂溶液换成 NaCl溶液,电键闭合一段时间后,丙池中溶液的pH将增大
D.当乙池中B极质量增加5.40g时,甲池中至少需通入消耗0.28LO₂
7.1T-MoS₂/石墨烯电极材料可在光照条件下产生电子(e⁻)和空穴(h⁺),其制氧效果优越,原理
如图所示。其中双极膜直流电场下,中间层水分子解离为 H⁺和OH⁻,分别通过阴阳膜向两
极迁移。下列叙述不正确的是
A.放电时,电子流向:b→导线→a
B.放电时,每消耗0.1mol O₂,负极区电解质溶液的质量增加13g
C.充电时,b应连接直流电源负极
❑
D.充电时,电池总反应: 2[Zn(OH) ] 2−→2Zn+O ↑+4OH−+2H O
4 2 2
8.下列事实与解释均正确的是
选项 事实 解释
利用了电解池原理设计的金属防护
A 水中的钢闸门连接直流电源的正极可起到保护作用。
措施。
镀层破损后,在空气中白铁皮中镀
白铁皮(镀锌铁)镀层破损后比马口铁(镀锡铁)镀层破损后更
B 层锌可与铁形成原电池,铁为正极
耐腐蚀。
受到保护。
电解质溶液的环境不是酸性就是碱
C 钢铁的腐蚀过程中,析氢腐蚀与吸氧腐蚀不可能同时发生。
性或中性。
原电池反应是导致金属腐蚀的主要
D 不能用原电池原理来减缓金属的腐蚀。
原因。
高二年级化学试题 第 2页(共6页)9.研究人员研制出一种可在一分钟内完成充放电的超常性能铝离子电池。该电池分别以铝和石墨为电
极,AlCl₄和有机阳离子构成的电解质溶液作为离子导体,其放电工作原理如图所示。下列说法不正
确的是
A.放电时,铝为负极,石墨为正极
B.放电时,有机阳离子向石墨电极方向移动
C.放电时,电流方向为:石墨电极→用电器→铝电极→石墨电极
D.充电时,阴极反应为: Al3++3e−=Al
10.下列关于判断过程的方向的说法正确的是
A.吸热的化学变化不能自发进行
B.自发反应在任何条件下都能发生
C.由焓判据和熵判据组合而成的复合判据,将更适合于所有的过程
D.只要物质的种类确定、物质的多少确定,那么熵值就是确定的
11.橡皮筋在拉伸和收缩状态时结构如图,在其拉伸过程中有放热现象。
25℃、101 kPa时,下列过程的焓变、熵变和自发性与橡皮筋从拉伸状
态到收缩状态一致的是
A.2H O=2H ↑+O ↑ B. NaOH固体的溶解
2 2 2
C.水蒸气的液化 D.硝酸铵的溶解
12.科学家开发新型电化学装置,用于从卤水[含 Li+ 、X−(Cl− 、Br−)等离子]中提取锂盐,简易装置
如图所示。已知通电后a电极上发生的反应是 FePO +Li++e−=LiFePO 。下列说法不正确的是
4 4
A.该装置工作一段时间后,在淡水池中得到LiX
B. c、d电极分别发生氧化反应、还原反应结合、释放X⁻
C.若卤水池中的卤水和淡水池中的淡水均足量,该装置提取锂盐
效果不明显时,分别将a与b、c与d电极对调可继续工作
D.充分电解后,将电源的正极、负极对调,淡水池中c(Li⁺)增大
13.研究表明氮氧化物和二氧化硫在形成雾霾时与大气中的氨有关(如图所示)。下列叙述正确的是
高二年级化学试题 第 3页(共6页)A.雾霾是胶体的根本原因是能发生丁达尔效应
B.SO →SO 的过程是吸热过程
2 3
C.反应 N O (g)+H O(1)=2HNO (aq)常温下能自发进行的原因是该反应△H<0
2 5 2 3
D.理论上图中氧化物和水的反应都能设计成原电池
14.二氧化铅—铜电池是一种电解质可循环流动的新型电池(如图所示)。下列有关该电池的说法不正
确的是
A.电池工作时,电子由 Cu电极经负载流向 PbO₂电极
B.电池工作过程中,电解质溶液的质量逐渐变小
C.电池总反应式为: PbO +Cu+2H SO =PbSO +CuSO +2H O
2 2 4 4 4 2
D.为了维持该电池长时间稳定工作,需定期及时向循环液中补充HSO₄
2
二、非选择题(本题共4 小题,共58 分)
15.(14分)研究化学反应过程中能量的转化对于实际生产具有重要的意义。
回答下列问题:
(1)化学反应中伴随着能量变化,下列变化属于放热反应的是 。
a.镁条与稀硫酸反应
b. NH Cl固体与 Ba(OH) ⋅8H O固体混合搅拌
4 2 2
c.碳酸钙高温分解
d.铝与氧化铁高温下的反应
e.氢氧化钠溶于水
(2)化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时释放的能量
不同引起的,气缸中1mol N₂和1mol O₂反应生成2mol NO的能量变化如图所示。
该条件下,NO分解生成N₂和O₂的热化学方程式为 。
(3)合成氨工业中,已知断开1mol H-H键、1mol N≡N键、1mol N-H 键分别需要吸收的能量为436kJ、
946kJ、391 kJ;则合成氨每生成2mol NH₃,会放出 kJ 能量。
(4)已知:( CH (g)+2O (g)=CO (g)+2H O(l)) ΔH₁=-890.3kJ· mol-¹
4 2 2 2
C(s,石墨) +O (g)=CO (g) ΔH =−393.5kJ⋅mol−1
2 2 2
H (g)+1/2O (g)=H O(l) △H =−285.8kJ·mol−1
2 2 2 3
则C(s,石墨) +2H (g)=CH (g) △H = 。
2 4
(5)某甲醇(CH OH)—氧气燃料电池的工作原理如图所示,a、b均为石墨电极。
3
①b为原电池 (填“正”或“负”)极。
②a极的电极反应式为 。
高二年级化学试题 第 4页(共6页)③溶液中 OH⁻移向 (填“a”或“b”)极。
④若用该燃料电池为铅蓄电池充电,燃料电池正极消耗标况下22.4L 气体时,铅蓄电池某电极会
新生成 mol 铅单质。(已知燃料电池化学能转化为电能的效率为 97%,假设充电过程
无其他形式能量损耗)
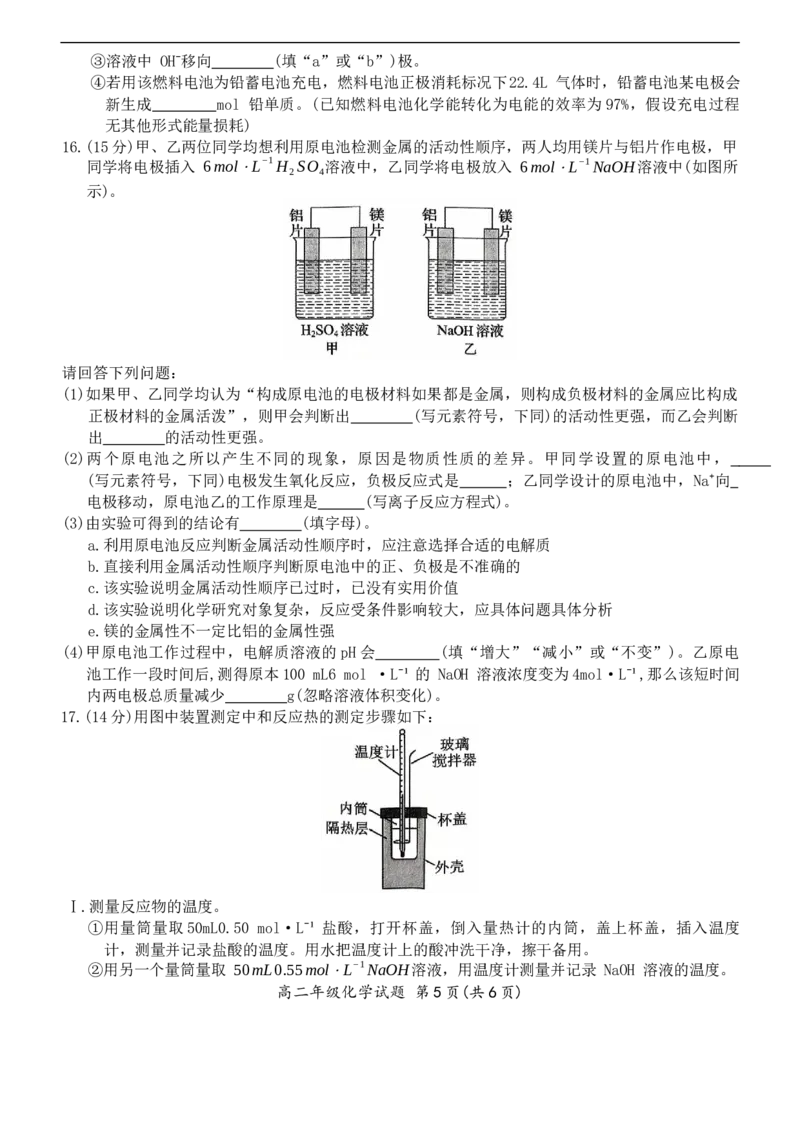
16.(15分)甲、乙两位同学均想利用原电池检测金属的活动性顺序,两人均用镁片与铝片作电极,甲
同学将电极插入 6mol⋅L−1H SO 溶液中,乙同学将电极放入 6mol⋅L−1NaOH溶液中(如图所
2 4
示)。
请回答下列问题:
(1)如果甲、乙同学均认为“构成原电池的电极材料如果都是金属,则构成负极材料的金属应比构成
正极材料的金属活泼”,则甲会判断出 (写元素符号,下同)的活动性更强,而乙会判断
出 的活动性更强。
(2)两个原电池之所以产生不同的现象,原因是物质性质的差异。甲同学设置的原电池中,
(写元素符号,下同)电极发生氧化反应,负极反应式是 ;乙同学设计的原电池中,Na⁺向
电极移动,原电池乙的工作原理是 (写离子反应方程式)。
(3)由实验可得到的结论有 (填字母)。
a.利用原电池反应判断金属活动性顺序时,应注意选择合适的电解质
b.直接利用金属活动性顺序判断原电池中的正、负极是不准确的
c.该实验说明金属活动性顺序已过时,已没有实用价值
d.该实验说明化学研究对象复杂,反应受条件影响较大,应具体问题具体分析
e.镁的金属性不一定比铝的金属性强
(4)甲原电池工作过程中,电解质溶液的 pH会 (填“增大”“减小”或“不变”)。乙原电
池工作一段时间后,测得原本100 mL6 mol ·L⁻¹的 NaOH 溶液浓度变为4mol·L⁻¹,那么该短时间
内两电极总质量减少 g(忽略溶液体积变化)。
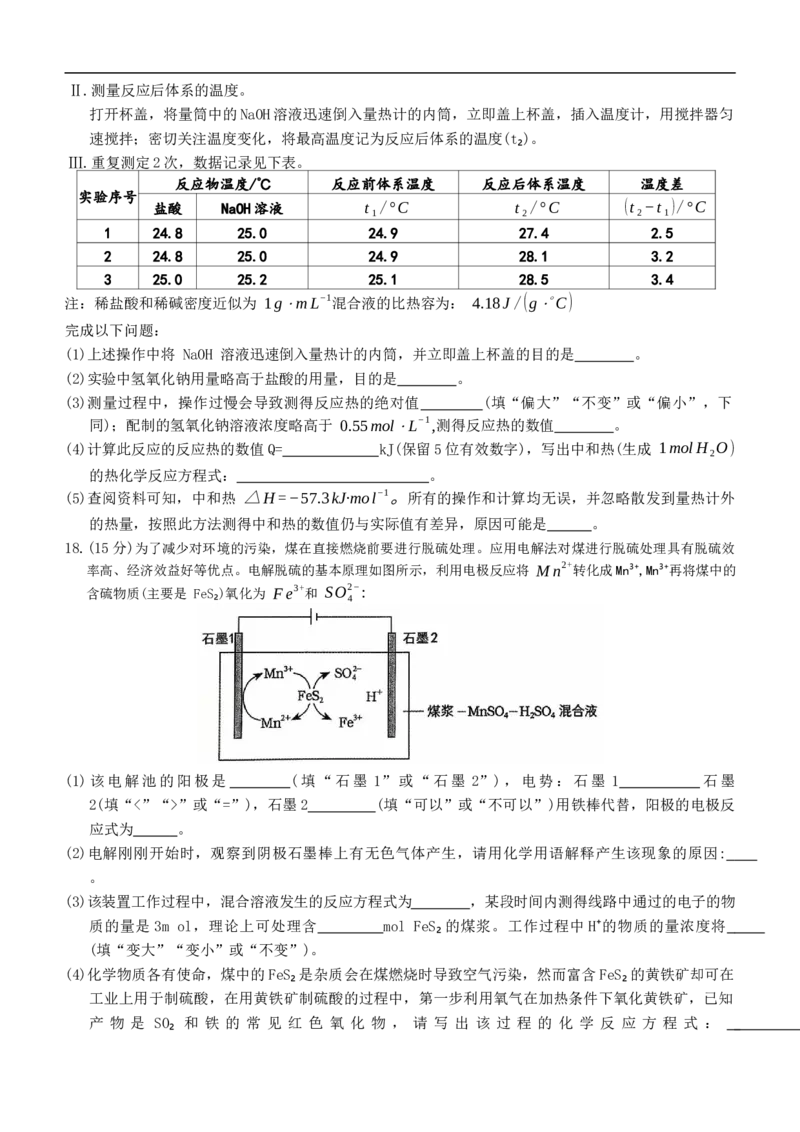
17.(14分)用图中装置测定中和反应热的测定步骤如下:
Ⅰ.测量反应物的温度。
①用量筒量取50mL0.50 mol·L⁻¹盐酸,打开杯盖,倒入量热计的内筒,盖上杯盖,插入温度
计,测量并记录盐酸的温度。用水把温度计上的酸冲洗干净,擦干备用。
②用另一个量筒量取 50mL0.55mol⋅L−1NaOH溶液,用温度计测量并记录 NaOH 溶液的温度。
高二年级化学试题 第5页(共6页)Ⅱ.测量反应后体系的温度。
打开杯盖,将量筒中的NaOH溶液迅速倒入量热计的内筒,立即盖上杯盖,插入温度计,用搅拌器匀
速搅拌;密切关注温度变化,将最高温度记为反应后体系的温度(t₂)。
Ⅲ.重复测定2次,数据记录见下表。
反应物温度/℃ 反应前体系温度 反应后体系温度 温度差
实验序号
盐酸 NaOH溶液 t₁/°C t₂/°C (t₂−t₁)/°C
1 24.8 25.0 24.9 27.4 2.5
2 24.8 25.0 24.9 28.1 3.2
3 25.0 25.2 25.1 28.5 3.4
注:稀盐酸和稀碱密度近似为 1g⋅mL−1混合液的比热容为: 4.18J/(g⋅∘C)
完成以下问题:
(1)上述操作中将 NaOH 溶液迅速倒入量热计的内筒,并立即盖上杯盖的目的是 。
(2)实验中氢氧化钠用量略高于盐酸的用量,目的是 。
(3)测量过程中,操作过慢会导致测得反应热的绝对值 (填“偏大”“不变”或“偏小”,下
同);配制的氢氧化钠溶液浓度略高于 0.55mol⋅L−1,测得反应热的数值 。
(4)计算此反应的反应热的数值Q= kJ(保留5位有效数字),写出中和热(生成 1molH O)
2
的热化学反应方程式: 。
(5)查阅资料可知,中和热 △H=−57.3kJ·mol−1 。所有的操作和计算均无误,并忽略散发到量热计外
的热量,按照此方法测得中和热的数值仍与实际值有差异,原因可能是 。
18.(15分)为了减少对环境的污染,煤在直接燃烧前要进行脱硫处理。应用电解法对煤进行脱硫处理具有脱硫效
率高、经济效益好等优点。电解脱硫的基本原理如图所示,利用电极反应将 Mn2+转化成Mn³⁺,Mn³⁺再将煤中的
含硫物质(主要是 FeS₂)氧化为 Fe3+和 SO2−:
4
(1)该电解池的阳极是 (填“石墨 1”或“石墨 2”),电势:石墨 1 石墨
2(填“<”“>”或“=”),石墨2 (填“可以”或“不可以”)用铁棒代替,阳极的电极反
应式为 。
(2)电解刚刚开始时,观察到阴极石墨棒上有无色气体产生,请用化学用语解释产生该现象的原因:
。
(3)该装置工作过程中,混合溶液发生的反应方程式为 ,某段时间内测得线路中通过的电子的物
质的量是3m ol,理论上可处理含 mol FeS₂的煤浆。工作过程中H⁺的物质的量浓度将
(填“变大”“变小”或“不变”)。
(4)化学物质各有使命,煤中的FeS₂是杂质会在煤燃烧时导致空气污染,然而富含FeS₂的黄铁矿却可在
工业上用于制硫酸,在用黄铁矿制硫酸的过程中,第一步利用氧气在加热条件下氧化黄铁矿,已知
产 物 是 SO₂ 和 铁 的 常 见 红 色 氧 化 物 , 请 写 出 该 过 程 的 化 学 反 应 方 程 式 :。
高二年级化学试题 第 6页(共6页)