文档内容
江苏省苏州市2025-2026学年高二上学期期中
化学试题
一、单选题
1.下列不属于清洁燃料的是
A.氢气 B.天然气 C.汽油 D.生物质能
2.化学知识与日常生活密切相关,下列有关解释不合理的是
A.清洗铁锅后及时擦干,能减缓铁锅因发生吸氧腐蚀而生锈
B.制作面点时加入食用纯碱,利用 中和发酵过程产生的酸
C.铁粉可用作食品脱氧剂,利用了铁粉的还原性
D.烹煮食物的后期加入碘盐,能避免 长时间受热而分解
3.下列属于吸热反应的是
A.铝与氧化铁在高温下反应
B.氢氧化钾溶液与硝酸溶液反应
C.铁丝在纯氧中燃烧
D.八水合氢氧化钡固体与氯化铵固体混合搅拌
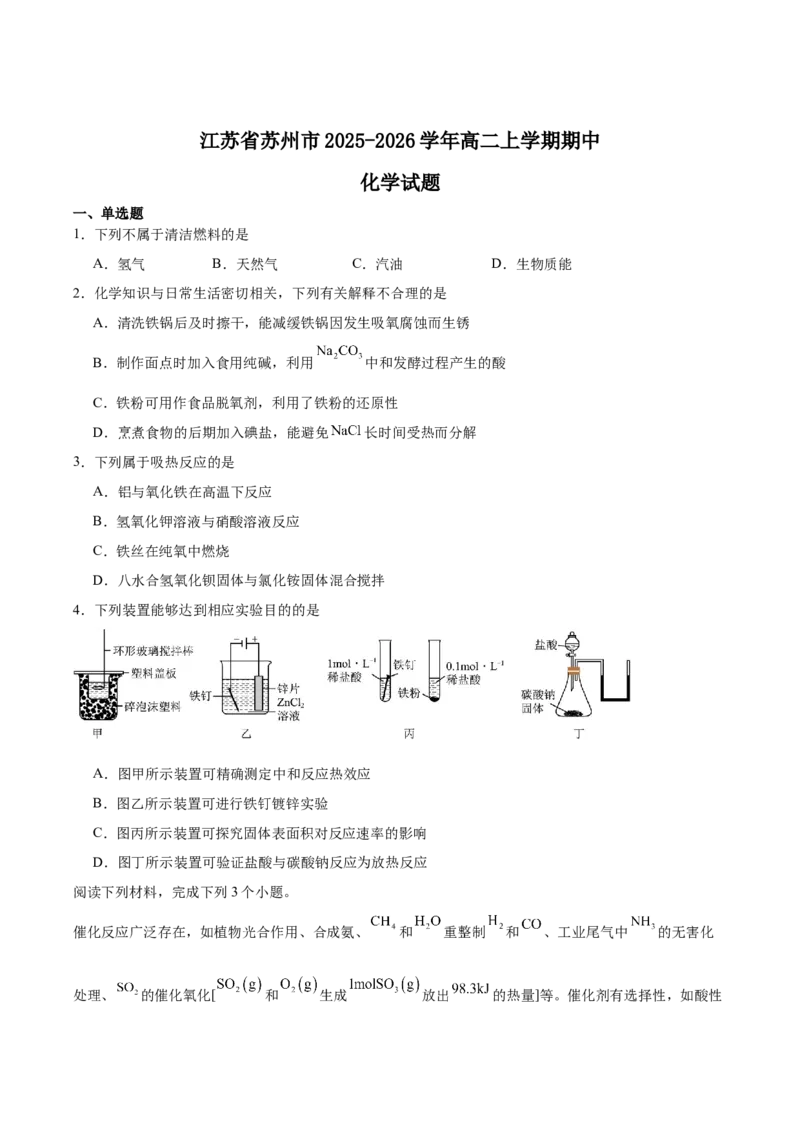
4.下列装置能够达到相应实验目的的是
A.图甲所示装置可精确测定中和反应热效应
B.图乙所示装置可进行铁钉镀锌实验
C.图丙所示装置可探究固体表面积对反应速率的影响
D.图丁所示装置可验证盐酸与碳酸钠反应为放热反应
阅读下列材料,完成下列3个小题。
催化反应广泛存在,如植物光合作用、合成氨、 和 重整制 和 、工业尾气中 的无害化
处理、 的催化氧化[ 和 生成 放出 的热量]等。催化剂有选择性,如酸性条件下锑电催化还原 ,相同时间内生成 的物质的量大于 。非均相催化指催化剂与反应物
处于不同聚集状态的催化反应。
5.下列说法不正确的是
A.植物光合作用过程中,酶能降低该反应的活化能
B.铁触媒催化合成氨的反应属于非均相催化
C.酸性条件下锑电催化还原 生成两种产物的速率:
D. 的催化氧化反应中,温度越高催化效果越好
6.下列化学反应表示正确的是
A. 和 催化重整制 和 :
B.工业尾气中 的无害化处理:
C. 的催化氧化:
D.锑电催化还原 生成 的阴极反应:
7.下列反应描述正确的是
A.合成氨温度选择 的原因之一是铁触媒在该温度范围内活性大
B.工业合成氨反应中, 在铁触媒表面吸附过程的
C. 的催化氧化反应,升高温度,逆反应速率减小
D. 转化为 时, 原子轨道的杂化类型由 转变为
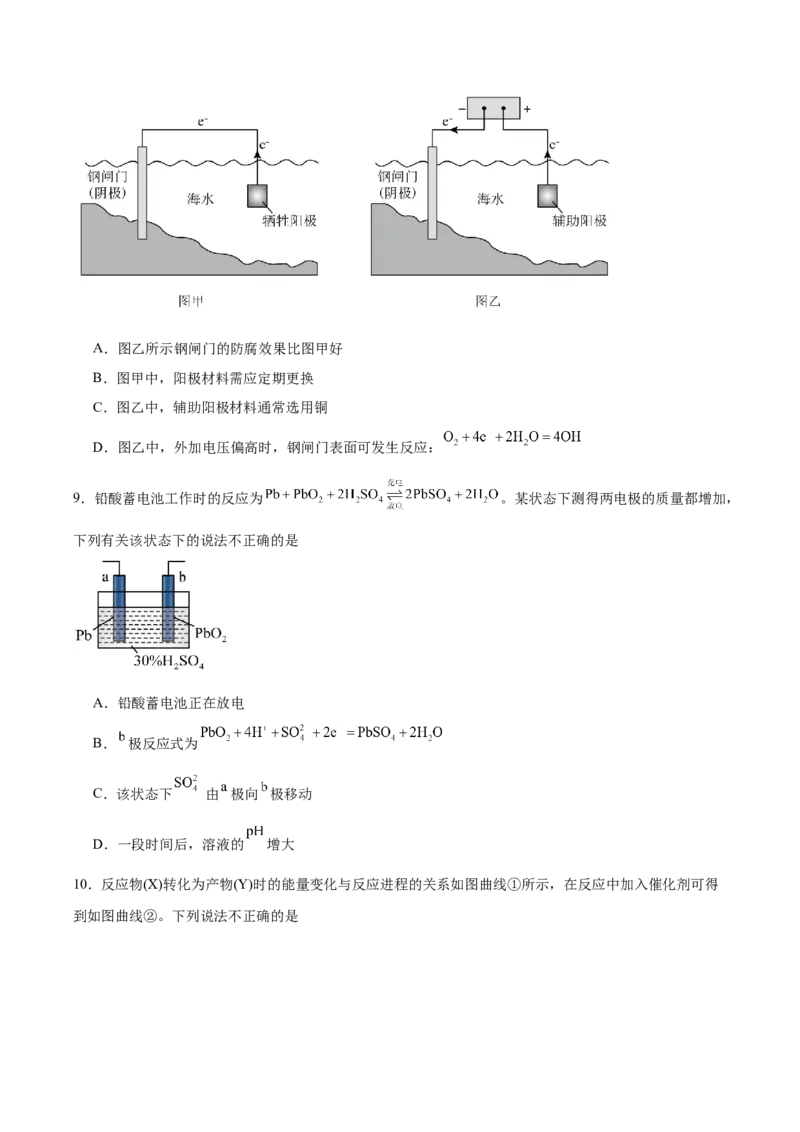
8.金属腐蚀会对设备产生严重危害,腐蚀快慢与材料种类、所处环境有关。下图为两种对海水中钢闸门
的防腐措施示意图。下列说法不正确的是A.图乙所示钢闸门的防腐效果比图甲好
B.图甲中,阳极材料需应定期更换
C.图乙中,辅助阳极材料通常选用铜
D.图乙中,外加电压偏高时,钢闸门表面可发生反应:
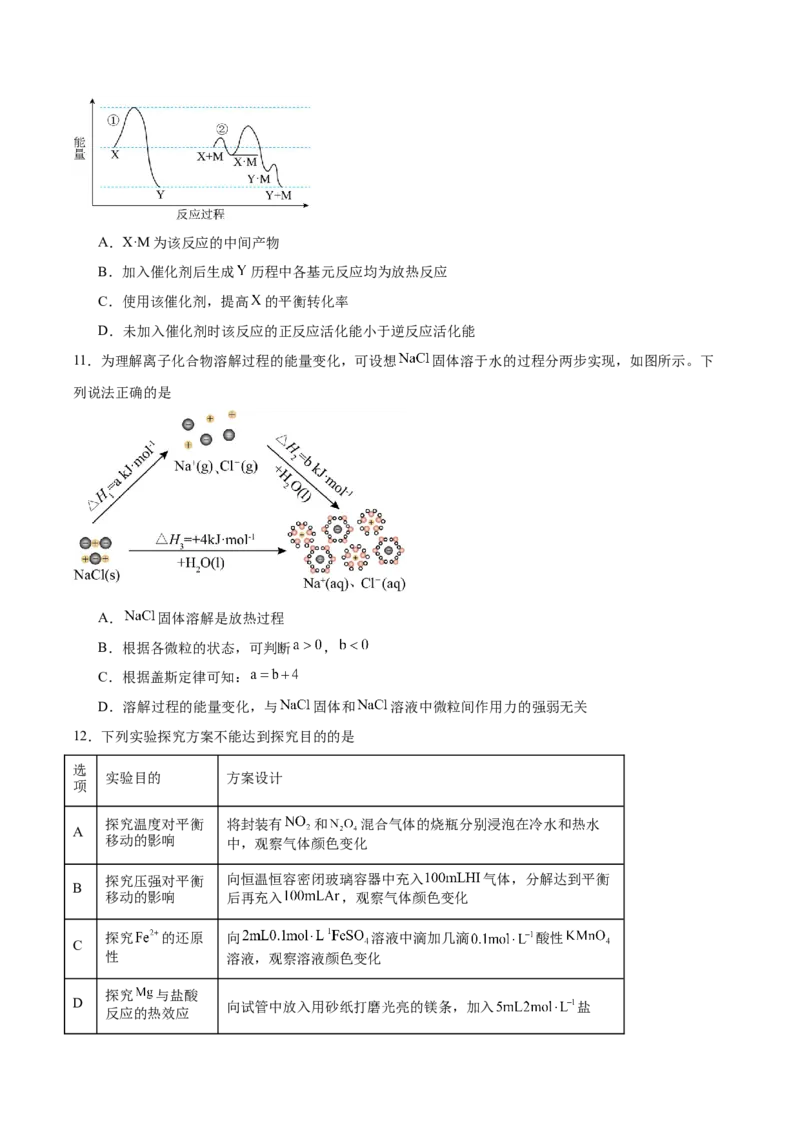
9.铅酸蓄电池工作时的反应为 。某状态下测得两电极的质量都增加,
下列有关该状态下的说法不正确的是
A.铅酸蓄电池正在放电
B. 极反应式为
C.该状态下 由 极向 极移动
D.一段时间后,溶液的 增大
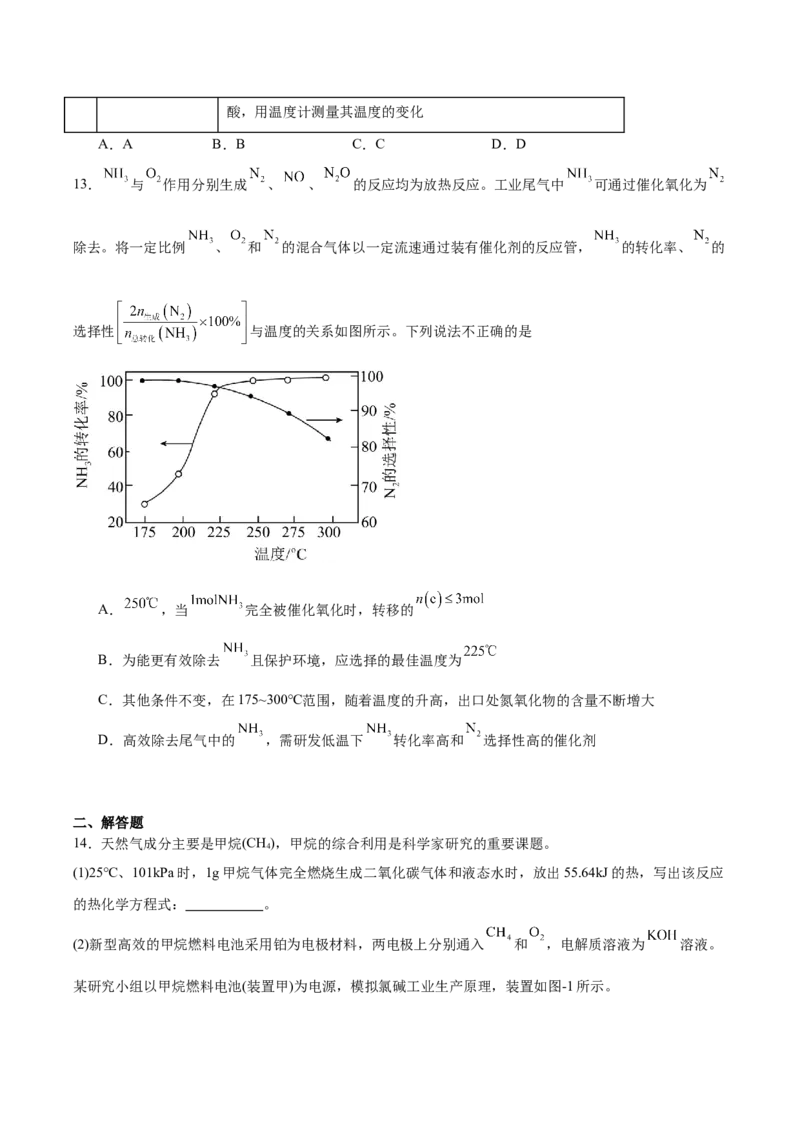
10.反应物(X)转化为产物(Y)时的能量变化与反应进程的关系如图曲线①所示,在反应中加入催化剂可得
到如图曲线②。下列说法不正确的是A.X·M为该反应的中间产物
B.加入催化剂后生成 历程中各基元反应均为放热反应
C.使用该催化剂,提高 的平衡转化率
D.未加入催化剂时该反应的正反应活化能小于逆反应活化能
11.为理解离子化合物溶解过程的能量变化,可设想 固体溶于水的过程分两步实现,如图所示。下
列说法正确的是
A. 固体溶解是放热过程
B.根据各微粒的状态,可判断 ,
C.根据盖斯定律可知:
D.溶解过程的能量变化,与 固体和 溶液中微粒间作用力的强弱无关
12.下列实验探究方案不能达到探究目的的是
选
实验目的 方案设计
项
探究温度对平衡 将封装有 和 混合气体的烧瓶分别浸泡在冷水和热水
A
移动的影响 中,观察气体颜色变化
探究压强对平衡 向恒温恒容密闭玻璃容器中充入 气体,分解达到平衡
B
移动的影响 后再充入 ,观察气体颜色变化
探究 的还原 向 溶液中滴加几滴 酸性
C
性 溶液,观察溶液颜色变化
探究 与盐酸
D 向试管中放入用砂纸打磨光亮的镁条,加入 盐
反应的热效应酸,用温度计测量其温度的变化
A.A B.B C.C D.D
13. 与 作用分别生成 、 、 的反应均为放热反应。工业尾气中 可通过催化氧化为
除去。将一定比例 、 和 的混合气体以一定流速通过装有催化剂的反应管, 的转化率、 的
选择性 与温度的关系如图所示。下列说法不正确的是
A. ,当 完全被催化氧化时,转移的
B.为能更有效除去 且保护环境,应选择的最佳温度为
C.其他条件不变,在175~300℃范围,随着温度的升高,出口处氮氧化物的含量不断增大
D.高效除去尾气中的 ,需研发低温下 转化率高和 选择性高的催化剂
二、解答题
14.天然气成分主要是甲烷(CH),甲烷的综合利用是科学家研究的重要课题。
4
(1)25℃、101kPa时,1g甲烷气体完全燃烧生成二氧化碳气体和液态水时,放出55.64kJ的热,写出该反应
的热化学方程式: 。
(2)新型高效的甲烷燃料电池采用铂为电极材料,两电极上分别通入 和 ,电解质溶液为 溶液。
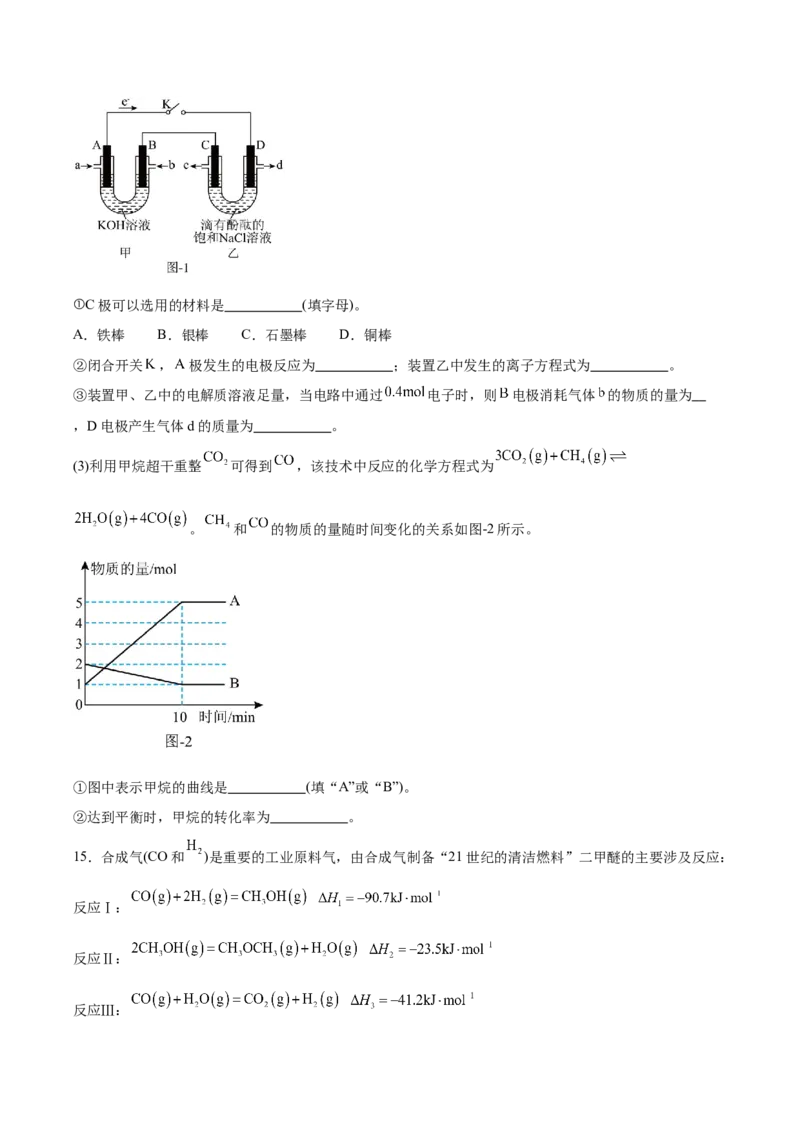
某研究小组以甲烷燃料电池(装置甲)为电源,模拟氯碱工业生产原理,装置如图-1所示。①C极可以选用的材料是 (填字母)。
A.铁棒 B.银棒 C.石墨棒 D.铜棒
②闭合开关 , 极发生的电极反应为 ;装置乙中发生的离子方程式为 。
③装置甲、乙中的电解质溶液足量,当电路中通过 电子时,则 电极消耗气体 的物质的量为
,D电极产生气体d的质量为 。
(3)利用甲烷超干重整 可得到 ,该技术中反应的化学方程式为
。 和 的物质的量随时间变化的关系如图-2所示。
①图中表示甲烷的曲线是 (填“A”或“B”)。
②达到平衡时,甲烷的转化率为 。
15.合成气(CO和 )是重要的工业原料气,由合成气制备“21世纪的清洁燃料”二甲醚的主要涉及反应:
反应Ⅰ:
反应Ⅱ:
反应Ⅲ:(1)反应 的 ; 和 分子中的化学键分别视
为 和 ,则估算该反应的 需要 (填数字)种化学键的键能。
(2)下列措施中,既能提高反应 中 平衡产率又能加快反
应速率的有 (填字母)。
a.升高温度 b.增大压强 c.加入合适的催化剂
(3)一定温度下,将 和 通入 恒容密闭容器中,若只发生反应 , 后达到化
学平衡,平衡后测得 的体积分数为0.2。
① 内 。
②下列情况一定能说明该反应已经达到平衡状态的是 (填字母)。
A.混合气体的压强保持不变
B.混合气体的密度保持不变
C. 与 的体积比保持不变
D.
(4)将合成气以 通入 的反应器中,一定条件下只发生反应:
,其中CO的平衡转化率随温度、压强的变化关系如图所
示。
① 0(填“>”、“<”或“=”,下同)。② 。
③ 点和 点对应的化学平衡常数 。
④不改变反应温度, 平衡转化率由 点达到 点的措施有 。
16.硝酸工业的尾气中含有大量氮氧化物 ,将 进行吸收与再利用,既可以减少环境污染,又能
获得额外的产品。研究者们研究了多种 的吸收与转化方法。
(1)水吸收法: 可与 发生反应生成 和 ,以下措施中一定可以提高 的吸收效率的有
(填字母)。
a.提高吸收用水的温度 b.延长吸收时间 c.采取气液逆流
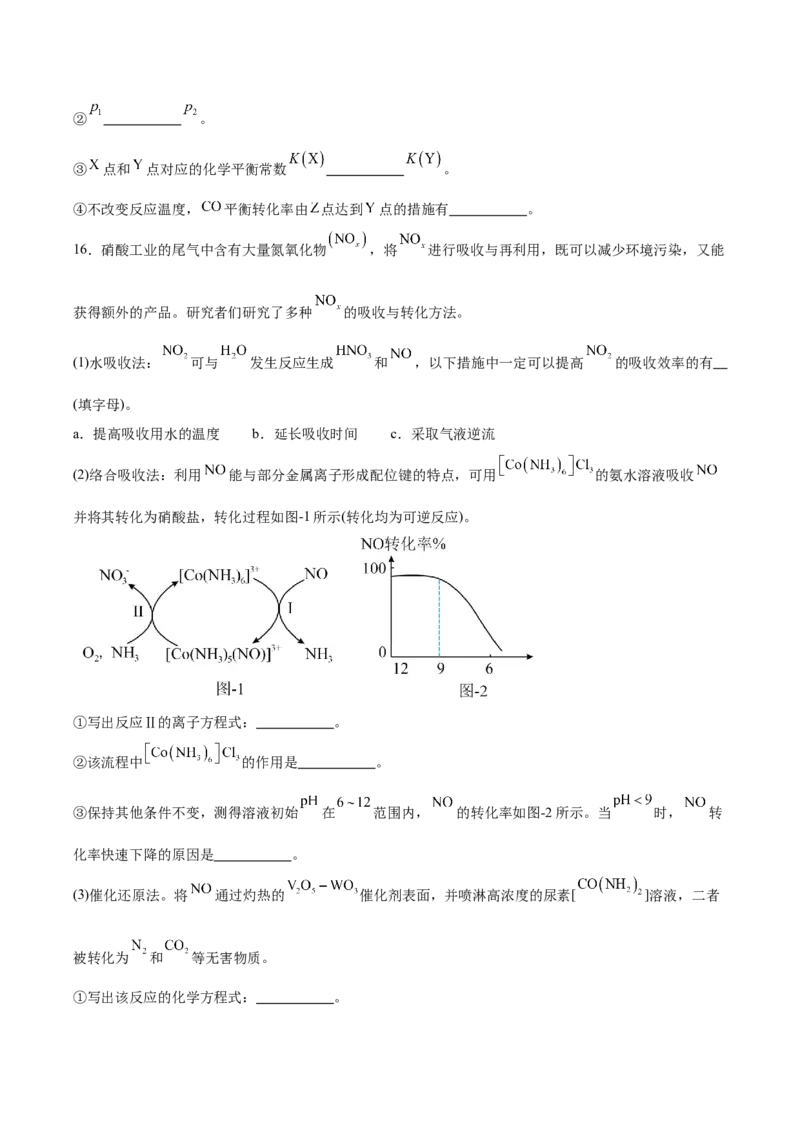
(2)络合吸收法:利用 能与部分金属离子形成配位键的特点,可用 的氨水溶液吸收
并将其转化为硝酸盐,转化过程如图-1所示(转化均为可逆反应)。
①写出反应Ⅱ的离子方程式: 。
②该流程中 的作用是 。
③保持其他条件不变,测得溶液初始 在 范围内, 的转化率如图-2所示。当 时, 转
化率快速下降的原因是 。
(3)催化还原法。将 通过灼热的 催化剂表面,并喷淋高浓度的尿素[ ]溶液,二者
被转化为 和 等无害物质。
①写出该反应的化学方程式: 。② 也可用于催化还原 ,与直接通入工业尾气与 的混合气体相比,催化还原法的优势是提供高
浓度的还原剂和 。
17.氢能是一种清洁能源,氢能产业链由制氢、储氢和用氢组成。
(1)甘油 水蒸气重整获得 过程中的主要反应:
反应Ⅰ:
反应Ⅱ:
反应Ⅲ:
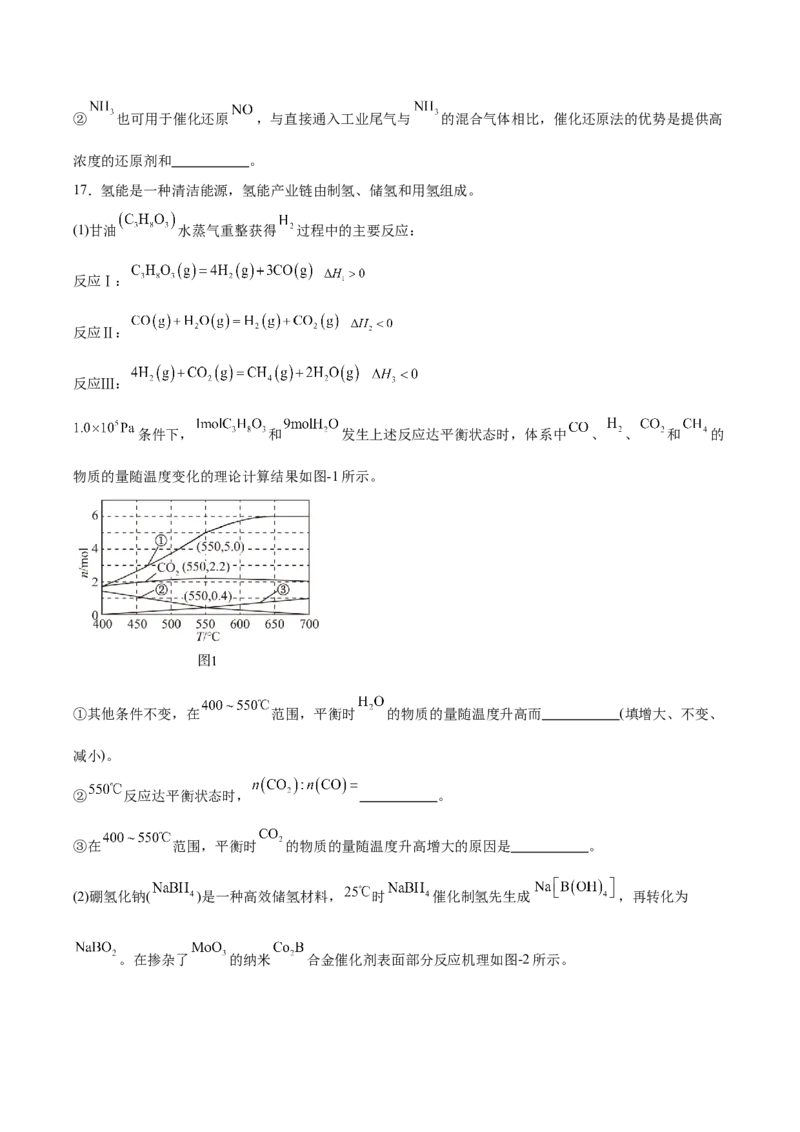
条件下, 和 发生上述反应达平衡状态时,体系中 、 、 和 的
物质的量随温度变化的理论计算结果如图-1所示。
①其他条件不变,在 范围,平衡时 的物质的量随温度升高而 (填增大、不变、
减小)。
② 反应达平衡状态时, 。
③在 范围,平衡时 的物质的量随温度升高增大的原因是 。
(2)硼氢化钠( )是一种高效储氢材料, 时 催化制氢先生成 ,再转化为
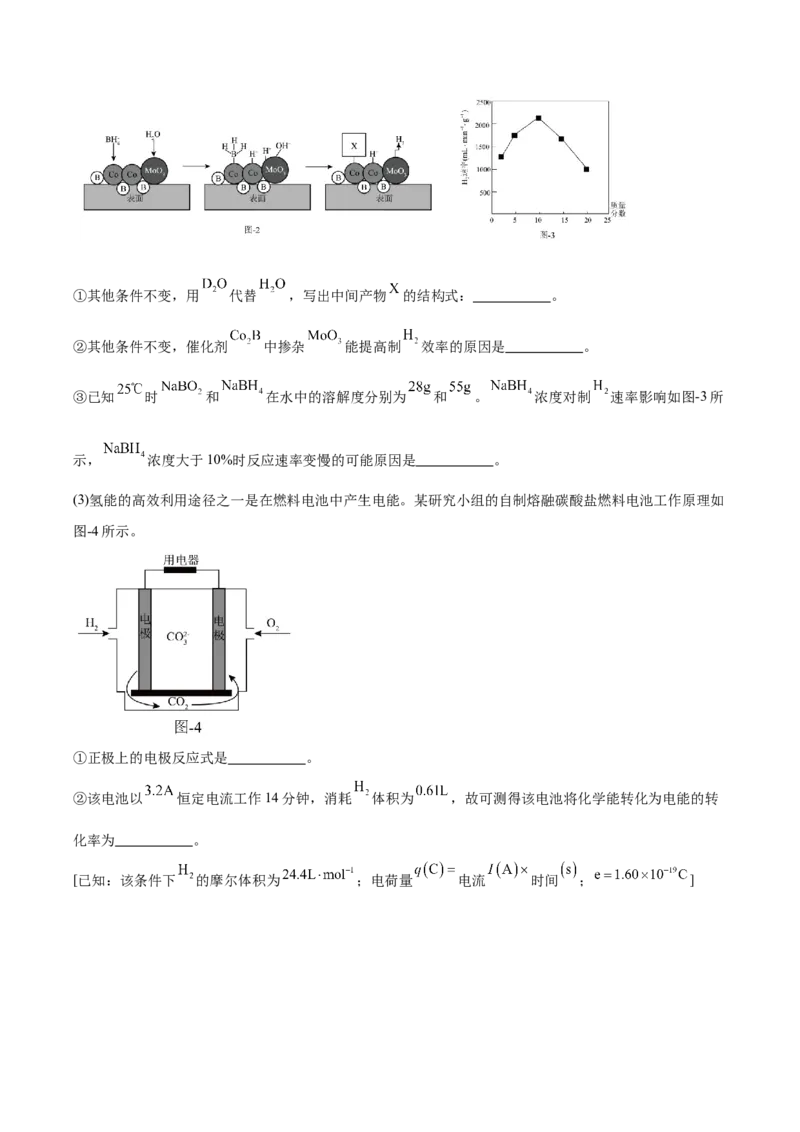
。在掺杂了 的纳米 合金催化剂表面部分反应机理如图-2所示。①其他条件不变,用 代替 ,写出中间产物 的结构式: 。
②其他条件不变,催化剂 中掺杂 能提高制 效率的原因是 。
③已知 时 和 在水中的溶解度分别为 和 。 浓度对制 速率影响如图-3所
示, 浓度大于10%时反应速率变慢的可能原因是 。
(3)氢能的高效利用途径之一是在燃料电池中产生电能。某研究小组的自制熔融碳酸盐燃料电池工作原理如
图-4所示。
①正极上的电极反应式是 。
②该电池以 恒定电流工作14分钟,消耗 体积为 ,故可测得该电池将化学能转化为电能的转
化率为 。
[已知:该条件下 的摩尔体积为 ;电荷量 电流 时间 ; ]参考答案
1.C
2.D
3.D
4.B
5.D 6.D 7.A
8.C
9.C
10.C
11.B
12.B
13.A
14.(1)
(2) C 0.1mol
0.4g
(3) B 50%
15.(1) 5
(2)b
(3) 0.016mol C
(4) < > = 增大起始时 的投料比,增大压强
16.(1)c
(2) 作催化剂
降低使 浓度增大,反应Ⅱ逆向移动, 浓度减小, 转化率快速下降
(3) 减少氨的催化氧化等副反应发生17.(1) 减小 11:2 反应Ⅱ的 ,升高温度平衡逆向移动, 生成的量减少,反应Ⅲ
的 ,高温下平衡逆向移动, 反应的量增多,且 增多的量大于减少的量
(2) 能吸附水分子并解离出 浓度较高时,生成的 覆盖在催
化剂表面,降低催化活性,反应速率降低, 过多吸附在 上,而减少 吸附