文档内容
济南一中 2022 级高三 10 月份学情检测——化学试题
本试卷满分100分 考试时间 90分钟
可能用到的相对原子质量:H-1 C-12 O-16 Cl-35.5 Sn-119 Na-23 K-39 Cr-52
一、选择题。本大题共10小题,每小题 2分,共 20分。(每小题只有一个正确答案)
1.下列说法不正确的是( )
A.新型农用薄膜能够选择性的透过种植某种植物所需要的特定波长的光,它的降解是化学变化
B.向煤中加入适量石灰石,使煤燃烧产生的SO 最终生成CaSO ,可减少对大气的污染
2 4
C.大力推广使用乙醇汽油、新型能源来缓解能源危机,乙醇汽油中的成分都是不可再生资源
D.碳纳米管是一种由石墨烯卷曲成的纳米材料,与富勒烯(C )中的有些C原子成键方式相似
60
2.金属元素的单质和化合物在日常生产和生活中应用广泛,其中涉及的化学知识正确的是( )
A.加入稀硝酸酸化的KSCN溶液检验蔬菜中的铁元素
B.火灾现场存放大量的钠,应立即用泡沫灭火器灭火
C.用覆铜板制作印刷电路板可以用FeCl 溶液作为“腐蚀液”
2
D.厨房中使用的小苏打易吸水结块,不可用作清洁剂
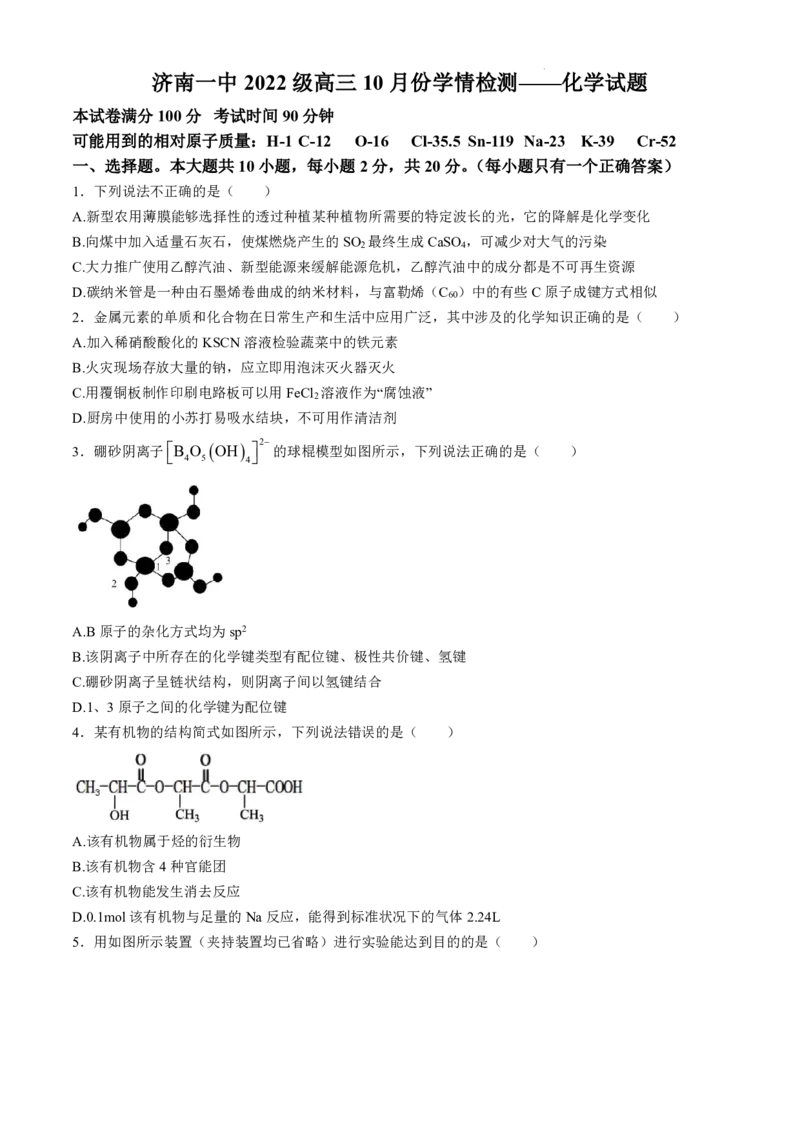
3.硼砂阴离子
B
4
O
5
OH
4
2 的球棍模型如图所示,下列说法正确的是( )
A.B原子的杂化方式均为sp2
B.该阴离子中所存在的化学键类型有配位键、极性共价键、氢键
C.硼砂阴离子呈链状结构,则阴离子间以氢键结合
D.1、3原子之间的化学键为配位键
4.某有机物的结构简式如图所示,下列说法错误的是( )
A.该有机物属于烃的衍生物
B.该有机物含4种官能团
C.该有机物能发生消去反应
D.0.1mol该有机物与足量的Na反应,能得到标准状况下的气体2.24L
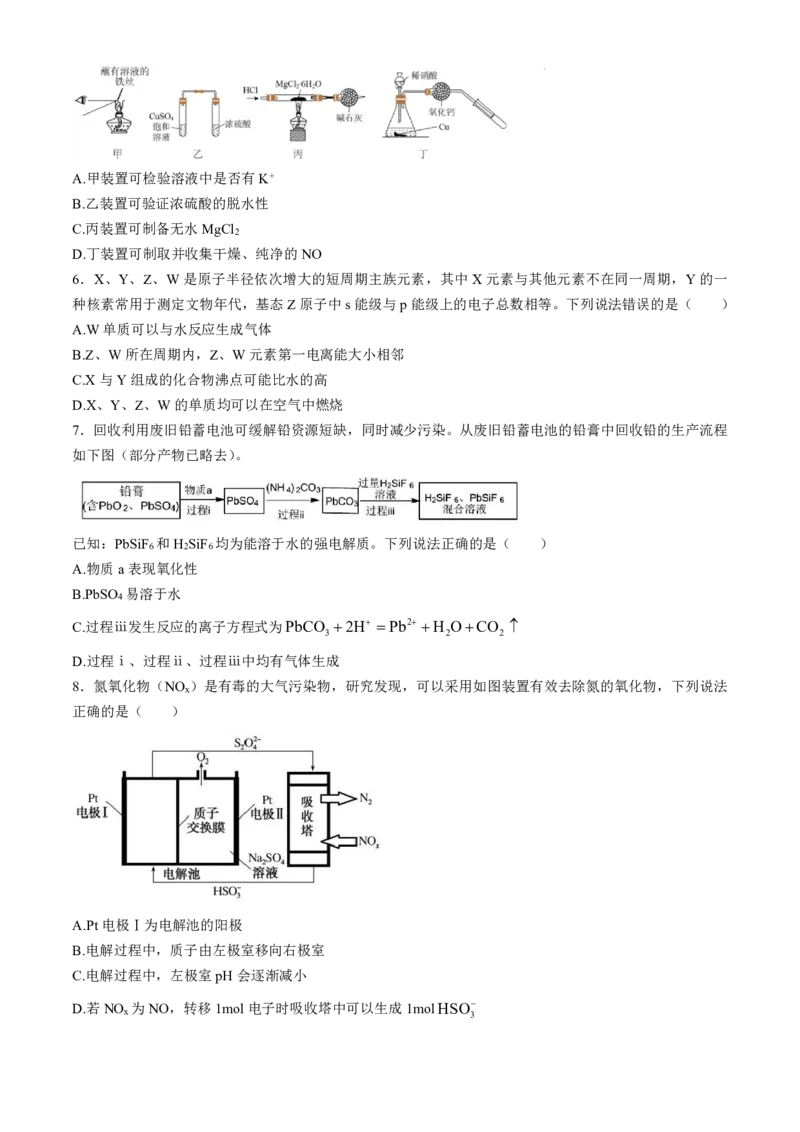
5.用如图所示装置(夹持装置均已省略)进行实验能达到目的的是( )
学科网(北京)股份有限公司A.甲装置可检验溶液中是否有K+
B.乙装置可验证浓硫酸的脱水性
C.丙装置可制备无水MgCl
2
D.丁装置可制取并收集干燥、纯净的NO
6.X、Y、Z、W是原子半径依次增大的短周期主族元素,其中X元素与其他元素不在同一周期,Y的一
种核素常用于测定文物年代,基态Z原子中s能级与p能级上的电子总数相等。下列说法错误的是( )
A.W单质可以与水反应生成气体
B.Z、W所在周期内,Z、W元素第一电离能大小相邻
C.X与Y组成的化合物沸点可能比水的高
D.X、Y、Z、W的单质均可以在空气中燃烧
7.回收利用废旧铅蓄电池可缓解铅资源短缺,同时减少污染。从废旧铅蓄电池的铅膏中回收铅的生产流程
如下图(部分产物已略去)。
已知:PbSiF 和H SiF 均为能溶于水的强电解质。下列说法正确的是( )
6 2 6
A.物质a表现氧化性
B.PbSO 易溶于水
4
C.过程ⅲ发生反应的离子方程式为PbCO 2H Pb2 H OCO
3 2 2
D.过程ⅰ、过程ⅱ、过程ⅲ中均有气体生成
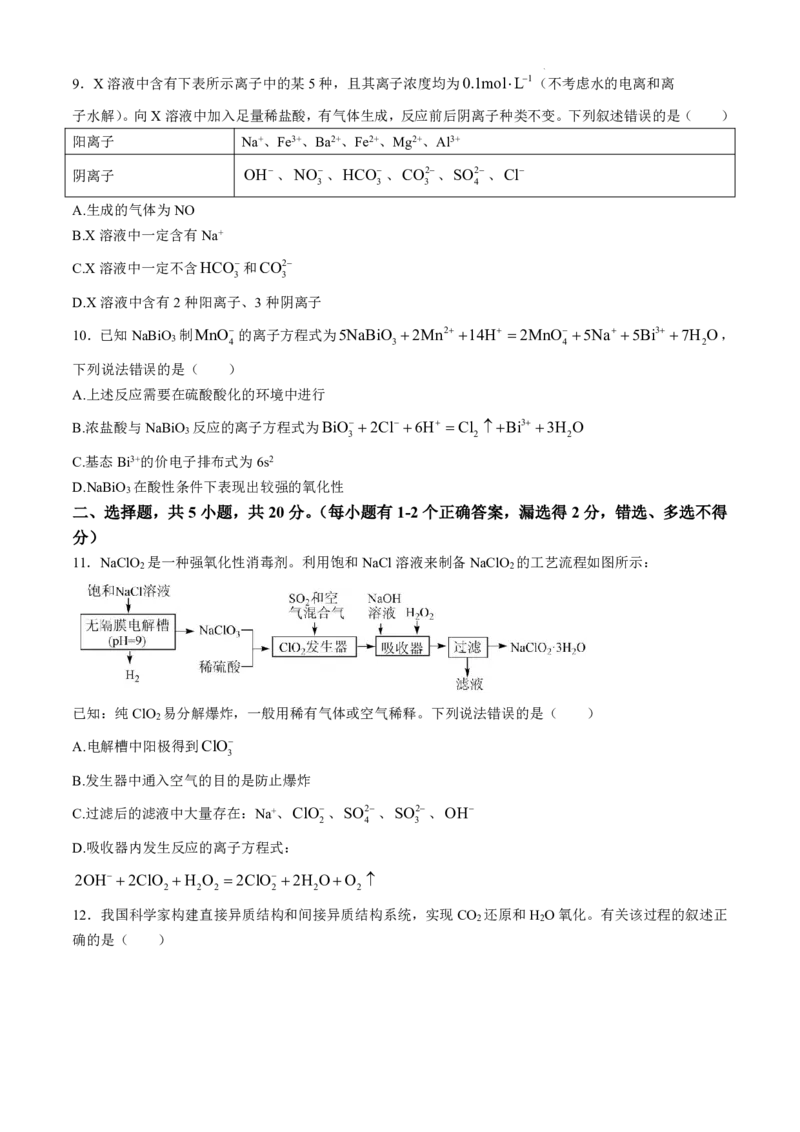
8.氮氧化物(NO )是有毒的大气污染物,研究发现,可以采用如图装置有效去除氮的氧化物,下列说法
x
正确的是( )
A.Pt电极Ⅰ为电解池的阳极
B.电解过程中,质子由左极室移向右极室
C.电解过程中,左极室pH会逐渐减小
D.若NO 为NO,转移1mol电子时吸收塔中可以生成1molHSO
x 3
学科网(北京)股份有限公司9.X溶液中含有下表所示离子中的某5种,且其离子浓度均为0.1molL1(不考虑水的电离和离
子水解)。向X溶液中加入足量稀盐酸,有气体生成,反应前后阴离子种类不变。下列叙述错误的是( )
阳离子 Na+、Fe3+、Ba2+、Fe2+、Mg2+、Al3+
阴离子 OH、NO、HCO、CO2、SO2、Cl
3 3 3 4
A.生成的气体为NO
B.X溶液中一定含有Na+
C.X溶液中一定不含HCO和CO2
3 3
D.X溶液中含有2种阳离子、3种阴离子
10.已知NaBiO 制MnO的离子方程式为5NaBiO 2Mn2 14H 2MnO 5Na 5Bi3 7H O,
3 4 3 4 2
下列说法错误的是( )
A.上述反应需要在硫酸酸化的环境中进行
B.浓盐酸与NaBiO 反应的离子方程式为BiO 2Cl 6H Cl Bi3 3H O
3 3 2 2
C.基态Bi3+的价电子排布式为6s2
D.NaBiO 在酸性条件下表现出较强的氧化性
3
二、选择题,共 5小题,共20分。(每小题有 1-2 个正确答案,漏选得2分,错选、多选不得
分)
11.NaClO 是一种强氧化性消毒剂。利用饱和NaCl溶液来制备NaClO 的工艺流程如图所示:
2 2
已知:纯ClO 易分解爆炸,一般用稀有气体或空气稀释。下列说法错误的是( )
2
A.电解槽中阳极得到ClO
3
B.发生器中通入空气的目的是防止爆炸
C.过滤后的滤液中大量存在:Na+、ClO、SO2、SO2、OH
2 4 3
D.吸收器内发生反应的离子方程式:
2OH 2ClO H O 2ClO 2H OO
2 2 2 2 2 2
12.我国科学家构建直接异质结构和间接异质结构系统,实现CO 还原和H O氧化。有关该过程的叙述正
2 2
确的是( )
学科网(北京)股份有限公司催化剂
A.总反应为:2H O2CO O 2HCOOH
2 2 2
B.金属Pt表面的反应为:Fe2 e Fe3
C.Fe2+/Fe3+作为氧化还原协同电对,可以换成I /I
2
D.该过程中不需补充Fe2+和Fe3+即可使反应正常进行
13.以Zn-Ni(OH) 原电池为电源电解处理工业废气CO 和SO ,工作原理如下:
2 2 2
已知:
①放电时,Zn转化为xZnCO ·yZn(OH)
3 2
②NaHCO 吸收废气后的混合液pH约为8
3
下列说法错误的是( )
A.当转移2mole-,有1molZn2+向Ni(OH) 电极迁移
2
B.a电极的反应式为 x y Zn2 x y e xCO2 2yOH xZnCO yZn OH
3 3 2
C.NaHCO 溶液的作用吸收废气CO 和SO
3 2 2
电解
D.乙装置中总反应为SO2 2CO H O SO2 H C O
3 2 2 4 2 2 4
14.下列实验的设计、现象和结论对应错误的是( )
选项 实验操作 现象 结论
溶液由无色变为蓝色 反应中Cu O既作氧化剂又作还
2
A 在稀H SO 中加入少量Cu O(s)
2 4 2
并有红色固体生成 原剂
B 向可能含苯酚的苯中加入适量浓溴水 未出现白色沉淀 苯中不含苯酚
加热浓硝酸,并将产生的气体通入淀粉 浓硝酸分解产生 NO 或挥发出
2
C 溶液变蓝
-KI溶液中 的硝酸蒸汽均可能氧化I-
Al (SO ) 溶液和CaCl 溶液均可
向Al (SO ) 溶液和 CaCl 溶液中分别加 2 4 3 2
D 2 4 3 2 均出现白色沉淀
入Na CO 溶液 使CO2的水解平衡正向移动
2 3 3
学科网(北京)股份有限公司
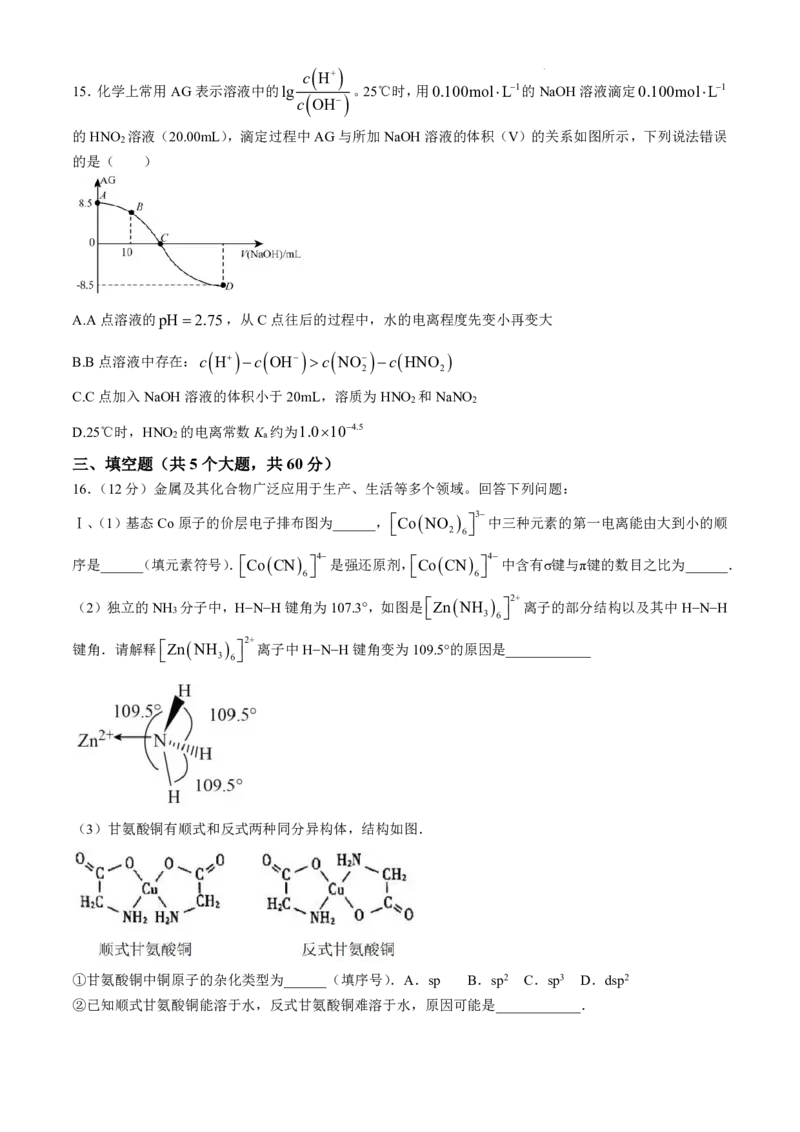
c H+
15.化学上常用AG表示溶液中的lg 。25℃时,用0.100molL1的NaOH溶液滴定0.100molL1
c
OH
的HNO 溶液(20.00mL),滴定过程中AG与所加NaOH溶液的体积(V)的关系如图所示,下列说法错误
2
的是( )
A.A点溶液的pH2.75,从C点往后的过程中,水的电离程度先变小再变大
B.B点溶液中存在:c H c OH c NO c HNO
2 2
C.C点加入NaOH溶液的体积小于20mL,溶质为HNO 和NaNO
2 2
D.25℃时,HNO 的电离常数K 约为1.0104.5
2 a
三、填空题(共 5个大题,共60分)
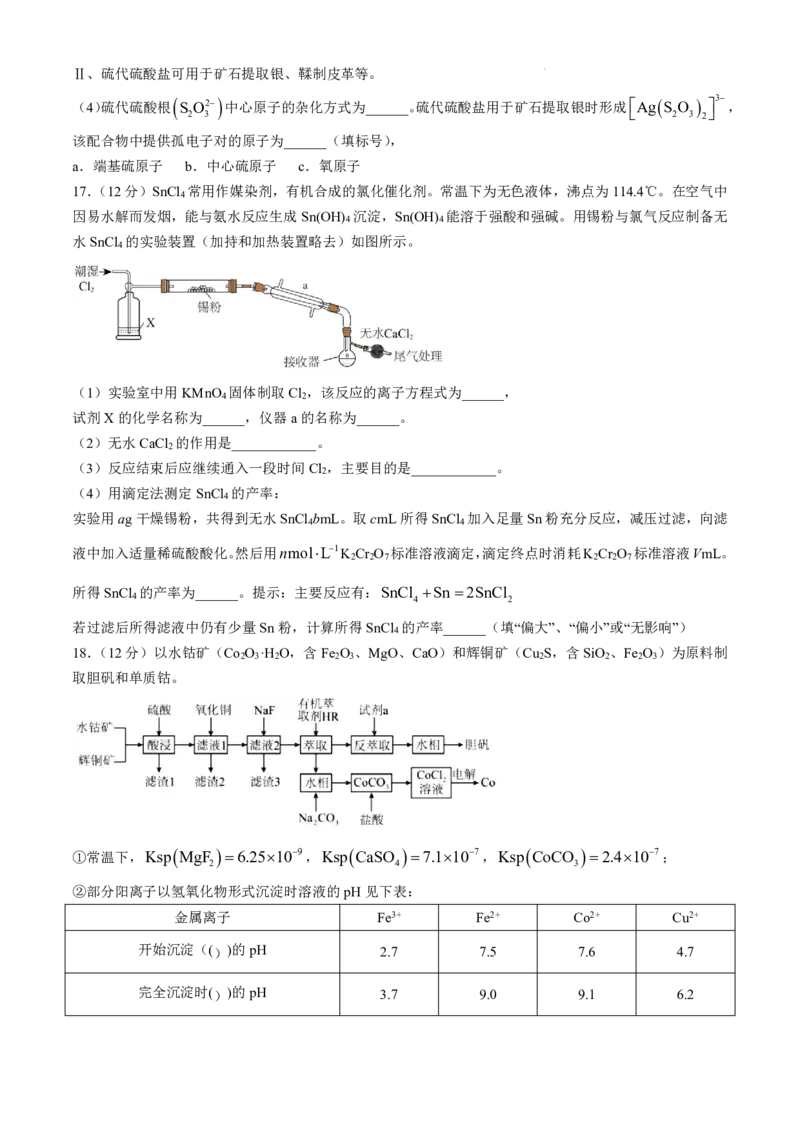
16.(12分)金属及其化合物广泛应用于生产、生活等多个领域。回答下列问题:
Ⅰ、(1)基态Co原子的价层电子排布图为______,
Co NO
2
6
3 中三种元素的第一电离能由大到小的顺
序是______(填元素符号).
Co CN
4 是强还原剂,
Co CN
4 中含有σ键与π键的数目之比为______.
6 6
(2)独立的NH
3
分子中,HNH键角为107.3,如图是
Zn NH
3
6
2+ 离子的部分结构以及其中HNH
键角.请解释
Zn NH
3
6
2+ 离子中HNH键角变为109.5°的原因是____________
(3)甘氨酸铜有顺式和反式两种同分异构体,结构如图.
①甘氨酸铜中铜原子的杂化类型为______(填序号).A.sp B.sp2 C.sp3 D.dsp2
②已知顺式甘氨酸铜能溶于水,反式甘氨酸铜难溶于水,原因可能是____________.
学科网(北京)股份有限公司Ⅱ、硫代硫酸盐可用于矿石提取银、鞣制皮革等。
(4)硫代硫酸根 S
2
O
3
2 中心原子的杂化方式为______。硫代硫酸盐用于矿石提取银时形成
Ag S
2
O
3
2
3 ,
该配合物中提供孤电子对的原子为______(填标号),
a.端基硫原子 b.中心硫原子 c.氧原子
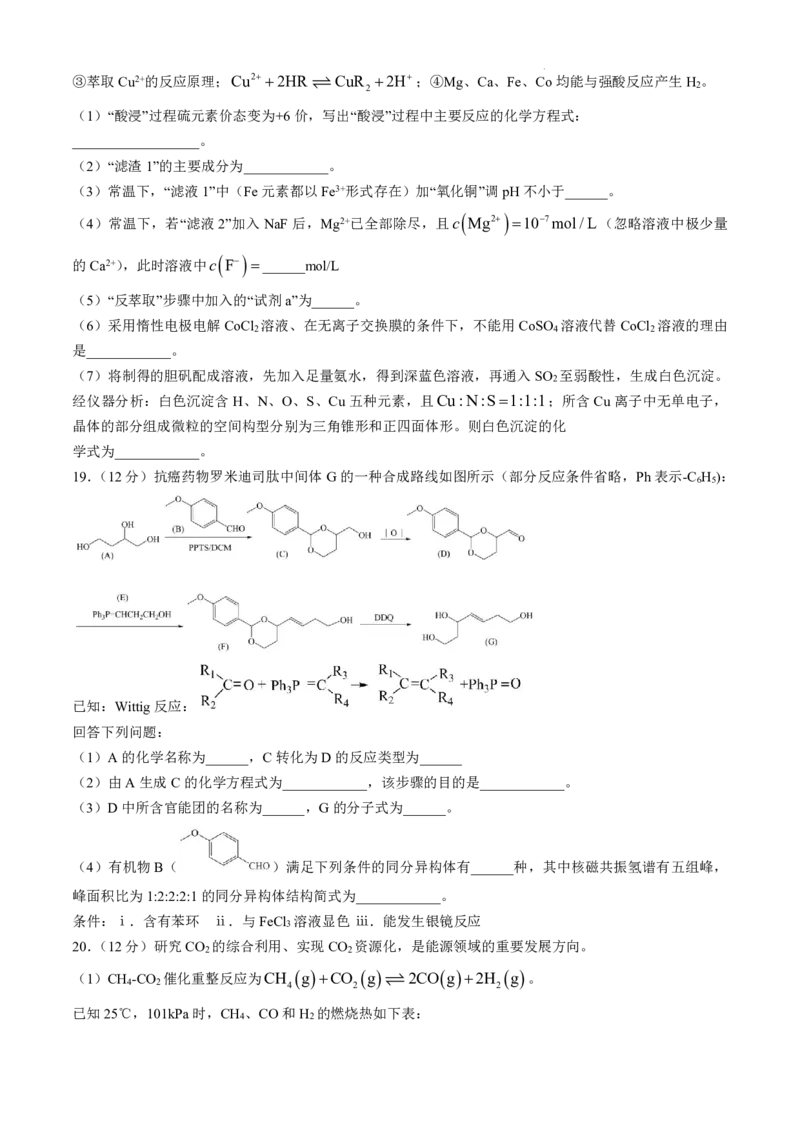
17.(12分)SnCl 常用作媒染剂,有机合成的氯化催化剂。常温下为无色液体,沸点为114.4℃。在空气中
4
因易水解而发烟,能与氨水反应生成Sn(OH) 沉淀,Sn(OH) 能溶于强酸和强碱。用锡粉与氯气反应制备无
4 4
水SnCl 的实验装置(加持和加热装置略去)如图所示。
4
(1)实验室中用KMnO 固体制取Cl ,该反应的离子方程式为______,
4 2
试剂X的化学名称为______,仪器a的名称为______。
(2)无水CaCl 的作用是____________。
2
(3)反应结束后应继续通入一段时间Cl ,主要目的是____________。
2
(4)用滴定法测定SnCl 的产率:
4
实验用ag干燥锡粉,共得到无水SnCl bmL。取cmL所得SnCl 加入足量Sn粉充分反应,减压过滤,向滤
4 4
液中加入适量稀硫酸酸化。然后用nmolL1K Cr O 标准溶液滴定,滴定终点时消耗K Cr O 标准溶液VmL。
2 2 7 2 2 7
所得SnCl 的产率为______。提示:主要反应有:SnCl Sn 2SnCl
4 4 2
若过滤后所得滤液中仍有少量Sn粉,计算所得SnCl 的产率______(填“偏大”、“偏小”或“无影响”)
4
18.(12分)以水钴矿(Co O ·H O,含Fe O 、MgO、CaO)和辉铜矿(Cu S,含SiO 、Fe O )为原料制
2 3 2 2 3 2 2 2 3
取胆矾和单质钴。
①常温下,Ksp MgF 6.25109,Ksp CaSO 7.1107,Ksp CoCO 2.4107;
2 4 3
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
金属离子 Fe3+ Fe2+ Co2+ Cu2+
开始沉淀(())的pH
2.7 7.5 7.6 4.7
完全沉淀时())的pH
3.7 9.0 9.1 6.2
学科网(北京)股份有限公司③萃取Cu2+的反应原理;Cu2 2HR CuR 2H;④Mg、Ca、Fe、Co均能与强酸反应产生H 。
2 2
(1)“酸浸”过程硫元素价态变为+6价,写出“酸浸”过程中主要反应的化学方程式:
__________________。
(2)“滤渣1”的主要成分为____________。
(3)常温下,“滤液1”中(Fe元素都以Fe3+形式存在)加“氧化铜”调pH不小于______。
(4)常温下,若“滤液2”加入NaF后,Mg2+已全部除尽,且c Mg2 107mol/L(忽略溶液中极少量
的Ca2+),此时溶液中c
F
______mol/L
(5)“反萃取”步骤中加入的“试剂a”为______。
(6)采用惰性电极电解CoCl 溶液、在无离子交换膜的条件下,不能用CoSO 溶液代替CoCl 溶液的理由
2 4 2
是____________。
(7)将制得的胆矾配成溶液,先加入足量氨水,得到深蓝色溶液,再通入SO 至弱酸性,生成白色沉淀。
2
经仪器分析:白色沉淀含H、N、O、S、Cu五种元素,且Cu:N:S1:1:1;所含Cu离子中无单电子,
晶体的部分组成微粒的空间构型分别为三角锥形和正四面体形。则白色沉淀的化
学式为____________。
19.(12分)抗癌药物罗米迪司肽中间体G的一种合成路线如图所示(部分反应条件省略,Ph表示-C H ):
6 5
已知:Wittig反应:
回答下列问题:
(1)A的化学名称为______,C转化为D的反应类型为______
(2)由A生成C的化学方程式为____________,该步骤的目的是____________。
(3)D中所含官能团的名称为______,G的分子式为______。
(4)有机物B( )满足下列条件的同分异构体有______种,其中核磁共振氢谱有五组峰,
峰面积比为1:2:2:2:1的同分异构体结构简式为____________。
条件:ⅰ.含有苯环 ⅱ.与FeCl 溶液显色 ⅲ.能发生银镜反应
3
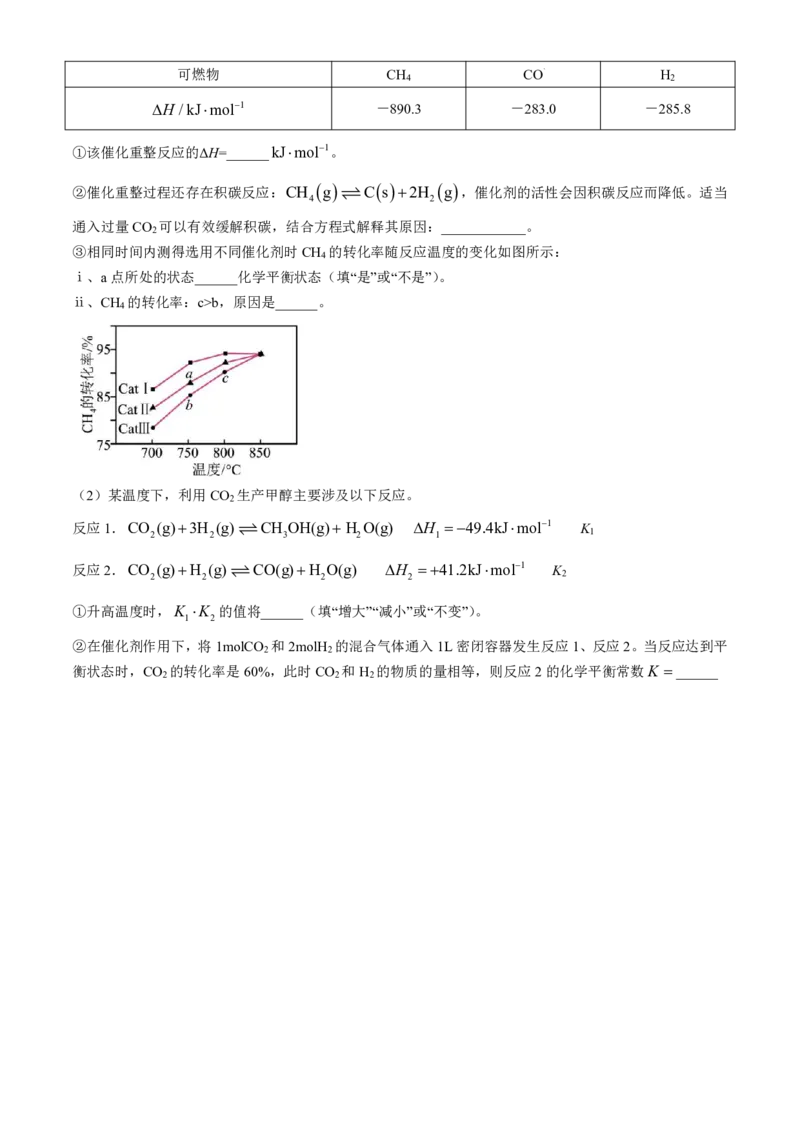
20.(12分)研究CO 的综合利用、实现CO 资源化,是能源领域的重要发展方向。
2 2
(1)CH -CO 催化重整反应为CH g CO g 2CO g 2H g 。
4 2 4 2 2
已知25℃,101kPa时,CH 、CO和H 的燃烧热如下表:
4 2
学科网(北京)股份有限公司可燃物 CH CO H
4 2
H /kJmol1 -890.3 -283.0 -285.8
①该催化重整反应的ΔH=______kJmol1。
②催化重整过程还存在积碳反应:CH g C s 2H g ,催化剂的活性会因积碳反应而降低。适当
4 2
通入过量CO 可以有效缓解积碳,结合方程式解释其原因:____________。
2
③相同时间内测得选用不同催化剂时CH 的转化率随反应温度的变化如图所示:
4
ⅰ、a点所处的状态______化学平衡状态(填“是”或“不是”)。
ⅱ、CH 的转化率:c>b,原因是______。
4
(2)某温度下,利用CO 生产甲醇主要涉及以下反应。
2
反应1.CO (g)3H (g) CH OH(g) H O(g) H 49.4kJmol1 K
2 2 3 2 1 1
反应2.CO (g)H (g) CO(g)H O(g) H 41.2kJmol1 K
2 2 2 2 2
①升高温度时,K K 的值将______(填“增大”“减小”或“不变”)。
1 2
②在催化剂作用下,将1molCO 和2molH 的混合气体通入1L密闭容器发生反应1、反应2。当反应达到平
2 2
衡状态时,CO 的转化率是60%,此时CO 和H 的物质的量相等,则反应2的化学平衡常数K ______
2 2 2
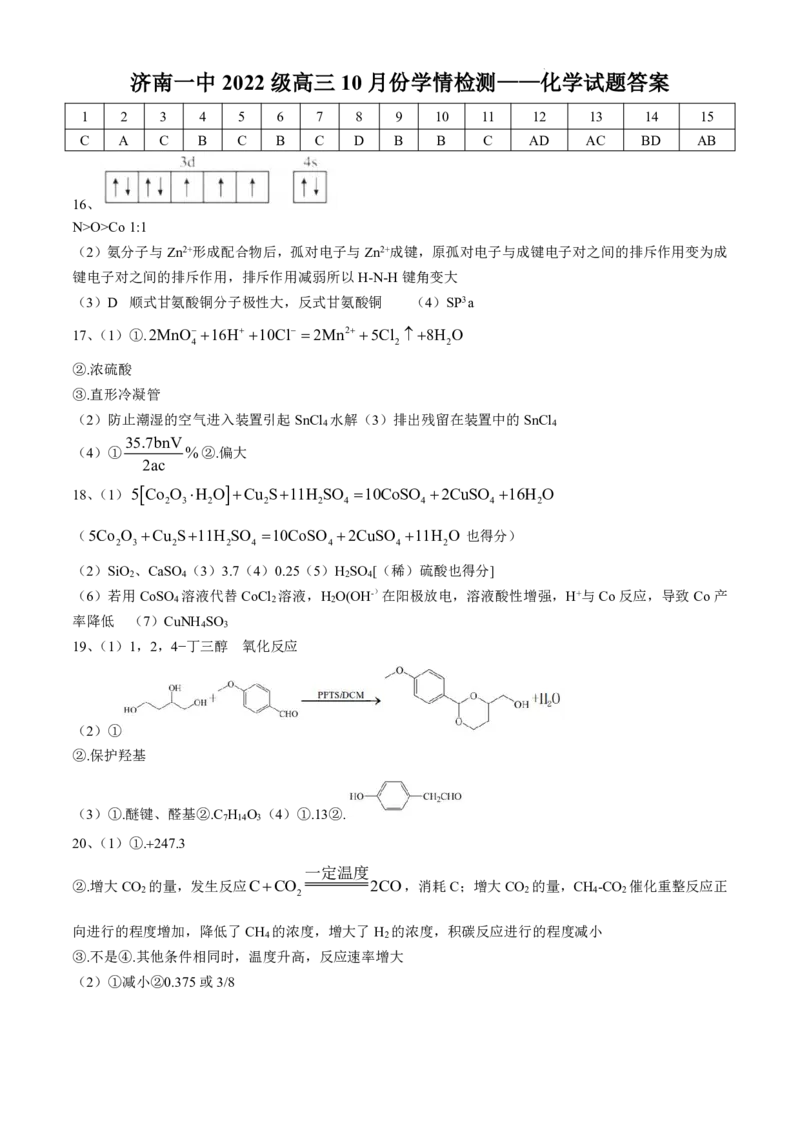
学科网(北京)股份有限公司济南一中 2022 级高三 10 月份学情检测——化学试题答案
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15
C A C B C B C D B B C AD AC BD AB
16、
N>O>Co1:1
(2)氨分子与Zn2+形成配合物后,孤对电子与Zn2+成键,原孤对电子与成键电子对之间的排斥作用变为成
键电子对之间的排斥作用,排斥作用减弱所以H-N-H键角变大
(3)D 顺式甘氨酸铜分子极性大,反式甘氨酸铜 (4)SP3a
17、(1)①.2MnO 16H 10Cl 2Mn2 5Cl 8H O
4 2 2
②.浓硫酸
③.直形冷凝管
(2)防止潮湿的空气进入装置引起SnCl 水解(3)排出残留在装置中的SnCl
4 4
35.7bnV
(4)① %②.偏大
2ac
18、(1)5 Co O H O Cu S11H SO 10CoSO 2CuSO 16H O
2 3 2 2 2 4 4 4 2
(5Co O Cu S11H SO 10CoSO 2CuSO 11H O 也得分)
2 3 2 2 4 4 4 2
(2)SiO 、CaSO (3)3.7(4)0.25(5)H SO [(稀)硫酸也得分]
2 4 2 4
(6)若用CoSO 溶液代替CoCl 溶液,H O(OH-)在阳极放电,溶液酸性增强,H+与Co反应,导致Co产
4 2 2
率降低 (7)CuNH SO
4 3
19、(1)1,2,4−丁三醇 氧化反应
(2)①
②.保护羟基
(3)①.醚键、醛基②.C H O (4)①.13②.
7 14 3
20、(1)①.247.3
一定温度
②.增大CO 的量,发生反应CCO 2CO,消耗C;增大CO 的量,CH -CO 催化重整反应正
2 2 2 4 2
向进行的程度增加,降低了CH 的浓度,增大了H 的浓度,积碳反应进行的程度减小
4 2
③.不是④.其他条件相同时,温度升高,反应速率增大
(2)①减小②0.375或3/8
学科网(北京)股份有限公司