文档内容
长春外国语学校2025-2026学年第一学期期中考试高二年级
C.该反应的平衡常数表达式K=
化学试卷(选考)
D.反应中每消耗11.2L NO,转移电子数目为6.02×1023
出题人 :姚林然 审题人:高凯
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,共 6页。考试结束后,将答题 5.设N A 为阿伏加德罗常数的值。下列说法不正确的是
卡交回。 A.2molSO 2 与1molO 2 置于容器中,充分反应,转移的电子数为4N A
注意事项: B.铅蓄电池中,当正极质量增加9.6g时,电路中通过的电子数目为0.3N A
1.答题前,考生先将自己的姓名、准考证号填写清楚,将条形码准确粘贴在考生信息条形码粘 C.11.2L CH
4
和22.4L Cl
2
(均为标准状况)在光照下充分反应后的分子数为1.5N
A
贴区。 D.1L0.1mol·L−1NaCO 溶液,阴离子总数大于0.1N
2 3 A
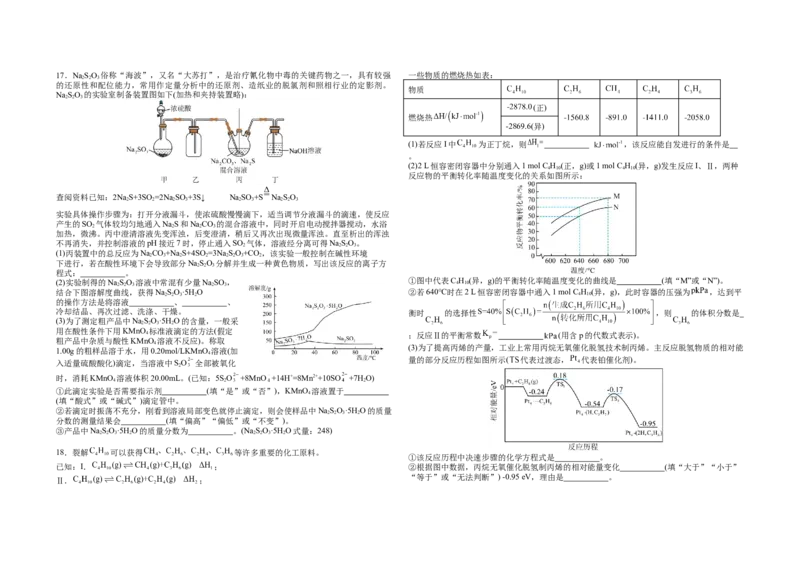
2.选择题必须使用2B铅笔填涂;非选择题必须使用0.5毫米黑色字迹的签字笔书写,字体工整、 6.下列实验操作对应的装置或试剂正确的是
笔迹清楚。
3.请按照题号顺序在各题目的答题区域内作答,超出答题区域书写的答案无效;在草稿纸、试
题卷上答题无效。
4.作图可先使用铅笔画出,确定后必须用黑色字迹的签字笔描黑。
5.保持卡面清洁,不要折叠,不要弄破、弄皱,不准使用涂改液、修正带、刮纸刀。
可能用到的相对原子质量:H-1 O-16 Na-23 S-32 Co-59 Pb-207
第Ⅰ卷
一、选择题:本题共15小题,每小题3分。在每小题给出的四个选项中,只有一项是符合题
A.配制一定物质的量浓度的KCl溶液 B.测定氯水的pH
目要求的。
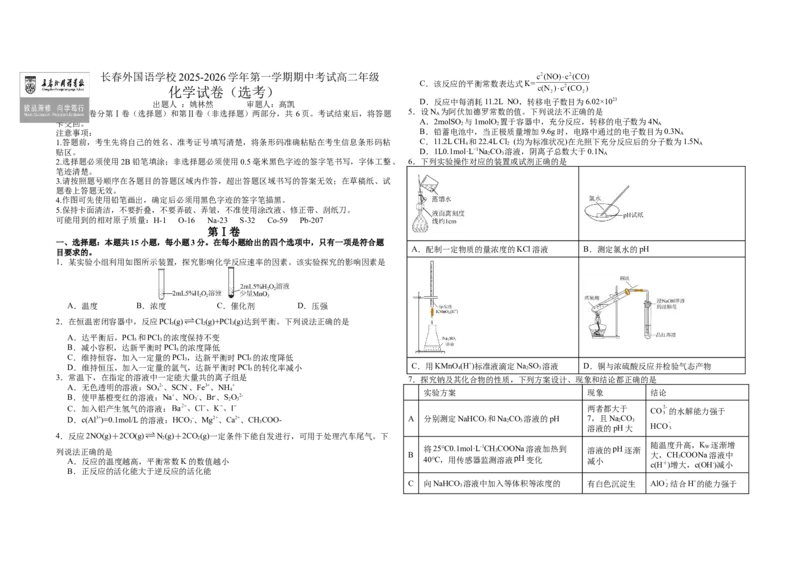
1.某实验小组利用如图所示装置,探究影响化学反应速率的因素。该实验探究的影响因素是
A.温度 B.浓度 C.催化剂 D.压强
2.在恒温密闭容器中,反应PCl (g) Cl(g)+PCl (g)达到平衡。下列说法正确的是
5 2 3
A.达平衡后,PCl 和PCl 的浓度保持不变
5 3
B.减小容积,达新平衡时PCl 的浓度降低
5
C.维持恒容,加入一定量的PCl ,达新平衡时PCl 的浓度降低
3 5
D.维持恒压,加入一定量的氩气,达新平衡时PCl 5 的转化率减小 C.用KMnO 4 (H+)标准液滴定Na 2 SO 3 溶液 D.铜与浓硫酸反应并检验气态产物
3.常温下,在指定的溶液中一定能大量共的离子组是 7.探究钠及其化合物的性质,下列方案设计、现象和结论都正确的是
A.无色透明的溶液:SO 2-、SCN-、Fe3+、NH +
4 4 实验方案 现象 结论
B.使甲基橙变红的溶液:Na+、NO -、Br-、SO2-
3 2 3
C.加入铝产生氢气的溶液: 两者都大于
CO 的水解能力强于
D.c(Al3+)=0.1mol/L的溶液:HCO 3 -、Mg2+、Ca2+、CH 3 COO- A 分别测定NaHCO 3 和Na 2 CO 3 溶液的pH 7,且Na 2 CO 3
溶液的pH大 HCO
4.反应2NO(g)+2CO(g) N(g)+2CO(g)一定条件下能自发进行,可用于处理汽车尾气。下
2 2
随温度升高,K 逐渐增
列说法正确的是 将25℃0.1mol·L-1CH 3 COONa溶液加热到 溶液的 逐渐 W
B 大,CHCOONa溶液中
A.反应的温度越高,平衡常数K的数值越小 40℃,用传感器监测溶液 变化 减小 3
c(H+)增大,c(OH-)减小
B.正反应的活化能大于逆反应的活化能
C 向NaHCO 溶液中加入等体积等浓度的 有白色沉淀生 AlO 结合H+的能力强于
3B.a点:
NaAlO 溶液 成 CO
2
C.b点溶液呈酸性的原因是有HCO 生成
2 3
测定中和热时,将稀 溶液缓慢倒入
中和反应放热,将 代入 D.该样品溶液中
D 到盛有稀 的内筒,搅拌使其充分混 温度差为
公式算得中和热( )
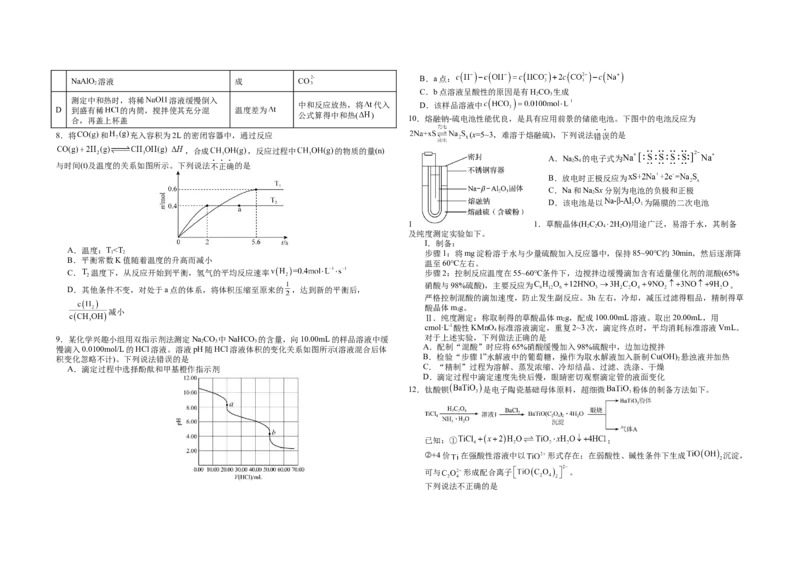
合,再盖上杯盖 10.熔融钠-硫电池性能优良,是具有应用前景的储能电池。下图中的电池反应为
8.将 和 充入容积为2L的密闭容器中,通过反应 (x=5~3,难溶于熔融硫),下列说法错误的是
,合成 ,反应过程中 的物质的量(n)
A.NaS 的电子式为
2 4
与时间(t)及温度的关系如图所示。下列说法不正确的是
B.放电时正极反应为
C.Na和NaSx分别为电池的负极和正极
2
D.该电池是以 为隔膜的二次电池
1 1.草酸晶体(H C O⋅2HO)用途广泛,易溶于水,其制备
2 2 4 2
及纯度测定实验如下。
I.制备:
A.温度:T”或“<”或“=”)
。
(5)①“除钙镁”后,滤液中 时, 。
②若“调pH”时溶液的pH偏低,将会导致 、 沉淀不完全,其原因是 。
(6)将 在空气中加热最终可得到钴的氧化物。分解时测得残留固体的质量随温度
变化的曲线如图所示。[已知: ]
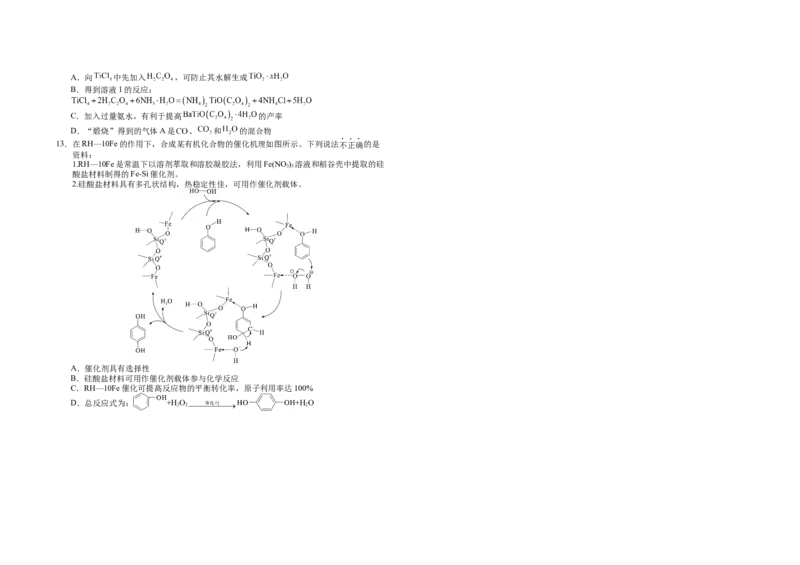
经测定,A→B过程中产生的气体只有 ,此过程中发生反应的化学方程式为 。题号 1 2 3 4 5 6 7 8 9 10
(2) 、
答案 C A C A A D C C B C
题号 11 12 13 14 15
答案 C C C D A
(3)
16
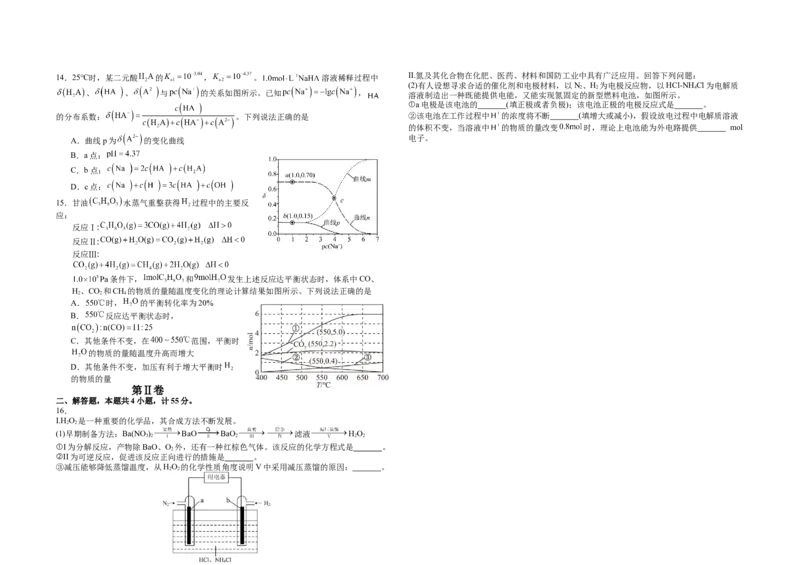
(4) >
(1) 2Ba(NO ) 2BaO+ O ↑+4NO↑ (5) pH偏低, 浓度过大, 和 结合成HF分子,降低了 浓度,导
3 2 2 2
增大压强或增大氧气的浓度或降低温度
致 、 溶解平衡向溶解方向移动
HO 受热易分解
2 2
(2) 正极 N+8H++6e-=2 减小 2.4
2 (6)
17
(1)S O +2H+=S↓+SO ↑+HO
2 2 2
(2)蒸发浓缩 趁热过滤
(3)否 酸式 偏低 62%
18
(1) 高温
(2) N (或 )
(3) 无法判断 因为 和H从 表面解吸需要能
量,而 成键又放出能量,没有给出二者的数据(合理即可)
19
(1)将含钴废料粉碎(或其他合理答案)