文档内容
高二化学
可能用到的相对原子质量:H-1 C-12 N-14 Mg-24
一、选择题(本题共 14 小题,每小题 3 分,共计 42 分。)
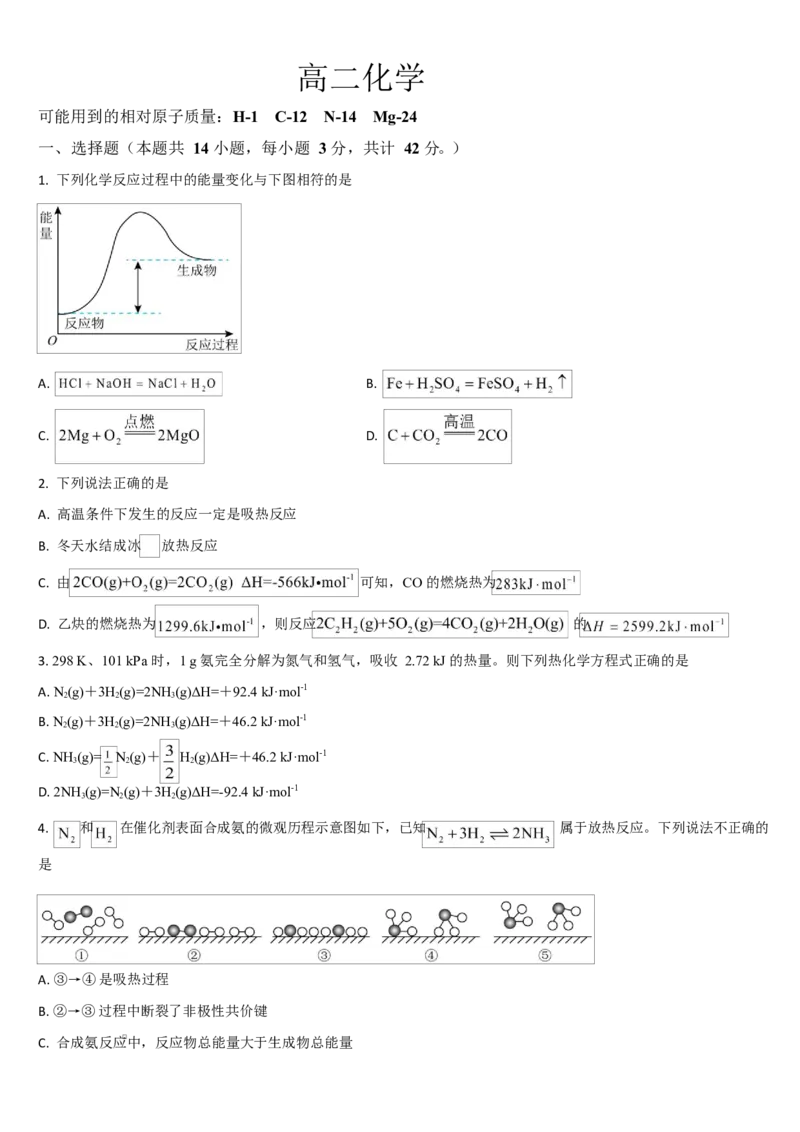
1. 下列化学反应过程中的能量变化与下图相符的是
A. B.
C. D.
2. 下列说法正确的是
A. 高温条件下发生的反应一定是吸热反应
B. 冬天水结成冰 放热反应
C. 由 可知,CO 的燃烧热为
D. 乙炔的燃烧热为 ,则反应 的
3. 298 K、101 kPa 时,1 g 氨完全分解为氮气和氢气,吸收 2.72 kJ 的热量。则下列热化学方程式正确的是
A. N(g)+3H(g)=2NH (g)ΔH=+92.4 kJ·mol-1
2 2 3
B. N(g)+3H(g)=2NH (g)ΔH=+46.2 kJ·mol-1
2 2 3
C. NH (g)= N(g)+ H(g)ΔH=+46.2 kJ·mol-1
3 2 2
D. 2NH (g)=N(g)+3H(g)ΔH=-92.4 kJ·mol-1
3 2 2
4. 和 在催化剂表面合成氨的微观历程示意图如下,已知 属于放热反应。下列说法不正确的
是
A. ③→④是吸热过程
B. ②→③过程中断裂了非极性共价键
C. 合成氨反应中,反应物总能量大于生成物总能量D. 合成氨反应中,反应物断键吸收的能量小于生成物成键释放的能量
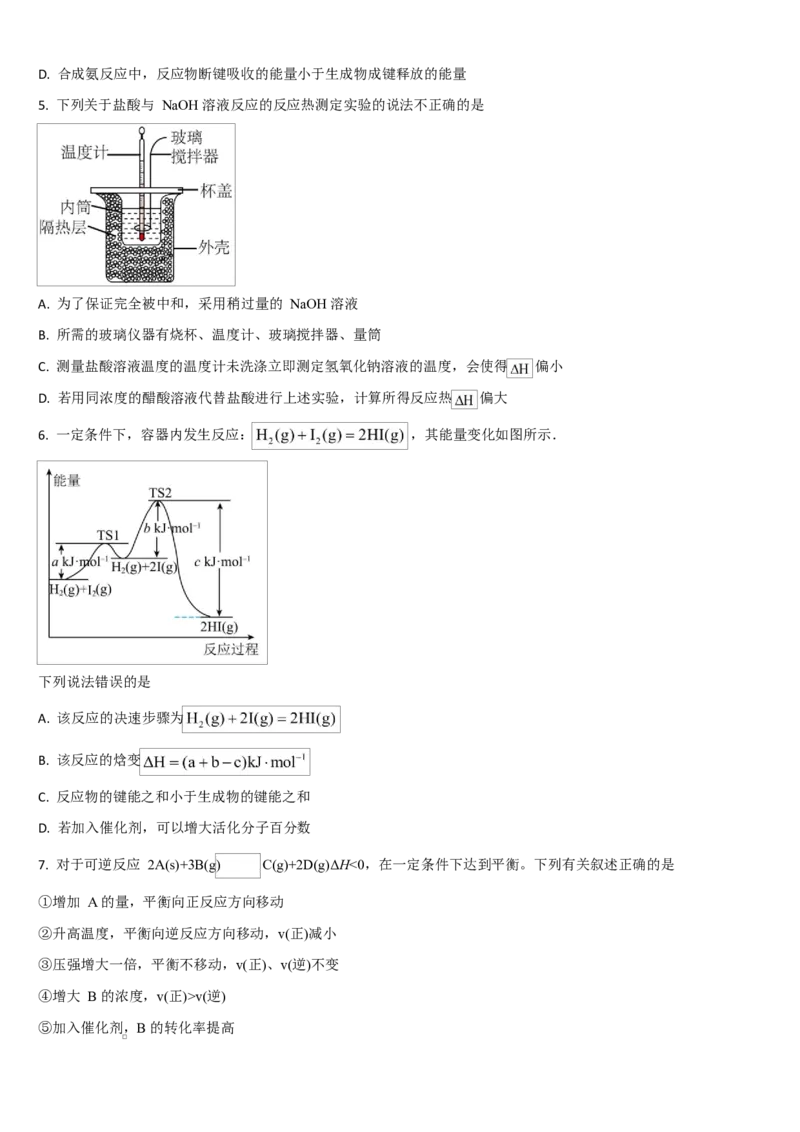
5. 下列关于盐酸与 NaOH 溶液反应的反应热测定实验的说法不正确的是
A. 为了保证完全被中和,采用稍过量的 NaOH 溶液
B. 所需的玻璃仪器有烧杯、温度计、玻璃搅拌器、量筒
C. 测量盐酸溶液温度的温度计未洗涤立即测定氢氧化钠溶液的温度,会使得 偏小
D. 若用同浓度的醋酸溶液代替盐酸进行上述实验,计算所得反应热 偏大
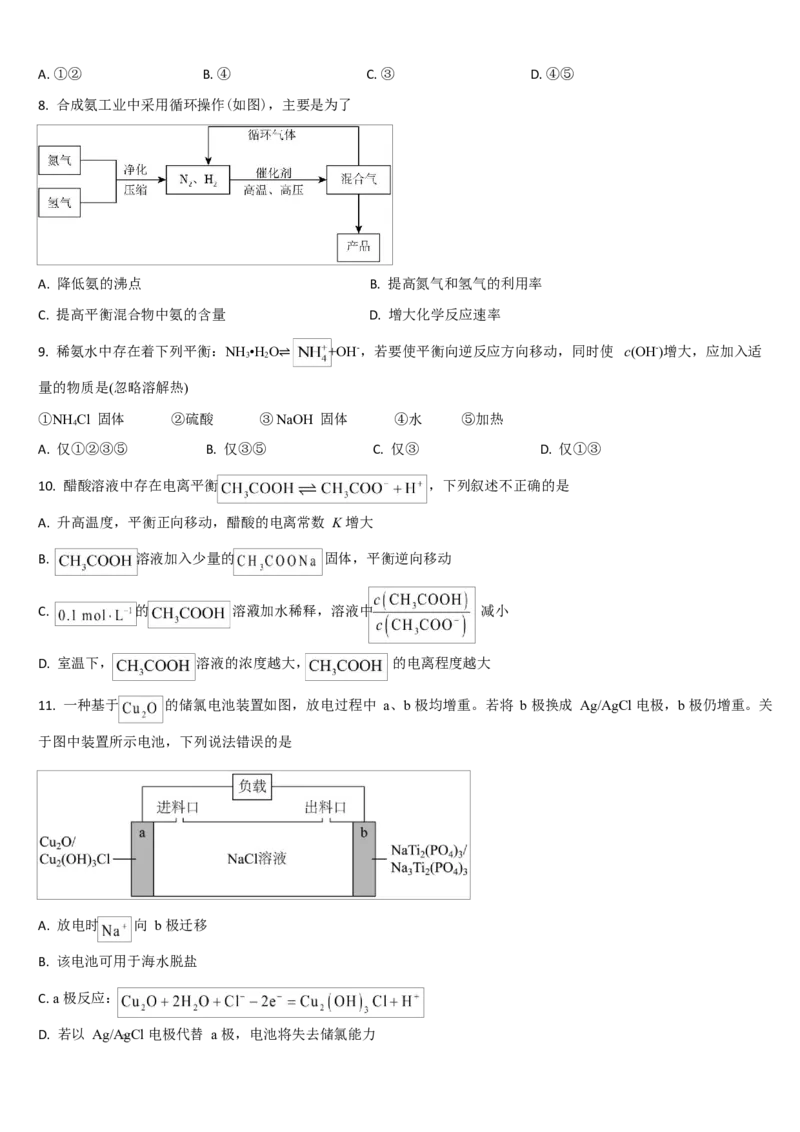
6. 一定条件下,容器内发生反应: ,其能量变化如图所示.
下列说法错误的是
A. 该反应的决速步骤为
B. 该反应的焓变
C. 反应物的键能之和小于生成物的键能之和
D. 若加入催化剂,可以增大活化分子百分数
7. 对于可逆反应 2A(s)+3B(g) C(g)+2D(g)ΔH<0,在一定条件下达到平衡。下列有关叙述正确的是
①增加 A 的量,平衡向正反应方向移动
②升高温度,平衡向逆反应方向移动,v(正)减小
③压强增大一倍,平衡不移动,v(正)、v(逆)不变
④增大 B 的浓度,v(正)>v(逆)
⑤加入催化剂,B 的转化率提高A. ①② B. ④ C. ③ D. ④⑤
8. 合成氨工业中采用循环操作(如图),主要是为了
A. 降低氨的沸点 B. 提高氮气和氢气的利用率
C. 提高平衡混合物中氨的含量 D. 增大化学反应速率
9. 稀氨水中存在着下列平衡:NH •H O +OH-,若要使平衡向逆反应方向移动,同时使 c(OH-)增大,应加入适
3 2
量的物质是(忽略溶解热) ⇌
①NH Cl 固体 ②硫酸 ③NaOH 固体 ④水 ⑤加热
4
A. 仅①②③⑤ B. 仅③⑤ C. 仅③ D. 仅①③
10. 醋酸溶液中存在电离平衡 ,下列叙述不正确的是
A. 升高温度,平衡正向移动,醋酸的电离常数 K 增大
B. 溶液加入少量的 固体,平衡逆向移动
C. 的 溶液加水稀释,溶液中 减小
D. 室温下, 溶液的浓度越大, 的电离程度越大
11. 一种基于 的储氯电池装置如图,放电过程中 a、b 极均增重。若将 b 极换成 Ag/AgCl 电极,b 极仍增重。关
于图中装置所示电池,下列说法错误的是
A. 放电时 向 b 极迁移
B. 该电池可用于海水脱盐
C. a 极反应:
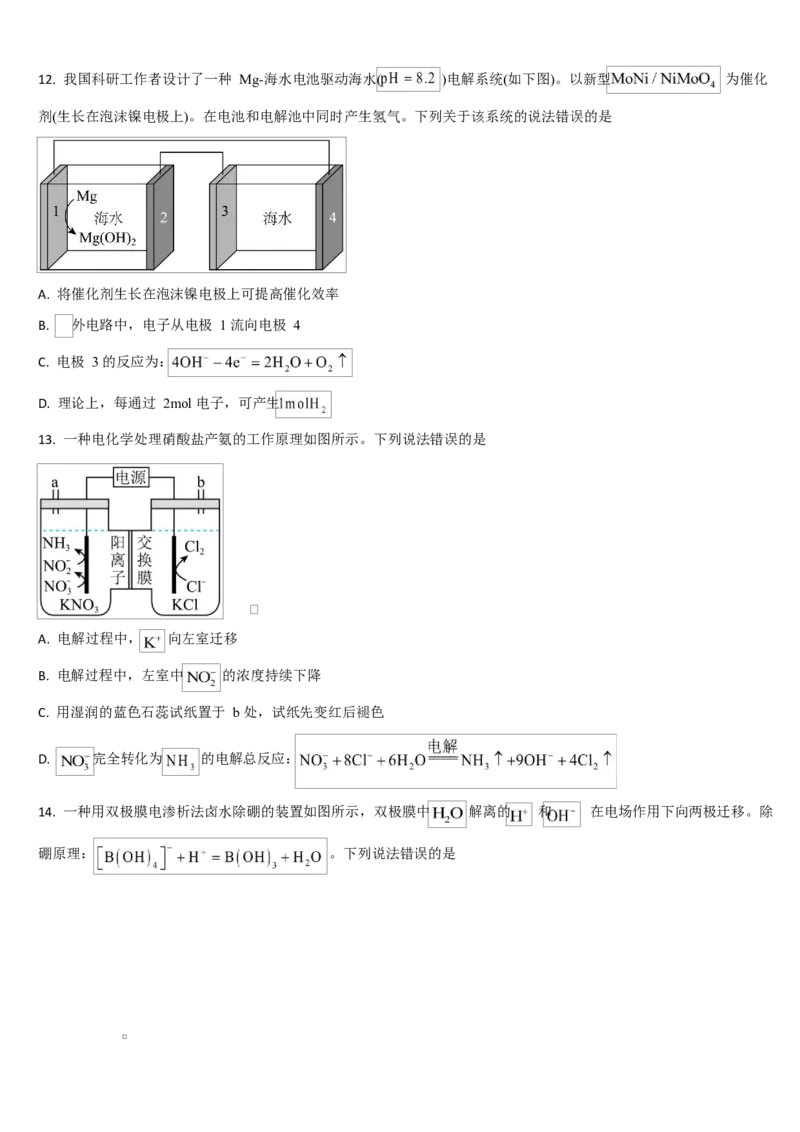
D. 若以 Ag/AgCl 电极代替 a 极,电池将失去储氯能力12. 我国科研工作者设计了一种 Mg-海水电池驱动海水( )电解系统(如下图)。以新型 为催化
剂(生长在泡沫镍电极上)。在电池和电解池中同时产生氢气。下列关于该系统的说法错误的是
A. 将催化剂生长在泡沫镍电极上可提高催化效率
B. 外电路中,电子从电极 1 流向电极 4
C. 电极 3 的反应为:
D. 理论上,每通过 2mol 电子,可产生
13. 一种电化学处理硝酸盐产氨的工作原理如图所示。下列说法错误的是
A. 电解过程中, 向左室迁移
B. 电解过程中,左室中 的浓度持续下降
C. 用湿润的蓝色石蕊试纸置于 b 处,试纸先变红后褪色
D. 完全转化为 的电解总反应:
14. 一种用双极膜电渗析法卤水除硼的装置如图所示,双极膜中 解离的 和 在电场作用下向两极迁移。除
硼原理: 。下列说法错误的是A. Pt 电极反应:
B. 外加电场可促进双极膜中水的电离
C. Ⅲ室中,X 膜、Y 膜分别为阳离子交换膜和阴离子交换膜
D. Ⅳ室每生成 ,同时Ⅱ室最多生成
二、填空题(本大题共 4 小题,58 分)
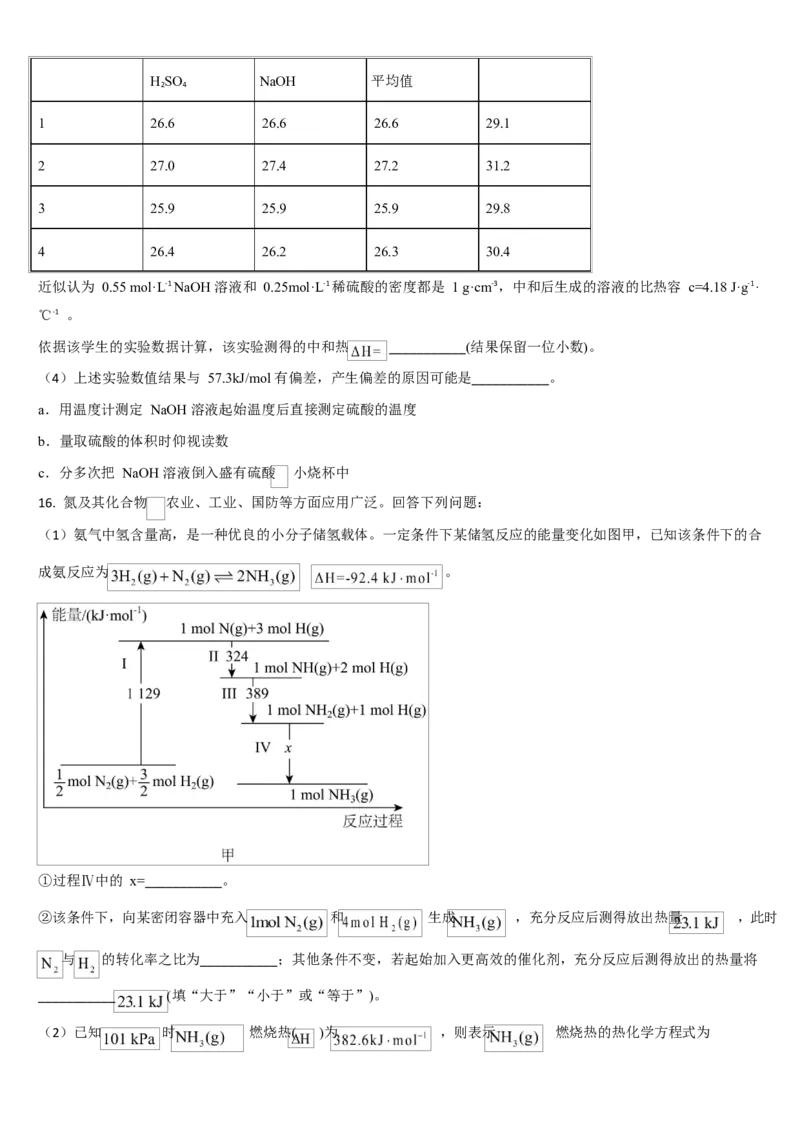
15. 中和热的测定是高中重要的定量实验。取 0.55mol/L 的 NaOH 溶液 50mL 与 0.25mol/L 的硫酸 50mL 置于如图所示
的装置中进行中和热的测定实验,回答下列问题:
(1)从如图实验装置看,其中缺少的一种玻璃用品是___________。
(2)若改用 和 溶液进行反应与上述实验相比,所放出的热量
___________(填“相等”“不相等”),若实验操作均正确,则所求中和热___________(填“相等”“不相等”),用相同浓
度和
体积的氨水( )代替 NaOH 溶液进行上述实验,测得的中和热的数值会___________(填“偏大”、“偏
小”、“无影
响”) 。
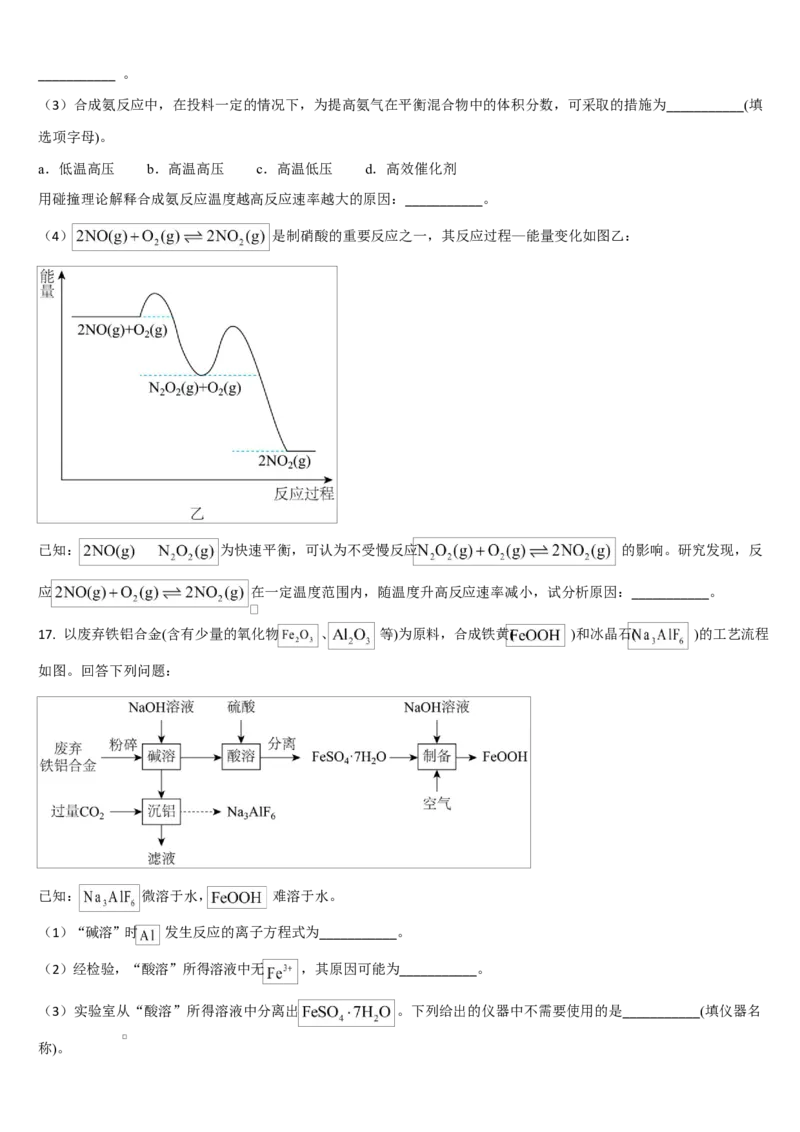
(3)某学生实验记录数据如下:
实验次数 起始温度 T /℃ 终止温度 T /℃
1 2H SO NaOH 平均值
2 4
1 26.6 26.6 26.6 29.1
2 27.0 27.4 27.2 31.2
3 25.9 25.9 25.9 29.8
4 26.4 26.2 26.3 30.4
近似认为 0.55 mol·L-1 NaOH 溶液和 0.25mol·L-1 稀硫酸的密度都是 1 g·cm-3,中和后生成的溶液的比热容 c=4.18 J·g-1·
℃-1 。
依据该学生的实验数据计算,该实验测得的中和热 ___________(结果保留一位小数)。
(4)上述实验数值结果与 57.3kJ/mol 有偏差,产生偏差的原因可能是___________。
a.用温度计测定 NaOH 溶液起始温度后直接测定硫酸的温度
b.量取硫酸的体积时仰视读数
c.分多次把 NaOH 溶液倒入盛有硫酸 小烧杯中
16. 氮及其化合物 农业、工业、国防等方面应用广泛。回答下列问题:
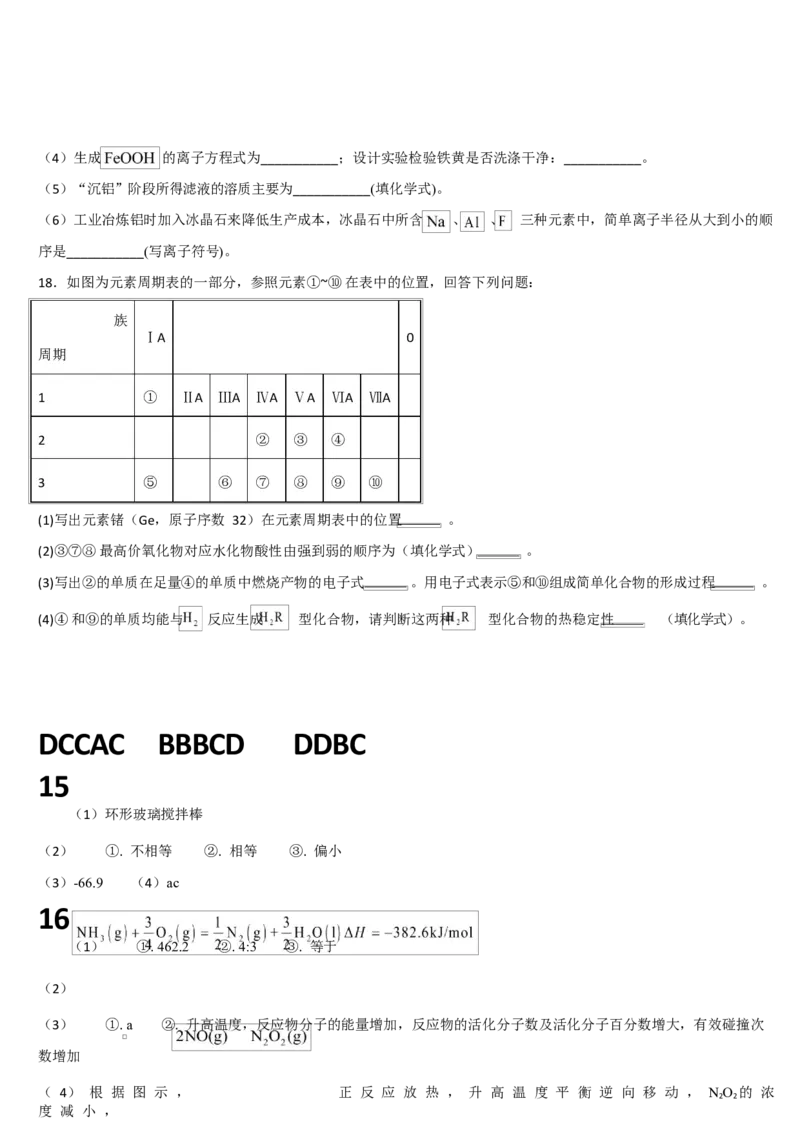
(1)氨气中氢含量高,是一种优良的小分子储氢载体。一定条件下某储氢反应的能量变化如图甲,已知该条件下的合
成氨反应为 。
①过程Ⅳ中的 x=___________。
②该条件下,向某密闭容器中充入 和 生成 ,充分反应后测得放出热量 ,此时
与 的转化率之比为___________;其他条件不变,若起始加入更高效的催化剂,充分反应后测得放出的热量将
___________ (填“大于”“小于”或“等于”)。
(2)已知 时 燃烧热( )为 ,则表示 燃烧热的热化学方程式为___________ 。
(3)合成氨反应中,在投料一定的情况下,为提高氨气在平衡混合物中的体积分数,可采取的措施为___________(填
选项字母)。
a.低温高压 b.高温高压 c.高温低压 d.高效催化剂
用碰撞理论解释合成氨反应温度越高反应速率越大的原因:___________。
(4) 是制硝酸的重要反应之一,其反应过程—能量变化如图乙:
已知: 为快速平衡,可认为不受慢反应 的影响。研究发现,反
应 在一定温度范围内,随温度升高反应速率减小,试分析原因:___________。
17. 以废弃铁铝合金(含有少量的氧化物 、 等)为原料,合成铁黄( )和冰晶石( )的工艺流程
如图。回答下列问题:
已知: 微溶于水, 难溶于水。
(1)“碱溶”时 发生反应的离子方程式为___________。
(2)经检验,“酸溶”所得溶液中无 ,其原因可能为___________。
(3)实验室从“酸溶”所得溶液中分离出 。下列给出的仪器中不需要使用的是___________(填仪器名
称)。(4)生成 的离子方程式为___________;设计实验检验铁黄是否洗涤干净:___________。
(5)“沉铝”阶段所得滤液的溶质主要为___________(填化学式)。
(6)工业冶炼铝时加入冰晶石来降低生产成本,冰晶石中所含 、 、 三种元素中,简单离子半径从大到小的顺
序是___________(写离子符号)。
18.如图为元素周期表的一部分,参照元素①~⑩在表中的位置,回答下列问题:
族
ⅠA 0
周期
1 ① ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA
2 ② ③ ④
3 ⑤ ⑥ ⑦ ⑧ ⑨ ⑩
(1)写出元素锗(Ge,原子序数 32)在元素周期表中的位置 。
(2)③⑦⑧最高价氧化物对应水化物酸性由强到弱的顺序为(填化学式) 。
(3)写出②的单质在足量④的单质中燃烧产物的电子式 。用电子式表示⑤和⑩组成简单化合物的形成过程 。
(4)④和⑨的单质均能与 反应生成 型化合物,请判断这两种 型化合物的热稳定性 (填化学式)。
DCCAC BBBCD DDBC
15
(1)环形玻璃搅拌棒
(2) ①. 不相等 ②. 相等 ③. 偏小
(3)-66.9 (4)ac
16
(1) ①. 462.2 ②. 4:3 ③. 等于
(2)
(3) ①. a ②. 升高温度,反应物分子的能量增加,反应物的活化分子数及活化分子百分数增大,有效碰撞次
数增加
( 4) 根 据 图 示 , 正 反 应 放 热 , 升 高 温 度 平 衡 逆 向 移 动 , N O 的 浓
2 2
度 减 小 ,速率减慢
17
(1)
(2)酸溶时,溶解生成的 Fe3+被 Fe 单质还原生成 Fe2+
(3)坩埚 (4) ①. ②. 取最后一次洗涤液,加入盐酸酸化的
BaCl 溶液,若未出现白色沉淀,则已洗净,反之亦然
2
(5)NaHCO (6)
3
18
(1)第四周期第ⅣA 族
(2)
(3)