文档内容
广东实验中学 2025—2026 学年(上)高二级中段模块考试
化学
命题:高二备课组 审定:高二备课组 校对:高二备课组
本试卷分选择题和非选择题两部分,共8页,满分100分,考试用时75分钟
注意事项:
1.答卷前,考生务必用黑色字迹的钢笔或签字笔将自己的姓名、考号填写在答题卷上。
2.选择题每小题选出答案后,用2B铅笔把答题卷上对应题目的答案标号涂黑;如需改动,用橡
皮擦干净后,再选涂其它答案;不能答在试卷上。
3.非选择题必须用黑色字迹的钢笔或签字笔作答,答案必须写在答题卷各题目指定区域内的相应
位置上;如需改动,先划掉原来的答案,然后再写上新的答案;不准使用铅笔和涂改液。不按
以上要求作答的答案无效。
4.考生必须保持答题卡的整洁,考试结束后,将答题卷收回。
可能用到的相对原子质量H-1 O-16 C-12
第一部分 选择题(共45分)
一、单选题(共15小题,每题3分,共45分)
1.高粱酿酒部分流程按顺序排列如图,其中能说明高粱转化过程中放出热量的是( )
A.“蒸粮”时加热 B.“拌曲”前摊晾 C.“堆酵”时升温 D.“馏酒”时控温
2.图为工业合成氨的流程图。下列说法错误的是( )
A.步骤①的目的是防止混入杂质使催化剂中毒
B.步骤②中“加压”既可以提高原料的转化率,又可以加快反应速率
C.步骤③选择500℃的重要原因是催化剂活性最高
D.步骤③、④、⑤均有利于提高原料的平衡转化率
第 1 页 共 8 页3.设N 为阿伏加德罗常数的值。下列说法正确的是( )
A
A.1mol/LNa2CO3 溶液中,阴离子总数小于NA
B.常温下,1.0LpH=1的H SO 溶液中含有H+的数目为0.2N
2 4 A
C.1molCH COONa完全溶于水配成1L溶液,c(CH COOH)+c(CH COO-)=0.1mol/L
3 3 3
D.H (g)+I (g)⇌ 2HI(g)ΔH=﹣14.9kJ·mol﹣1,将1molH (g)和1molI (g)放
2 2 2 2
入容器发生反应,放出14.9kJ热量
4.劳动有利于“知行合一”。下列劳动项目与所述化学知识均正确的是( )
选项 劳动项目 化学知识
A 化工运输:用橡胶塞玻璃瓶储存NaF溶液 NaF溶液显碱性,不能用磨口玻璃塞
B 环保行动:用FeS除去废水中的Hg2+ 溶度积:K (FeS)>K (HgS)
sp sp
C 工业实践:用FeCl 溶液刻蚀覆铜板 FeCl 溶液呈酸性
3 3
D 学农活动:将草木灰与氯化铵同时加入土壤 同时含有氮元素和钾元素,提高肥效
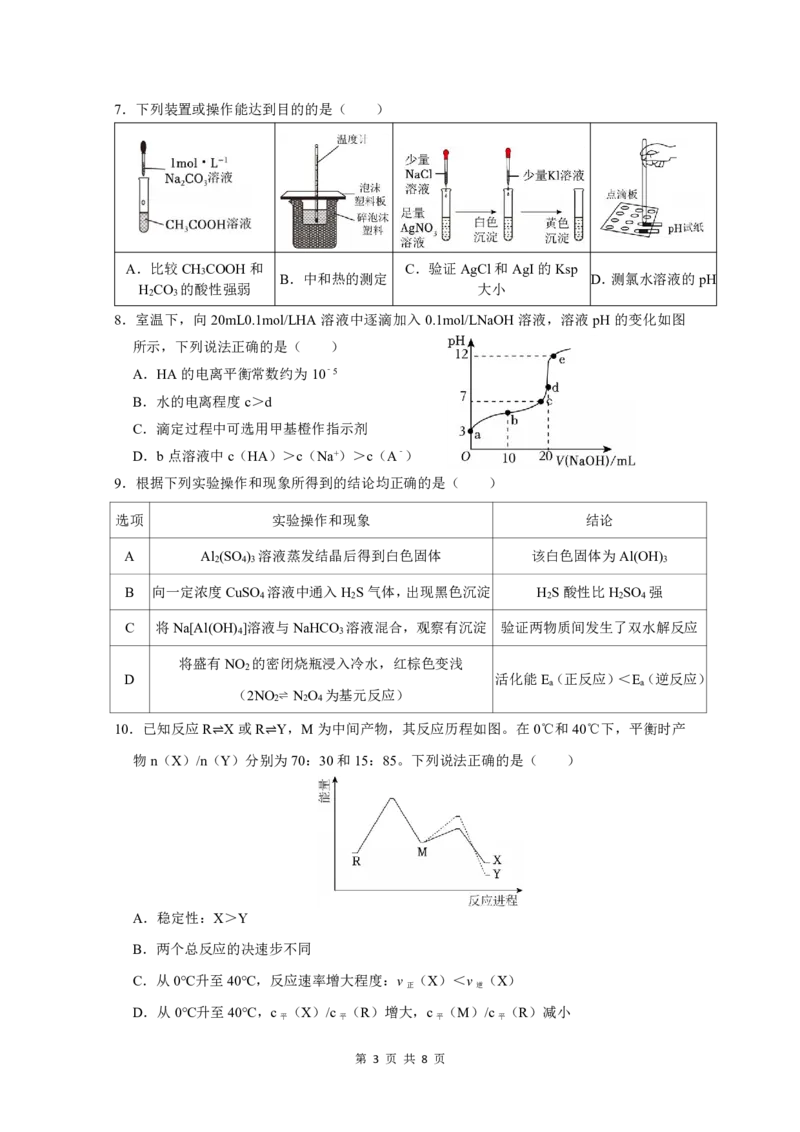
5.丙烷脱氢是制备丙烯的一种常见方法,Ga O 催化该过程反应历程及能量变化如图(X为
2 3
丙烷,Y为丙烯),下列说法正确的是( )
A.Ga O 反应前后质量不变,未参与反应
2 3
B.反应X(g)→Y(g)+H (g) ΔH=﹣167kJ•mol﹣1
2
C.以上反应历程中主要包含了四步变化,其中第三步反应速率最慢
D.1mol丙烷的总键能小于1mol丙烯与1mol氢气的总键能之和
6.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.使pH试纸变红的溶液:K+、Na+、[Al(OH) ]﹣、NO−
4 3
B.在水电离出c(H+)=1×10﹣12mol/L的溶液:K+、Al3+、Cl﹣、SO2−
4
C.c(H+)= K 的溶液:Fe3+、K+、SO2−、HCO−
w 4 3
D.能使甲基橙变红的溶液中:Na+、Al3+、SO2−、Cl﹣
4
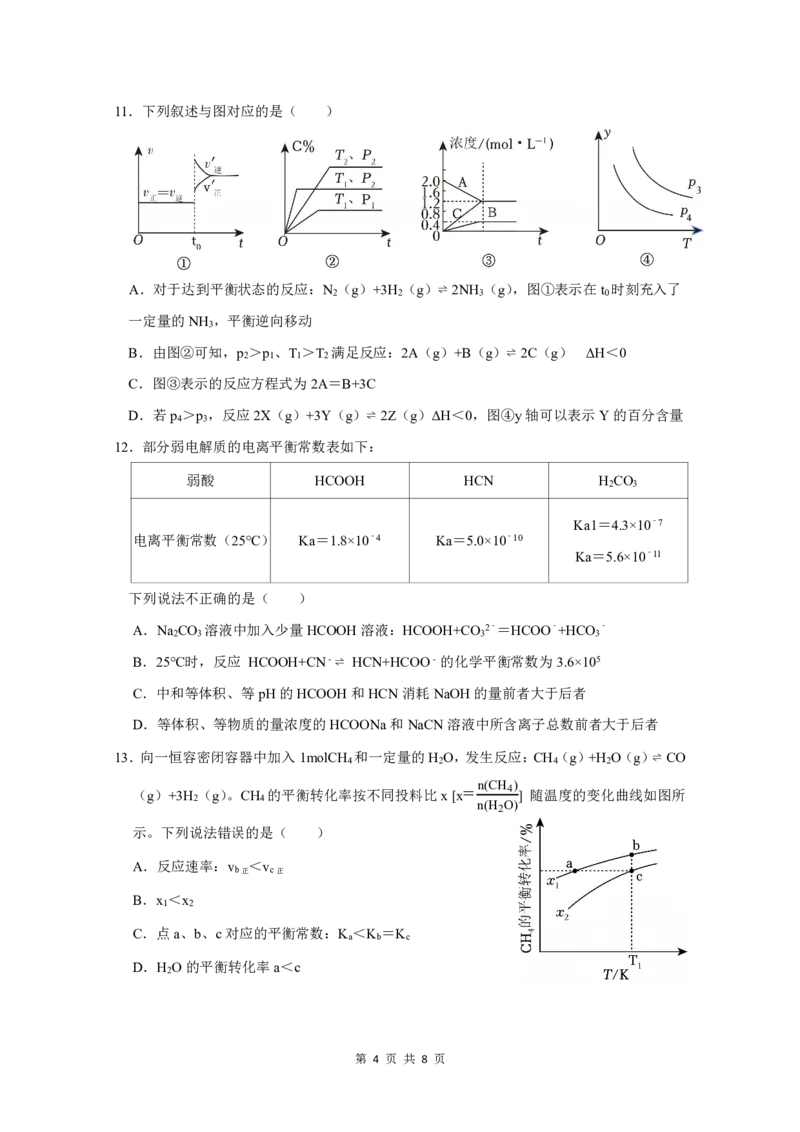
第 2 页 共 8 页7.下列装置或操作能达到目的的是( )
A.比较CH COOH和 C.验证AgCl和AgI的Ksp
3 B.中和热的测定 D.测氯水溶液的pH
H CO 的酸性强弱 大小
2 3
8.室温下,向20mL0.1mol/LHA溶液中逐滴加入0.1mol/LNaOH溶液,溶液pH的变化如图
所示,下列说法正确的是( )
A.HA的电离平衡常数约为10﹣5
B.水的电离程度c>d
C.滴定过程中可选用甲基橙作指示剂
D.b点溶液中c(HA)>c(Na+)>c(A﹣)
9.根据下列实验操作和现象所得到的结论均正确的是( )
选项 实验操作和现象 结论
A Al (SO ) 溶液蒸发结晶后得到白色固体 该白色固体为Al(OH)
2 4 3 3
B 向一定浓度CuSO 溶液中通入H S气体,出现黑色沉淀 H S酸性比H SO 强
4 2 2 2 4
C 将Na[Al(OH) ]溶液与NaHCO 溶液混合,观察有沉淀 验证两物质间发生了双水解反应
4 3
将盛有NO 的密闭烧瓶浸入冷水,红棕色变浅
2
D 活化能E(正反应)<E(逆反应)
a a
(2NO ⇌ N O 为基元反应)
2 2 4
10.已知反应R X或R Y,M为中间产物,其反应历程如图。在0℃和40℃下,平衡时产
物n(X)/n(⇌Y)分别⇌为70:30和15:85。下列说法正确的是( )
A.稳定性:X>Y
B.两个总反应的决速步不同
C.从0℃升至40℃,反应速率增大程度:v (X)<v (X)
正 逆
D.从0℃升至40℃,c (X)/c (R)增大,c (M)/c (R)减小
平 平 平 平
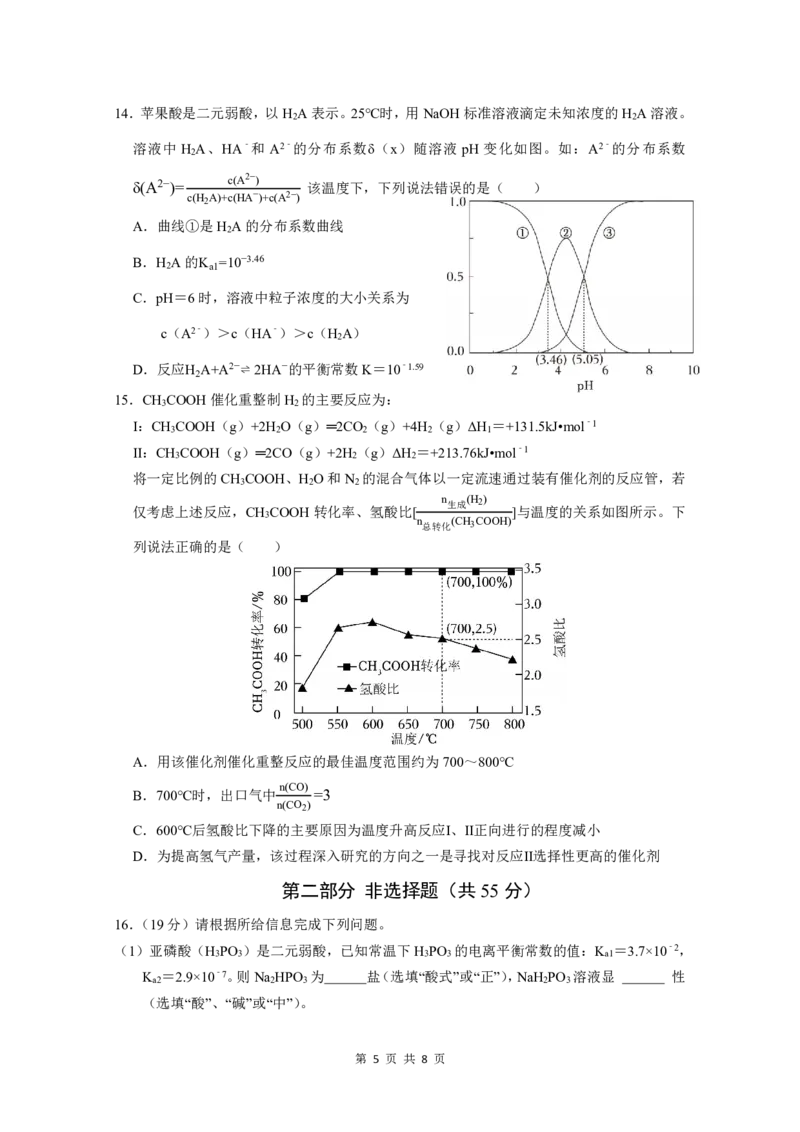
第 3 页 共 8 页11.下列叙述与图对应的是( )
A.对于达到平衡状态的反应:N (g)+3H (g)⇌ 2NH (g),图①表示在t 时刻充入了
2 2 3 0
一定量的NH ,平衡逆向移动
3
B.由图②可知,p >p 、T >T 满足反应:2A(g)+B(g)⇌ 2C(g) ΔH<0
2 1 1 2
C.图③表示的反应方程式为2A=B+3C
D.若p >p ,反应2X(g)+3Y(g)⇌ 2Z(g)ΔH<0,图④y轴可以表示Y的百分含量
4 3
12.部分弱电解质的电离平衡常数表如下:
弱酸 HCOOH HCN H CO
2 3
Ka1=4.3×10﹣7
电离平衡常数(25℃) Ka=1.8×10﹣4 Ka=5.0×10﹣10
Ka=5.6×10﹣11
下列说法不正确的是( )
A.Na CO 溶液中加入少量HCOOH溶液:HCOOH+CO 2﹣=HCOO﹣+HCO ﹣
2 3 3 3
B.25℃时,反应 HCOOH+CN-⇌ HCN+HCOO- 的化学平衡常数为3.6×105
C.中和等体积、等pH的HCOOH和HCN消耗NaOH的量前者大于后者
D.等体积、等物质的量浓度的HCOONa和NaCN溶液中所含离子总数前者大于后者
13.向一恒容密闭容器中加入1molCH 和一定量的H O,发生反应:CH(g)+H O(g)⇌ CO
4 2 4 2
n(CH )
(g)+3H (g)。CH 的平衡转化率按不同投料比x[x= 4 ] 随温度的变化曲线如图所
2 4
n(H O)
2
示。下列说法错误的是( )
A.反应速率:v <v
b正 c正
B.x <x
1 2
C.点a、b、c对应的平衡常数:K <K =K
a b c
D.H O的平衡转化率a<c
2
第 4 页 共 8 页14.苹果酸是二元弱酸,以H A表示。25℃时,用NaOH标准溶液滴定未知浓度的H A溶液。
2 2
溶液中 H A、HA﹣和 A2﹣的分布系数δ(x)随溶液 pH 变化如图。如:A2﹣的分布系数
2
δ(A2−)=
c(A2−)
该温度下,下列说法错误的是( )
c(H2A)+c(HA−)+c(A2−)
A.曲线①是H A的分布系数曲线
2
B.H A的K =10−3.46
2 a1
C.pH=6时,溶液中粒子浓度的大小关系为
c(A2﹣)>c(HA﹣)>c(H A)
2
D.反应H A+A2−⇌ 2HA−的平衡常数K=10﹣1.59
2
15.CH COOH催化重整制H 的主要反应为:
3 2
Ⅰ:CH COOH(g)+2H O(g)═2CO (g)+4H (g)ΔH =+131.5kJ•mol﹣1
3 2 2 2 1
Ⅱ:CH COOH(g)═2CO(g)+2H (g)ΔH =+213.76kJ•mol﹣1
3 2 2
将一定比例的CH COOH、H O和N 的混合气体以一定流速通过装有催化剂的反应管,若
3 2 2
n
生成
(H2)
仅考虑上述反应,CH COOH转化率、氢酸比[ ]与温度的关系如图所示。下
3
n
总转化
(CH3COOH)
列说法正确的是( )
A.用该催化剂催化重整反应的最佳温度范围约为700~800℃
n(CO)
B.700℃时,出口气中 =3
n(CO2)
C.600℃后氢酸比下降的主要原因为温度升高反应Ⅰ、Ⅱ正向进行的程度减小
D.为提高氢气产量,该过程深入研究的方向之一是寻找对反应Ⅱ选择性更高的催化剂
第二部分 非选择题(共 55 分)
16.(19分)请根据所给信息完成下列问题。
(1)亚磷酸(H PO )是二元弱酸,已知常温下H PO 的电离平衡常数的值:K =3.7×10﹣2,
3 3 3 3 a1
K =2.9×10﹣7。则Na HPO 为 盐(选填“酸式”或“正”),NaH PO 溶液显 性
a2 2 3 2 3
(选填“酸”、“碱”或“中”)。
第 5 页 共 8 页(2)已知:硒酸(H SeO )在水溶液中的电离如下:H SeO =H++HSeO−,HSeO−⇌ H++SeO2−,
2 4 2 4 4 4 4
K =1.0×10﹣2(25℃)。H CO 的电离平衡常数K =4.4×10﹣7,K =4.4×10﹣11。
a 2 3 a1 a2
①向H SeO 溶液中滴加少量氨水,该反应的离子方程式为 。
2 4
②KHCO 和KHSeO 两溶液混合反应的离子方程式为: 。
3 4
③CO 可被NaOH溶液捕获。当所得溶液中c(CO 2﹣)=c(H CO )时,溶液中c(H+)= 。
2 3 2 3
(3)某实验小组为了测定草酸晶体H C O •xH O中的x值,进行如下实验:
2 2 4 2
步骤一:称取1.260g草酸晶体,配成100mL溶液。
步骤二:取25.00mL该H C O 溶液加入锥形瓶内,再加入适量稀硫酸。
2 2 4
步骤三:用浓度为0.05000mol•L﹣1的KMnO 溶液滴定至终点。
4
①滴定终点的现象为 。
②由图可知消耗KMnO 溶液体积为 。
4
③根据数据,计算x= 。
④若滴定终点读数俯视KMnO 溶液液面,则x值会
4
(填“偏大”、“偏小”或“无影响”)。
17.(10分)某小组同学探究氯化铝和强碱弱酸盐的反应。
【理论分析】从盐类水解规律分析,AlCl 溶液显酸性,强碱弱酸盐溶液显碱性,两者混合会
3
发生反应。
(1)用离子方程式表示AlCl 溶液显酸性的原因: 。
3
【实验验证】
试管编号 滴管中试剂(2mL) 实验现象
Ⅰ.迅速产生大量
a 1mol•L﹣1NaHCO 溶液
3
气泡和白色沉淀
b 1mol•L﹣1CH COONa溶液 Ⅱ.无明显现象
2mL0.33mol•L﹣1AlCl 溶液(pH≈3) 3
3
(2)现象Ⅰ中的白色沉淀是Al(OH) ,气体是 。
3
(3)针对现象Ⅱ,同学们提出猜想如下。
猜想1:c(OH﹣)小,未生成Al(OH) 沉淀;
3
猜想2:其他反应导致c(Al3+)减小,未生成Al(OH) 沉淀。
3
为了验证猜想,补充实验,测得b中混合溶液pH≈5。
甲同学结合常温下K [Al(OH) ]=1.3×10−33,证明猜想2成立。其推理过程是 。
sp 3
经检验,b中生成了配合物Al(CH COO) 。
3 3
(4)乙同学将b中混合溶液加热,观察到有白色沉淀[AlOH(CH COO) ]生成。
3 2
①写出生成白色沉淀的化学方程式: 。
②设计实验证明白色沉淀不是Al(OH) ,补全实验操作和现象:分别取洗净后的白色沉淀和
3
Al(OH) 固体于两支试管中,加入等体积等浓度的盐酸, 。
3
第 6 页 共 8 页18.(16分)在铁系催化剂作用下,二氧化碳催化加氢合成乙烯。发生的主要反应如下:
Ⅰ:2CO (g)+6H (g)⇌ C H (g)+4H O(g) ΔH
2 2 2 4 2 1
Ⅱ:CO (g)+H (g)⇌ CO(g)+H O(g) ΔH > 0
2 2 2 2
回答下列问题:
(1)反应Ⅰ能自发进行,则△H 0(填“<”或“>”或“=”)。该反应自发进行的条件
1
是 。(填“高温”或“低温”)
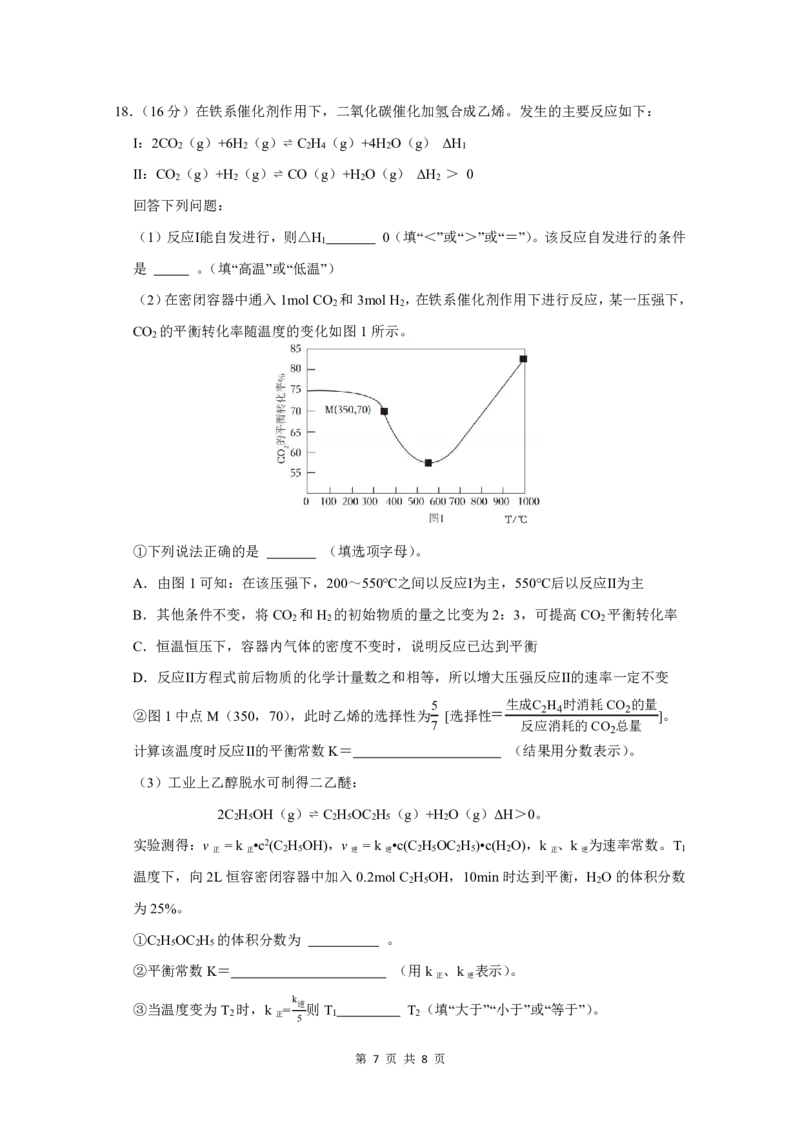
(2)在密闭容器中通入1molCO 和3molH ,在铁系催化剂作用下进行反应,某一压强下,
2 2
CO 的平衡转化率随温度的变化如图1所示。
2
①下列说法正确的是 (填选项字母)。
A.由图1可知:在该压强下,200~550℃之间以反应Ⅰ为主,550℃后以反应Ⅱ为主
B.其他条件不变,将CO 和H 的初始物质的量之比变为2:3,可提高CO 平衡转化率
2 2 2
C.恒温恒压下,容器内气体的密度不变时,说明反应已达到平衡
D.反应Ⅱ方程式前后物质的化学计量数之和相等,所以增大压强反应Ⅱ的速率一定不变
5 生成C H 时消耗CO 的量
②图1中点M(350,70),此时乙烯的选择性为 [选择性= 2 4 2 ]。
7 反应消耗的CO 总量
2
计算该温度时反应Ⅱ的平衡常数K= (结果用分数表示)。
(3)工业上乙醇脱水可制得二乙醚:
2C H OH(g)⇌ C H OC H (g)+H O(g)ΔH>0。
2 5 2 5 2 5 2
实验测得:v =k •c2(C H OH),v =k •c(C H OC H )•c(H O),k 、k 为速率常数。T
正 正 2 5 逆 逆 2 5 2 5 2 正 逆 1
温度下,向2L恒容密闭容器中加入0.2molC H OH,10min时达到平衡,H O的体积分数
2 5 2
为25%。
①C H OC H 的体积分数为 。
2 5 2 5
②平衡常数K= (用k 、k 表示)。
正 逆
k
③当温度变为T 时,k = 逆则T T (填“大于”“小于”或“等于”)。
2 正 1 2
5
第 7 页 共 8 页19.(10分)工业上用CO 和H 制备CH OH的原理如下:
2 2 3
Ⅰ:CO (g)+3H (g)⇌ CH OH(g)+H O(g) ΔH <
2 2 3 2 1
Ⅱ:CO 2 (g)+H 2 (g)⇌ CO(g)+H 2 O(g) ΔH 2 0
(1)已知CO和H 的燃烧热分别为283.0kJ•mol﹣1和285.8kJ•mol﹣1,H O(l)=H O(g)
2 2 2
△H =+44.0kJ•mol﹣1,则△H = 。
3 2
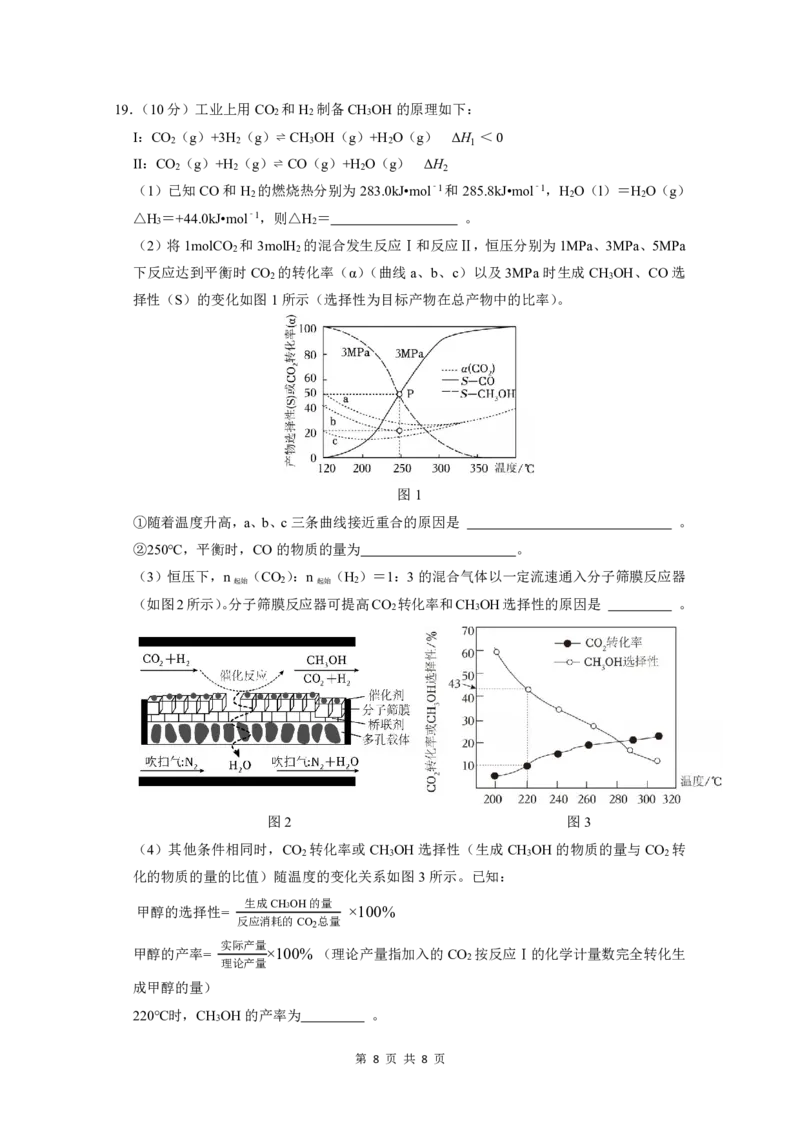
(2)将1molCO 和3molH 的混合发生反应Ⅰ和反应Ⅱ,恒压分别为1MPa、3MPa、5MPa
2 2
下反应达到平衡时CO 的转化率(α)(曲线a、b、c)以及3MPa时生成CH OH、CO选
2 3
择性(S)的变化如图1所示(选择性为目标产物在总产物中的比率)。
图1
①随着温度升高,a、b、c三条曲线接近重合的原因是 。
②250℃,平衡时,CO的物质的量为 。
(3)恒压下,n (CO ):n (H )=1:3的混合气体以一定流速通入分子筛膜反应器
起始 2 起始 2
(如图2所示)。分子筛膜反应器可提高CO 转化率和CH OH选择性的原因是 。
2 3
图2 图3
(4)其他条件相同时,CO 转化率或CH OH选择性(生成CH OH的物质的量与CO 转
2 3 3 2
化的物质的量的比值)随温度的变化关系如图3所示。已知:
甲醇的选择性=
生成CH3OH的量
×100%
反应消耗的CO2 总量
实际产量
甲醇的产率= ×100%(理论产量指加入的CO 按反应Ⅰ的化学计量数完全转化生
理论产量 2
成甲醇的量)
220℃时,CH OH的产率为 。
3
第 8 页 共 8 页