文档内容
高二化学期中考试
一、选择题:本题共14小题,每小题3分,共42分。每小题只有一个选项符合题目要求。
1. 下列做法与调控化学反应速率无关的是
A. 用冰箱冷藏以保鲜食物 B. 酸浸时先将矿石粉碎
C. 食盐中添加碘酸钾预防缺碘 D. 适当温度下,使用加酶洗衣粉洗涤衣物
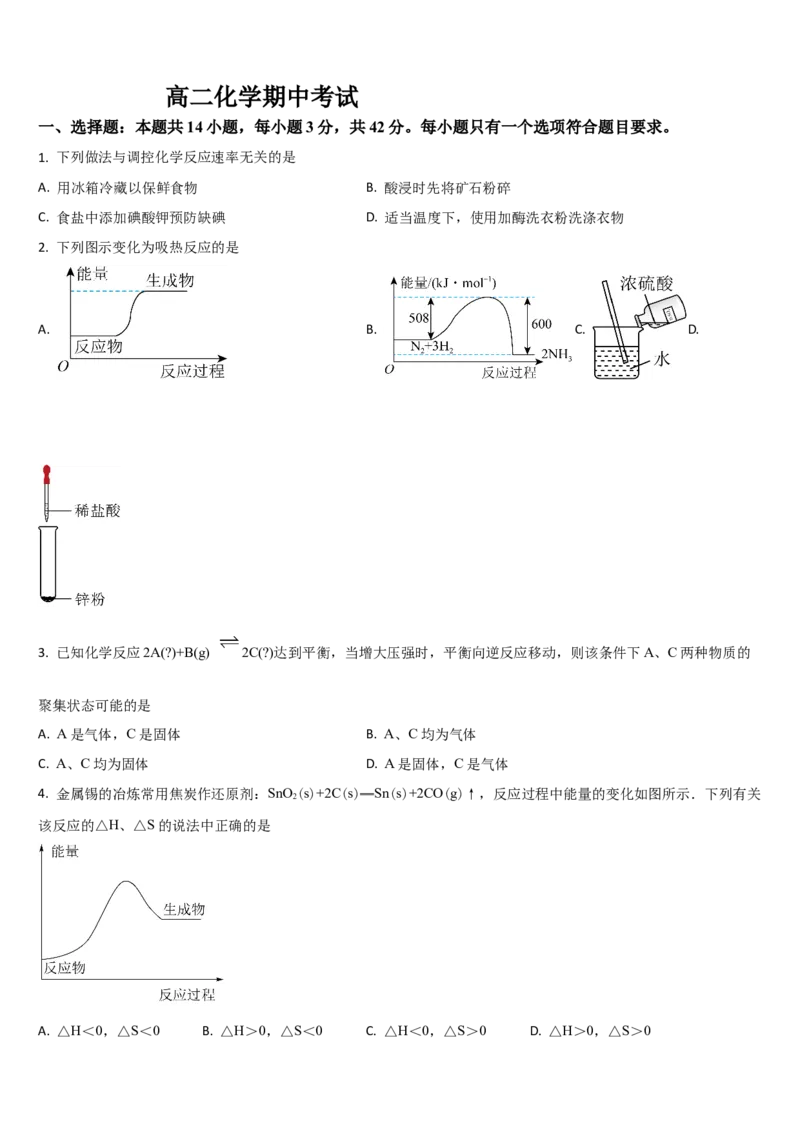
2. 下列图示变化为吸热反应的是
A. B. C. D.
3. 已知化学反应2A(?)+B(g) 2C(?)达到平衡,当增大压强时,平衡向逆反应移动,则该条件下A、C两种物质的
聚集状态可能的是
A. A是气体,C是固体 B. A、C均为气体
C. A、C均为固体 D. A是固体,C是气体
4. 金属锡的冶炼常用焦炭作还原剂:SnO (s)+2C(s)═Sn(s)+2CO(g)↑,反应过程中能量的变化如图所示.下列有关
2
该反应的△H、△S的说法中正确的是
A. △H<0,△S<0 B. △H>0,△S<0 C. △H<0,△S>0 D. △H>0,△S>05. 对于可逆反应3H+N 2NH ,下列措施能使反应物中活化分子百分数、化学反应速率和化学平衡常数都变化的是
2 2 3
A. 增大压强 ⇌B. 充入更多N
2
C. 使用高效催化剂 D. 降低温度
6. 下列叙述正确的是
A. 合成氨反应放热,采用低温可以提高氨的生成速率
B. 常温下,等物质的量浓度的CHCOOH溶液和HCl溶液中,水的电离程度相同
3
C. 反应4Fe(OH) (s)+2HO(l)+O(g)=4Fe(OH) (s)常温下能自发进行,该反应的△H<0
2 2 2 3
的
D. 在一容积可变 密闭容器中反应2SO (g)+O(g) 2SO (g)达平衡后,保持温度不变,缩小体积,平衡正向移动,
2 2 3
⇌
的值增大
7. 氮气和氢气生成氨气,开始时氮气浓度为8mol/L,5秒后氮气浓度为6mol/L,则用浓度变化表示的氮气的反应速率
是
A. 0.4mol/(L.s) B. 0.2mol/(L.s) C. 0.8mol/(L.s) D. 1.2mol/(L.s)
的
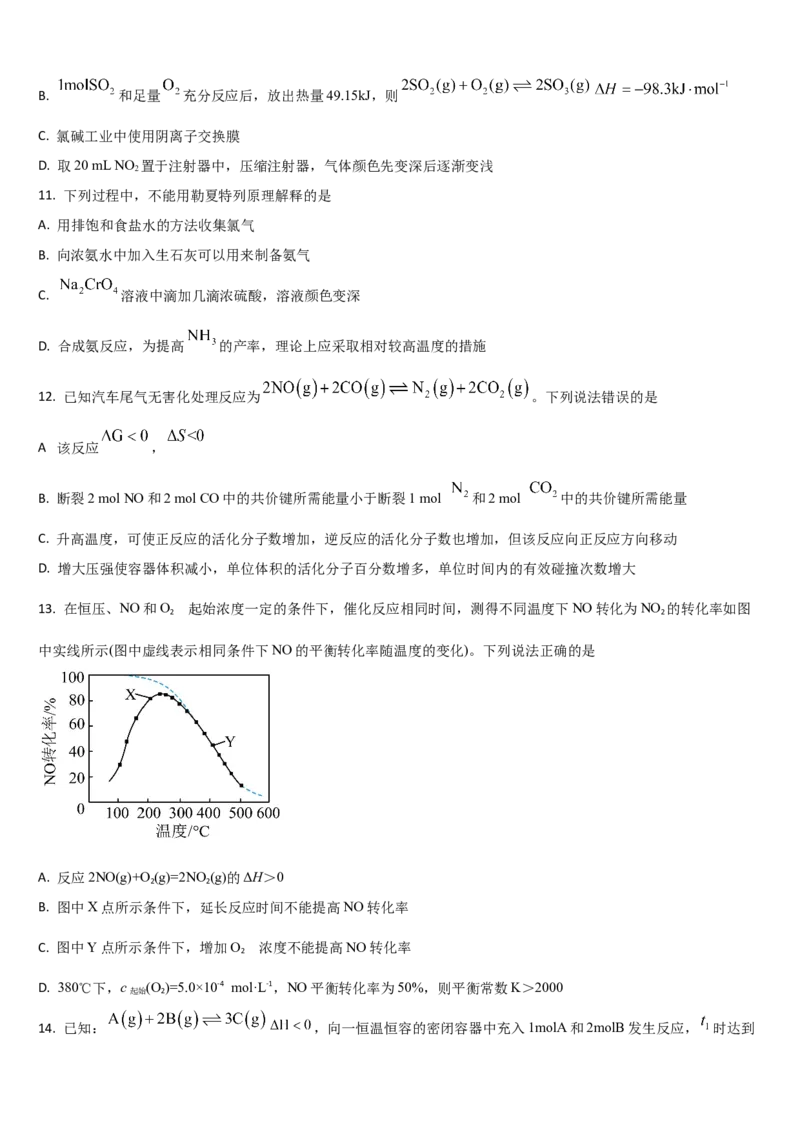
8. 某反应4A(g) mB(g)+2C(g) ΔH<0,正反应速率 变化如图。其中t、t、t、t 只改变一个条件,t 时刻图象变
1 2 3 4 2
化并非加入催化剂引起,下列叙述中错误的是
A. m=2 B. t 时增大了A的浓度
1
C. t 时减小了压强 D. t 至t 时间段内,化学平衡常数的值保持不变
3 1 4
9. 汽车尾气在催化剂的作用下可发生反应:2NO(g) + 2CO(g) 2CO (g) + N (g),下列说法正确的是
2 2
A. 该反应能自发进行,说明反应物的总能量大于产物的总能量
.
B 加入催化剂可以加快反应速率,增大反应限度
C. 反应中每消耗1mol NO转移电子的数目约等于4×6.02×1023
D. 使用高效催化剂能降低反应的焓变
10. 下列有关说法中正确的是
A. 表示H 的燃烧热的热化学方程式是:2H(g)+O(g)=2HO(1) ΔH=-571.6kJ/mol
2 2 2 2B. 和足量 充分反应后,放出热量49.15kJ,则
C. 氯碱工业中使用阴离子交换膜
D. 取20 mL NO 置于注射器中,压缩注射器,气体颜色先变深后逐渐变浅
2
11. 下列过程中,不能用勒夏特列原理解释的是
A. 用排饱和食盐水的方法收集氯气
B. 向浓氨水中加入生石灰可以用来制备氨气
C. 溶液中滴加几滴浓硫酸,溶液颜色变深
D. 合成氨反应,为提高 的产率,理论上应采取相对较高温度的措施
12. 已知汽车尾气无害化处理反应为 。下列说法错误的是
.
A 该反应 ,
B. 断裂2 mol NO和2 mol CO中的共价键所需能量小于断裂1 mol 和2 mol 中的共价键所需能量
C. 升高温度,可使正反应的活化分子数增加,逆反应的活化分子数也增加,但该反应向正反应方向移动
D. 增大压强使容器体积减小,单位体积的活化分子百分数增多,单位时间内的有效碰撞次数增大
的
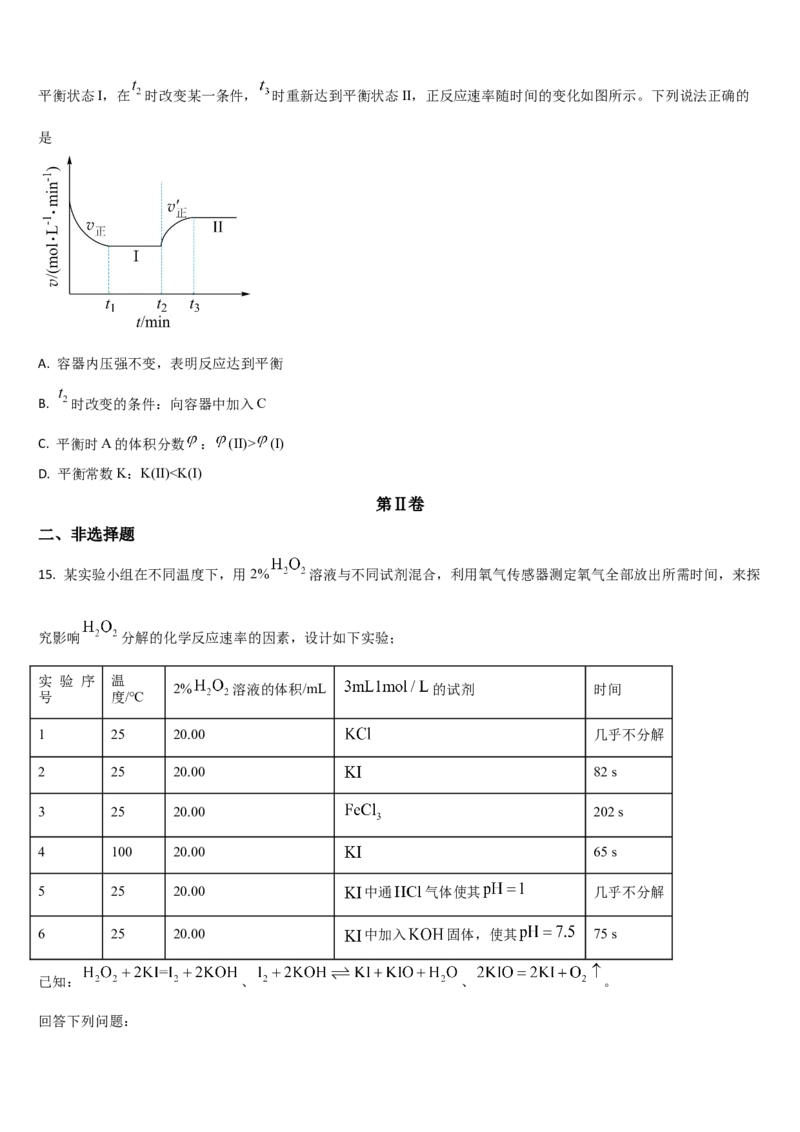
13. 在恒压、NO和O 起始浓度一定的条件下,催化反应相同时间,测得不同温度下NO转化为NO 的转化率如图
2 2
中实线所示(图中虚线表示相同条件下NO的平衡转化率随温度的变化)。下列说法正确的是
A. 反应2NO(g)+O (g)=2NO (g)的ΔH>0
2 2
B. 图中X点所示条件下,延长反应时间不能提高NO转化率
的
C. 图中Y点所示条件下,增加O 浓度不能提高NO转化率
2
D. 380℃下,c (O )=5.0×10-4 mol·L-1,NO平衡转化率为50%,则平衡常数K>2000
起始 2
14. 已知: ,向一恒温恒容的密闭容器中充入1molA和2molB发生反应, 时达到平衡状态I,在 时改变某一条件, 时重新达到平衡状态II,正反应速率随时间的变化如图所示。下列说法正确的
是
A. 容器内压强不变,表明反应达到平衡
B. 时改变的条件:向容器中加入C
C. 平衡时A的体积分数 : (II)> (I)
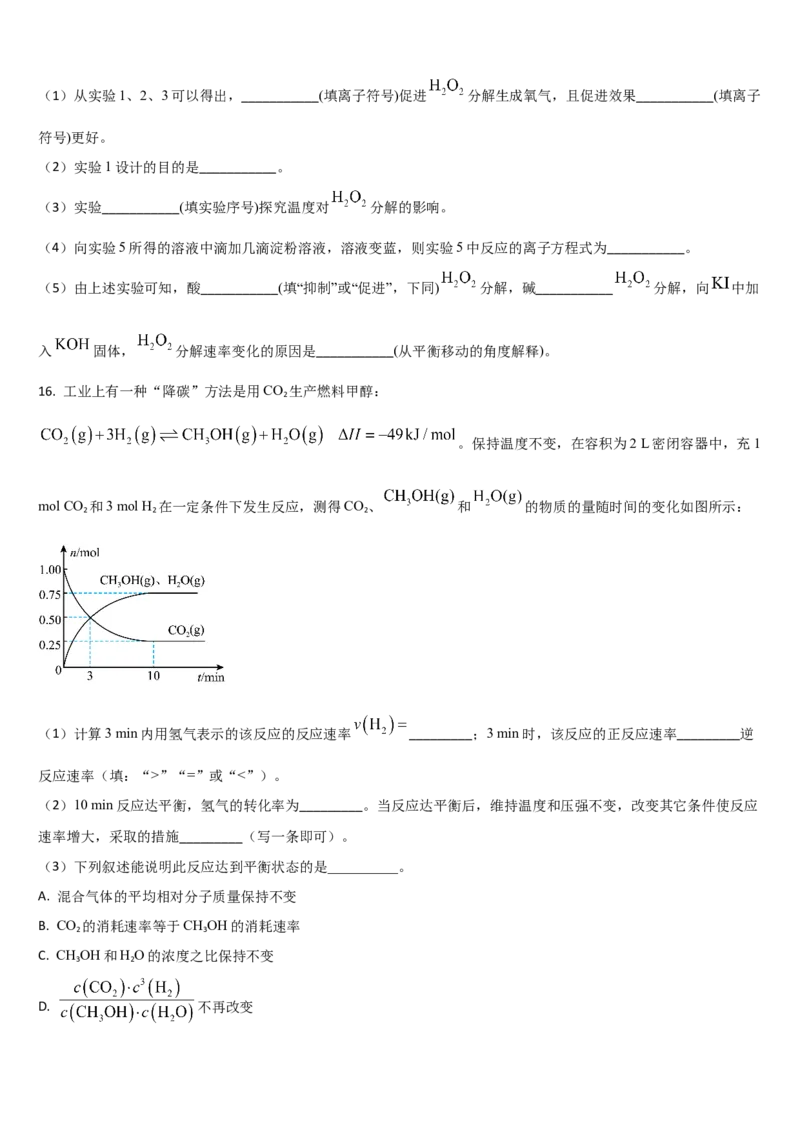
D. 平衡常数K:K(II)”“=”或“<”)。
(2)10 min反应达平衡,氢气的转化率为_________。当反应达平衡后,维持温度和压强不变,改变其它条件使反应
速率增大,采取的措施_________(写一条即可)。
(3)下列叙述能说明此反应达到平衡状态的是__________。
A. 混合气体的平均相对分子质量保持不变
B. CO 的消耗速率等于CH OH的消耗速率
2 3
C. CH OH和H O的浓度之比保持不变
3 2
D. 不再改变(4)下列措施可以增大CO 平衡转化率的是_________。
2
A.在原容器中再充入1 mol CO
2
B.在原容器中再充入1 mol H
2
C.在原容器中充入1 mol氦气
D.使用更有效的催化剂
E.扩大容器的容积
F.将水蒸气从体系中分离
(5)一定比例的合成气在装有催化剂的反应器中反应12小时。体系中甲醇的产率和催化剂的催化活性与温度的关系
如图所示。温度为470 K时,图中P点_________(填“是”或“不是”)处于平衡状态。490 K之后,甲醇产率下降
的原因是_________。
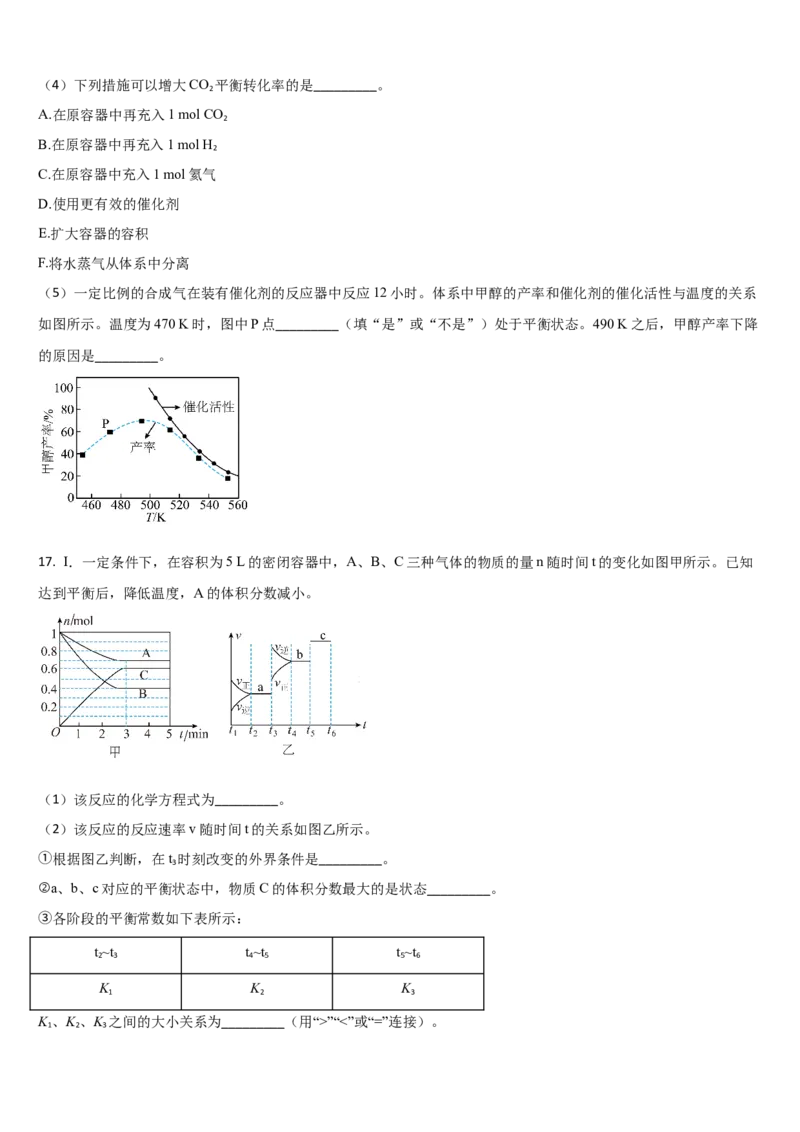
17. Ⅰ.一定条件下,在容积为5 L的密闭容器中,A、B、C三种气体的物质的量n随时间t的变化如图甲所示。已知
达到平衡后,降低温度,A的体积分数减小。
(1)该反应的化学方程式为_________。
(2)该反应的反应速率v随时间t的关系如图乙所示。
①根据图乙判断,在t 时刻改变的外界条件是_________。
3
②a、b、c对应的平衡状态中,物质C的体积分数最大的是状态_________。
③各阶段的平衡常数如下表所示:
t ~t t ~t t ~t
2 3 4 5 5 6
K K K
1 2 3
K 、K 、K 之间的大小关系为_________(用“>”“<”或“=”连接)。
1 2 3Ⅱ.在密闭容器中充入一定量的H S,发生反应: ,如图丙所示为H S气体分解生
2 2
成 和 的平衡转化率与温度、压强的关系。
(3) __________(填“>”“<”或“=”)0。
的
(4)图丙中压强(P 、P 、P )由大到小 顺序为_________。
1 2 3
(5)图丙中M点对应的平衡常数K=__________(用平衡物质的量分数代替平衡浓度计算)。
18. 氮、硫及其化合物在生产生活中有广泛应用。研究它们反应的机理,对于消除污染、工业、农业等多方面都有重
要的意义。回答下列问题:
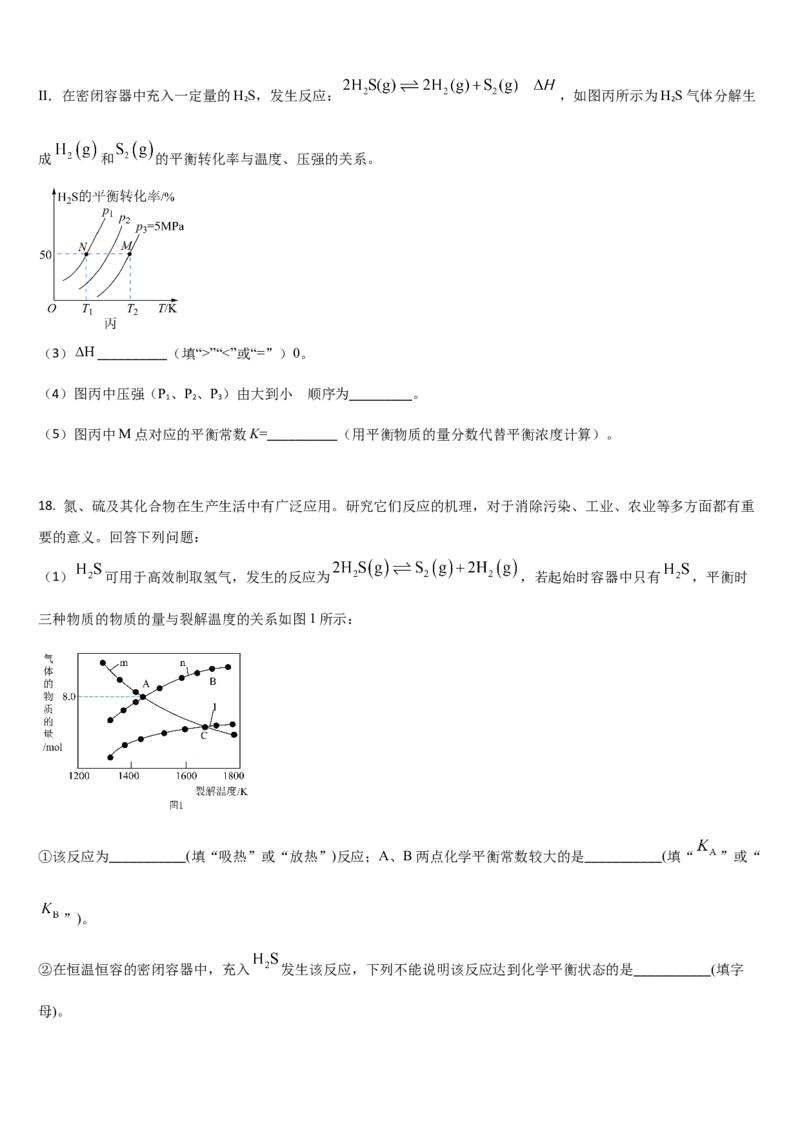
(1) 可用于高效制取氢气,发生的反应为 ,若起始时容器中只有 ,平衡时
三种物质的物质的量与裂解温度的关系如图1所示:
①该反应为___________(填“吸热”或“放热”)反应;A、B两点化学平衡常数较大的是___________(填“ ”或“
”)。
②在恒温恒容的密闭容器中,充入 发生该反应,下列不能说明该反应达到化学平衡状态的是___________(填字
母)。A.混合气体密度保持不变 B. 转化率保持不变 C. 保持不变 D.
的
(2)用氯气除去废水中 的反应为 该反应的正、逆反应速率表达式分别
为 , ,( 、 分别为正、逆反应的速率常数,与温度有关),化学平
衡常数K与 、 的关系是___________。
(3)在催化转化器中,汽车尾气中的CO和NO可发生反应: ,若在容积
为10 L的恒温恒容密闭容器中进行该反应,起始时充入0.4 mol CO、0.2 mol NO,反应在不同条件下进行,反应体系
总压强随时间的变化如图2所示。实验b从开始至达到平衡时的反应速率 ___________mol·L-1·min-1;实验a
中NO的平衡转化率为___________。
(4)用 还原NO的反应为 kJ·mol-1.为研究 和NO的
起始投料比 对NO平衡转化率的影响,分别在不同温度下,向三个体积均为a L的刚性密闭容器中
加入一定量 和NO发生反应,实验结果如图3所示:①反应温度 、 、 从大到小的关系为___________。
② 温度下,充入 、NO分别为3 mol、3 mol,容器内的压强为W Pa,反应进行到10 min时达平衡,该反应的平
衡常数 ___________Pa-1(写出计算表达式,以分压表示的平衡常数为 ,分压=总压×物质的量分数)。
CADDD CACAD DCDB
15(1) ①. I-、Fe3+ ②. I-
(2)作对照,排除K+和Cl-对过氧化氢分解速率的影响
(3)2和4 (4)2I-+H O+2H+=I +2H O
2 2 2 2
(5) ①. 抑制 ②. 促进 ③. 增大KOH溶液的浓度,反应I+2KOH KI+KIO+H O的平衡正向移动,
2 2
KIO的浓度增大,KIO分解生成O 的速率加快,所以过氧化氢的分解速率加快
2
16(1) ①. ②. >
(2) ①. 75% ②. 使用催化剂或增加反应物浓度(其它答案合理均可) (3)ABD
(4)BF (5) ①. 不是 ②. 该反应放热 ,升高温度,平衡逆向移动或催化剂活性降低
17(1)
(2) ①. 升高温度 ②. a ③. K >K =K
1 2 3
(3)> (4)p>p>p
3 2 1(5)0.2
18(1) ①. 吸热 ②. ③. AC
(2)
(3) ①. ②. 60%
(4) ①. ②. (或 )