文档内容
2024~2025 学年度第一学期高二年级期中考试
化 学
考生注意:
1.本试卷分选择题和非选择题两部分。满分100分,考试时间75分钟。
2.答题前,考生务必用直径0.5毫米黑色墨水签字笔将密封线内项目填写清楚。
3.考生作答时,请将答案答在答题卡上。选择题每小题选出答案后,用 2B铅笔把答题卡上
对应题目的答案标号涂黑;非选择题请用直径 0.5毫米黑色墨水签字笔在答题卡上各题的答
题区域内作答,超出答题区域书写的答案无效,在试题卷、草稿纸上作答无效。
4.本卷命题范围:苏教版选择性必修1专题1~专题2。
5.可能用到的相对原子质量:H1 C12 N14 O16 P31
一、选择题(本题共 14小题,每小题3分,共42分。在每小题给出的四个选项中,只有一
项是符合题目要求的)
1.下列文物修复与保护,主要运用“金属电化学腐蚀与金属保护”原理的是( )
选项 A B C D
文物
名称 元青花四爱图梅瓶 越王勾践剑 云梦睡虎地秦简 石家河玉人像
2.下列化学电池最符合绿色化学要求的是( )
A.锌锰干电池 B.铅蓄电池 C.纽扣锌银电池 D.氢氧燃料电池
3.天然气属于化石燃料,它的主要成分是 , 的标准燃烧热为8890kJ⋅mol ,则下列热化学方
程式中正确的是( )
A. kJ⋅mo[
B. kJ⋅mol
C. kJ⋅mol
D. kJ⋅mol
4.水煤气变换反应为 。830℃时,浓度均为1.00mol⋅L的CO、 发生上述反应,10min后反应达平衡状态,平衡时 。下列说法正确的是( )
A.压强不变说明反应已达平衡状态
B.反应达到平衡时
C.10min时该反应的化学反应速率为0.05mol⋅L ⋅min
D.再充入少量 ,平衡正向移动,K值增大
5.如图所示,a、b两电极的材料分别为铁和铜中的一种。下列说法正确的是( )
A.该装置可将电能转化为化学能 B.a极可能发生反应
C.电极b质量可能增加 D.该过程可能有大量气体产生
6.合成氨的热化学方程式为 kJ⋅mol ,下列有关叙述
错误的是( )
A.反应物的总能量大于生成物的总能量
B.将1mol 与3mol 置于密闭容器中充分反应后放出热量为akJ
C.形成化学键放出的总能量大于断裂化学键吸收的总能量
D.生成1mol 时放出 kJ的热量
7.在10L密闭容器中,1molA和3molB在一定条件下反应: ,2min时测得混合
气体共4mol且生成了0.4molC,则下列说法错误的是( )
A.x等于1 B.前2minB的平均反应速率为0.01mol⋅L ⋅min
C.2min时A的转化率为20% D.2min时,
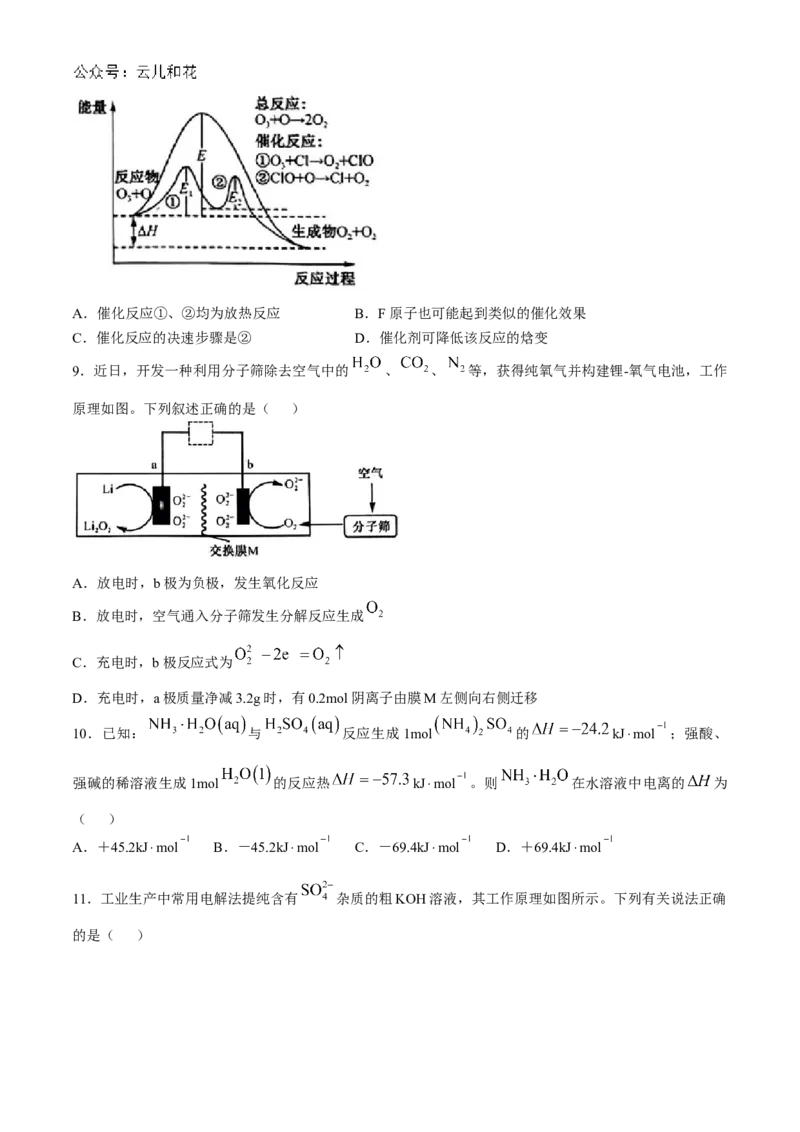
8.臭氧层中臭氧的分解历程如图所示,下列说法正确的是( )A.催化反应①、②均为放热反应 B.F原子也可能起到类似的催化效果
C.催化反应的决速步骤是② D.催化剂可降低该反应的焓变
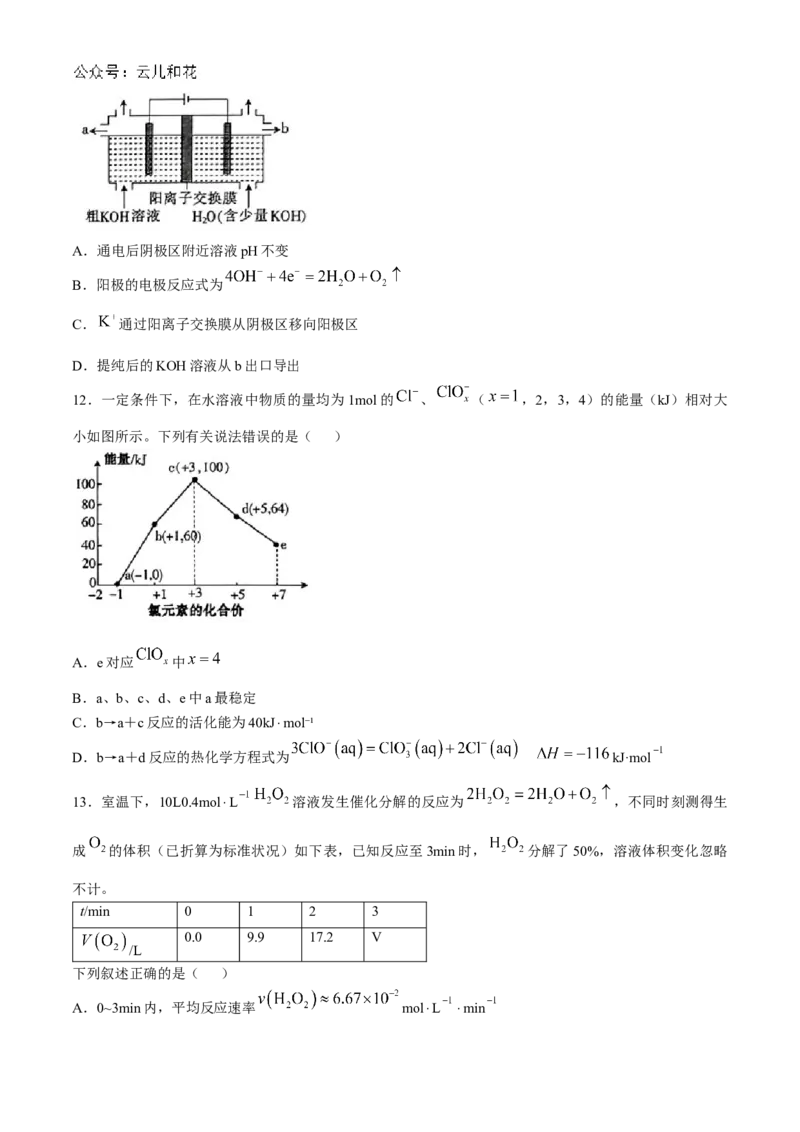
9.近日,开发一种利用分子筛除去空气中的 、 、 等,获得纯氧气并构建锂-氧气电池,工作
原理如图。下列叙述正确的是( )
A.放电时,b极为负极,发生氧化反应
B.放电时,空气通入分子筛发生分解反应生成
C.充电时,b极反应式为
D.充电时,a极质量净减3.2g时,有0.2mol阴离子由膜M左侧向右侧迁移
10.已知: 与 反应生成1mol 的 kJ⋅mol ;强酸、
强碱的稀溶液生成1mol 的反应热 kJ⋅mol 。则 在水溶液中电离的 为
( )
A.+45.2kJ⋅mol B.-45.2kJ⋅mol C.-69.4kJ⋅mol D.+69.4kJ⋅mol
11.工业生产中常用电解法提纯含有 杂质的粗KOH溶液,其工作原理如图所示。下列有关说法正确
的是( )A.通电后阴极区附近溶液pH不变
B.阳极的电极反应式为
C. 通过阳离子交换膜从阴极区移向阳极区
D.提纯后的KOH溶液从b出口导出
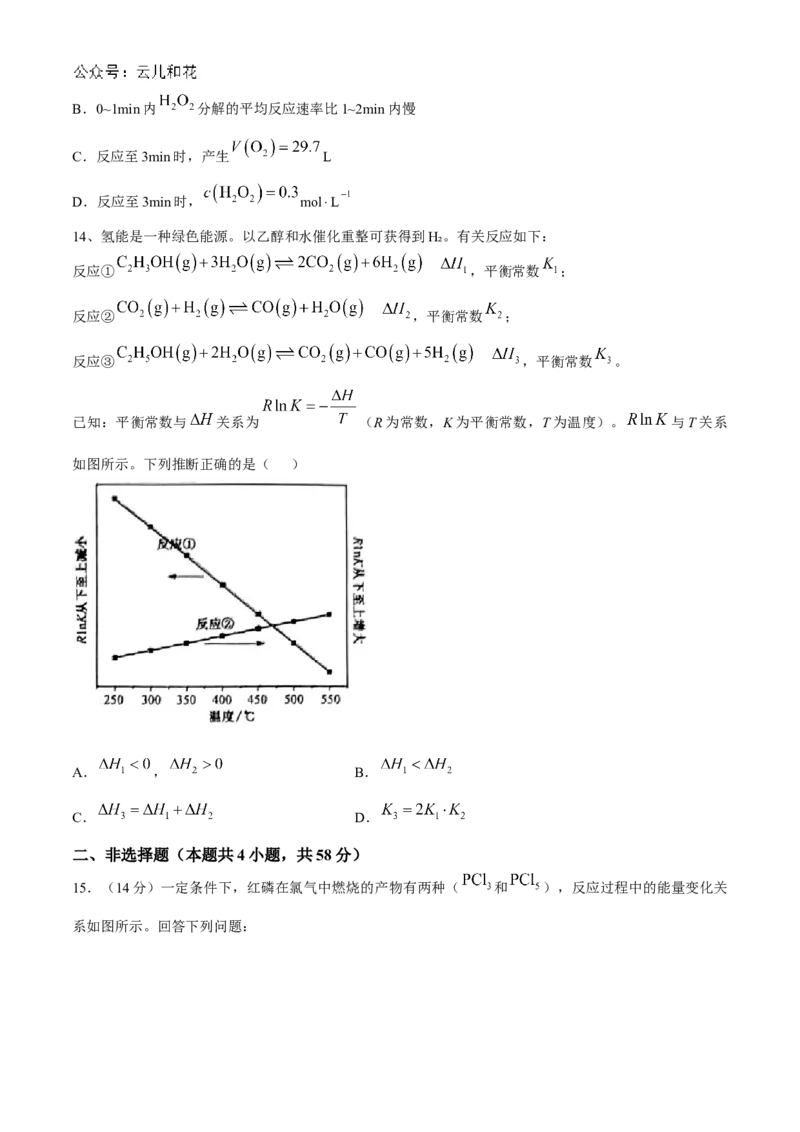
12.一定条件下,在水溶液中物质的量均为1mol的 、 ( ,2,3,4)的能量(kJ)相对大
小如图所示。下列有关说法错误的是( )
A.e对应 中
B.a、b、c、d、e中a最稳定
C.b→a+c反应的活化能为40kJ⋅mol⁻¹
D.b→a+d反应的热化学方程式为 kJ·mol
13.室温下,10L0.4mol⋅L 溶液发生催化分解的反应为 ,不同时刻测得生
成 的体积(已折算为标准状况)如下表,已知反应至3min时, 分解了50%,溶液体积变化忽略
不计。
t/min 0 1 2 3
0.0 9.9 17.2 V
/L
下列叙述正确的是( )
A.0~3min内,平均反应速率 mol⋅L ⋅minB.0~1min内 分解的平均反应速率比1~2min内慢
C.反应至3min时,产生 L
D.反应至3min时, mol⋅L
14、氢能是一种绿色能源。以乙醇和水催化重整可获得到H₂。有关反应如下:
反应① ,平衡常数 ;
反应② ,平衡常数 ;
反应③ ,平衡常数 。
已知:平衡常数与 关系为 (R为常数,K为平衡常数,T为温度)。 与T关系
如图所示。下列推断正确的是( )
A. , B.
C. D.
二、非选择题(本题共4小题,共58分)
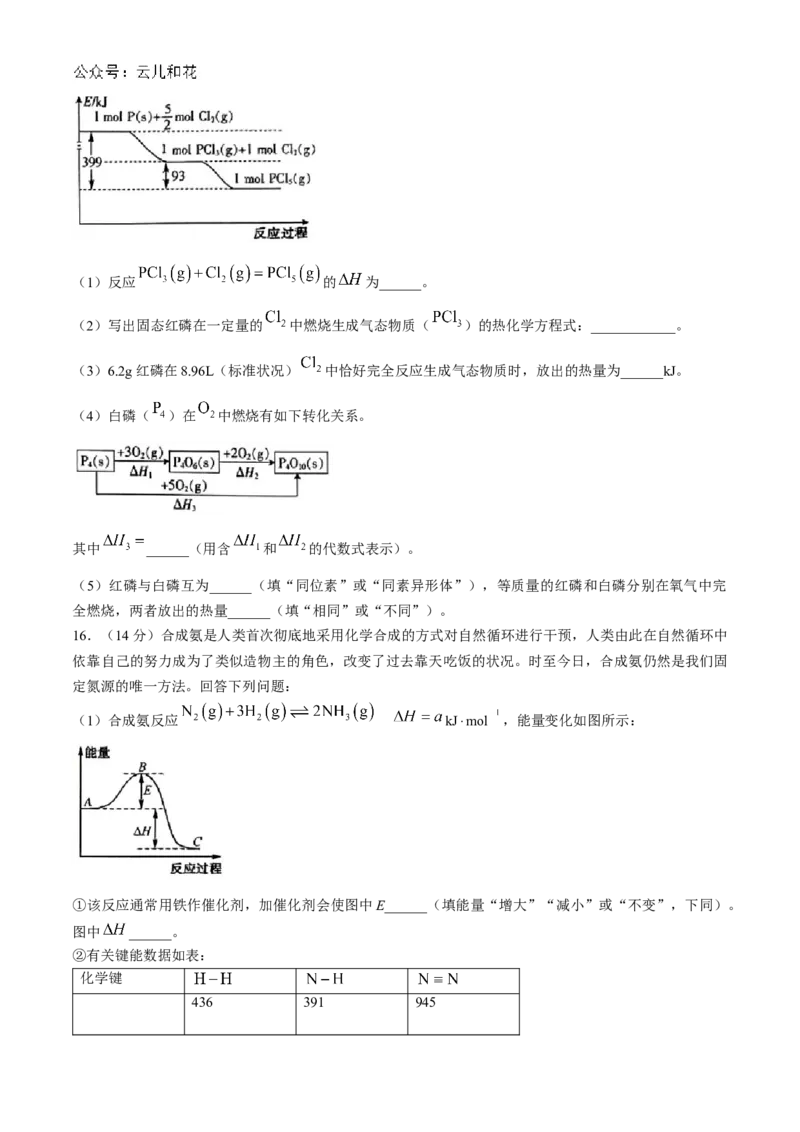
15.(14分)一定条件下,红磷在氯气中燃烧的产物有两种( 和 ),反应过程中的能量变化关
系如图所示。回答下列问题:(1)反应 的 为______。
(2)写出固态红磷在一定量的 中燃烧生成气态物质( )的热化学方程式:____________。
(3)6.2g红磷在8.96L(标准状况) 中恰好完全反应生成气态物质时,放出的热量为______kJ。
(4)白磷( )在 中燃烧有如下转化关系。
其中 ______(用含 和 的代数式表示)。
(5)红磷与白磷互为______(填“同位素”或“同素异形体”),等质量的红磷和白磷分别在氧气中完
全燃烧,两者放出的热量______(填“相同”或“不同”)。
16.(14分)合成氨是人类首次彻底地采用化学合成的方式对自然循环进行干预,人类由此在自然循环中
依靠自己的努力成为了类似造物主的角色,改变了过去靠天吃饭的状况。时至今日,合成氨仍然是我们固
定氮源的唯一方法。回答下列问题:
(1)合成氨反应 kJ⋅mol ,能量变化如图所示:
①该反应通常用铁作催化剂,加催化剂会使图中E______(填能量“增大”“减小”或“不变”,下同)。
图中 ______。
②有关键能数据如表:
化学键
436 391 945键能(kJ·mol
)
试根据表中所列键能数据计算a为______。
(2)对于合成氨反应,当其他条件不变时,只改变一个反应条件,将生成 的反应速率的变化填入下
表空格里(填“增大”“减小”或“不变”)。
编号 改变的条件
生成 的速率
① 升高温度
② 分离出氨气
③ 恒容下充入Ne
(3)工业上可以采用催化剂催化水煤气变换反应制取氢气:
,过程示意图如图所示,下列说法错误的是______(填字母)。
A.过程Ⅰ、过程Ⅱ中都有水参与反应
B.过程Ⅲ是放热过程
C.催化过程中既有极性键的断裂和形成,也有非极性键的断裂和形成
D.温度过高可能使催化剂失活,所以催化反应时并不是温度越高越好
17.(14分)银是常见的装饰品。银的电解精炼、银器表面的黑斑( )处理等均利用了电化学原理。
回答下列问题:
(1)如图为电解精炼银的原理示意图,图中a极名称为______(填“阳极”或“阴极”),______(填
“a”或“b”)极为含有杂质的粗银,若b极上有少量红棕色气体生成,则生成该气体的电极反应为
____________。
(2)银锌蓄电池应用广泛,放电时总反应为 ,电解质溶液为KOH
溶液。该电池放电时负极的电极反应式为____________,放电时正极区溶液的 ______(填“增
大”“减小”或“不变”)。(3)为处理银器表面的黑斑( ),将银器浸于铝质容器中的食盐水中并与铝接触, 转化为
Ag,正极的电极反应式为____________;铝质容器质量会减小的原因是____________。
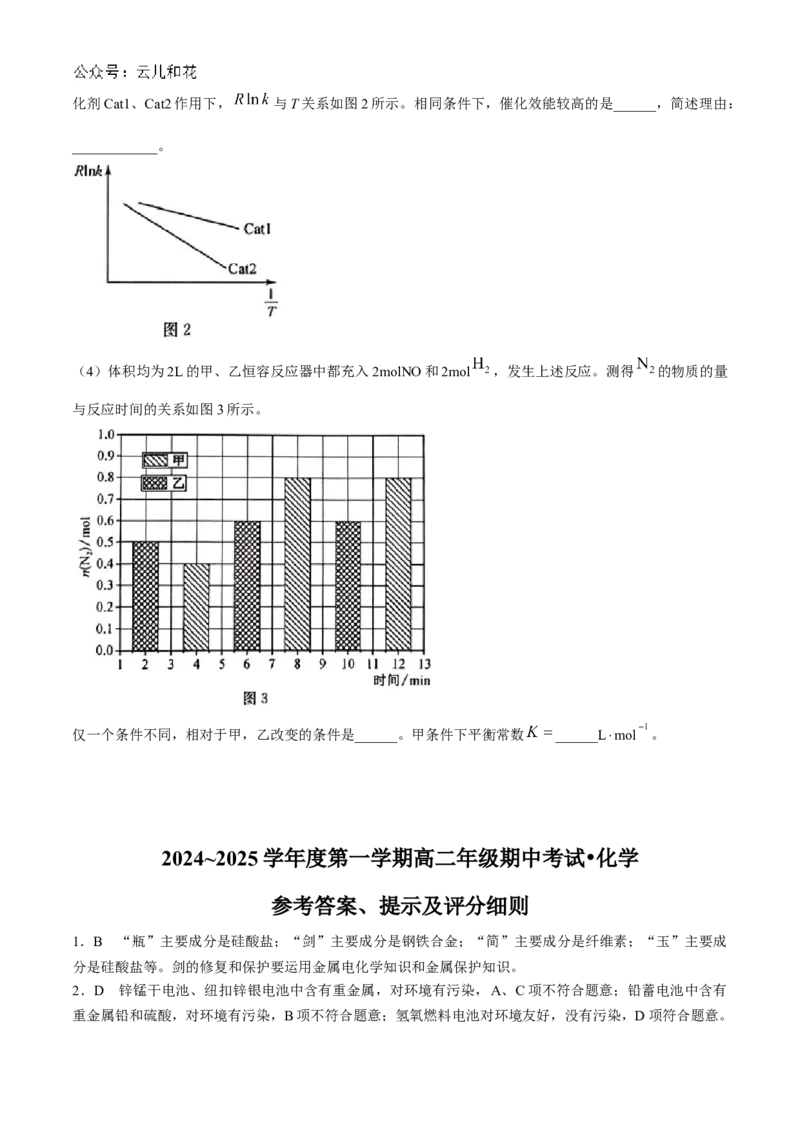
18.(16分)工业上,可以用 还原NO,发生反应: 。
回答下列问题:
(1)研究发现,总反应分两步进行:
① ;
② 。
相对能量与反应历程如图1所示。
加入催化剂,主要降低______(填序号)反应的活化能。
(2)已知共价键的键能:
化学键
键能/kJ·mol 607 436 946 463
______kJ·mol 。
(3) 的速率方程为 ( 为速率常数
只与温度、催化剂有关)。一定温度下,不同初始浓度与正反应速率关系相关数据如下表。
实验
/mol·L /mol·L
a 0.1 0.1 v
b 0.2 0.1 4v
c 0.1 0.2 2v
d 0.2 x 16v
① ______, ______, ______。
②已知:速率常数(k)与活化能( )、温度(T)的关系式为 (R为常数)。总反应在催化剂Cat1、Cat2作用下, 与T关系如图2所示。相同条件下,催化效能较高的是______,简述理由:
____________。
(4)体积均为2L的甲、乙恒容反应器中都充入2molNO和2mol ,发生上述反应。测得 的物质的量
与反应时间的关系如图3所示。
仅一个条件不同,相对于甲,乙改变的条件是______。甲条件下平衡常数 ______L⋅mol 。
2024~2025 学年度第一学期高二年级期中考试•化学
参考答案、提示及评分细则
1.B “瓶”主要成分是硅酸盐;“剑”主要成分是钢铁合金;“简”主要成分是纤维素;“玉”主要成
分是硅酸盐等。剑的修复和保护要运用金属电化学知识和金属保护知识。
2.D 锌锰干电池、纽扣锌银电池中含有重金属,对环境有污染,A、C项不符合题意;铅蓄电池中含有
重金属铅和硫酸,对环境有污染,B项不符合题意;氢氧燃料电池对环境友好,没有污染,D项符合题意。3.B 的标准燃烧热是指1mol 与 反应生成 与 时所释放的热量,所以可知
A、C项的热化学方程式的 无法判断其大小,即A、C两项错误,B项正确;该反应为放热反应,其
,D项错误。
4.B 该反应前后气体分子数不变,压强始终不变,压强不变不能说明反应已达平衡状态,A项错误;反
应达平衡时,正逆反应速率之比等于系数之比,B项正确;化学反应速率为一段时间内的平均速率,而不
是瞬时速率,C项错误;温度不变,平衡常数不变,D项错误。
5.C 构成原电池,能将化学能转化为电能,A项错误;原电池反应为 ,反应
中 得电子而不是Cu失电子,B项错误;若b极为Cu,则发生电极反应为 ,C项正
确;由电池反应知,D项错误。
6.B 该反应为放热反应,A、C两项正确;由 kJ⋅mol ,这
是一个可逆反应,反应不可能完全,B项错误;反应放出的热量与化学反应方程式的计量数成正比,D项
正确。
7.D
混合气体共4mol mol mol mol,解得 ,A项正确;前2min用B表示的平均反应
速率为0.01mol⋅L ⋅min ,B项正确;2min时A的转化率为20%,C项正确;根据方程式知,生成
0.4molC需要0.2molA、0.2molB,2min时,A、B、C的物质的量分别为 mol mol、
mol mol、0.4mol,A、B、C的物质的量之比 mol∶2.8mol:0.4mol=2∶7∶1,D项错误。
8.B 由图可知反应①为吸热反应,反应②为放热反应,A项错误;F与Cl同属卤族元素,氟原子也可能
对臭氧的分解有催化作用,B项正确;由图可知,E₁>E₂,,可知决速步骤为催化反应①,C项错误;催化
剂只能改变活化能而不会改变反应焓变,D项错误。
9.C 放电时,a极为负极,A项错误;分子筛分离出氧气,属于物理变化,没有发生化学变化,B项错误
充电时,b极为阳极,过氧根离子发生氧化反应生成氧气,C项正确;充电时,a极为阴极,电极反应式为
,阴极减少质量等于脱去过氧根离子质量,阴极净减 3.2g,相当于脱离0.1mol,根据电荷守恒,有0.1mol 由膜M左侧向右侧迁移,D项错误。
10.A 由题意知 kJ·mol
,即: kJ·mol ①,强酸与强碱中和反应反应
热 可 表 示 为 kJ⋅mol ② , ① - ② 可 得 :
kJ⋅mol ,A项正确。
11.D 阴极的电极反应式为 ,由水电离出的氢氧根离子浓度增大,pH增大,A项错误;
阳极的电极反应式为 ,B项错误; 通过阳离子交换膜从阳极区移向阴极区,
C项错误;左侧溶液中 转化为 ,多余的 透过阳离子交换膜进入右侧,右侧由水电离出的 转
化为 ,剩余大量由水电离出的 ,加上透过阳离子交换膜过来的 ,使右侧溶液中KOH的浓度增
大,所以提纯后的KOH溶液从b出口导出,D项正确。
12.C e点对应Cl元素的化合价为+7,A项正确;a、b、c、d、e中a的能量最低,所以a最稳定,B项
正确;根据图中数据无法判断b→a+c反应的活化能,C项错误;b→a+d,根据得失电子守恒规律知该反
应的离子方程式为 , (64kJ⋅mol kJ⋅mol ) kJ⋅mol
kJ⋅mol ,所以该反应的热化学方程式为
kJ⋅mol ,D项正确。
13.A 0~3min内,平均反应速率 mol⋅L min mol⋅L ⋅min ,A项正
确;0~1min 内 分解生成 L,1∼2min 内 分解生成 L L
L,故0~1min内 分解的平均速率比1~2min内快,B项错误;初始时双氧水的物质的量是4mol,反
应至3min时, 分解了50%,则生成 的物质的量为1mol,标准状况下的体积是22.4L,C项错误;
反应至3min时, 分解了50%,则 mol⋅L ,D项错误。
14.C 审题时抓住“箭头”方向是关键,左纵轴从下至上减小,即随着温度升高,反应①K增大,是吸热反应;右纵轴从下至上增大,反应②是吸热反应,A项错误;温度由 升至 ,则平衡常数变化:
,由此可知,吸热越多,平衡常数变化越大,即反应①平衡常数斜率(变化程度)
大于反应②,说明 ,B项错误;根据盖斯定律,反应①+反应②=反应③,C项正确;根据反
应平衡常数表达式可知, ,D项错误。
15.(1)-93kJ·mol (2分)
(2) kJ⋅mol (3分)
(3)70.5(3分)
(4) (2分)
(5)同素异形体;不同(各2分)
16.(1)①减小;不变②-93
(2)①增大②减小③不变
(3)C(每空2分)
17.(1)阳极;a;
(2) ;增大
(3) ;Al作负极,发生反应 (每空2分)
18.(1)①(1分)
(2)-712(2分)
(3)①2;1;0.4(各2分)
②Cat1(1分);改变相同温度,斜率越小,活化能越小,催化效能越大(2分)
(4)升温;160(各2分)
解析:
(1)①活化能较大,反应较慢,控制总反应速率,加入催化剂主要降低速控反应活化能。
(2)反应热等于断裂总键能与形成总键能之差, kJ·mol
kJ⋅mol 。
(3)①利用a、b组数据计算: ,同理利用a、c组数据计算: 。将d组数据代入方程可计算: 。
②根据表达式,改变温度相同, 变化值与活化能成正比例,活化能越大,其变化值越大,斜率越大,
催化效能越低。故Cat1催化效能较高。
(4)正反应是气体分子数减小的反应,是焓减反应,相对甲容器,乙容器反应较快,乙容器平衡时 物
质的量较少,说明改变条件是“升温”。甲条件下,平衡时 为0.8mol。
。