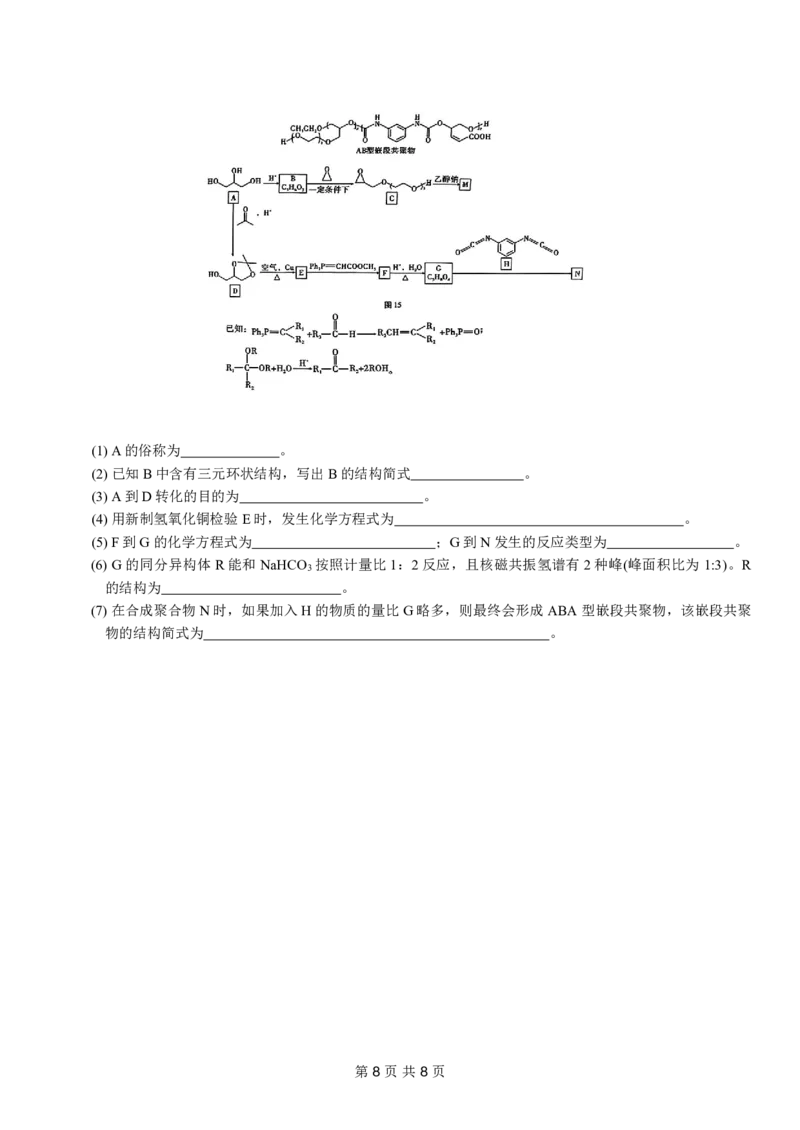
文档内容
重庆市第八中学 2024 届高考适应性月考卷(六)
化 学 试 卷
注意事项:
1. 答题前,考生务必用黑色碳素笔将自己的姓名、准考证号、考场号、座位号在答题卡上填写清楚。
2. 每小题选出答案后,用2B 铅笔把答题卡上对应题目的答案标号涂黑,如需改动,用橡皮擦干净后,再选
涂其他答案标号。在试题卷上作答无效。
3. 考试结束后,请将本试卷和答题卡一并交回。满分 100分,考试用时75分钟。
可能用到的相对原子质量:H—1 C—12 O—16 F—19 Na—23 S—32 Ca—40 Fe—56Co—59 Zn—65
一、选择题:本题共 14 小题,每小题 3分,共 42 分。在每小题给出的四个选项中,只有一项是符合题目要求
的。
1.化学和生活、科技、社会发展息息相关,下列说法正确的是
A.利用烯烃发生缩聚反应制备聚乙烯塑料
B.华为新上市的mate60pro手机引发关注,其芯片的基础材料是SiO₂
C.三星堆黄金面具出土时光亮且薄如纸,说明金不活泼和有很好的延展性
D.火星全球影像彩图显示了火星表土颜色,表土中赤铁矿主要成分为Fe₃O₄
2.下列化学用语表达正确的是
A.Cl₂分子中共价键电子云轮廓图:
B.CCl₄分子的空间填充模型为
C.次氯酸钠的电子式:
的名称:2-甲基丁酸
3.常
D.
温
CH
下
₃C
,
H
下
C
列
H₃
各
C
组
H₂
离
CO
子
O
在
H
指定溶液中一定能大量共存的是
A.在澄清透明溶液中:Cu²⁺、NH₄、Cl⁻、NO₃
B.在新制氯水中:NH:、Na⁺、SO²⁻、SO²⁻
C.在加入铝粉能产生H₂的溶液中:Fe²⁺、Na⁺、SO²⁻、NO₃
D.加入KSCN溶液显红色的溶液中:K⁺、CO²⁻、CN⁻、AlO₂
4.下述说法不正确的是
A.Cl₂和I₂分别与Fe反应生成FeCl₃和FeI₂
B.分别向NaAlO₂溶液和饱和Na₂CO₃溶液中通入过量的CO₂时均可析出白色沉淀
C.新制氯水和浓硝酸在光照下可产生同种气体
D.将等物质的量的Al和Si分别加入足量NaOH溶液中,生成气体的物质的量之比为4:3
5.设N 为阿伏加德罗常数的值。下列说法正确的是
A
A.25℃时,pH=12的Na₂CO₃溶液中含有OH⁻的数目为0.01N
A
B.标准状况下,2.24LCH₃Cl含有的C—H键数为0.3N
A
第1页共8页C.常温下,56gFe与足量浓硫酸充分反应生成气体的分子数为N
A
,溶液中含铬的离子总数为0.2N
A
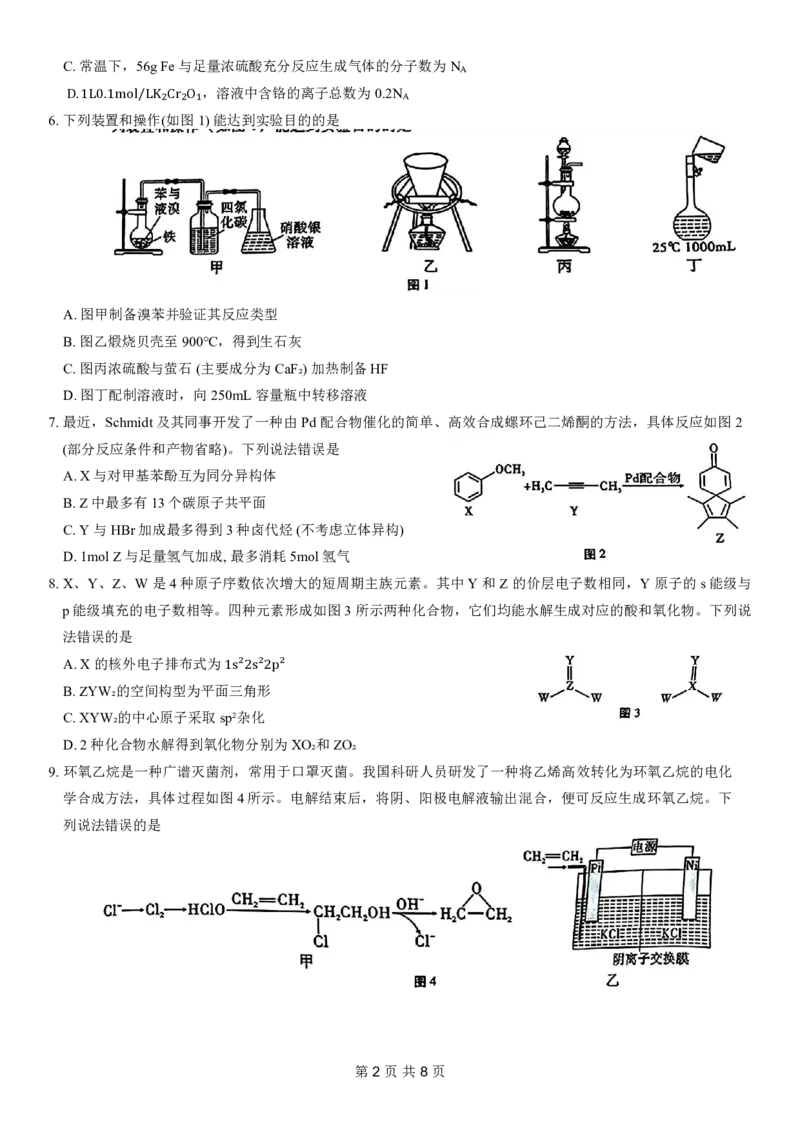
6.下 D. 列 1L 装 0. 置 1m 和 o 操 l/L 作 K(₂ 如 Cr 图 ₂O₁1)能达到实验目的的是
A.图甲制备溴苯并验证其反应类型
B.图乙煅烧贝壳至900℃,得到生石灰
C.图丙浓硫酸与萤石(主要成分为CaF₂)加热制备HF
D.图丁配制溶液时,向250mL容量瓶中转移溶液
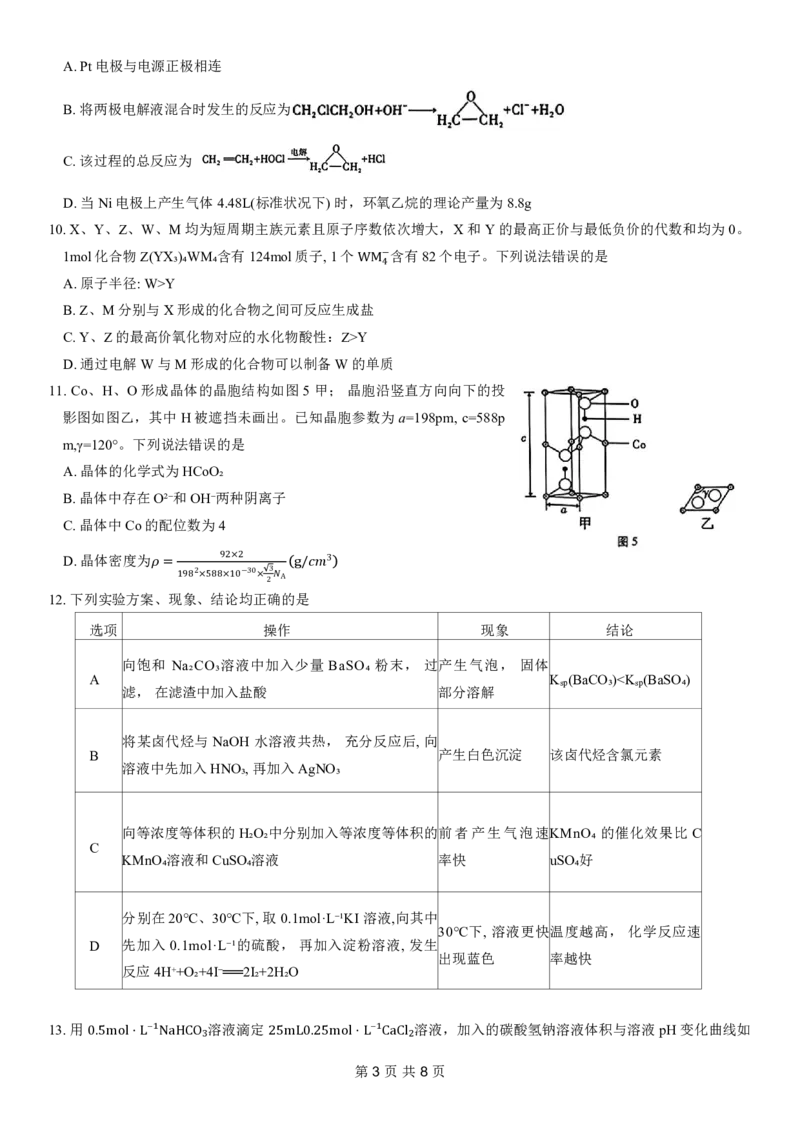
7.最近,Schmidt及其同事开发了一种由Pd配合物催化的简单、高效合成螺环己二烯酮的方法,具体反应如图2
(部分反应条件和产物省略)。下列说法错误是
A.X与对甲基苯酚互为同分异构体
B.Z中最多有13个碳原子共平面
C.Y与HBr加成最多得到3种卤代烃(不考虑立体异构)
D.1molZ与足量氢气加成,最多消耗5mol氢气
8.X、Y、Z、W是4种原子序数依次增大的短周期主族元素。其中Y和Z的价层电子数相同,Y原子的s能级与
p能级填充的电子数相等。四种元素形成如图3所示两种化合物,它们均能水解生成对应的酸和氧化物。下列说
法错误的是
A.X的核外电子排布式为
B.ZYW₂的空间构型为平面
1
三
s²
角
2s
形
²2p²
C.XYW₂的中心原子采取sp²杂化
D.2种化合物水解得到氧化物分别为XO₂和ZO₂
9.环氧乙烷是一种广谱灭菌剂,常用于口罩灭菌。我国科研人员研发了一种将乙烯高效转化为环氧乙烷的电化
学合成方法,具体过程如图4所示。电解结束后,将阴、阳极电解液输出混合,便可反应生成环氧乙烷。下
列说法错误的是
第2页共8页A.Pt电极与电源正极相连
B.将两极电解液混合时发生的反应为
C.该过程的总反应为
D.当Ni电极上产生气体4.48L(标准状况下)时,环氧乙烷的理论产量为8.8g
10.X、Y、Z、W、M均为短周期主族元素且原子序数依次增大,X和Y的最高正价与最低负价的代数和均为0。
1mol化合物Z(YX₃)₄WM₄含有124mol质子,1个 含有82个电子。下列说法错误的是
−
A.原子半径:W>Y WM4
B.Z、M分别与X形成的化合物之间可反应生成盐
C.Y、Z的最高价氧化物对应的水化物酸性:Z>Y
D.通过电解W与M形成的化合物可以制备W的单质
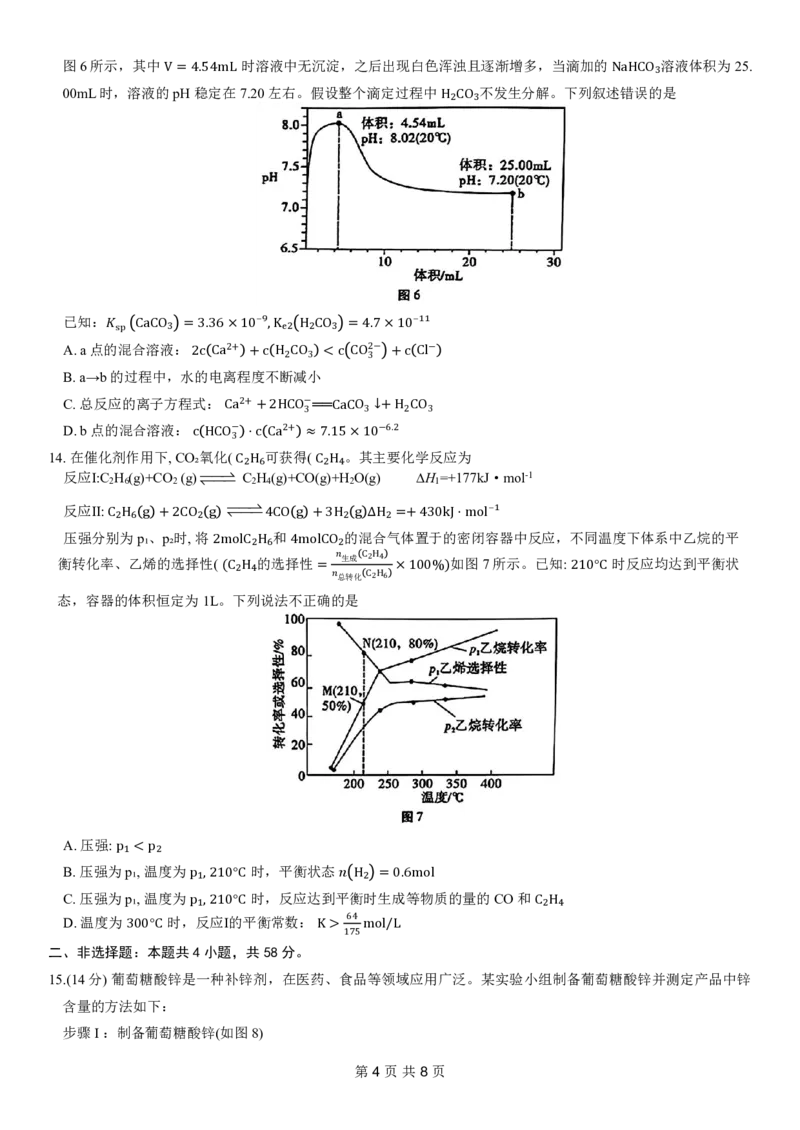
11. Co、H、O形成晶体的晶胞结构如图5 甲; 晶胞沿竖直方向向下的投
影图如图乙,其中 H被遮挡未画出。已知晶胞参数为a=198pm, c=588p
m,γ=120°。下列说法错误的是
A.晶体的化学式为HCoO₂
B.晶体中存在O²⁻和OH⁻两种阴离子
C.晶体中Co的配位数为4
D.晶体密度为
92×2 3
12.下列实验方案 、 = 现1象98 2 、×5结88×论10均 −30 正×2确 3 A的 g 是 /
选项 操作 现象 结论
向饱和 Na₂CO₃溶液中加入少量 BaSO₄ 粉末, 过产生气泡, 固体
A K (BaCO₃) 175mol/L
15.(14分)葡萄糖酸锌是一种补锌剂,在医药、食品等领域应用广泛。某实验小组制备葡萄糖酸锌并测定产品中锌
含量的方法如下:
步骤Ⅰ:制备葡萄糖酸锌(如图8)
第4页共8页部分物质的化学式和性质如下表:
名称 化学式 性质
葡萄糖酸 C₆H₁₂O₇ 易溶于水,微溶于乙醇
葡萄糖酸钙 Ca(C₆H₁₁O₇)₂ 溶于水
葡萄糖酸锌 Zn(C₆H₁₁O₇)₂ 溶于水,不溶于乙醇
回答下列问题:
(1)步骤Ⅰ中采用的最佳的加热方式为 ,操作①的名称为 。
(2)步骤Ⅰ中,葡萄糖酸钙与稀硫酸反应的化学方程式是 ,葡萄糖酸易溶于水
的原因是 。
(3)将滤液1通过H⁺型阳离子交换树脂的目的是 。
(4)向滤液2中加入 (填序号)并搅拌促进晶体析出,待晶体充分析出后,减压过滤、洗涤、干燥
得葡萄糖酸锌固体。
a.浓硫酸 b.95%乙醇溶液 c.CaO
(5)步骤Ⅱ:测定产品中锌含量
取ag提纯后的产品溶于水配制成100.00mL 溶液,取25.00mL 置于锥形瓶中,向其中滴入少量EBT作为指
示剂(遇Zn²⁺生成Zn-EBT),再加入过量的 无色溶液(遇Zn²⁺生成Zn-EDTA),同时发生反应:
Zn-EBT(酒红色)+EDTA ══Zn-EDTA (无 V 色 ₁m)+LEc₁BmTo(蓝 l/L 色 ED)。 TA 再用 标准溶液滴定至终点。三次滴定
平均消耗锌标准溶液V₂mL。
c₂mol/LZn²⁺
①滴定终点的颜色变化为由 色变为 色。
②该产品中锌元素的质量分数为 %。(用含a,c₁、c₂,V₁、V₂的代数式表示)
③若滴定前滴定管的尖嘴处无气泡,滴定后产生气泡,则会导致此次测定结果 (填“偏高”“偏低”
或“不变”)。
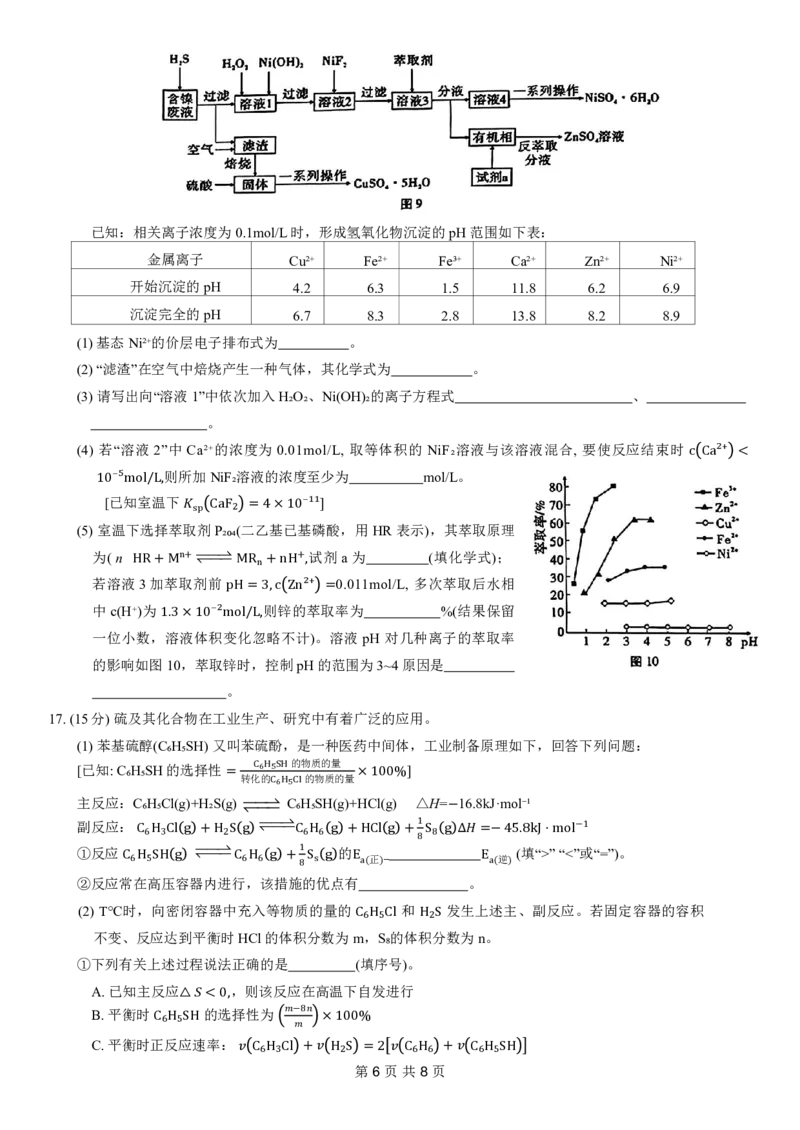
16. (14分) 从工业含镍的废液 (主要含 、 等) 中提纯得到硫酸镍晶体并回收胆矾晶
2∗ 2∗ 2∗ 3∗ 2∗ 2∗
体,某课题小组设计了图9流程:
Ni ,Cu Fe ,Fe ,Ca ,Zn
第5页共8页已知:相关离子浓度为0.1mol/L时,形成氢氧化物沉淀的pH范围如下表:
金属离子 Cu²⁺ Fe²⁺ Fe³⁺ Ca²⁺ Zn²⁺ Ni²⁺
开始沉淀的pH 4.2 6.3 1.5 11.8 6.2 6.9
沉淀完全的pH 6.7 8.3 2.8 13.8 8.2 8.9
(1)基态Ni²⁺的价层电子排布式为 。
(2)“滤渣”在空气中焙烧产生一种气体,其化学式为 。
(3)请写出向“溶液1”中依次加入H₂O₂、Ni(OH)₂的离子方程式 、
。
(4) 若“溶液 2”中 Ca²⁺的浓度为 0.01mol/L, 取等体积的 NiF₂溶液与该溶液混合, 要使反应结束时
则所加NiF₂溶液的浓度至少为 mol/L。
c Ca²⁺ <
[已知室温下
10⁻⁵mol/L,
(5)室温下选择萃取
s剂p CPa₂F₀₄₂(二
=
乙
4
基
×
已
10
基
⁻¹
磷
¹]
酸,用HR 表示),其萃取原理
为( n 试剂 a 为 (填化学式);
n+ +
若溶液 H3R 加 + 萃 M 取剂前 MRn+nH , 0.011mol/L, 多次萃取后水相
中c(H⁺)为
pH=3
则
,c
锌
Z
的
n²
萃
⁺
取
=
率为 %(结果保留
一位小数, 1 溶 .3 液 × 体 10 积 ⁻²m 变 o 化 l/ 忽 L, 略不计)。溶液 pH 对几种离子的萃取率
的影响如图10,萃取锌时,控制pH的范围为3~4原因是
。
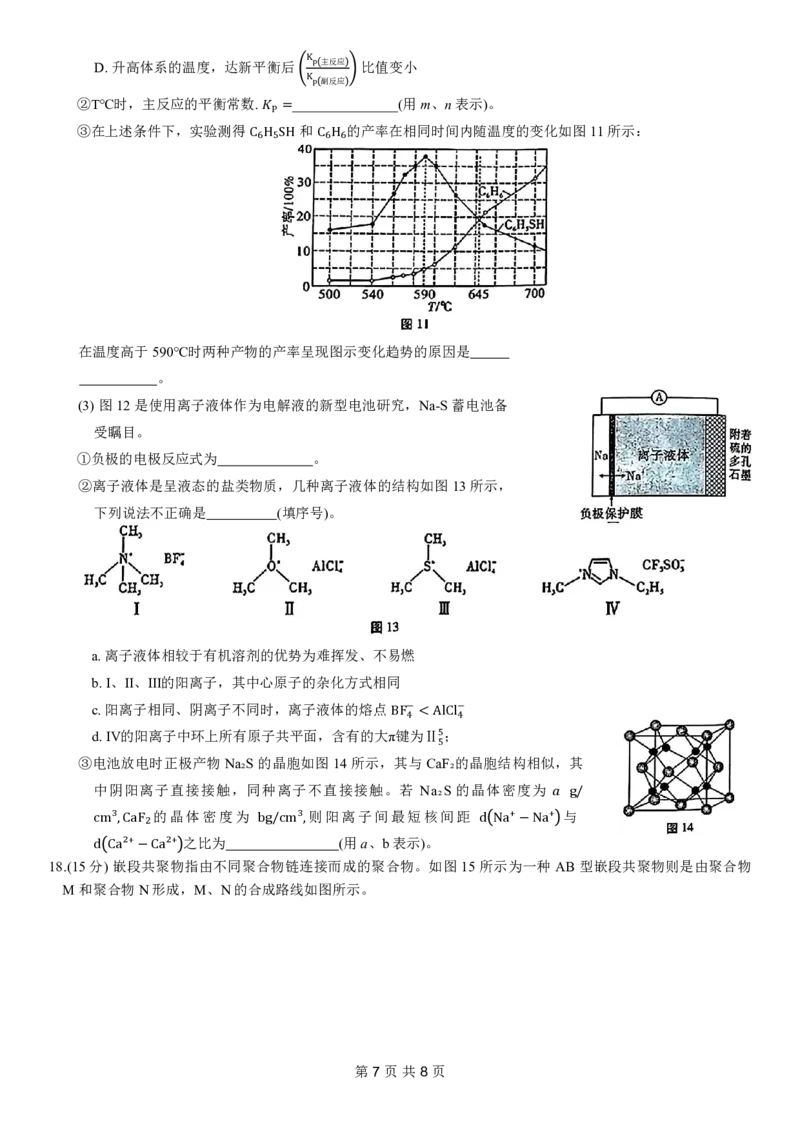
17.(15分)硫及其化合物在工业生产、研究中有着广泛的应用。
(1)苯基硫醇(C₆H₅SH)又叫苯硫酚,是一种医药中间体,工业制备原理如下,回答下列问题:
的物质的量
[已知:C₆H₅SH的选择性
转化的 的物质的量
C6H5SH
主反应:C₆H₅Cl(g)+H₂S(g=) C6HC5C₆lH₅SH(g)+H×C1l0(g0)%]△H= 16.8kJ·mol⁻¹
副反应:
−
①反应 C6H3Cl g + H 2S g C6H6 g 的 +H正Cl g + 1 8S8 g Δ =−逆45(. 填 8k“J>⋅”m“o