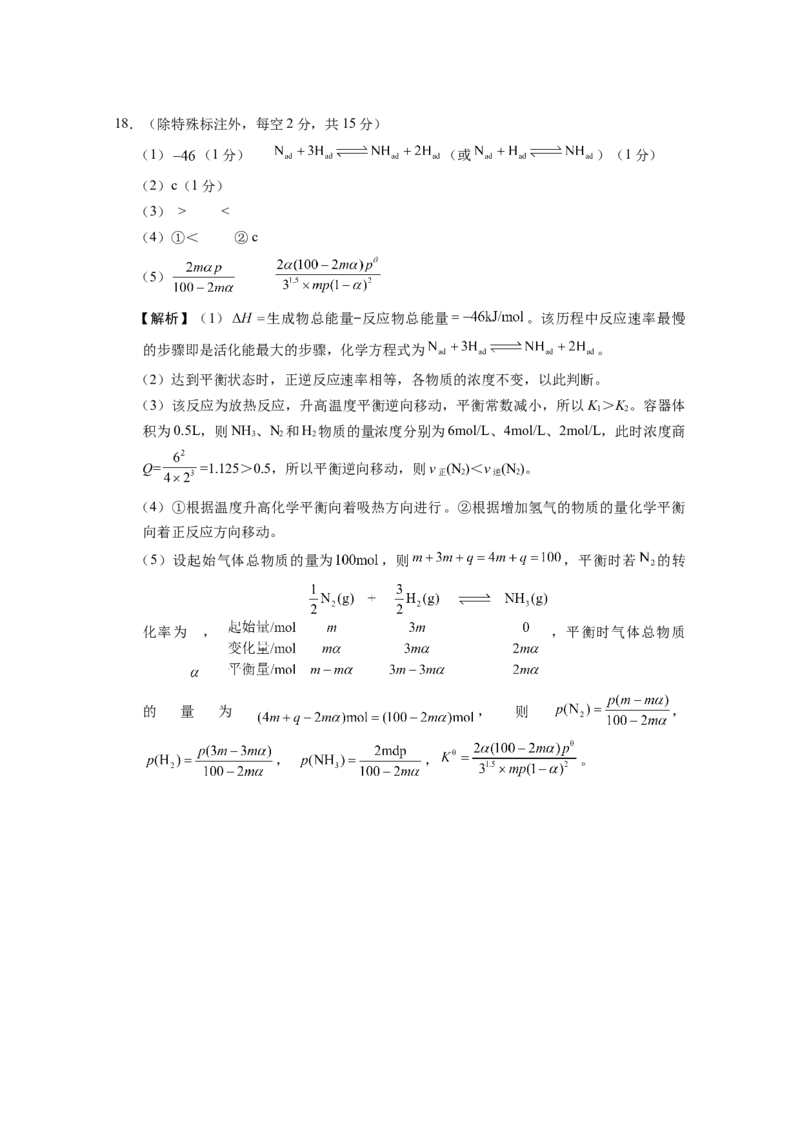文档内容
昭通一中教研联盟 2025 年秋季学期高二年级期中考试
化学(A 卷)参考答案
第Ⅰ卷(选择题,共42分)
一、选择题(本大题共14小题,每小题3分,共42分。在每小题给出的四个选项中,只有
一项是符合题目要求的)
题号 1 2 3 4 5 6 7
答案 A C C A D B C
题号 8 9 10 11 12 13 14
答案 D B A D C B D
【解析】
1.金刚石转化为石墨的过程放热,石墨能量更低更稳定,A正确。硫固体转化为硫蒸气需要
吸热,故硫蒸气的能量高于硫固体,等质量时硫蒸气燃烧释放更多热量,B错误。对于反
应S(g)+O (g)=SO (g) ΔH=−297.23 kJ/mol,表明形成1mol SO (g)的化学键所释放的
2 2 2
总能量大于断裂 1mol S(g)和1mol O(g)的化学键所吸收的总能量,C错误。氢气的燃烧
2
热是指1mol氢气完全燃烧生成液态水放出的热量,则由热化学方程式可知,氢气的燃烧
热为 ,D错误。故选A。
2.稀Ba(OH) 溶液和硫酸反应时,除H+与OH-的中和反应外,Ba2+与 还会生成BaSO
2 4
沉淀,沉淀过程放热,导致总热量大于单纯中和反应的热量,影响测定结果,A错误。测
定中和热实验中为保证盐酸完全被中和,常用稍过量的NaOH溶液,B错误。铜是热的良
导体,用铜质搅拌器会导致热量散失增加,使测得的温度升高值偏小,计算出的放热数
值偏低,C正确。为了使酸碱充分反应,应将量筒中的NaOH溶液迅速一次倒入量热计中
并搅拌,减少热量散失,D错误。故答案选C。
3.由该反应的热化学方程式可知,该反应涉及的主要物质有HCl、O 、CuO、Cl 、HO。
2 2 2
CuO与Y反应生成Cu(OH)Cl,则Y为HCl。Cu(OH)Cl分解生成W和Cu OCl ,则W为
2 2
HO。CuCl 分解为X和CuCl,则X为Cl 。CuCl和Z反应生成Cu OCl ,则Z为O 。综
2 2 2 2 2 2
上所述,X、Y、Z、W依次是 、 、 、 。Z为反应物O ,X为生成物Cl ,
2 2
A正确。总反应为放热反应,其他条件一定,降温平衡正向移动,平衡常数增大,B正确。
在反应中作催化剂,会不断循环,适量即可,C错误。该反应是一个熵减的放热反应,在低温下能自发进行,D正确。故选C。
4.pH=1的溶液呈强酸性, 、 、Cl-、 能大量共存,A符合题意。 的
NH Fe(SO ) 溶液中含有Fe3+,它会和 发生双水解,不能大量共存,B不符合题意。
4 4 2
25℃ 时 , =1×10−12 , 由 K =1×10−14 可 知 , c(H+)=1×10−13mol·L−1 , c(OH - )
w
=1×10−1mol·L−1,则溶液为强碱性, 会与OH-反应生成 ,不能大量共存,C不
符合题意。水电离出的 的溶液可能为酸性或碱性。若为碱性, 会
生成 沉淀,无法大量共存,故该组离子不一定能大量共存,D不符合题意。故选
A。
5.减小容积(加压),PCl 的浓度升高,平衡向气体物质的量少的一侧(逆反应)移动,但
3
根据勒夏特列原理,只能减弱不能完全抵消,PCl 的浓度最终升高,A错误。恒容下加入
3
PCl ,平衡逆向移动,生成更多PCl ,其浓度应升高而非降低,B错误。恒压下加入氦气,
3 5
容器体积增大,相当于减压,平衡正向移动,PCl 的转化率应增大而非减小,C错误。达
5
平衡时,各物质的浓度不再变化是化学平衡的基本特征,因此PCl 和Cl 的浓度保持不变,
5 2
D正确。故选D。
6.氢氧化钠与乙酸乙酯和乙酸均反应,不能除杂,应该用饱和碳酸钠溶液,A错误。反应④
为乙醇与乙酸的酯化反应,属于取代反应。反应③为乙醇氧化生成乙酸,属于氧化反应,
B正确。油脂是小分子化合物,C错误。淀粉和纤维素的分子式均为 ,但二者
的n值不同,分子式不同,不互为同分异构体,D错误。故选B。
7.T ℃时,水的离子积常数 > (25 ℃时 ),
水的电离为吸热过程,温度越高,水的离子积常数越大,则 ,A错误。若加入
NaOH, 增大,水的电离平衡 向左移动,抑制水的电离,B错
误。b点(25 ℃)对应水的离子积为 ,溶液中 ,
mol/L,水电离产生的 等于水电离产生的 ,该点的溶液中由水电离产生的
mol/L,C正确。c点溶液中 ,溶液呈碱性,含有大量的OH
-,与 、 均不能大量共存,D错误。故选C。
8.若HA为强酸,0.1mol·L−1的HA溶液pH为1.0,现测得溶液pH为2.0,则HA为弱酸,A
正确。因HS-水解程度大于其电离程度,NaHS溶液显碱性,B正确。pH值为4.0的溶液
中c(H+)=1×10−4mol/L,在25℃时,水的离子积K =1×10−14,故c(OH-)=1×10−10mol/L,
wC正确。若HA为强酸,与NaOH等体积等浓度混合后,所得溶液pH为7.0,若HA为弱
酸,与NaOH等体积等浓度混合后,所得溶液pH大于7.0,D不正确。答案选D。
9.铁钉表面油污为酯类,可在碱性条件下水解(皂化反应),NaCO 溶液呈碱性,加热并
2 3
搅拌可促进油污水解,装置中用烧杯盛NaCO 溶液、加热、搅拌的操作合理,A正确。
2 3
CHCOOH易挥发,生成的CO 中混有CHCOOH蒸气,CHCOOH也能与NaSiO 反应生
3 2 3 3 2 3
成HSiO,NaSiO 溶液变浑浊不能证明酸性:HCO> HSiO,B错误。标准NaOH溶液
2 3 2 3 2 3 2 3
滴定未知浓度盐酸时,NaOH为强碱,聚四氟乙烯活塞的滴定管耐酸碱腐蚀,可作为碱式
滴定管使用,锥形瓶中盛放未知浓度的HCl溶液,滴定时振荡锥形瓶,装置操作合理,C
正确。直接加热MgCl ·6HO,Mg2+会水解为Mg(OH) ,得不到无水MgCl ,而在干燥的
2 2 2 2
HCl气流中加热MgCl ·6HO,干燥的HCl会抑制Mg2+水解并带走结晶水,能得到无水
2 2
MgCl ,D能达到实验目的。
2
10.N点溶液中溶质为 ,溶液pH=10,溶液呈碱性,说明 的水解程度大于电
离程度,因此 ,A错误。M点溶液pH在4附近,
若使用酚酞作指示剂,则消耗的NaOH的体积偏大,M点可用甲基橙作指示剂指示滴定
终点,B正确。M→N过程中 和 的混合溶液,则混合溶液中电荷守恒
式为: ,C 正确。M 点溶质为
NaH PO ,根据物料守恒,满足c(Na+)=c(H PO )+c( )+c( )+c( ),D正确。
2 4 3 4
故选A。
11.HCOONa溶液的pH更小,说明HCOOH的酸性强于CHCOOH,醋酸根水解程度更大,
3
因此HCOO-的碱性弱于CHCOO-,结合H+的能力更弱,A错误。向稀 溶液
3
中加浓硫酸,虽 浓度增大抑制 水解,但浓硫酸稀释时放热,未控制变量,无法
单独验证 的影响,B错误。 和 均为白色沉淀,无法通过现象确定沉淀
种类,无法比较 和 溶度积常数的大小,C错误。三氯乙酸溶液中产生气泡
的速率更快,说明溶液中 更大,可证明酸性:三氯乙酸>乙酸,D正确。故选D。
12.矿石(含MnO 、Co O 、Fe O )经过硫酸和稻草浸出过滤得到滤液,滤液含有Fe3+、
2 3 4 2 3
Mn2+、Co2+,加入NaCO 沉铁得到FeOOH,过滤,滤液再加入NaS沉钴得到CoS,过
2 3 2
滤最后得到硫酸锰溶液。根据分析可知,加入硫酸和稻草浸出,硫酸作催化剂和浸取剂,
A正确。根据图示可知,“浸出”时,Mn和Co的化合价都降低,被还原,Fe的化合价
没有变化,Fe元素没有被还原,B正确。“沉钴”后的上层清液存在CoS的沉淀溶解平
衡,满足Q=K =c(Co2+)·c(S2−)=10−20.4,但沉钴时NaS通常会过量,故c(Co2+)CHCOOH>H CO>HClO
2 3 3 2 3
②c(NH )>c(ClO-)>c(OH-)>c(H+)
③ =
④60
(2)小于 大于
(3)0.52
【解析】(1)①电离平衡常数越大说明酸性越强,根据电离平衡常数可得酸性由强到弱
的顺序为HSO >CHCOOH>H CO>HClO。
2 3 3 2 3
②由电离常数可知,一水合氨的电离大于次氯酸的电离,次氯酸铵溶液中,次氯酸根的
水解大于铵根离子的水解,溶液呈碱性,则溶液中离子浓度的大小顺序为c(NH )>c(ClO
-) >c(OH-)>c(H+)。
③向 溶液中加入过量 溶液,根据酸性: ,
发生反应的离子方程式是 = 。
④NaOH溶液吸收 的过程发生反应: = ,所得溶液
中 。
(2) a、c 两点 相同,水的电离随温度升高正移,K 增大,故 a 点溶液的
w
小于c点溶液的 。b点溶液显碱性,根据电荷守恒:
= ,可得: 。
(3)硫酸钡与碳酸钠溶液的反应方程式为 BaSO(s)+CO (aq)= BaCO (s)+SO
4 3
(aq),反应的平衡常数 K= = =0.04,
23.3g硫酸钡的物质的量为0.1mol,设0.1mol硫酸钡完全转化为碳酸钡需要碳酸钠溶液
的浓度为 xmol/L,当硫酸钡完全转化为碳酸钡后,5L 溶液中硫酸根离子的浓度
0.02mol/L,溶液中碳酸根离子的浓度为(x−0.02)mol/L,由平衡常数可得
=0.04,解得x=0.52。18.(除特殊标注外,每空2分,共15分)
(1) (1分) (或 )(1分)
(2)c(1分)
(3) > <
(4)①< ②c
(5)
【解析】(1) 生成物总能量−反应物总能量 。该历程中反应速率最慢
的步骤即是活化能最大的步骤,化学方程式为 。
(2)达到平衡状态时,正逆反应速率相等,各物质的浓度不变,以此判断。
(3)该反应为放热反应,升高温度平衡逆向移动,平衡常数减小,所以K >K 。容器体
1 2
积为0.5L,则NH 、N 和H 物质的量浓度分别为6mol/L、4mol/L、2mol/L,此时浓度商
3 2 2
Q= =1.125>0.5,所以平衡逆向移动,则v (N )<v (N )。
正 2 逆 2
(4)①根据温度升高化学平衡向着吸热方向进行。②根据增加氢气的物质的量化学平衡
向着正反应方向移动。
(5)设起始气体总物质的量为 ,则 ,平衡时若 的转
化率为 , ,平衡时气体总物质
的 量 为 , 则 ,
, , 。