文档内容
长安一中 2021 级高三第三次教学质量检测
化学试题
相对原子质量:H1 C12 N14 O16 Na 23 S 32 Fe 56 Cu 64 Zn65 Ce 140
一、选择题:本题共20小题,1-10每小题2分,11-20每小题3分,共50分。在每小题
给出的四个选项中,只有一项是符合题目要求的。
1. 以下有关物质用途的叙述正确的是( )
A. 废旧钢材焊接前,可依次用饱和Na CO 溶液、饱和NH Cl溶液处理焊点
2 3 4
B. 金属钠、金属镁等活泼金属着火时,可以使用干粉灭火器来灭火
C. 食品包装袋中常放入小袋的生石灰,目的是防止食品氧化变质
D. 中国蓝是古代人工合成的蓝色化合物,其化学式为BaCuSi O ,可改写成
4 10
BaO·4SiO ·CuO
2
2.下列叙述不涉及氧化还原反应的是 ( )
A.谷物发酵酿造食醋 B.大气中SO 参与酸雨形成
2
C.含氯消毒剂用于环境消毒 D.小苏打用作食品膨松剂
3. 已知 (a)、 (b)的分子式均为C H ,下列说法正确的是( )
8 8
A. a、b 的一氯代物分别有5 种和4种(不考虑立体异构)
B. a、b 中所有原子均可能处于同一平面
C. a、b 均可使酸性高锰酸钾溶液褪色
D. a 的同分异构体只有b一种
4. 下列实验的现象及结论均正确且两者具有因果关系的是( )
选项 实验 现象 结论
出现红褐色沉淀和
A 向FeCl 溶液中加入适量Na O 粉末 FeCl 部分变质
2 2 2 无色气体 2
向NaBr溶液中滴入少量氯水和苯,振 分层,上层呈橙红
B Br-还原性强于Cl-
荡,静置 色
将SO 通入BaCl 溶液中,然后滴入稀硝 产生白色沉淀且沉 白色沉淀为BaSO ,然
C 2 2 3
酸 淀不溶于稀硝酸 后转化为BaSO
4
将装满氯水的圆底烧瓶倒置在有氯水的
D 烧瓶内有气泡向上 日光照射时,溶解的
高三三模化学试卷
第 1 页 共 12页
学科网(北京)股份有限公司水槽中,日光照射 逸出 Cl 逸出
2
5.下列各组离子在常温下一定能大量共存的是( )
A.pH=0的溶液中:Cl-、Na+、NO -、Fe2+
3
B.在c(H+)=10-2 mol·L-1的溶液中:NH +、NO -、K+、Cl-
4 3
C.加入铝粉能放出H 的溶液中:Ba2+、NH +、NO -、Cl-
2 4 3
D.含有大量Cu2+的溶液中:Al3+、S2-、Br-、Na+
6.下列说法正确的是( )
A.硬脂酸甘油酯在碱性条件下的水解反应属于皂化反应
B.向淀粉溶液中加入硫酸溶液,加热后滴入几滴新制氢氧化铜悬浊液,再加热至沸腾,
未出现红色物质,说明淀粉未水解
C.将无机盐硫酸铜溶液加入到蛋白质溶液中会出现沉淀,这种现象叫做盐析
D.淀粉、蛋白质均可以水解,水解产物均含有电解质
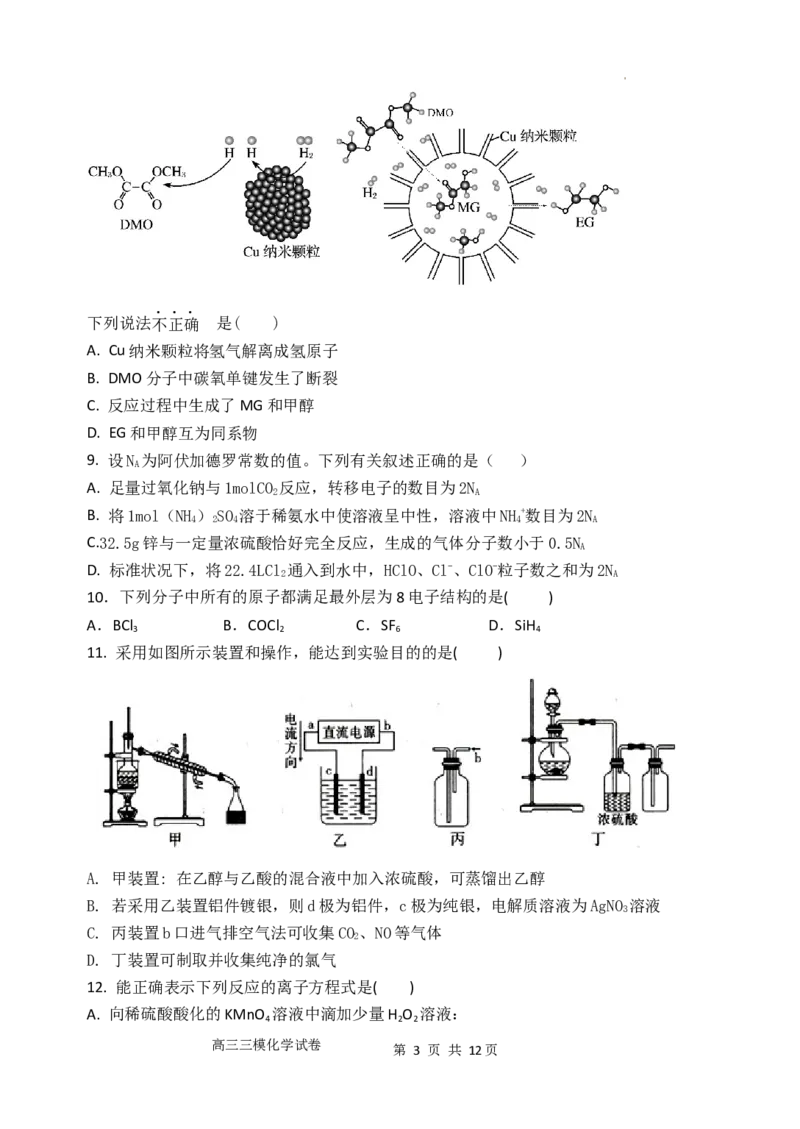
的
7. 短周期主族元素W、X、Y、Z 原子序数依次增加。A是元素Y的单质。常温下,甲的
浓溶液具有脱水性,和A发生钝化。丙、丁、戊是由这些元素组成的二元化合物,且丙
是无色刺激性气味气体。上述物质的转化关系如图所示。下列说法正确的是( )
A. 丁和戊中所含化学键种类相同
B. 简单离子半径大小:X<Y
C. 气态氢化物的还原性:X<Z
D. Y的简单离子与Z的简单离子在水溶液中可大量共存
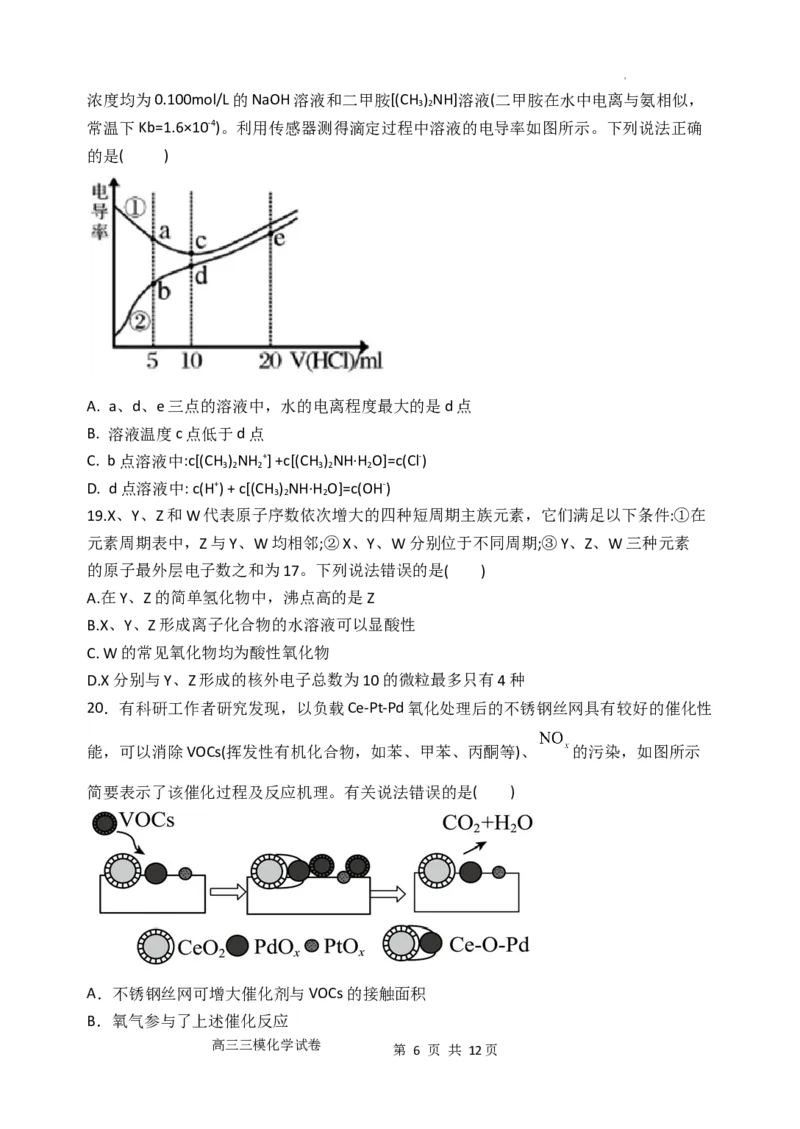
8. 我国学者研制了一种纳米反应器,用于催化草酸二甲酯(DMO)和氢气反应获得EG。反
应过程示意图如图:
高三三模化学试卷
第 2 页 共 12页
学科网(北京)股份有限公司下列说法不正确 的是( )
A. Cu纳米颗粒将氢气解离成氢原子
B. DMO分子中碳氧单键发生了断裂
C. 反应过程中生成了MG和甲醇
D. EG和甲醇互为同系物
9. 设N 为阿伏加德罗常数的值。下列有关叙述正确的是( )
A
A. 足量过氧化钠与1molCO 反应,转移电子的数目为2N
2 A
B. 将1mol(NH)SO 溶于稀氨水中使溶液呈中性,溶液中NH+数目为2N
4 2 4 4 A
C.32.5g锌与一定量浓硫酸恰好完全反应,生成的气体分子数小于0.5N
A
D. 标准状况下,将22.4LCl 通入到水中,HClO、Cl-、ClO-粒子数之和为2N
2 A
10.下列分子中所有的原子都满足最外层为8电子结构的是( )
A.BCl B.COCl C.SF D.SiH
3 2 6 4
11. 采用如图所示装置和操作,能达到实验目的的是( )
A. 甲装置: 在乙醇与乙酸的混合液中加入浓硫酸,可蒸馏出乙醇
B. 若采用乙装置铝件镀银,则d极为铝件,c极为纯银,电解质溶液为AgNO 溶液
3
C. 丙装置b口进气排空气法可收集CO、NO等气体
2
D. 丁装置可制取并收集纯净的氯气
12. 能正确表示下列反应的离子方程式是( )
A. 向稀硫酸酸化的KMnO 溶液中滴加少量H O 溶液:
4 2 2
高三三模化学试卷
第 3 页 共 12页
学科网(北京)股份有限公司2MnO -+6H++3H O =2Mn2++4O ↑+6H O
4 2 2 2 2
B. 向明矾[KAl(SO ) ]溶液中逐滴加入Ba(OH) 溶液至SO 恰好沉淀完全:2Al3++3SO +3Ba2+
4 2 2
+6OH- =2Al(OH) ↓+3BaSO ↓
3 4
C. 用铜做电极电解CuSO 溶液:2Cu2++2H O 2Cu+O ↑+4H+
4 2 2
D. 将ClO 气体通入H O 、NaOH的混合溶液中制NaClO :
2 2 2 2
2ClO +H O +2OH-=2ClO -+O +2H O
2 2 2 2 2 2
13. 连二亚硫酸钠(Na S O )俗称保险粉,易被氧气氧化。利用如图装置,在锥形瓶中加
2 2 4
入HCOONa、NaOH、CH OH 和水形成的混合液,通入 SO 时发生反应生成保险粉和一种
3 2
常见气体,下列说法错误的是( )
A. 制备保险粉的离子方程式为:HCOO-+OH-+2SO =S O 2-+CO ↑+H O
2 2 4 2 2
B. 多孔玻璃球泡的作用是增大气体与溶液的接触面积,使 SO 能被充分吸收
2
C. NaOH 溶液的主要作用是吸收逸出的CO
2
D. 为避免 Na S O 被 O 氧化,使硫酸与亚硫酸钠先反应,产生的 SO 排出装置中的
2 2 4 2 2
O
2
14.水热法制备Fe O 纳米颗粒的反应如下(反应条件忽略):
3 4
3Fe2++2SO2-+O+xOH-===Fe O+SO2-+2HO,下列说法不正确的是( )
2 3 2 3 4 4 6 2
A.离子方程式中x=4
B.该反应中SO2-是还原剂
2 3
C.3 mol Fe2+被氧化时有1 mol O 被还原
2
D.每生成1 mol Fe O 转移4 mol电子
3 4
15. 硼酸(HBO)为一元弱酸,已知HBO 与足量NaOH溶液反应的离子方程式为:HBO+OH-
3 3 3 3 3 3
= B(OH)-,HBO 可以通过电解的方法制备。其工作原理如下图所示(阳膜和阴膜分别只允
4 3 3
许阳离子、阴离子通过)。下列说法正确的是( )
高三三模化学试卷
第 4 页 共 12页
学科网(北京)股份有限公司.
A 电子流向: 电源负极→b电极→电解液→a 电极→电源正极
B. 阳极的电极反应式为:2HO - 4e- = O↑+4H+
2 2
C. 当电路中通过3mol电子时,可得到1mol HBO
3 3
D. A膜为阳膜,B膜为阴膜,且穿过A膜和B膜的离子数相同
16.氯化亚铜(CuCl)是白色粉末,微溶于水,广泛应用于化工和印染等行业。某研究性学
习小组模拟热分解CuCl •2H O制备CuCl的过程,并进行相关物质转化的探究。
2 2
已知:酸性条件下Cu+不稳定
下列说法不正确的是( )
A.X气体是HCl,可抑制CuCl •2H O加热时水解
2 2
B.途径1中产生的Cl 可以回收利用,也可以通入饱和NaOH溶液中除去
2
C.途径2中200℃时反应的化学方程式为Cu (OH) Cl 2CuO+2HCl↑
2 2 2
D.CuCl与稀硫酸反应的离子方程式为2Cu++4H++SO =2Cu2++SO ↑+2H O
2 2
17.将m g CuS和Cu S的混合物投入500 mL c mol·L-1的稀HNO 溶液中恰好完全反应,收集
2 3
到NO气体17.92 L(标准状况),向反应后的溶液中(存在Cu2+和SO 2-)加入V mL 3 mol·L-1
4
NaOH溶液恰好使Cu2+完全沉淀,过滤、洗涤、灼烧,得到36 g CuO。下列说法正确的是
( )
A.NO的质量为27 g
B.V=400
C.CuS和Cu S的物质的量之比为4:1
2
D.反应后的溶液中SO 2-的物质的量为0.25 mol
4
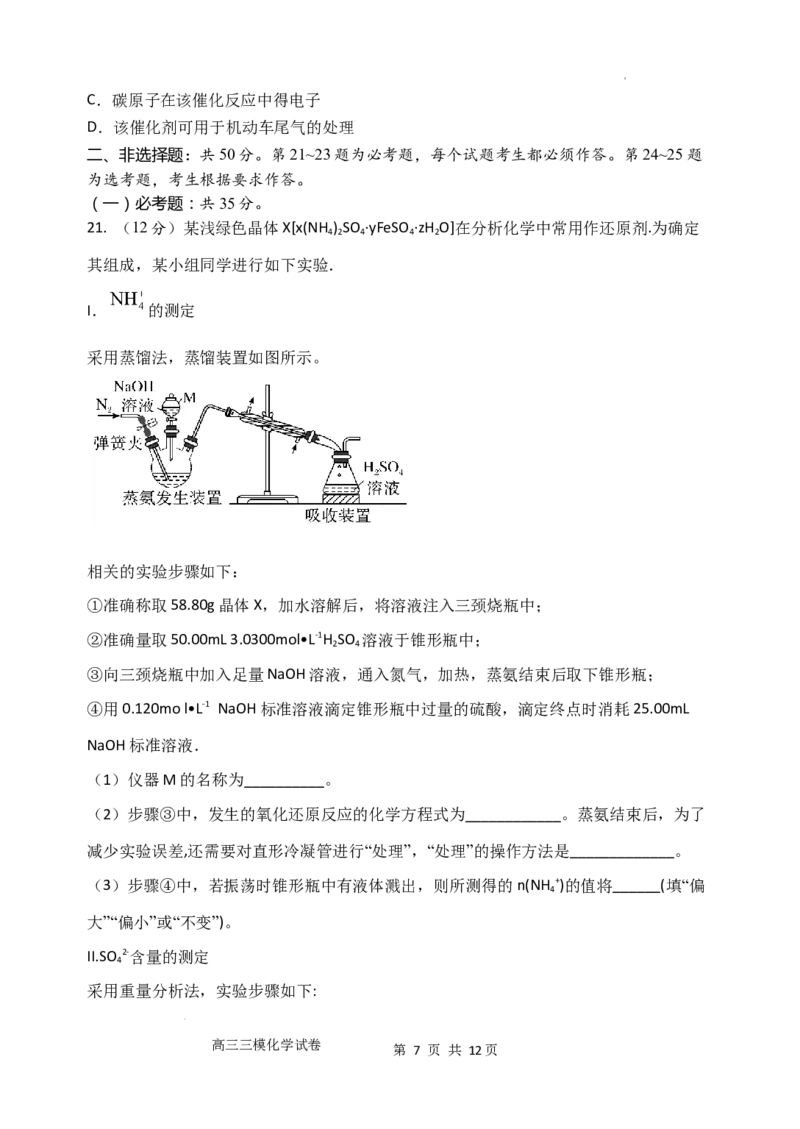
18. 电解质溶液电导率越大导电能力越强。常温下用0.100 mol/L盐酸分别滴定10.00mL
高三三模化学试卷
第 5 页 共 12页
学科网(北京)股份有限公司浓度均为0.100mol/L的NaOH溶液和二甲胺[(CH ) NH]溶液(二甲胺在水中电离与氨相似,
3 2
常温下Kb=1.6×10-4)。利用传感器测得滴定过程中溶液的电导率如图所示。下列说法正确
的是( )
A. a、d、e三点的溶液中,水的电离程度最大的是d点
B. 溶液温度c点低于d点
C. b点溶液中:c[(CH ) NH +] +c[(CH ) NH·H O]=c(Cl-)
3 2 2 3 2 2
D. d点溶液中: c(H+) + c[(CH ) NH·H O]=c(OH-)
3 2 2
19.X、Y、Z和W代表原子序数依次增大的四种短周期主族元素,它们满足以下条件:①在
元素周期表中,Z与Y、W均相邻;②X、Y、W分别位于不同周期;③Y、Z、W三种元素
的原子最外层电子数之和为17。下列说法错误的是( )
A.在Y、Z的简单氢化物中,沸点高的是Z
B.X、Y、Z形成离子化合物的水溶液可以显酸性
C. W的常见氧化物均为酸性氧化物
D.X分别与Y、Z形成的核外电子总数为10的微粒最多只有4种
20.有科研工作者研究发现,以负载Ce-Pt-Pd氧化处理后的不锈钢丝网具有较好的催化性
能,可以消除VOCs(挥发性有机化合物,如苯、甲苯、丙酮等)、 的污染,如图所示
简要表示了该催化过程及反应机理。有关说法错误的是( )
A.不锈钢丝网可增大催化剂与VOCs的接触面积
B.氧气参与了上述催化反应
高三三模化学试卷
第 6 页 共 12页
学科网(北京)股份有限公司C.碳原子在该催化反应中得电子
D.该催化剂可用于机动车尾气的处理
二、非选择题:共50分。第21~23题为必考题,每个试题考生都必须作答。第24~25题
为选考题,考生根据要求作答。
(一)必考题:共35分。
21. (12分)某浅绿色晶体X[x(NH ) SO ·yFeSO ·zH O]在分析化学中常用作还原剂.为确定
4 2 4 4 2
其组成,某小组同学进行如下实验.
I. 的测定
采用蒸馏法,蒸馏装置如图所示。
相关的实验步骤如下:
①准确称取58.80g晶体X,加水溶解后,将溶液注入三颈烧瓶中;
②准确量取50.00mL 3.0300mol•L-1H SO 溶液于锥形瓶中;
2 4
③向三颈烧瓶中加入足量NaOH溶液,通入氮气,加热,蒸氨结束后取下锥形瓶;
④用0.120mo l•L-1 NaOH标准溶液滴定锥形瓶中过量的硫酸,滴定终点时消耗25.00mL
NaOH标准溶液.
(1)仪器M的名称为__________。
(2)步骤③中,发生的氧化还原反应的化学方程式为____________。蒸氨结束后,为了
减少实验误差,还需要对直形冷凝管进行“处理”,“处理”的操作方法是_____________。
(3)步骤④中,若振荡时锥形瓶中有液体溅出,则所测得的n(NH +)的值将______(填“偏
4
大”“偏小”或“不变”)。
II.SO 2-含量的测定
4
采用重量分析法,实验步骤如下:
高三三模化学试卷
第 7 页 共 12页
学科网(北京)股份有限公司①另准确称取58.80g晶体X于烧杯中,加水溶解,边搅拌边加入过量的BaCl 溶液;
2
②将得到的溶液用无灰滤纸(灰分质量很小,可忽略)过滤,洗涤沉淀3~4次;
③用滤纸包裹好沉淀取出,灼烧滤纸包至滤纸完全灰化;
④继续灼烧沉淀至恒重、称量,得沉淀质量为69.90g。
(4)步骤①中,判断BaCl 溶液已过量的实验操作和现象是___________。
2
(5)步骤②中,采用冷水洗涤沉淀,其主要目的是___________。
(6)结合实验Ⅰ、Ⅱ通过计算得出晶体X的化学式为__________。
22.(13分)实现变废为宝和资源的回收利用是实现“碳中和”的重要途径。一种利用
碲化亚铜废渣制备二氧化碲和单质银的工业流程如图所示:
已知:①碲化亚铜废渣的主要成分为 ,还含有少量 ;
②二氧化碲是两性氧化物,微溶于水;
③本流程条件下, 。
回答下列问题:
(1)碲 是52号元素,其在元素周期表中的位置为___________。
(2)“酸浸氧化”后 元素以 形式存在,由 生成 的化学方程式为
___________,双氧水实际消耗量为理论消耗量的 倍,原因为___________。
(3)“碱转化除铜”时应调节溶液的 为13,此时溶液中的 为___________
高三三模化学试卷
第 8 页 共 12页
学科网(北京)股份有限公司。
(4)“中和沉碲”时需控制溶液的 为 ,温度为 ,若溶液的 过
低,将导致___________。
(5)酸浸渣的主要成分为___________(填化学式),“还原”工序中发生的反应中氧化剂
与还原剂的物质的量之比为___________。
(6)以上述流程制得的 为原料制备高纯碲单质的方法如下:将 溶于 溶
液生成 ,电解 溶液即可在阴极获得单质碲。若溶液中 过低,
在阴极会产生 ,生成该离子的电极反应式为___________。
23.(10分)二氧化碳的综合利用是实现碳达峰、碳中和的关键。
I.利用 和 合成甲醇,涉及的主要反应如下:
已知:a.
b.
c.
(1)计算 _______。
(2)一定条件下,向密闭容器中充入物质的量之比为1:3的 和 发生上述反应,使
用不同催化剂经相同反应时间, 的转化率和甲醇的选择性随温度的变化如图所示:
高三三模化学试卷
第 9 页 共 12页
学科网(北京)股份有限公司甲醇的选择性
①210-270℃间,在甲醇的选择性上,催化效果较好的是_______。
②210-270℃间,催化剂2条件下 的转化率随温度的升高而增大,可能原因为
_______。
II.工业上用 和 通过如下反应合成尿素 :
。t℃时,向容积恒定为 的密闭容器中充
入 和 发生反应。
(3)下列能说明反应达到化学平衡状态的是_______(填字母)。
a.相同时间内, 键断裂,同时有 键形成
b.容器内气体总压强不再变化
c.
d.容器内气体的密度不再改变
(4) 的物质的量随时间的变化如下表所示:
高三三模化学试卷
第 10 页 共 12页
学科网(北京)股份有限公司时间/min 0 30 70 80 100
1.6 l.0 0.8 0.8 0.8
的平衡转化率为_______;t°C时,该反应的平衡常数K=_______。
(二)选考题:共15分。请考生从2道题中任选一题作答。如果多做,则按所做的第一
题计分。
24. A、B、C、D、E五种原子序数依次增大的元素(原子序数均小于30)。A的基态原子的
2p能级有3个电子;C的基态原子2p能级有1个单电子;E原子最外层有1个单电子,其
次外层有3个能级且均排满电子;D与E同周期,价电子数为2。回答下列问题:
(1)写出基态E+的价电子排布式:_________。基态A原子的第一电离能比B的大,其原因是
__________。
(2)A +由美国空军研究实验室推进科学与先进概念部Karl .O. Christed 于1999年成功合成,
5
其结构呈‘V'形且该离子中各原子均达到8电子稳定结构,则A +的结构式为________。
5
(3)B 分子的空间构型为______,其中B原子的杂化类型是______,与B 分子互为等电子
3 3
体的微粒有_________(写一种离子)。
(4)向E的硫酸盐溶液中通入A的气态氢化物至过量,产生蓝色沉淀,随后沉淀溶解得到
深蓝色溶液,向溶液中加入适量乙醇,析出蓝色晶体。加入乙醇的目的___________。
写出该配合物中配离子的结构简式__________。
(5)由长周期元素组成的镧镍合金、铜钙合金有相同类型的晶体结构XY,它们有很强的储
n
氢能力,其中铜钙合金的晶体的部分结构如图所示。
高三三模化学试卷
第 11 页 共 12页
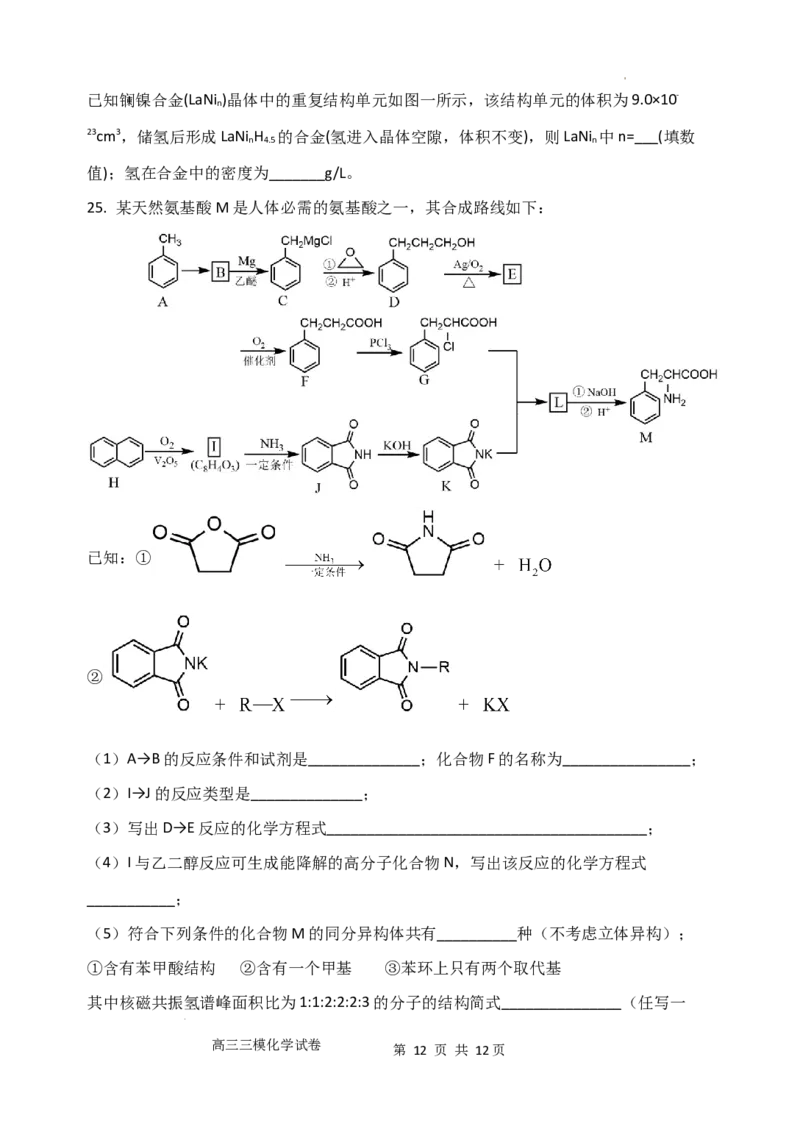
学科网(北京)股份有限公司已知镧镍合金(LaNi )晶体中的重复结构单元如图一所示,该结构单元的体积为9.0×10-
n
23cm3,储氢后形成LaNi H 的合金(氢进入晶体空隙,体积不变),则LaNi 中n=___(填数
n 4.5 n
值);氢在合金中的密度为_______g/L。
25. 某天然氨基酸M是人体必需的氨基酸之一,其合成路线如下:
已知:①
②
(1)A→B的反应条件和试剂是______________;化合物F的名称为________________;
(2)I→J的反应类型是______________;
(3)写出D→E反应的化学方程式________________________________________;
(4)I与乙二醇反应可生成能降解的高分子化合物N,写出该反应的化学方程式
___________;
(5)符合下列条件的化合物M的同分异构体共有__________种(不考虑立体异构);
①含有苯甲酸结构 ②含有一个甲基 ③苯环上只有两个取代基
其中核磁共振氢谱峰面积比为1:1:2:2:2:3的分子的结构简式_______________(任写一
高三三模化学试卷
第 12 页 共 12页
学科网(北京)股份有限公司种);
(6)请结合以上合成路线,写出以丙酸和上述流程中出现的物质为原料经三步合成丙氨
酸( )的路线。__________________
高三三模化学试卷
第 13 页 共 12页
学科网(北京)股份有限公司