文档内容
莆田锦江中学2023-2024学年上学期期中考试卷
高三化学试题答案
1.C
【详解】A.聚氯乙烯塑料可由氯乙烯通过加成反应制得,A错误;
B.碳化硅是一种新型的无机非金属材料,性能优良用途广泛,B错误;
C.聚氨酯材料可以通过缩聚反应制成,反应中得到高聚物和小分子物质,C正确;
D.分子中n值不确定,故为混合物,D错误;
故选C。
2.B
【详解】A.4.6g Na与含0.1mol HCl的稀盐酸反应时,Na先与盐酸反应,后继续与水反
应,转移电子数目为 ×1×N /mol=0.2N ,故A正确;
A A
B.Cu与S反应生成Cu S,1mol Cu与足量的S反应,失去1mol即N 个电子,故B错误;
2 A
C.2g 与 的混合物中所含中子、电子数目均为 ×10×N /mol=N ,故C
A A
正确;
D.46g的NO 和NO 混合气体含有的原子数为 ×3×N /mol=3N ,故D正确;
2 2 4 A A
故选B。
3.B
【详解】A.与苯环直接相连的原子共面,故a至少有12个原子共平面,A正确;
B. 的反应为硝基被还原为氨基的反应,属于还原反应,B错误;
C.c苯环上有2种等效氢,则其一氯代物有2种,C正确;
D.酚羟基、酰胺基均可以和氢氧化钠反应,故 最多能与 反应,D正确;
故选B。
4.B
【详解】A.大气污染物中氮氧化合物中二氧化氮和水转化为硝酸,酸性条件下硝酸会氧
化二氧化硫转化为硫酸离子,干扰硫酸离子的鉴定,A错误;
B.从图中看,反应①中氧化剂是 ,还原剂是 ,两者发生氧化还原反应生成 、
学科网(北京)股份有限公司,方程式为 , B正确;
C.反应②中氧气中氧元素化合价由0变为-2,为氧化剂, 化合价升高发生氧化反应得
到氧化产物 ,根据电子守恒可知 ,故氧化剂与氧化产物的物质的量之
比为1:4,C错误;
D.根据电子守恒可知 ,理论上每吸收标准状况下 (为
0.01mol),消耗0.005mol氧气,为0.16g,D错误;
故选B。
5.B
【详解】A.根据有机物Ⅰ的结构可知,其中不存在饱和碳原子,其中没有手性碳原子,A
错误;
B.有机物Ⅰ中苯环上的碳原子确定一个平面,和苯环直接相连的碳原子也在这个平面上,
B正确;
C.有机物Ⅱ含有一个苯环,一个碳碳三键,则 有机物Ⅱ最多能与 发生加成反
应,C错误;
D.有机物Ⅲ中含有氮原子,可以和酸反应,但是不可以和碱反应,不具有两性,D错误;
故选B。
6、C
【详解】A.向NaBr溶液中滴加过量氯水,溴离子被氧化为溴单质,但氯水过量,再加入
淀粉KI溶液,过量的氯水可以将碘离子氧化为碘单质,无法证明溴单质的氧化性强于碘单
质,A错误;
B.向蔗糖溶液中滴加稀硫酸,水浴加热后,应加入氢氧化钠溶液使体系呈碱性,若不加
氢氧化钠,未反应的稀硫酸会和新制氢氧化铜反应,则不会产生砖红色沉淀,不能说明蔗
糖没有发生水解,B错误;
C.石蜡油加强热,产生的气体能使溴的四氯化碳溶液褪色,说明气体中含有不饱和烃,
与溴发生加成反应使溴的四氯化碳溶液褪色,C正确;
D.聚氯乙烯加强热产生能使湿润蓝色湿润试纸变红的气体,说明产生了氯化氢,不能说
明氯乙烯加聚是可逆反应,可逆反应是指在同一条件下,既能向正反应方向进行,同时又
学科网(北京)股份有限公司能向逆反应的方向进行的反应,而氯乙烯加聚和聚氯乙烯加强热分解条件不同,D错误;
答案选C。
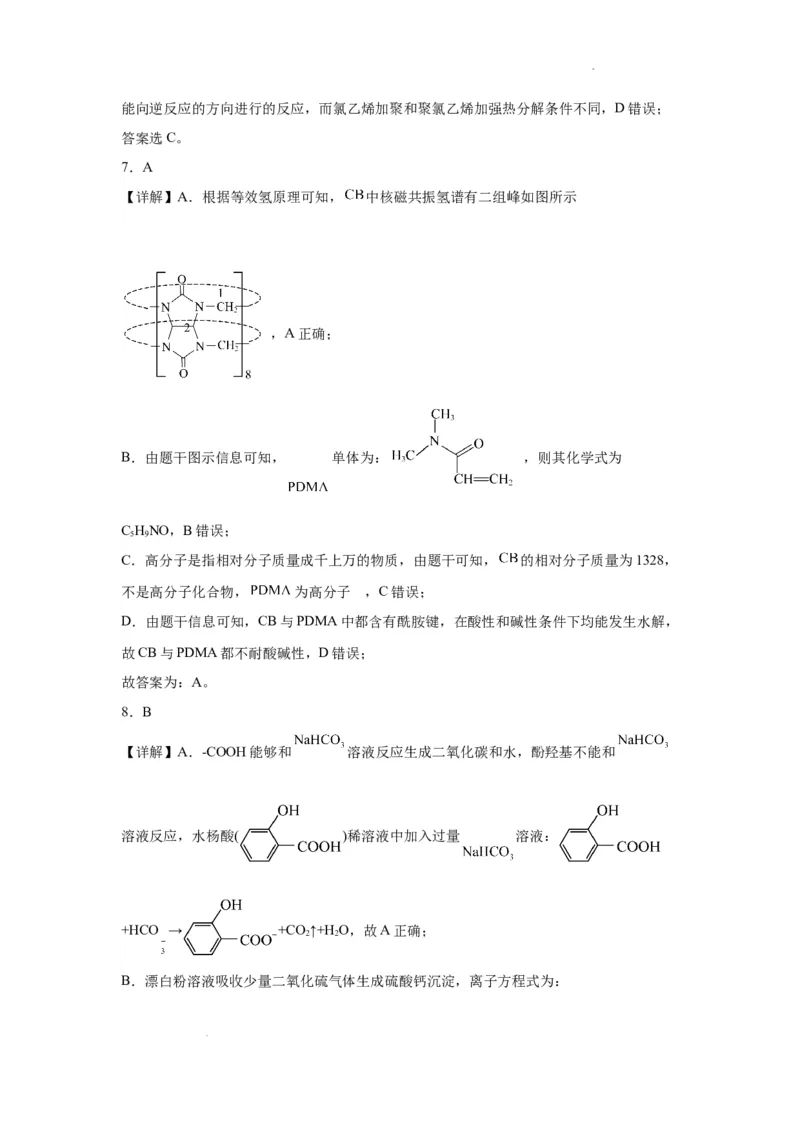
7.A
【详解】A.根据等效氢原理可知, 中核磁共振氢谱有二组峰如图所示
,A正确;
B.由题干图示信息可知, 单体为: ,则其化学式为
C HNO,B错误;
5 9
C.高分子是指相对分子质量成千上万的物质,由题干可知, 的相对分子质量为1328,
不是高分子化合物, 为高分子 ,C错误;
D.由题干信息可知,CB与PDMA中都含有酰胺键,在酸性和碱性条件下均能发生水解,
故CB与PDMA都不耐酸碱性,D错误;
故答案为:A。
8.B
【详解】A.-COOH能够和 溶液反应生成二氧化碳和水,酚羟基不能和
溶液反应,水杨酸( )稀溶液中加入过量 溶液:
+HCO → +CO ↑+H O,故A正确;
2 2
B.漂白粉溶液吸收少量二氧化硫气体生成硫酸钙沉淀,离子方程式为:
学科网(北京)股份有限公司,故B错误;
C. 和醋酸反应生成醋酸钙、二氧化碳和水,离子方程式为:
,故C正确;
D.过量铁粉与稀硝酸反应生成硝酸亚铁,离子方程式为:
,故D正确;
故选B。
9.D
【分析】在如图所示的反应机理中化合物C在该流程中参与反应生成A,接着B反应后又
生成C,因此C是该反应的催化剂;同时反应过程中并未出现非极性共价键的形成。
【详解】A.化合物C在该流程中参与反应生成A,接着B反应后又生成C,所以C可以
反复出现,因此C是该反应的催化剂, A正确;
B.DMF的名称为N,N-二甲基甲胺,属于胺类化合物,右侧- N<中N原子上有两个甲基
取代,叫做N,N-二甲基,左侧HCO-为甲酸HCOOH去掉-OH后的基团,称为甲酰基,合
在一起叫N,N-二甲基甲酰胺,B正确;
C.从图可以看出,反应流程加入了CO、HN< (二甲胺)和H,最终生成了DMF和HO,
2 2 2
催化剂为C,所以总反应符合流程图含义, C正确;
D.B中上方的络合四元环中,H-H键断开(非极性共价键断裂),形成C-H键和O-H键(极
性共价键的形成),HCOOH和HN<的反应为
+H O,显然甲酸中的C-O键和二甲胺中的H-N键断开(极性共价键的断裂),
2
但反应中并未出现非极性共价键的形成,D错误;
故选D。
学科网(北京)股份有限公司10.D
【详解】A.由结构简式分析可知,化合物M中共存在11种环境的氢原子,故其核磁共振
氢谱共有11个吸收峰,A选项正确;
B. 分子中含有酯基、硝基、亚磷酸酯基三种含氧官能团,B
选项正确;
C. 分子中单键N原子为sp3杂化,硝基中的双键N原子为sp2
杂化,C选项正确;
D.该分子中与3mol NaOH发生水解反应后会生成2mol酚,会再与2molNaOH发生反应,
故1mol该物质与足量NaOH溶液反应时消耗5molNaOH,D选项错误;
答案选D。
11.(1)将矿石粉碎、适当升高反应温度、搅拌
(2) 1:3
(3)
(4)20%
(5)
(6) 6
【分析】由题给流程可知,菱锌矿加入硫酸浸取,铜不反应成为滤渣1,Zn、Ni、Cd、Fe
元素转化为相应盐溶液,溶液加入过氧化氢将二价铁转化为三价铁,加入氧化锌调节pH
生成氢氧化铁沉淀,滤液加入硫化钠将Cu2+、Cd2+、Ni2+转化为硫化物沉淀得到滤渣2,过
学科网(北京)股份有限公司量滤液加入锌将残余杂质金属离子转化为金属单质得到滤渣3,滤液加入碳酸钠可得碱式
碳酸锌和二氧化碳气体,沉淀煅烧得到氧化锌;
【详解】(1)为了提高“溶浸”效果,可采取的措施矿石粉碎、适当升高反应温度、搅拌
等;
(2)“除铁”时,加入HO 将二价铁转化为三价铁,发生反应的离子方程式为
2 2
。如果用NaClO 代替HO,反应中氯元素化合价由+5变
3 2 2
为-1,过氧化氢中氧元素由-1变为-2,恰好完全反应时,根据电子守恒可知,
,理论上消耗n(NaClO):n(H O)=1:3;
3 2 2
(3)常温下,“调pH=5”时,pOH=9,Fe3+的浓度降到了8×10-11mol/L,此时Fe(OH) 的溶
3
度积常数的数值为 ;
(4)在加NaS使Cu2+在溶液中的残留浓度为6.3×10-11mol/L时,此时
2
,此时Cd2+的浓度为
,Cd2+的去除率为 ;
(5)在近中性条件下加入NaCO 和锌离子反应生成碱式碳酸锌[ZnCO•2Zn(OH)•H O]固
2 3 3 2 2
体,同时产生大量的气体,根据质量守恒可知生成气体为二氧化碳气体,该反应的离子方
程式为 ;
(6)①与Zn原子等距离且最近的Zn原子在xyz轴各有2个,则共有6个。
②据“均摊法”,晶胞中含 个Zn、 Cu,则晶体密度为
。
12.
学科网(北京)股份有限公司13.(1)-90.8
(2) 吸收 原料气中N 相对易得,适度过量有利于提高H 的转化率 N 在催化
2 2 2
剂上的吸附是决速步骤,适度过量有利于提高整体反应速率 BD
(3) > 0.05
(4)2NH +2e-=2 NH +H ↑或2NH +2e-=H ↑+2NH
3 2 3 2
【详解】(1)根据表中键能数据,可得 H=反应物的键能总和-生成物的键能总和=946.0
kJ·mol-1+436.0 kJ·mol-1 -390.8 kJ·mol-1 ∆6=-90.8 kJ/mol。
(2)i.根据模拟示意图可知,图②到图③的过程表示的是化学键断裂的过程,化学键断裂
学科网(北京)股份有限公司