文档内容
2024 学年第一学期江浙皖高中(县中)发展共同体高三年级 10 月联考(浙江卷)
化学参考答案
一.选择题(本大题共16题,每小题3分,共48分。)
1 2 3 4 5 6 7 8
C C D A D B B D
9 10 11 12 13 14 15 16
A B D B C B C A
【解析】
12.A项:因为要攫取α-H,使其以H+离去,所以要用碱做催化剂,正确。
B项:乙醛和丙醛可以发生两两反应和自身反应,至少可以生成4种羟醛缩合产物,错误。
C项:单双键交替的结构属于共轭体系,可增加物质的稳定性,正确。
D项:丙酮由于甲基的推电子作用,使得另一个甲基上的C-H键极性减弱,α-H活性降低,转化成
H+离去的能力减弱,所以发生羟醛缩合的反应速率减慢,正确。
14.A项:因为所有原子共平面,所以三聚氰胺中的N均采用sp2杂化,正确。
B项:三聚氰胺为非极性分子,在极性溶剂水中的溶解度小,错误。
C项:三聚氰胺环上的N原子有孤电子对,可以与H+结合,所以有碱性,正确。
D项:三聚氰胺的氨基在酸性溶液中会水解生成羟基,正确。
n(HX) c (In)
15.由变化曲线图可知,当 1.0时, 平 3.0,设初始c (KIn)=c mol/L ,则初始
n (KIn) n (HIn) 0 0
0 平
c(HX)=c mol/L ,转化的物质的量浓度为xmol/L,可列出三段式如下:
0
In- + HX X- + HIn
起始浓度(mol/L) c c 0 0
0 0
转化浓度(mol/L) x x x x
平衡浓度(mol/L) c -x c -x x x
0 0
c (In) c x
由 平 3.0,即 0 3.0,解得x 0.25c ,则该反应的平衡常数为
n (HIn) x 0
平
c(X-)c(HIn) c(X-)c(HIn)c(H+) K(HA) 0.25c 0.25c K (HA)
K = 0 0 a
1 c(In-)c(HX) c(In-)c(HX)c(H+) K(HIn) 0.75c 0.75c 3.610-20
0 0
解得K (HA)=4.01021,A正确;
a
n(HB)
根据图像可知,当 1.0时,设此时转化的物质的量浓度为ymol/L,可列出三段式如下:
n (KIn)
0
In- + HX X- + HIn
起始浓度(mol/L) c c 0 0
0 0
转化浓度(mol/L) y y y y
平衡浓度(mol/L) c -y c -y y y
0 0
高三化学参考答案 第 1 页 共 4 页
{#{QQABQQKUggiIAJAAAAhCQwE6CEIQkAEAASgOxFAIIAABSRFABAA=}#}c (In) c -y K (HB)
此时 平 <1.0,即 0 <1.0,则y>0.5c ,则平衡常数K = a >K ,则
n (HIn) y 0 2 K(HIn) 1
平
K (HB)>K (HA)。
a a
反应B-+HA⇌ A-+HB的K<1,B正确。
HA和HB在非水溶剂和水溶液中的Ka值会发生变化,C错误。
K (HB)
由于y>0.5c ,则K a >1,K (HB)>K (HIn) ,D正确。
0 2 K(HIn) a a
二.非选择题(本大题共5小题,共52分)
17.(10分)
(1)4(1分) GaN(2分) GaCl +4NH =GaN+3NH Cl(2分)
3 3 4
(2)AB(2分)
(3)<(1分)化合物X中的N以sp2杂化,N原子上的孤电子对形成大Π键,不易结合H+。(2分)
【解析】(1)根据晶胞图,可观察出Ga和N的配位数均为4,所以该化合物的化学式为GaN;根据题干
所给信息,可得GaCl +4NH =GaN+3NH Cl。
3 3 4
(2)A项:P的价电子排布为3s23p3,根据洪特规则,3个p轨道均有一个单电子,所以只有一
种排布方式,正确。
B项:Al的第二电离能和Mg的第一电离能均为3s2→3s1,但Al为第二电离能,更大,正
确。
C项:As的基态原子简化电子排布式为[Ar]3d104s24p3,错误。
D项:优先失去的是4s轨道上的电子,错误。
(3)<化合物X中的N以sp2杂化,N原子上的孤电子对形成大Π键,不易结合H+。
18.(10分)
隔绝空气
(1)还原性 (1分) 2CuCl 2CuClCl (2分) 乙醇(1分)
2 2
(2)CD(2分)
(3)取少量白色沉淀于试管中,滴入适量稀硝酸,若溶液呈蓝色,说明有铜元素;
再向溶液中加入硝酸银溶液,若有白色沉淀生成,说明有氯元素。(2分)
(4)固体D中一价铜的价电子排布为3d10,处于半充满结构,较稳定;而CuCl 中二价铜的价电子
2
排布为3d9,不稳定。(2分)
隔 绝 空气
2CuCl 2CuCl Cl
【解析】(1)根据题干信息,可写出反应 2 2 Cl元素体现了还原性。
C中溶质为[Cu(NH ) ]Cl ,可采用醇析法结晶,故加入乙醇。
3 4 2
(2)A项:溶液中存在[CuCl ]2-+4H O⇌ [Cu(H O) ]2++4Cl-加入盐酸可使平衡左移,实现溶液
4 2 2 4
B向溶液A的转化,正确。
B项:二价铜有氧化性,水合肼有还原性,两者反应生成CuCl和N ,正确。
2
C项:[Cu(NH ) ]+有还原性,在空气中久置会被氧化成[Cu(NH ) ]2+,溶液由无色变为深蓝色,
3 2 3 4
错误。
D项:气态产物为氯气,可以用于药物的制造,错误。
(3)CuCl溶于稀硝酸,溶解后生成Cu2+ 和 Cl-。
(4)固体D中一价铜的价电子排布为3d10,处于半充满结构,较稳定;而CuCl 中二价铜的价电
2
子排布为3d9,不稳定。
19.(10分)
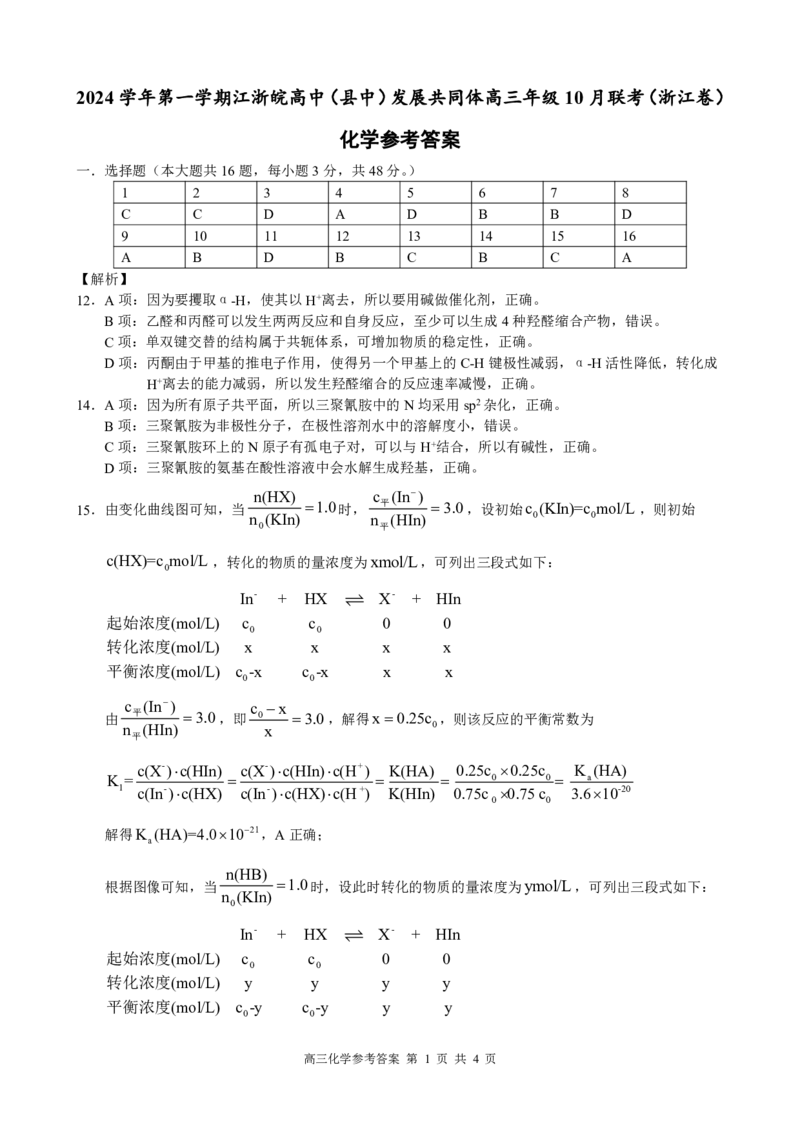
(1)①B(1分)
高三化学参考答案 第 2 页 共 4 页
{#{QQABQQKUggiIAJAAAAhCQwE6CEIQkAEAASgOxFAIIAABSRFABAA=}#}反应i的活化能小于反应ii,反应开始阶段,反应i的速率大于反应ii,所以NH COONH 的
2 4
生成速率大于其消耗速率,NH COONH 的质量增加;随着反应的进行,反应i的反应物浓度
2 4
②
减小,速率减慢,NH COONH 的消耗速率大于其生成速率,NH COONH 的质量减小。(2分)
2 4 2 4
AB(2分)
(2)①2NO -+16e-+CO +18H+=CO(NH ) +7H O(2分)
3 2 2 2 2
③
②80%(1分)
(3)90(2分)
【解析】(1)①由图可知,反应iΔH<0,ΔS<0,自发条件为低温,选B
②反应i的活化能小于反应ii,反应开始阶段,反应i的速率大于反应ii,所以NH COONH
2 4
的生成速率大于其消耗速率,NH COONH 的质量增加;随着反应的进行,反应i的反应
2 4
物浓度减小,速率减慢,NH COONH 的消耗速率大于其生成速率,NH COONH 的质量
2 4 2 4
减小。
③总反应2NH (g)+CO (g)⇌ CO(NH ) +H O(g) ΔH<0,ΔS<0,所以降温,加压可增大尿
3 2 2 2 2
素的平衡产率,选AB。
(2)②(0.49/24.5×4×6.0×1023×1.6×10-19)/(4×40×60)=80%
(3)Kp=242=576Kpa2
p(CO ) ≥576/6=96Kpa ∴p(CO ) =96-6=90Kpa
2 平衡 2 初始
20.(10分)
(1)硫酸质量分数过高溶液中H+的浓度小,硫酸质量分数过低不利于SO 逸出 (1分)
2
(2)B(1分)
(3)MnS O +Na CO =MnCO ↓+Na S O (2分)
2 6 2 3 3 2 2 6
(4)静置,向上层清液中继续滴加几滴饱和Na CO 溶液,若不再产生沉淀,说明Mn2+已沉淀完全
2 3
(2分)
(5)B→D→F(1分)
(6)96.8%(2分)偏高(1分)
【解析】(2)A项:温度越低,气体溶解度越大,正确。
B项:MnO 会将产物氧化到更高的价态,错误。
2
C项:温度过高会增大MnO 的氧化性,有可能将S元素氧化到+6价,正确。
2
D项:温度越高,气体溶解度越小,正确
(5)产物带结晶水,应采用蒸发浓缩,冷却结晶,滤纸干燥的方式。故选BDF。
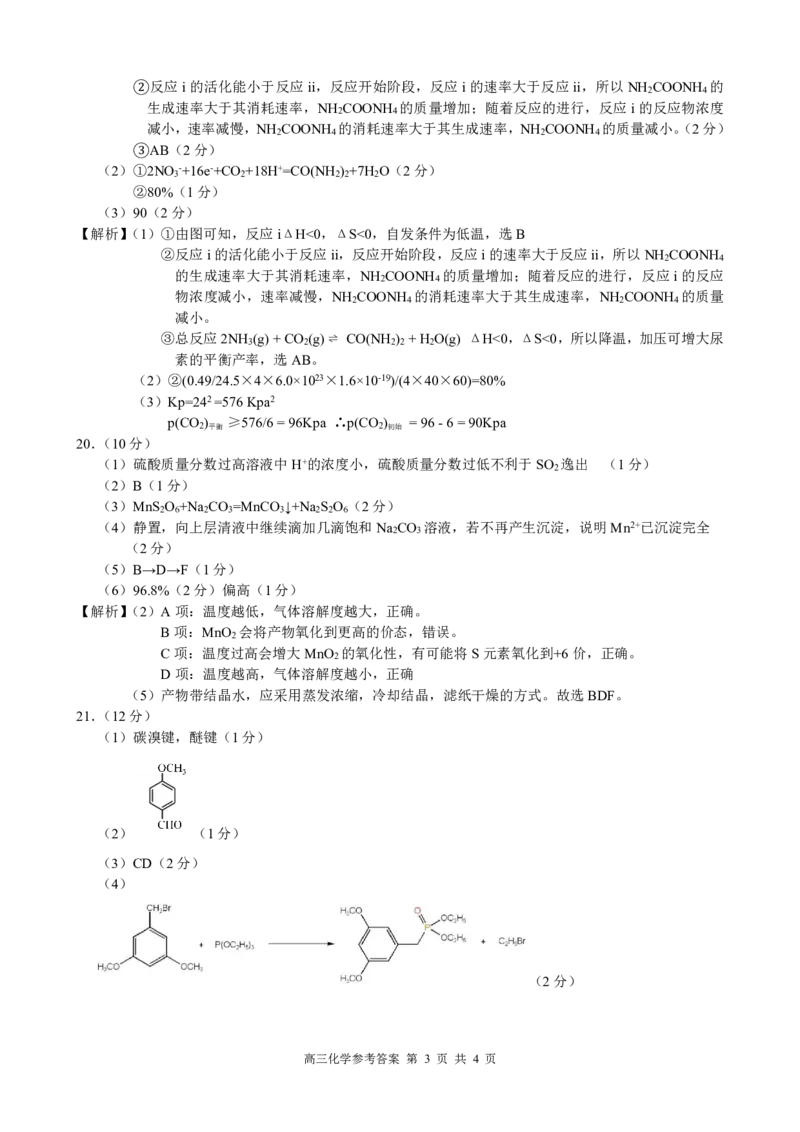
21.(12分)
(1)碳溴键,醚键(1分)
(2) (1分)
(3)CD(2分)
(4)
(2分)
高三化学参考答案 第 3 页 共 4 页
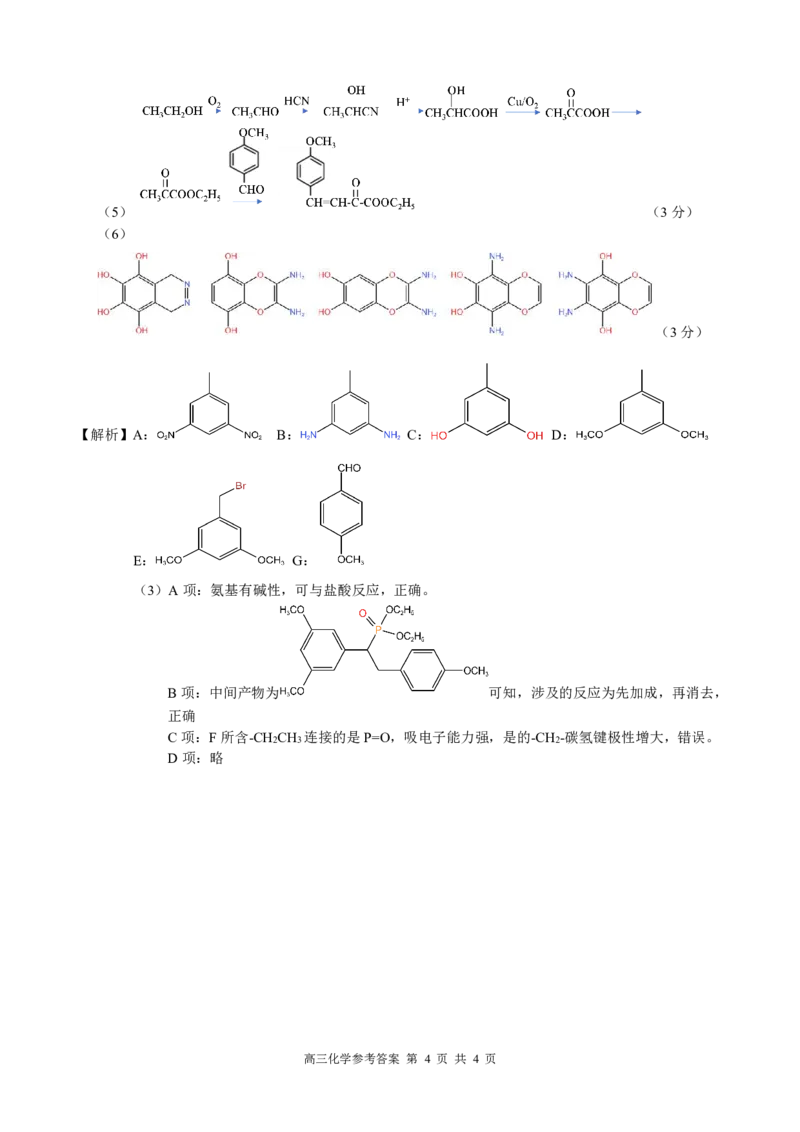
{#{QQABQQKUggiIAJAAAAhCQwE6CEIQkAEAASgOxFAIIAABSRFABAA=}#}(5) (3分)
(6)
(3分)
【解析】A: B: C: D:
E: G:
(3)A项:氨基有碱性,可与盐酸反应,正确。
B项:中间产物为 可知,涉及的反应为先加成,再消去,
正确
C项:F所含-CH CH 连接的是P=O,吸电子能力强,是的-CH -碳氢键极性增大,错误。
2 3 2
D项:略
高三化学参考答案 第 4 页 共 4 页
{#{QQABQQKUggiIAJAAAAhCQwE6CEIQkAEAASgOxFAIIAABSRFABAA=}#}