文档内容
2024-2025 学年江苏省泰州中学高三模拟一考试
化学试题
可能用到的相对原子质量:H1 C12 N14 O16 Na23 S32 K39 Cr52 Ag108
一、单项选选题:共14小题,每题3分,共42分。每题只有一个选项最符合题意。
1.中华古诗词精深唯美,下列有关说法不正确的是
A.“百宝都从海舶来,玻璃大镜比门排”:制玻璃的原料之一可用作制光导纤维
B.“纷纷灿烂如星陨,赫赫喧豗似火攻”:烟花利用的“焰色反应”属于化学变化
C.“独忆飞絮鹅毛下,非复青丝马尾垂”:鉴别丝和飞絮可用灼烧的方法
D.“粉身碎骨全不怕,要留清白在人间”:有化学能和热能的相互转化
2.下列关于ClO 、ClO -和ClO -的说法正确的是
2 2 3
A.ClO 属于共价化合物 B.ClO -中含有非极性键
2 2
C.ClO -的空间构型为平面三角形 D.ClO -和ClO -的键角相等
3 2 3
3.A、B、C、D短周期的四种元素,原子序数依次增大。A、B、D三种元素分别位于不同短周期的不同主
族。C、D对应的简单离子核外电子排布相同,A、B、C、D元素可形成一种新型漂白剂(结构如图),下列
说法不正确的是
A.电负性C>B>A>D B、C杂化方式相同
C.该化合物1mol阴离子含有2mol配位键 D.漂白剂中C的化合价-1、-2价
4.下列说法不正确的是
A.植物油含有不饱和高级脂肪酸甘油酯,能使溴的四氯化碳溶液褪色
B.向某溶液中加入茚三酮溶液,加热煮沸出现蓝紫色,可判断该溶液含有蛋白质
C.麦芽糖、葡萄糖都能发生银镜反应
D.饱和氯水既有酸性,又有漂白性,加入适量NaHCO 固体,其漂白性增强。
3
5.Fe3O4 可表示为Fe(ⅡFe(Ⅲ)[Fe(Ⅲ)O4],下列说法正确的是
A. 在常温下锈蚀或在纯氧中燃烧,均生成
B.加热条件下, 与浓硝酸反应能生成致密的氧化物保护膜C.氧化亚铁晶体中 ,是因为其晶体中混有零价
D.铁元素的两种离子与 的结合能力:
6.下列由废铜屑制取CuSO4·5H2O的实验原理与装置不能达到实验目的的是
A. 用装置甲除去废铜屑表面的油污用装置
B. 用装置乙在加热的条件下溶解废铜屑
C. 用装置丙过滤得到CuSO4 溶液
D. 丁蒸干溶液获得CuSO4·5H2O
7.合成马蔺子甲素的部分路线如图所示,下列说法正确的是
A. X可以发生取代、氧化、缩聚反应
B.X分子存在顺反异构体
C.Y在水中的溶解度比X大
D.Y分子与足量H2 加成后的产物中含有3个手性碳原子
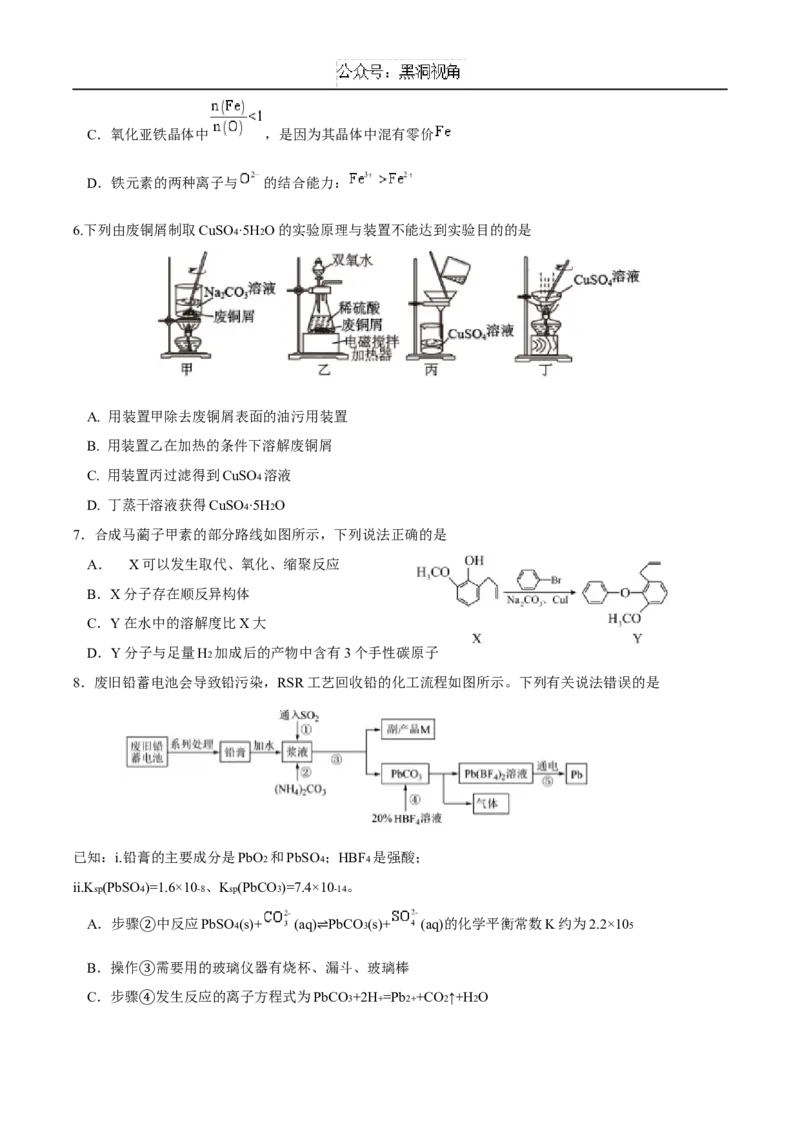
8.废旧铅蓄电池会导致铅污染,RSR工艺回收铅的化工流程如图所示。下列有关说法错误的是
已知:i.铅膏的主要成分是PbO2 和PbSO4 ;HBF4 是强酸;
ii.Ksp(PbSO4)=1.6×10-8 、Ksp(PbCO3)=7.4×10-14 。
A.步骤 中反应PbSO4(s)+ (aq) PbCO3(s)+ (aq)的化学平衡常数K约为2.2×105
② ⇌
B.操作 需要用的玻璃仪器有烧杯、漏斗、玻璃棒
C.步骤③发生反应的离子方程式为PbCO3+2H+=Pb2++CO2↑+H2O
④D.副产品M的主要成分是(NH4)2SO3
9.盐酸羟胺(NH3OHCl)是一种常见的还原剂和显像剂,其化学性质类似NH4Cl。工业上主要采用
图1所示的方法制备。其电池装置中含Fe的催化电极反应机理如图2所示。不考虑溶液体积变化,下列说
法正确的是
A.电池工作时,Pt电极是正极
B.图2中,A为H+ 和e- ,B为NH3OH+
C.电池工作时,每消耗2.24LNO(标准状况下),左室溶液质量增加3.3g
D.电池工作一段时间后,正、负极区溶液的pH均下降
10.根据下列实验操作和现象所得到 结论正确的是
选项 操作和现象 结论
向碳酸钠溶液中加入浓盐酸,将反应后的气体通入苯酚钠溶液
A 酸性:碳酸>苯酚
中,溶液变浑浊
向等体积AgCl与AgBr的饱和溶液中分别加入足量的浓
B
AgNO3 溶液,析出沉淀的物质的量AgCl多于AgBr
Ksp(AgCl)>Ksp(AgBr)
将石蜡油蒸气通过炽热的素瓷片分解,得到的气体通入酸性
C 分解产物中含乙烯
KMnO4 溶液,溶液褪色
取5mL0.1mol•L-1FeCl3 溶液,滴加5滴0.1mol•L-1KI溶液,振
D 荡,再加入5mLCCl4 ,振荡,静置,取上层液体,向其中滴加
KI和FeCl3 反应有一
定的限度
KSCN溶液,显血红色
11.草酸锌晶体加热可得纳米级ZnO,原理为ZnC2O4(s) ZnO(s)+CO(g)+CO2(g) ΔH>0
下列说法正确的是
A.该反应能自发进行,其原因是ΔS<0
B.上述反应中消耗1 mol ZnC2O4 ,转移电子的数目为2×6.02×1023
C.如题11图所示ZnO晶胞中,Zn2+ 的配位数为4
D.CO2 是由非极性键构成的非极性分子
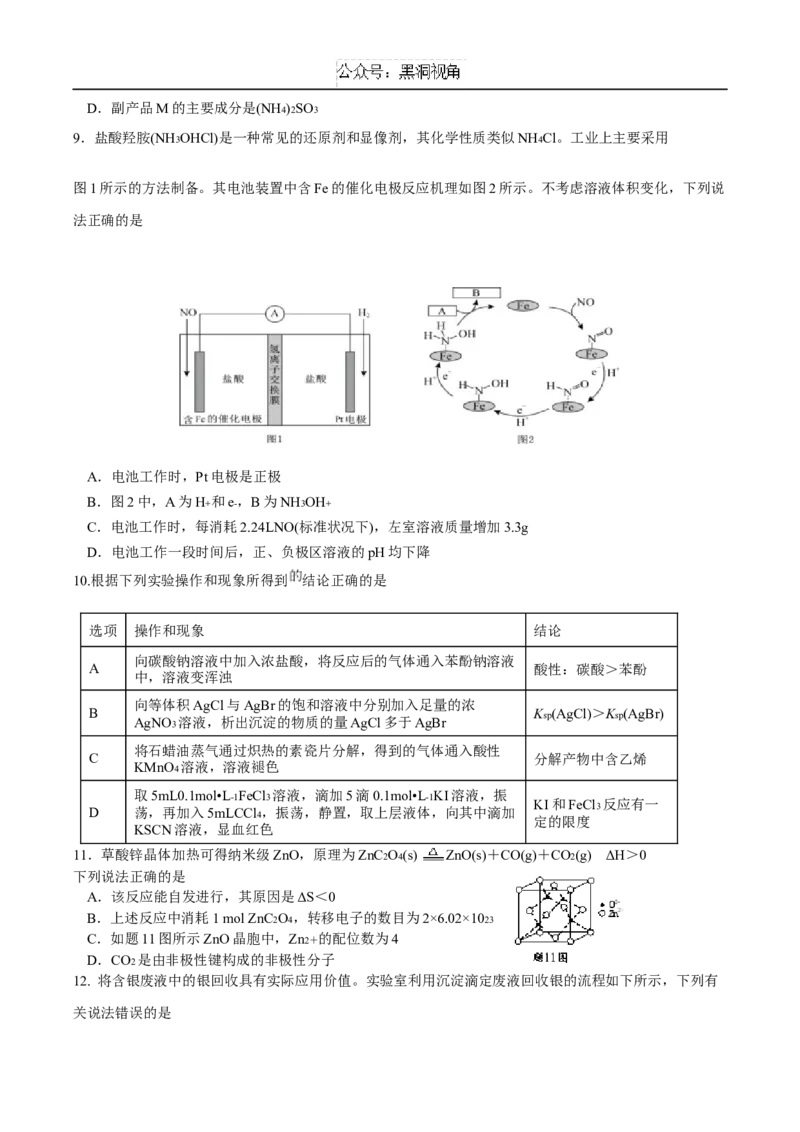
12. 将含银废液中的银回收具有实际应用价值。实验室利用沉淀滴定废液回收银的流程如下所示,下列有
关说法错误的是A. 回收过程的主要分离操作为萃取,所用到的玻璃仪器有分液漏斗和烧杯
B. B. 氯化银中加入氨水发生的离子反应为:
C. 当析出4.3200 g Ag时理论上至少消耗甲醛物质的量为0.02 mol
D. 操作X为:减压蒸发、结晶、30 下干燥
℃
13.酒石酸 (简写为 )是一种常用的食品添加剂,已知常温下酒石酸的电离平衡常数
,草酸 H2C2O4 的电离平衡常数 。下列说法正确
的是
A. H T在水溶液中的电离方程式为:HT 2H++T2-
2 2
B. 常温下,往0.01mol/LNaHT水溶液中继⇌续加水稀释,溶液的PH逐渐增大
C. 0.01mol/LNa2T水溶液中:C(OH-)=C(H+)+C(HT-)+C(H2T)
D. H2C2O4 与过量的Na2T水溶液反应的离子方程式:H2C2O4+T2-=HC2O4-+HT-
14.在催化剂作用下,以CO2 和H2 为原料进行合成CH3OH的实验。保持压强一定,将起始
n(CO2) n(H2)=1 3的混合气体通过装有催化剂的反应管,测得出口处CO2 的转化率和CH3OH的选择性
∶ ∶
与温度的关系如下图所示。下列说法正确的是
已知反应管内发生的反应为反应1 CO2(g)+3H2(g)=CH3OH(g)+H2O(g) H1=-49.5 kJ·mol-1
反应2∶CO2(g)+H2(g)=CO(g)+H2O(g) H2=△41.2 kJ·mol-1
A.CO∶(g)+2H2(g)=CH3OH(g)的 H=9△0.7kJ·mol-1
B.280 时,出口处CH3OH的△体积分数的实验值小于平衡值
℃
C.220 ~240 时CO2 的平衡转化率随温度升高而降低,原因是反应2转化的CO2 随温度的升高而减少
D.220℃~280℃时,反应1的速率高于反应2的速率
二、非
℃
选择题
℃
:共4题,共58分。
15.科幻电影《阿凡达》中外星人流的是蓝色的血液,其实血液的颜色主要是由血蛋白中含有的金属元素决
定的,如含铁元素的为常见红色血液、含铜元素的为蓝色血液、含钒元素的为绿色血液等,铜、铁、钒在
科学研究和工农业生产中有许多用途。回答下列问题:
(1) 在周期表中处 区;基态 原子的价层电子排布式为 ;基态 、 的核外未成对电子数
之比为: 。
(2) 有+2、+3、+4、+5等多种化合价,其中最稳定的化合价是 , 的第三电离能 小于 的
第三电离能 ,原因是 。
(3) 溶液常用作农业杀菌剂,溶液中存在 。
该离子中存在的化学键有 (填字母)。
①A.共价键 B.离子键 C.氢键 D.范德华力
E.配位键
含有 键的数目为 。
②
向 溶液里加过量氨水,可生成 ,再向溶液中加入乙醇,可以析出深蓝色固体,要
③
确定该固体是晶体还是非晶体,最科学的方法是 。
与 的结构相似,二者键角大小关系为 (填“>”或“<”) ,理由是: 。
④
(4)铁单质和氨气在 可发生置换反应;产物之一的晶胞结构如图所示(黑球代表 ,白球代表 )。若
该晶体的密度为 ,则两个距离最近的 原子间的距离为 (列出计算式,设 为阿伏加
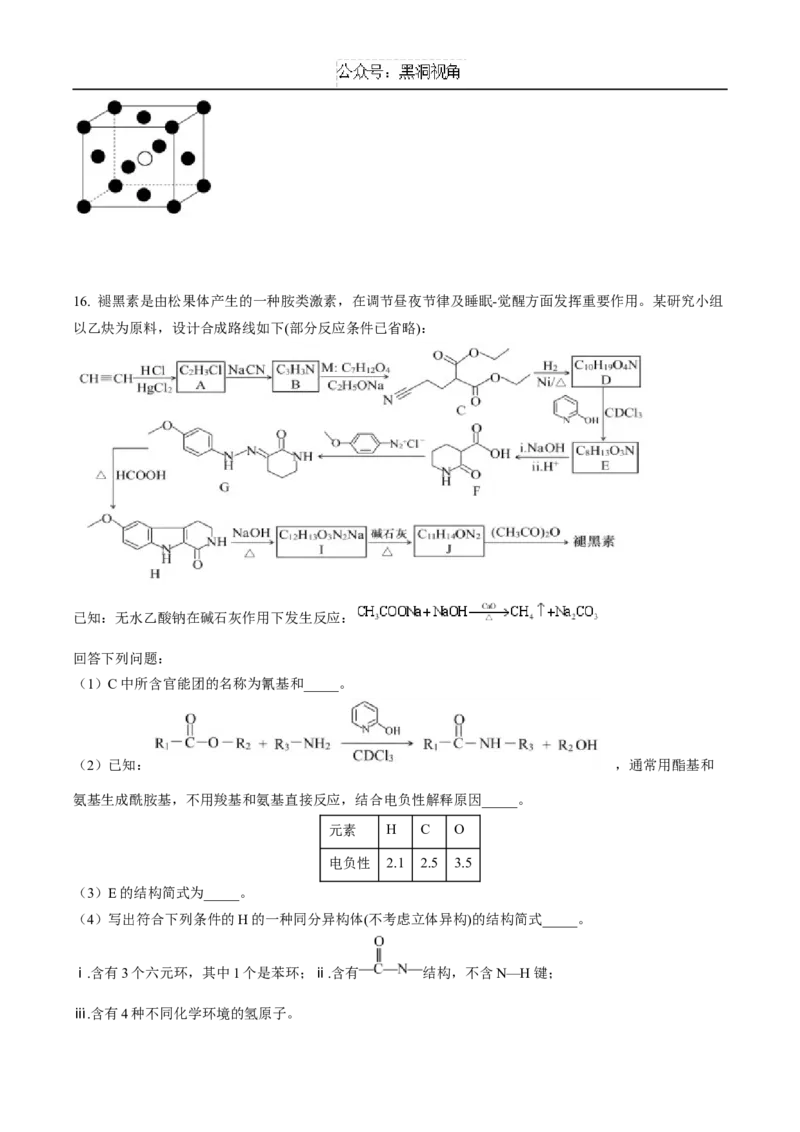
德罗常数的值)。16. 褪黑素是由松果体产生的一种胺类激素,在调节昼夜节律及睡眠-觉醒方面发挥重要作用。某研究小组
以乙炔为原料,设计合成路线如下(部分反应条件已省略):
已知:无水乙酸钠在碱石灰作用下发生反应:
回答下列问题:
(1)C中所含官能团的名称为氰基和_____。
(2)已知: ,通常用酯基和
氨基生成酰胺基,不用羧基和氨基直接反应,结合电负性解释原因_____。
元素 H C O
电负性 2.1 2.5 3.5
(3)E的结构简式为_____。
(4)写出符合下列条件的H的一种同分异构体(不考虑立体异构)的结构简式_____。
ⅰ.含有3个六元环,其中1个是苯环;ⅱ.含有 结构,不含N—H键;
ⅲ.含有4种不同化学环境的氢原子。(5)已知: ,综合上述信息,写出由二氯甲烷和乙醇制备 的
合成路线(无机试剂、有机溶剂任选)_____。
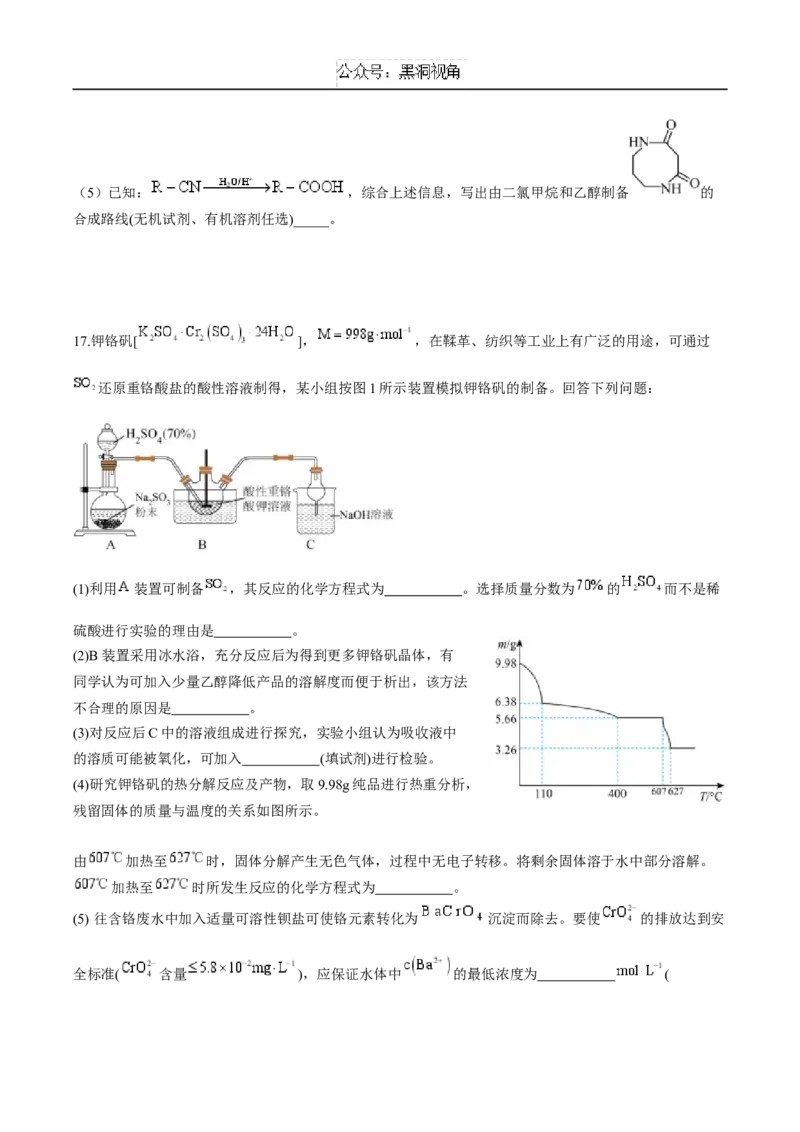
17.钾铬矾[ ], ,在鞣革、纺织等工业上有广泛的用途,可通过
还原重铬酸盐的酸性溶液制得,某小组按图1所示装置模拟钾铬矾的制备。回答下列问题:
(1)利用 装置可制备 ,其反应的化学方程式为 。选择质量分数为 的 而不是稀
硫酸进行实验的理由是 。
(2)B装置采用冰水浴,充分反应后为得到更多钾铬矾晶体,有
同学认为可加入少量乙醇降低产品的溶解度而便于析出,该方法
不合理的原因是 。
(3)对反应后C中的溶液组成进行探究,实验小组认为吸收液中
的溶质可能被氧化,可加入 (填试剂)进行检验。
(4)研究钾铬矾的热分解反应及产物,取9.98g纯品进行热重分析,
残留固体的质量与温度的关系如图所示。
由 加热至 时,固体分解产生无色气体,过程中无电子转移。将剩余固体溶于水中部分溶解。
加热至 时所发生反应的化学方程式为 。
(5) 往含铬废水中加入适量可溶性钡盐可使铬元素转化为 沉淀而除去。要使 的排放达到安
全标准( 含量 ),应保证水体中 的最低浓度为 (,写出计算过程)。
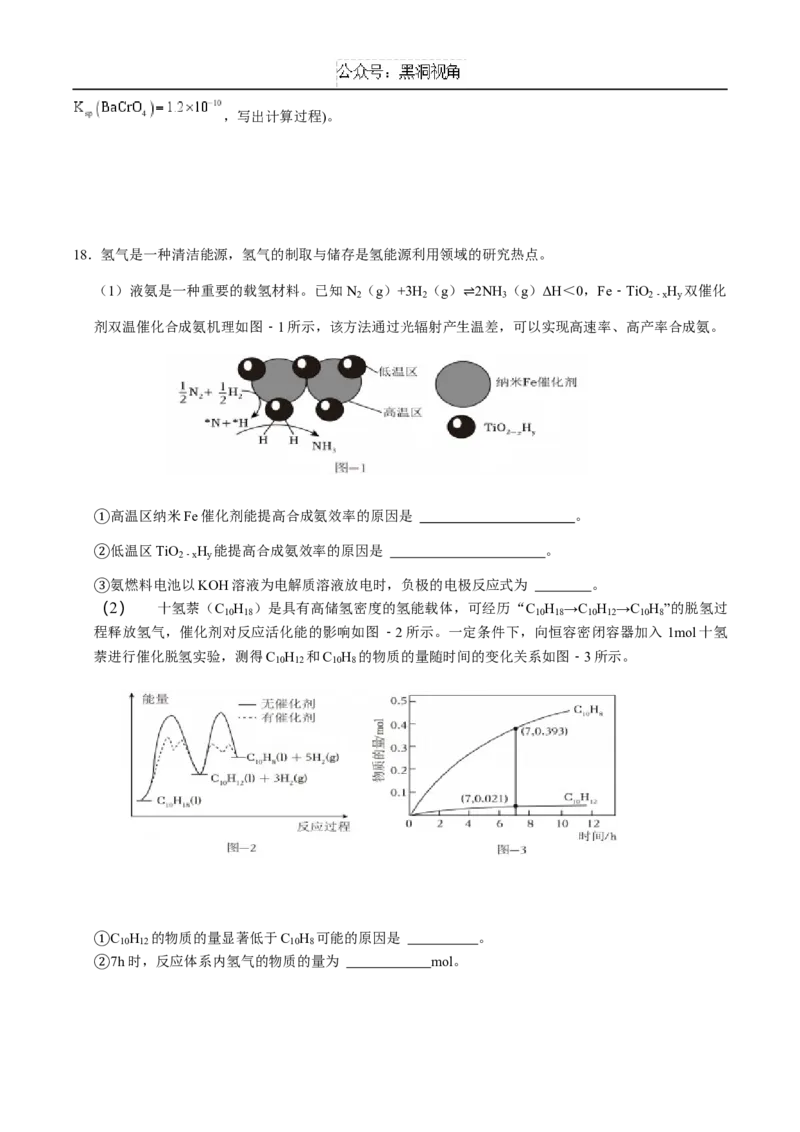
18.氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点。
(1)液氨是一种重要的载氢材料。已知N (g)+3H (g) 2NH (g)ΔH<0,Fe﹣TiO H 双催化
2 2 3 2﹣x y
剂双温催化合成氨机理如图﹣1所示,该方法通过光辐射产生⇌温差,可以实现高速率、高产率合成氨。
高温区纳米Fe催化剂能提高合成氨效率的原因是 。
①低温区TiO H 能提高合成氨效率的原因是 。
2﹣x y
②氨燃料电池以KOH溶液为电解质溶液放电时,负极的电极反应式为 。
(2) 十氢萘(C H )是具有高储氢密度的氢能载体,可经历“C H →C H →C H ”的脱氢过
③ 10 18 10 18 10 12 10 8
程释放氢气,催化剂对反应活化能的影响如图﹣2所示。一定条件下,向恒容密闭容器加入 1mol十氢
萘进行催化脱氢实验,测得C H 和C H 的物质的量随时间的变化关系如图﹣3所示。
10 12 10 8
C H 的物质的量显著低于C H 可能的原因是 。
10 12 10 8
7h时,反应体系内氢气的物质的量为 mol。
①
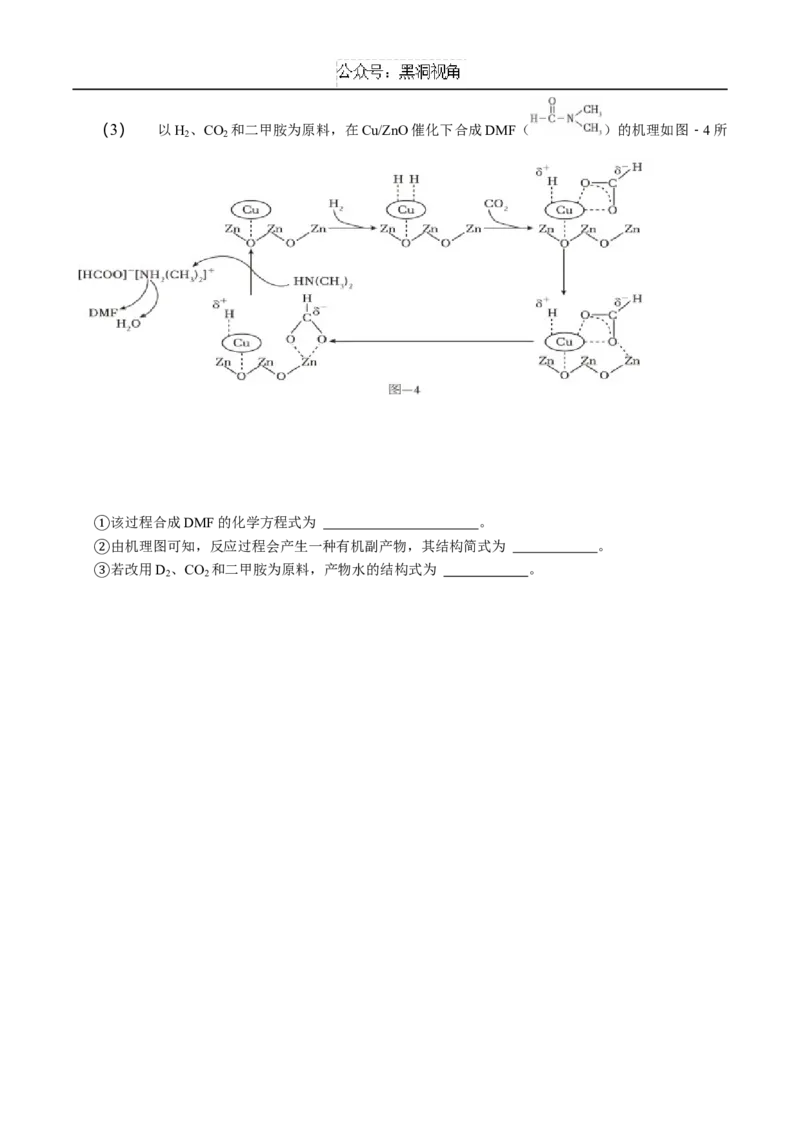
②(3) 以H 、CO 和二甲胺为原料,在Cu/ZnO催化下合成DMF( )的机理如图﹣4所
2 2
示。
该过程合成DMF的化学方程式为 。
由机理图可知,反应过程会产生一种有机副产物,其结构简式为 。
①
若改用D 、CO 和二甲胺为原料,产物水的结构式为 。
② 2 2
③答案
题型 1 2 3 4 5 6 7 8 9 10 11 12 13 14
答案 B A A B D D A D C B C D B D
1-5 BAABD 6-10 DADCB 11-15 CDBD
15.(12分)(1) d 4:3
(2) +5 的价电子排布式为 , 的价电子排布式为 , 的 轨道处于半充满状
态,能量更低更稳定,使得 失去第3个电子所需能量更高,所以 的第三电离能 小于 的第三
电离能
(3) AE 射线衍射法 < 电负性: ,在 中成键电子对偏向 ,
成键电子对之间的排斥力大,键角大, 中成键电子对偏向 ,成键电子对之间的排斥力小,键角小
(4)
16.(16分)(1)酯基 (2)酯基中碳氧元素电负性差值最大,最容易断裂,形成酰胺比较容易;羧基
中氧氢元素电负性差值最大,比碳氧键更容易断裂,羧基与氨基难生成酰胺
(3)
(4)(5)
17.(14分)(1) 增大 浓度加快反应速率,减少
溶解量,促进 逸出
(2)酸性 溶液可以将乙醇氧化
(3)稀盐酸酸化的氯化钡溶液
(4)
(5)
18.(16分)(1) 纳米铁可以吸附更多N ,高温有利于N≡N、H—H断裂,加快反应速率;
2
反应放热,低温①区促进N、H合成氨,平衡正向移动,提高NH
3
平衡产率;
②
2NH ﹣6e﹣+6OH﹣=N +6H O;
3 2 2
③
(2) 催化剂显著降低了C H 转化为C H 的活化能,C H 分解速率大于其生成速率;
10 12 10 8 10 12
① 2.028;
(3) ②H +CO +HN(CH ) H O+;
2 2 3 2 2
① HCOOH;
②H—O—D。
③