文档内容
第 3 章 第 3 节 课时 2 乙酸
一、乙酸的物理性质、结构及弱酸性
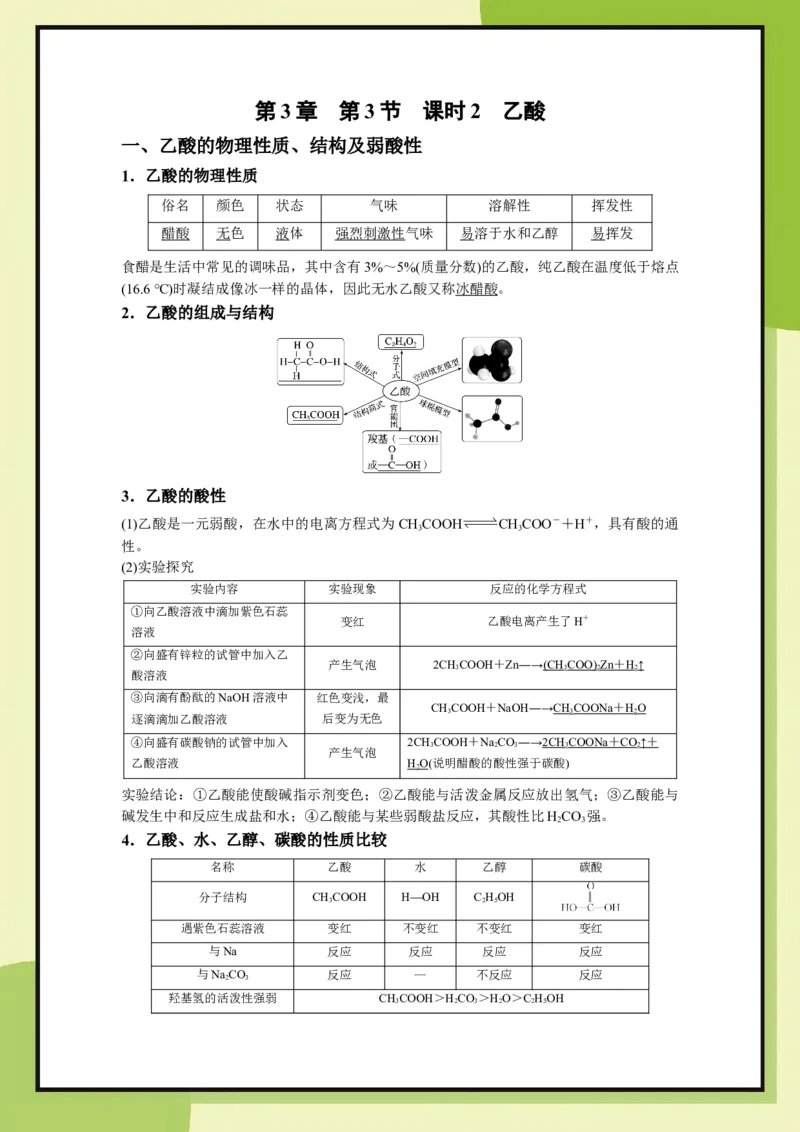
1.乙酸的物理性质
俗名 颜色 状态 气味 溶解性 挥发性
醋酸 无色 液体 强烈刺激性气味 易溶于水和乙醇 易挥发
食醋是生活中常见的调味品,其中含有3%~5%(质量分数)的乙酸,纯乙酸在温度低于熔点
(16.6 ℃)时凝结成像冰一样的晶体,因此无水乙酸又称冰醋酸。
2.乙酸的组成与结构
3.乙酸的酸性
(1)乙酸是一元弱酸,在水中的电离方程式为CHCOOH CHCOO-+H+,具有酸的通
3 3
性。
(2)实验探究
实验内容 实验现象 反应的化学方程式
①向乙酸溶液中滴加紫色石蕊
变红 乙酸电离产生了H+
溶液
②向盛有锌粒的试管中加入乙
产生气泡 2CHCOOH+Zn―→(CHCOO) Zn + H ↑
3 3 2 2
酸溶液
③向滴有酚酞的NaOH溶液中 红色变浅,最
CHCOOH+NaOH―→CH COONa + H O
3 3 2
逐滴滴加乙酸溶液 后变为无色
④向盛有碳酸钠的试管中加入 2CHCOOH+NaCO―→2CH COONa + CO ↑ +
3 2 3 3 2
产生气泡
乙酸溶液 HO(说明醋酸的酸性强于碳酸)
2
实验结论:①乙酸能使酸碱指示剂变色;②乙酸能与活泼金属反应放出氢气;③乙酸能与
碱发生中和反应生成盐和水;④乙酸能与某些弱酸盐反应,其酸性比HCO 强。
2 3
4.乙酸、水、乙醇、碳酸的性质比较
名称 乙酸 水 乙醇 碳酸
分子结构 CHCOOH H—OH CHOH
3 2 5
遇紫色石蕊溶液 变红 不变红 不变红 变红
与Na 反应 反应 反应 反应
与NaCO 反应 — 不反应 反应
2 3
羟基氢的活泼性强弱 CHCOOH>HCO>HO>CHOH
3 2 3 2 2 5二、乙酸的典型性质——酯化反应
1.酯化反应
(1)定义:羧酸和醇生成酯和水的反应。
(2)反应特点:酯化反应属于可逆反应,也属于取代反应。
(3)反应机理(乙醇中含有18O原子)
即酸脱羟基醇脱氢原子。
2.实验探究
实验操作
实验现象 饱和NaCO 溶液的液面上有无色透明油状液体生成,出现分层,且能闻到香味
2 3
化学方程式
CHCOOH+CHCHOH CHCOOCHCH + H O
3 3 2 3 2 3 2
(1)浓硫酸的作用:催化剂、吸水剂。
(2)饱和碳酸钠溶液的作用
①通过碳酸钠与乙酸反应除去乙酸乙酯中混有的乙酸。
②通过乙醇溶于碳酸钠溶液除去乙酸乙酯中混有的乙醇。
③降低乙酸乙酯的溶解度,便于分层,以收集更多的乙酸乙酯。
(3)安全措施
①试管内加入碎瓷片的作用:防止混合液在加热过程中发生暴沸。
②配制混合液时试剂加入的顺序:先加入乙醇和乙酸,然后一边振荡试管一边慢慢加入浓
硫酸;或先向试管中加入乙醇,然后加入浓硫酸,冷却后加入乙酸。但一定不能先加入浓
硫酸再加入其他物质,以防止液体飞溅。
③导管起导气兼冷凝的作用。导管末端不能伸入饱和碳酸钠溶液中,防止发生倒吸。
3.乙酸乙酯
(1)结构;乙酸乙酯的结构简式为 ,官能团为 。
(2)物理性质:乙酸乙酯是一种无色透明、有香味的油状液体,易溶于乙醇和乙醚等有机溶
剂,密度比水小。
(3)化学性质:乙酸乙酯在酸或碱存在的条件下,能够发生水解反应。