文档内容
配套《高中必刷题 化学 必修第一册 LK》使用
第3章 物质的性质与转化
第1节 铁的多样性
课时2铁的单质 铁的氧化物和氢氧化物
一、铁的单质
1.铁的存在和冶炼
(1)存在
铁在自然界中可以以单质形态(陨铁)存在,但主要是以 + 2 价和 + 3 价化合物的形态存在于
矿石中。铁元素在地壳中的含量居第四位,仅次于氧、硅和铝。
(2)冶炼
工业炼铁的原理是用还原法把铁从铁矿石中提炼出来,化学方程式(以Fe O 为例):3CO+
2 3
Fe O=====2Fe+3CO。
2 3 2
2.铁的物理性质
铁有延展性、导热性、导电性,但其导电性不如铜和铝,铁还能被磁体吸引,其熔、沸点
较高。
3.铁的化学性质
(1)与某些非金属单质、非氧化性酸和盐溶液反应。
写出下列有关反应的化学方程式,是离子反应的写出离子方程式。
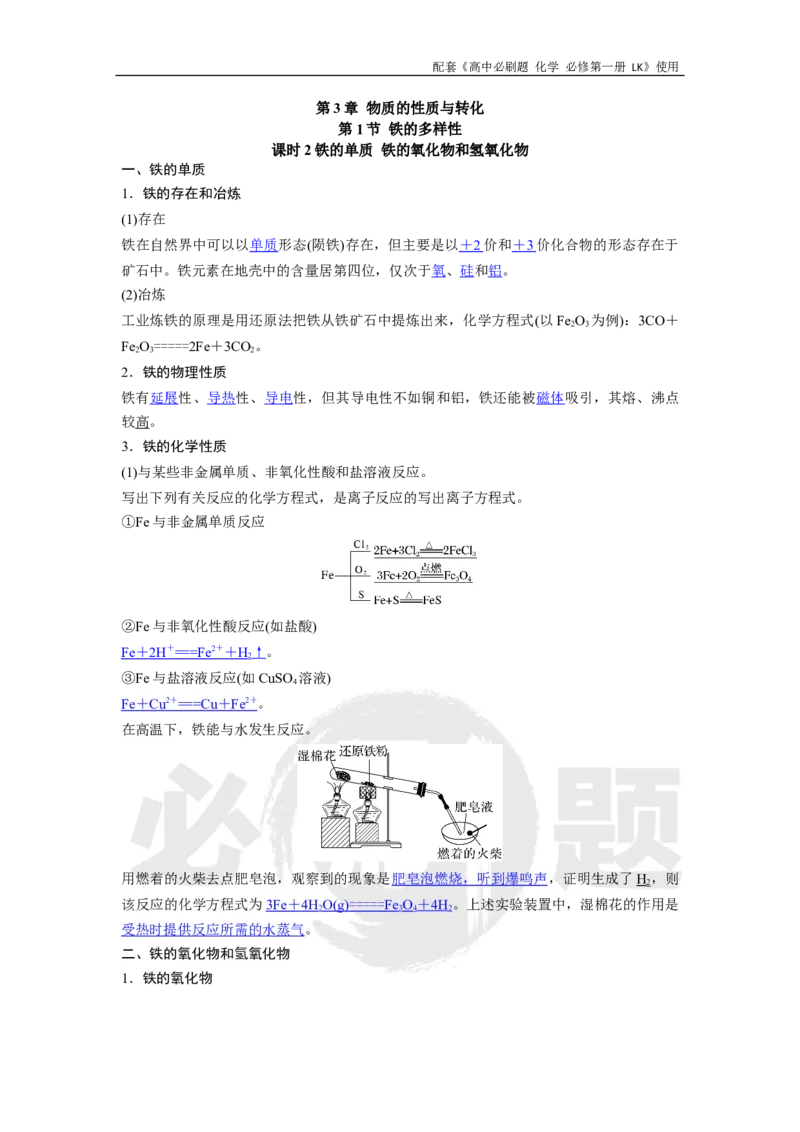
①Fe与非金属单质反应
②Fe与非氧化性酸反应(如盐酸)
Fe + 2H + == = Fe 2 + + H ↑。
2
③Fe与盐溶液反应(如CuSO 溶液)
4
Fe + Cu 2 + == = Cu + Fe 2 + 。
在高温下,铁能与水发生反应。
用燃着的火柴去点肥皂泡,观察到的现象是肥皂泡燃烧,听到爆鸣声,证明生成了H ,则
2
该反应的化学方程式为 3Fe + 4H O(g) ===== Fe O + 4H 。上述实验装置中,湿棉花的作用是
2 3 4 2
受热时提供反应所需的水蒸气。
二、铁的氧化物和氢氧化物
1.铁的氧化物配套《高中必刷题 化学 必修第一册 LK》使用
氧化亚铁(FeO) 氧化铁(Fe O) 四氧化三铁(Fe O)
2 3 3 4
俗称 — 铁红 磁性氧化铁
颜色、状态 黑色粉末 红棕色粉末 黑色晶体(有磁性)
溶解性 不溶于水
类别 碱性氧化物 - -
铁的价态 + 2 + 3 + 2、 + 3
与H+反应的 FeO+2H+===Fe2++ 6H++Fe O===2Fe3+ Fe O+8H+===2Fe3+
2 3 3 4
离子方程式 HO +3HO +Fe2++4HO
2 2 2
6FeO+
稳定性 稳定 稳定
O=====2Fe O
2 3 4
与CO、C、
生成单质铁及CO 或HO
H 反应 2 2
2
Fe O 常用作油漆、涂料、油墨和橡胶的红色颜料,赤铁矿(主要成分
用途 2 3
是Fe O)是炼铁的原料
2 3
2.铁的氢氧化物
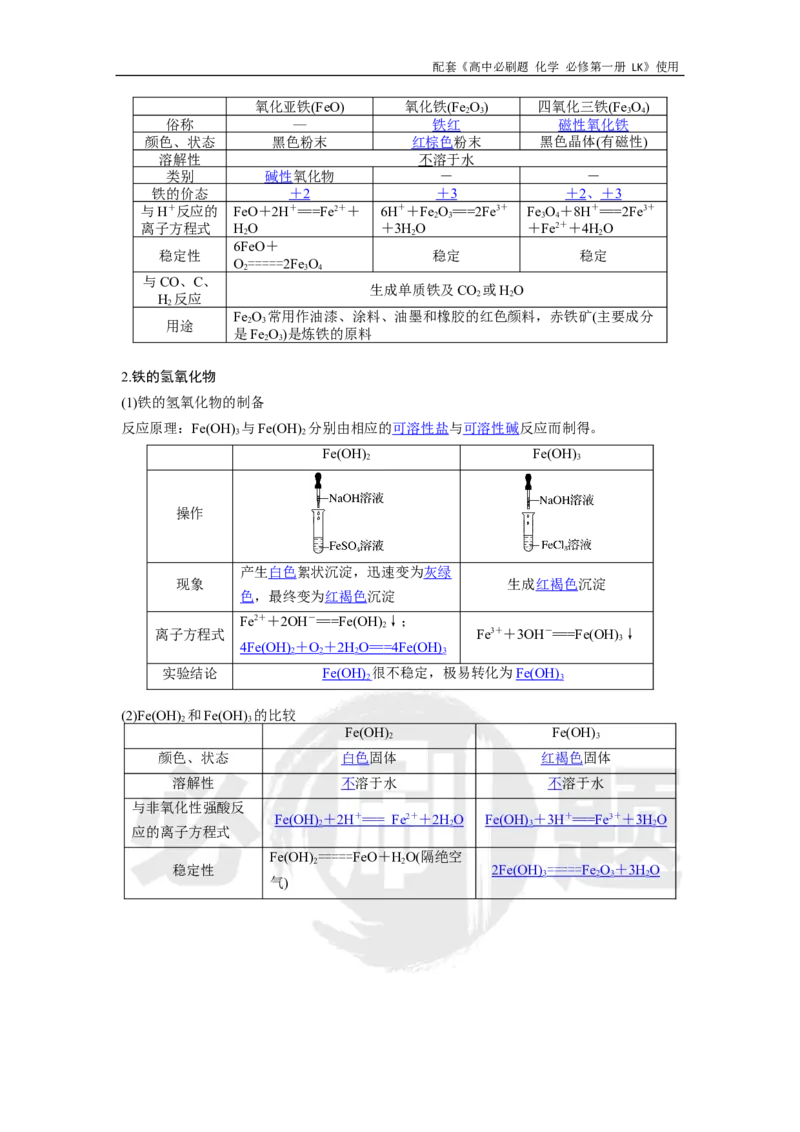
(1)铁的氢氧化物的制备
反应原理:Fe(OH) 与Fe(OH) 分别由相应的可溶性盐与可溶性碱反应而制得。
3 2
Fe(OH) Fe(OH)
2 3
操作
产生白色絮状沉淀,迅速变为灰绿
现象 生成红褐色沉淀
色,最终变为红褐色沉淀
Fe2++2OH-===Fe(OH) ↓;
2
离子方程式 Fe3++3OH-===Fe(OH) ↓
3
4Fe(OH) + O + 2H O == = 4Fe(OH)
2 2 2 3
实验结论 Fe(OH) 很不稳定,极易转化为Fe(OH)
2 3
(2)Fe(OH) 和Fe(OH) 的比较
2 3
Fe(OH) Fe(OH)
2 3
颜色、状态 白色固体 红褐色固体
溶解性 不溶于水 不溶于水
与非氧化性强酸反
Fe(OH) + 2H + == = F e 2 + + 2H O Fe(OH) + 3H + == = F e 3 + + 3H O
2 2 3 2
应的离子方程式
Fe(OH) =====FeO+HO(隔绝空
2 2
稳定性 2Fe(OH) ==== = F e O + 3H O
3 2 3 2
气)