文档内容
重难点 02 氧化还原反应综合推断与计算
1.(2024·高一上·河南省洛阳市·期末)A、B、C三种物质中均含有同一种元素M,它们之间有如图所示
的转化关系。A为一种金属单质,其产量直接关系国民经济命脉。反应①②③均为化合反应,反应④
为置换反应。下列有关说法错误的是
A.①中所加试剂可能是氯气
B.③中需要加具有还原性的试剂
C.由B到C发生的变化也能通过加碘化钾溶液实现
D.B的溶液可作为“腐蚀液”去除覆铜板上不需要的铜
【答案】B
【分析】A为一种金属单质,其产量直接关系国民经济命脉,故A为Fe;A、B、C三种物质中均含
有同一种元素M,反应①②③均为化合反应,反应④为置换反应,Fe与Cl(或Br )反应得到FeCl
2 2 3
(或FeBr ),FeCl (或FeBr )与Fe反应得到FeCl (或FeBr ),FeCl (或FeBr )与Cl(或Br )
3 3 3 2 2 2 2 2 2
反应得到FeCl (或FeBr ),Fe与HCl(或HBr)发生置换反应可以得到FeCl (或FeBr ),综合可
3 3 2 2
知,A为Fe、B为FeCl (或FeBr )、C为FeCl (或FeBr ),据此分析。
3 3 2 2
【解析】A.根据上述分析,①中所加试剂可能为氯气,故A正确;
B.反应③为Fe2+→Fe3+,需要加具有氧化性的试剂,故B错误;
C.B的溶液中铁元素化合价为+3价,具有强氧化性,能将I-氧化成I,本身还原成Fe2+,根据上述
2
分析,C中铁元素的化合价为+2价,即反应为: 可以发生,故C正确;
D.B的溶液中铁元素化合价为+3价,具有强氧化性,能发生反应: ,即可以作
为“腐蚀液”去除覆铜板上不需要的铜,故D正确;
故答案选B。
2.(2024·高一上·山西省部分学校·期末)工业上用 和石灰乳反应制取漂白粉,化学方程式为
,下列关于该反应的说法错误的是
A. 既是氧化剂又是还原剂
B.被氧化和被还原的氯元素质量比为1:1
C.漂白粉的有效成分是
D.当有0.1mol电子转移时,消耗 的体积一定为2.24L
【答案】D
【解析】A. 中Cl元素的化合价既升高又降低, 既是氧化剂又是还原剂,故A正确;
B. 中Cl元素有一半被氧化,一半被还原,被氧化和被还原的氯元素质量比为1:1,故B正确;
1
学科网(北京)股份有限公司C.漂白粉的有效成分是 ,故C正确;
D.气体的温度和压强是未知的,故无法计算Cl 的体积,故D错误。
2
答案选D。
3.(2024·高一上·湖北省十堰市·期末)二氧化碳的利用具有十分重要的意义,科学家设想用太阳能将CO
2
转化成O 和C(石墨烯),其设想如图所示。下列说法正确的是
2
A.FeO粉末能在空气中稳定存在
B.石墨烯能导电,故石墨烯为电解质
C.反应Ⅰ、Ⅱ均为氧化还原反应
D.CO 属于碱性氧化物
2
【答案】C
【解析】A.FeO具有还原性,则FeO粉末能被空气中的O 氧化,则其在空气中不能稳定存在,A错
2
误;
B.已知电解质是指在水溶液或熔融状态下能够导电的化合物,石墨烯虽然能导电,但石墨烯是单
质,不为电解质,B错误;
C.由题干反应历程图可知,反应Ⅰ为:6FeO+CO 2Fe O+C,反应Ⅱ为:2Fe O
2 3 4 3 4
6FeO+O,均有元素的化合价发生改变,则均为氧化还原反应,C正确;
2
D.CO 为非金属氧化物,能与碱反应生成盐和水,故属于酸性氧化物,D错误;
2
故答案为:C。
4.(2024·高一上·福建省龙岩市一级校联盟·期末) 和 可用于烟气中的大量氮氧化物 转化
为无害物质.将NO与 的混合气体通入 和 的混合溶液中,发生以下转化过程.下列说法
错误的是
A.反应前后溶液中 和 的总物质的量不变
2
学科网(北京)股份有限公司B.参加反应Ⅰ的氧化剂与还原剂的个数之比为2∶1
C.反应Ⅱ的离子方程式为
D.反应过程中消耗 与生成 的体积(标况下)相等
【答案】D
【分析】根据图示分析,过程I: ,过程II:
,以此解题。
【解析】A.根据分析,两过程反应整理得总反应: ,反应过程中溶液内
Ce3+和Ce4+总数保持不变,A正确;
B.反应Ⅰ为 ,氧化剂与还原剂的物质的量之比为2:1,B正确;
C.由分析可知,反应Ⅱ的离子方程式为 ,C正确;
D.根据选项A分析可知,总反应为 ,则反应过程中消耗 与生成 的体积
比为2∶1,D错误;
故选D。
5.(2024·高一上·吉林省长春市东北师范大学附属中学·期末) 与浓 反应的化学方程式:
。正确的是
A.所得氯气的相对分子质量约为71
B. 中
C. 中x既含 又含
D. 中 、 个数比为1∶5
【答案】D
【分析】 ,35Cl中Cl元素的化合价由+5价降低为0,37Cl中
Cl元素的化合价由-1价升高为0,37Cl中Cl元素部分化合价不变;
【解析】A.生成 的相对分子质量为 =73.33,选项A错误;
B. 中37Cl的Cl元素化合价不变, 中 ,选项B错误;
C. 中x只含 ,选项C错误;
D.氯酸钾是氧化剂、部分HCl是还原剂,则被氧化和被还原的氯原子数之比为5:1, 中 、
个数比为1∶5,选项D正确;
答案选D。
6.(2024·高一上·陕西省西安市5校联考·期末)LiAlH 和LiH是金属储氢材料,又是有机合成中的常用试
4
剂,遇水均能剧烈反应释放出H,LiAlH 在125℃分解为LiH、H 和Al。下列说法正确的是( )
2 4 2
A.LiH与DO反应,所得氢气的摩尔质量为2g·mol-1
2
3
学科网(北京)股份有限公司B.1molLiAlH 在125℃完全分解,转移3mol电子
4
C.1molLiAlH 与足量水反应生成的氢气体积为89.6L
4
D.LiAlH 与乙醛反应可生成乙醇,其中LiAlH 作氧化剂
4 4
【答案】B
【解析】A. 由LiH+D O═LiOD+HD↑可知,所得氢气的摩尔质量为3g⋅mol−1,故A错误;
2
B. LiAlH 在125℃分解为LiH、H 和Al,Al由+3价降低为0,则1mol LiAlH 在125℃完全分解,转移
4 2 4
3 mol电子,故B正确;
C. 由LiAlH +4H O═LiOH+Al(OH) ↓+4H ↑可知,1mol LiAlH 跟足量水反应可生成4mol氢气;没有说
4 2 3 2 4
明是否为标况,氢气的体积不一定是89.6L,故C错误;
D. LiAlH 与乙醛反应可生成乙醇,乙醛被还原,LiAlH 作还原剂,故D错误;
4 4
故选B。
7.(2024·高一上·湖南省怀化市·期末)下图为以太阳能为热源经铁氧化合物循环分解水制H 的示意图。
2
下列说法不正确的是
A.FeO在分解水制H 的过程中作催化剂
2
B.反应I中每生成6molFeO转移4mol电子
C.反应Ⅱ的化学方程式为3FeO+HO=Fe O+H ↑
2 3 4 2
D.总反应方程式为2HO 2H↑+O ↑
2 2 2
【答案】A
【解析】A.FeO在分解水制H 的过程中是中间产物,不是催化剂,故A错误;
2
B.根据化合价升降守恒,可得过程Ⅰ的方程式为:2Fe O=6FeO+O ↑,则反应中每生成12molFeO,
3 4 2
同时生成2molO ,转移8mol电子,故每生成6molFeO转移4mol电子,故B正确;
2
C.根据化合价升降守恒,可得过程Ⅱ的方程式为:3FeO+HO=H↑+Fe O,故C正确;
2 2 3 4
D.由示意图可知,总反应方程式为2HO 2H↑+O ↑,故D正确;
2 2 2
答案选A。
8.(2024·高一上·山东省日照市·期末) 溶液、双氧水、酸性 溶液作氧化剂时分别被还原为
、 、 。下列说法正确的是
A.可以用 试纸测定 溶液的
B. 溶液可以与洁厕灵混合使用以增强消毒效果
4
学科网(北京)股份有限公司C.以单位质量氧化剂的得电子数表示消毒效率,消毒效率:
D. 可与酸性 溶液反应生成 ,氧化性:酸性
【答案】D
【解析】A. 溶液具有漂白性,不能用 试纸测定 溶液的 ,A错误;
B.将 溶液与洁厕灵混用会放出有毒的氯气,消毒效果降低,B错误;
C.以单位质量氧化剂的得电子数表示消毒效率,64.5g 得电子数为2N ,34g H O 得电子数为
A 2 2
2N ,故消毒效率: ,C错误;
A
D. 可与酸性 溶液反应生成 , 为氧化剂, 为还原剂,故氧化性:酸性
,D正确;
答案选D。
9.(2024·高一上·湖北省十堰市·期末)如图是一种综合处理含 尾气的工艺流程,下列分析正确的是
A.“吸收”步骤中 为还原剂
B.通入空气是将 氧化为
C.由反应过程可推知氧化性的强弱顺序:
D.该尾气处理工艺要消耗大量的 和空气来氧化尾气中的
【答案】C
【分析】根据流程可知,吸收反应:2HO+SO +Fe (SO )=2FeSO+2H SO ,氧化反应:
2 2 2 4 3 4 2 4
4FeSO +O +2H SO =2Fe SO )+2H O,据此分析解题。
4 2 2 4 2( 4 3 2
【解析】A.“吸收”步骤中发生的反应为2HO+SO +Fe (SO )=2FeSO+2H SO ,Fe的化合价降低,
2 2 2 4 3 4 2 4
则Fe (SO ) 发生还原反应、为氧化剂,A错误;
2 4 3
B.由分析可知,通入空气是将FeSO 氧化为Fe SO ),B错误;
4 2( 4 3
C.“吸收”步骤和“氧化”步骤发生的反应分别为:①2HO+SO +Fe (SO )=2FeSO+2H SO ;
2 2 2 4 3 4 2 4
②4FeSO +O +2H SO =2Fe SO )+2H O,氧化还原反应中,氧化剂的氧化性大于氧化产物的氧化性,
4 2 2 4 2( 4 3 2
①中氧化剂是Fe3+,氧化产物是SO ;氧化性:Fe3+>SO (氧化剂>氧化产物),②中氧化剂是O,
2
氧化产物是Fe3+,氧化性:O>Fe3+,故 ,C正确;
2
D.根据上述分析及题给反应方程式得, 溶液在上述流程中可以循环使用,不需消耗大量的
,D错误;
5
学科网(北京)股份有限公司故选C。
10.(2024·高一上·山东省青岛市·期末)已知转化Ⅰ: ;转化Ⅱ:
。下列说法错误的是
A.氧化性:PbO > >Cl
2 2
B.转化Ⅰ、Ⅱ消耗或生成等物质的量的 ,转移电子数相同
C. 做氧化剂时,酸性越强,氧化性越强
D.PbO 与FeSO 溶液反应:
2 4
【答案】D
【解析】A.反应Ⅰ中氧化剂是 ,氧化产物是Cl;反应Ⅱ中氧化剂是PbO ,氧化产物是
2 2
,根据氧化还原反应中氧化性:氧化剂>氧化产物,可知物质的氧化性:PbO > >Cl,A正
2 2
确;
B.根据电子守恒可知:在反应Ⅰ中每消耗1 mol ,反应过程中转移5 mol电子;而在反应Ⅱ
中,每反应生成1 mol ,反应过程中转移5 mol电子,因此转化Ⅰ、Ⅱ消耗或生成等物质的量的
,转移电子数相同,B正确;
C.微粒的氧化性或还原性与溶液的酸碱性有关, 做氧化剂时,溶液的酸性越强,物质的氧化性
就越强,C正确;
D.Pb2+与 会反应产生难溶性PbSO 沉淀,不能大量共存,反应的离子方程式应该为:PbO +2Fe2+
4 2
+4H++ =PbSO+2Fe3++2H O,D错误;
4 2
故合理选项是D。
11.(2024·高一上·山东省日照市·期末)将 与空气的混合气体通入 、 、 的混合溶液
中可回收S并消除空气污染,其机理如图所示。下列说法正确的是
A.反应①中氧化剂与还原剂的物质的量之比为1∶2
B.反应②的离子方程式为:
C.转化过程中,共有4种元素的化合价发生变化
D.总反应的化学方程式为:
6
学科网(北京)股份有限公司【答案】D
【分析】由图可知,过程①发生的反应为酸性条件下溶液中的亚铁离子与氧气反应生成铁离子和水,
反应的离子方程式为 ,过程②发生的反应为硫化氢与溶液中的铜离子反
应生成硫化铜沉淀和氢离子,反应的离子方程式为HS+Cu2+=CuS↓+2H+,过程③发生的反应为溶液中
2
铁离子与硫化铜反应生成铜离子、亚铁离子和硫,反应的离子方程式为CuS+2Fe3+=Cu2++2Fe2++S,则
总反应为铜离子和铁离子做催化剂条件下,硫化氢与氧气反应生成硫和水,反应方程式为
2HS+O=2H O+2S↓;
2 2 2
【解析】A.过程①反应的离子方程式为 ,氧化剂与还原剂的物质的量
之比为1∶4,A错误;
B.过程②发生的反应为硫化氢与溶液中的铜离子反应生成硫化铜沉淀和氢离子,反应的离子方程式
为HS+Cu2+=CuS↓+2H+,B错误;
2
C.由分析,反应中氧、铁、硫元素化合价改变,C错误;
D.总反应为铜离子和铁离子做催化剂条件下,硫化氢与氧气反应生成硫和水,D正确;
故选D。
12.(2024·高一上·陕西省名校·期末)某学生做如下实验:第一步,在淀粉-KI溶液中,滴入少量NaClO
溶液,并加入少量稀硫酸,溶液立即变蓝;第二步,在上述蓝色溶液中,滴加足量的NaSO 溶液,蓝
2 3
色逐渐消失。下列有关该同学对实验原理的解释和所得结论的叙述不正确的是。
A.氧化性:ClO->I>SO
2
B.蓝色消失的原因是NaSO 溶液具有漂白性
2 3
C.淀粉-KI溶液变蓝是因为I-被ClO-氧化为I,I 使淀粉变蓝
2 2
D.已知Cl 能使淀粉-KI溶液变蓝,则将NaSO 溶液加入氯水中,氯水不褪色
2 2 3
【答案】BD
【解析】A.在淀粉-KI溶液中加入少量NaClO溶液,并加入少量的稀硫酸,溶液立即变蓝,说明
NaClO将KI氧化为单质碘;加入足量的NaSO 溶液,蓝色逐渐消失,说明碘单质将NaSO 氧化为
2 3 2 3
NaSO ,自身成为碘离子,第一步反应生成了碘单质,说明氧化性:ClO->I,第二步碘被NaSO 还
2 4 2 2 3
原,说明氧化性:I>SO ,则可知氧化性:ClO->I>SO ,A项正确;
2 2
B.根据以上分析知,蓝色消失的原因是NaSO 溶液具有还原性,B项错误;
2 3
C.根据以上分析知,淀粉-KI溶液变蓝是因为I-被ClO-氧化为I,I 使淀粉变蓝,C项正确;
2 2
D.Cl 能使淀粉-KI溶液变蓝,说明Cl 将KI氧化为单质碘,则氧化性Cl>I,即Cl>I>SO ,
2 2 2 2 2 2
根据“强制弱原理”,则可以判断Cl 能把NaSO 氧化生成硫酸钠,同时氯气被还原为氯离子,所以
2 2 3
氯水褪色,D项错误;
故选BD。
13.(2024·高一上·湖南省名校联考联合体·期末)铅与碳是同族元素,有 两种价态,铅的氧化物均
难溶于水,已知有下列两个反应:① ;②
7
学科网(北京)股份有限公司。下列有关叙述不正确的是
A. 可写成 的形式
B.反应②中 是氧化产物
C.生成相同质量的 ,反应①②转移电子数之比为
D.根据反应可推测在题给条件下氧化性:
【答案】C
【解析】A.Pb元素分别表现 价和 价,根据电荷守恒,可写成 的形式,A正确;
B.反应②中, 是还原剂,对应的生成物 是氧化产物,B正确;
C.反应①为非氧化还原反应,不发生电子转移,反应②中,生成 ,转移 电子,C错
误;
D.反应①为非氧化还原反应,表明 不能将 价的铅氧化,而 能将 氧化为 ,
则表明在题给条件下氧化性: ,D正确;
故选C。
14.(2024·高一上·北京市朝阳区·期末)2023年杭州亚运会使用甲醇( )作为主火炬燃料。
(1) 是一种清洁、可再生燃料,燃烧时发生反应: 。
在该反应中每消耗 ,生成 的物质的量是 ,生成 的质量是
g。
(2) 燃烧时,火焰为淡蓝色。在 中添加含 (填序号)元素的化合物,可使火炬
的火焰呈黄色。
a.钠 b.钾
(3) 可由废弃的 制得,其原理为:
在该反应中,作还原剂的物质是 ,每生成 ,转移电子的物质的量是
。
(4)一种富集烟气中 的方法示意图如下。
8
学科网(北京)股份有限公司①比较“吸收”和“解吸”过程的温度: (填“>”或“<”)。
②写出“解吸”过程的化学方程式: 。
【答案】(1)1 36
(2)a
(3)氢气 6
(4)<
【解析】(1)由化学计量系数可知每消耗 ,生成1mol ,生成2mol水即36g水;
(2)钠的焰色是黄色,故在 中添加含钠元素的化合物,可使火炬的火焰呈黄色,故选a;
(3)氢气是还原剂,3mol氢气失电子变成+1价氢,故每生成 ,转移电子的物质的量是
mol=6mol;
(4)“吸收”的过程是碳酸钠和水、二氧化碳化合生成碳酸氢钠的过程,放出热量;“解吸”过程
是碳酸氢钠受热分解的吸热过程,故T”) ,每消耗 转移 。
(2)湿法制备 ,将 固体加入含有一定浓度的 和 的混合溶液中,搅拌
一段时间后,可得到 和 。
①实验需要 溶液,如图所示的仪器中配制溶液肯定不需要的是
(填字母,下同)。
②下列有关容量瓶使用方法的操作中,错误的是 。
A.使用容量瓶之前应检查它是否漏水
B.容量瓶用蒸馏水洗净后,无需用待配溶液润洗
C.定容时,将蒸馏水小心倒入容量瓶中直至与刻度线齐平
D.配制溶液时,如果试样是液体,用量筒量取试样后直接倒入容量瓶中定容
③在配制 溶液时,若 固体溶解后立即移入容量瓶→洗烧杯→洗涤液移入容量瓶→定容,
则所得溶液浓度 (填“>”“<”或“=”) 。
10
学科网(北京)股份有限公司④写出湿法制备 的化学方程式: 。
(3)如果以单位质量的氧化剂所得到的电子物质的量来表示消毒的效率, 的消毒效率为
(用分数表示, )。
【答案】(1)盐 > 4
(2)AB CD > 2Fe(OH) +3NaClO+4NaOH=2Na FeO+3NaCl+5HO
3 2 4 2
(3)
【解析】(1)①NaFeO 属于盐类,由金属阳离子和酸根构成;
2 4
②Na O 由2个钠离子和1个过氧根构成,则电子式 ;
2 2
③根据方程式分析,NaO 为氧化剂,1molNa O 得2mol电子发生还原反应,FeSO 为还原剂,1molFe
2 2 2 2 4
失去4mol电子发生氧化反应生成NaFeO 为氧化产物,每消耗1 mol FeSO 转移4mole-,氧化剂的氧
2 4 4
化性大于氧化产物,则氧化性,NaO>NaFeO;
2 2 2 4
(2)①配制480mL溶液,需要用500mL容量瓶,且用胶头滴管进行定容,不需要圆底烧瓶和分液漏
斗,故选AB;
②A.容量瓶在使用前需要检查其是否漏水,A正确;
B.容量瓶用蒸馏水洗净后,无需润洗和干燥,B正确;
C.定容时,用胶头滴管逐滴加入至凹液面最低处与刻度线相切,C错误;
D.配制溶液时,如果试样是液体,用量筒量取试样后需要在烧杯中进行稀释后,恢复至室温后,再
转移至容量瓶中定容,D错误;
故答案为:CD;
③如果没有冷却,直接将溶解后的溶液转移至容量瓶,根据热胀冷缩的原理,导致定容时加入水的体
积偏小,最终浓度偏大;
④Fe(OH) 与具有氧化性的次氯酸钠反应,次氯酸钠体现氧化性发生还原反应生成NaCl,Fe(OH) 体现
3 3
还原性,发生氧化反应生成高铁酸钠,根据得失电子守恒,元素守恒配平,湿法制备NaFeO 的化学
2 4
方程式为:2Fe(OH) +3NaClO+4NaOH=2Na FeO+3NaCl+5HO;
3 2 4 2
(3)已知以单位质量的氧化剂所得到的电子数来表示消毒的效率,NaFeO 作氧化剂,还原产物为
2 4
Fe3+,则1mol Na FeO 得3mol电子,则消毒效率为 。
2 4
17.(2024·高一上·江西省新余市·期末)Ⅰ.已知 具有强氧化性,某强酸性反应体系中,反应物和生
成物共六种物质: 、 (难溶盐)、 (强电解质)、 、X(水溶液呈无色)、
,已知X是一种盐,且 在该反应中失去 个电子。
(1)写出X的化学式: 。
(2)若有 参加反应,则转移电子的物质的量为 mol。
11
学科网(北京)股份有限公司Ⅱ.二氧化氯 具有强氧化性,是国际公认的高效消毒灭菌剂。 可用于水体中 的去
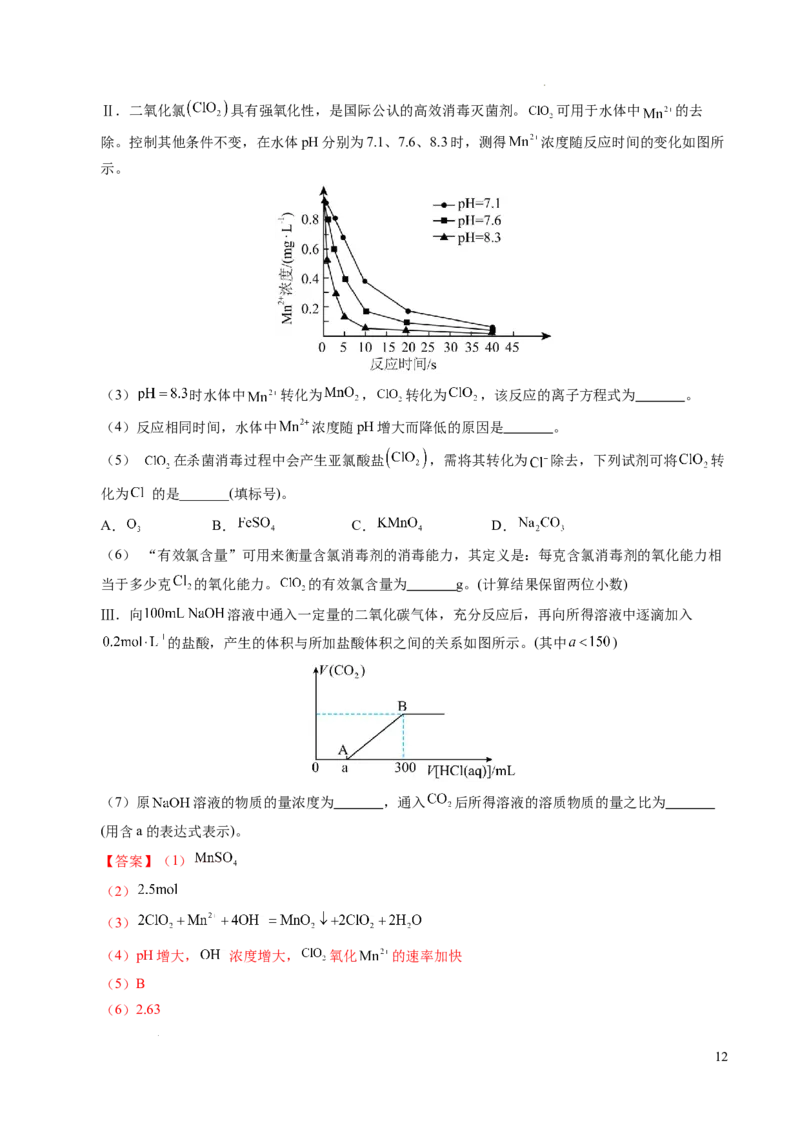
除。控制其他条件不变,在水体pH分别为7.1、7.6、8.3时,测得 浓度随反应时间的变化如图所
示。
(3) 时水体中 转化为 , 转化为 ,该反应的离子方程式为 。
(4)反应相同时间,水体中 浓度随pH增大而降低的原因是 。
(5) 在杀菌消毒过程中会产生亚氯酸盐 ,需将其转化为 除去,下列试剂可将 转
化为 的是_______(填标号)。
A. B. C. D.
(6) “有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力相
当于多少克 的氧化能力。 的有效氯含量为 g。(计算结果保留两位小数)
Ⅲ.向 溶液中通入一定量的二氧化碳气体,充分反应后,再向所得溶液中逐滴加入
的盐酸,产生的体积与所加盐酸体积之间的关系如图所示。(其中 )
(7)原 溶液的物质的量浓度为 ,通入 后所得溶液的溶质物质的量之比为
(用含a的表达式表示)。
【答案】(1)
(2)
(3)
(4)pH增大, 浓度增大, 氧化 的速率加快
(5)B
(6)2.63
12
学科网(北京)股份有限公司(7) 或
【分析】 具有强氧化性,可知反应体系中 作氧化剂,根据元素守恒, 、
是还原产物; 在该反应中失去 个电子,可知X是还原剂,根据元素守恒,X中含有
Mn元素,且Mn元素化合价升高5, 中Mn元素化合价为+7,则X中Mn元素化合价为
+2;根据元素守恒,X为 ;根据得失电子守恒配平反应方程式为
。
【解析】(1)根据以上分析,X为 ;
(2)根据 ,2mol硫酸参加反应转移10mol电
子, 的物质的量为0.5mol,若有 参加反应,则转移电子的物质的量为2.5mol。
(3) 时水体中 转化为 ,锰元素化合价由+2升高为+4, 转化为 ,氯元素
化合价由+4降低为+3,根据得失电子守恒,该反应的离子方程式为
;
(4)pH增大, 浓度增大, 氧化 的速率加快,所以反应相同时间,水体中 浓度随
pH增大而降低;
(5) 转化为 , 发生还原反应,需要还原剂,加入的物质具有还原性。 具有氧化性,
具有还原性, 具有氧化性, 即没有氧化性有没有还原性,故选B。
(6)根据“有效氯含量”的定义,设 的有效氯含量为ag。
,a=2.63g。
(7)滴入300mL盐酸时恰好完全反应,溶质为氯化钠,根据元素守恒,n(NaOH)=n(HCl)=
,原 溶液的物质的量浓度为 ; ,可知通入
后所得溶液的溶质物质为碳酸钠和碳酸氢钠,0~amL盐酸发生反应
,n(Na CO)= ,根据钠元素守恒,n(NaHCO )=0.06mol-
2 3 3
, 。
13
学科网(北京)股份有限公司