文档内容
2025 年陕西、山西、宁夏、青海高考真题化学试题
一、单选题
1.“国之重器”是我国科技综合实力的结晶。下述材料属于金属材料的是
A.“C919”大飞机用的氮化硅涂层 B.“梦想”号钻探船钻头用的合金
C.“望宇”登月服用的聚酰亚胺隔热层 D.“雪龙2”号破冰船制淡水用的反渗透膜
【答案】B
【详解】
A.氮化硅涂层属于新型陶瓷材料,属于无机非金属材料,A不符合题意;
B.合金是金属与其他元素熔合而成的材料,属于金属材料,B符合题意;
C.聚酰亚胺是高分子有机材料,不属于金属材料,C不符合题意;
D.反渗透膜通常由高分子聚合物制成,属于有机材料,D不符合题意;
故选B。
2.下列化学用语或图示表达正确的是
A.CS 的电子式为 B.基态Be原子的价电子排布式为2s22p2
2
C.C H 的球棍模型为 D.反-2-丁烯的结构简式为
2 2
【答案】A
【详解】
A.CS 与CO 结构类似,电子式为 ,A正确;
2 2
B.Be是4号元素,基态Be原子的价电子排布式为2s2,B错误;
C.乙炔的球棍模型为 ,图中表示乙炔的空间填充模型,C错误;
D.反-2-丁烯的分子中,两个甲基位于双键的不同侧,结构简式是 ,D错误;
故选A。
3.下列有关物质性质与用途对应关系错误的是
A.单晶硅熔点高,可用于制造芯片 B.金属铝具有还原性,可用于冶炼金属
C.浓硫酸具有吸水性,可用作干燥剂 D.乙炔燃烧火焰温度高,可用于切割金属
【答案】A
【详解】
A.单晶硅用于制造芯片主要因其半导体性质,而非熔点高,熔点高与用途无直接关联,A错误;
B.金属铝还原性强,可通过铝热反应冶炼金属(如Fe、Mn等),B正确;
C.浓硫酸吸水性使其可干燥中性/酸性气体(如H 、CO ),C正确;
2 2
D.乙炔燃烧产生高温氧炔焰(约3000℃),可熔化金属进行切割,D正确;
故选A。
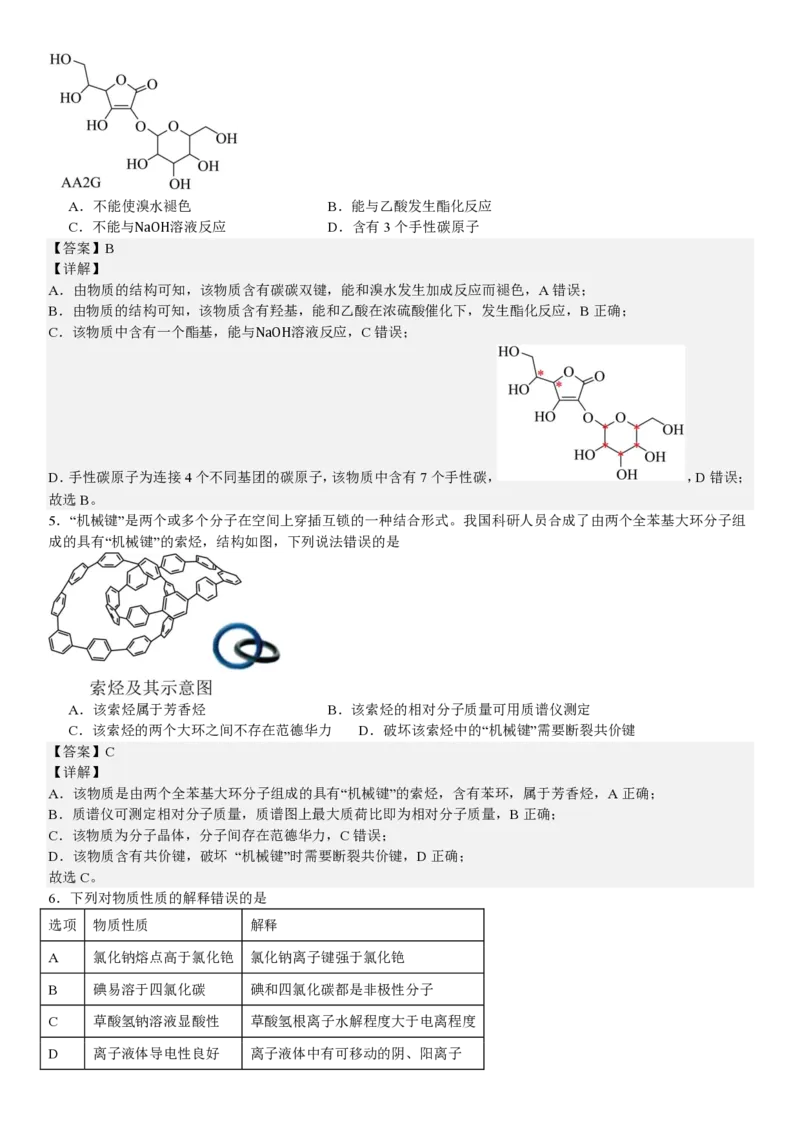
4.抗坏血酸葡萄糖苷(AA2G)具有抗氧化功能。下列关于AA2G的说法正确的是A.不能使溴水褪色 B.能与乙酸发生酯化反应
C.不能与NaOH溶液反应 D.含有3个手性碳原子
【答案】B
【详解】
A.由物质的结构可知,该物质含有碳碳双键,能和溴水发生加成反应而褪色,A错误;
B.由物质的结构可知,该物质含有羟基,能和乙酸在浓硫酸催化下,发生酯化反应,B正确;
C.该物质中含有一个酯基,能与NaOH溶液反应,C错误;
D.手性碳原子为连接4个不同基团的碳原子,该物质中含有7个手性碳, ,D错误;
故选B。
5.“机械键”是两个或多个分子在空间上穿插互锁的一种结合形式。我国科研人员合成了由两个全苯基大环分子组
成的具有“机械键”的索烃,结构如图,下列说法错误的是
A.该索烃属于芳香烃 B.该索烃的相对分子质量可用质谱仪测定
C.该索烃的两个大环之间不存在范德华力 D.破坏该索烃中的“机械键”需要断裂共价键
【答案】C
【详解】
A.该物质是由两个全苯基大环分子组成的具有“机械键”的索烃,含有苯环,属于芳香烃,A正确;
B.质谱仪可测定相对分子质量,质谱图上最大质荷比即为相对分子质量,B正确;
C.该物质为分子晶体,分子间存在范德华力,C错误;
D.该物质含有共价键,破坏 “机械键”时需要断裂共价键,D正确;
故选C。
6.下列对物质性质的解释错误的是
选项 物质性质 解释
A 氯化钠熔点高于氯化铯 氯化钠离子键强于氯化铯
B 碘易溶于四氯化碳 碘和四氯化碳都是非极性分子
C 草酸氢钠溶液显酸性 草酸氢根离子水解程度大于电离程度
D 离子液体导电性良好 离子液体中有可移动的阴、阳离子A.A B.B C.C D.D
【答案】C
【详解】
A.氯化钠中的钠离子半径(Na+)比氯化铯中的铯离子半径(Cs+)小,离子键强度更大,因此熔点更高,解释正
确,A正确;
B.碘和四氯化碳均为非极性分子,符合“相似相溶”原理,解释正确,B正确;
C.草酸氢钠溶液显酸性是因为草酸氢根(HC O 2−)的电离程度(释放H+)大于水解程度(生成OH⁻),解释错
2 4
误,C错误;
D.离子液体的导电性源于其内部可自由移动的阴、阳离子,解释正确,D正确;
故选C。
7.下列有关反应方程式错误的是
A.泡沫灭火器反应原理:6NaHCO +Al (SO ) =3Na SO +2Al(OH) ↓+6CO ↑
3 2 4 3 2 4 3 2
B.用金属钠除去甲苯中的微量水:2Na+2H O=2NaOH+H ↑
2 2
C.用NaOH溶液吸收尾气中的NO :2NO +2OH-=NO-+NO-+H O
2 2 3 2 2
D.氯气通入冷的石灰乳中制漂白粉:Cl +2OH-=ClO-+Cl-+H O
2 2
【答案】D
【详解】
A.泡沫灭火器中Al3+与HCO −发生双水解,生成Al(OH) 和CO ,方程式配平正确,A正确;
3 3 2
B.金属钠优先与水反应生成NaOH和H ,甲苯不参与反应,方程式正确,B正确;
2
C.NO 与NaOH反应生成NO −和NO −,方程式配平及产物均正确,C正确;
2 3 2
D.石灰乳(Ca(OH) 悬浊液)不能拆为OH-,正确反应应为2Cl + 2Ca(OH) = CaCl + Ca(ClO) + 2H O,D错误;
2 2 2 2 2 2
故选D。
8.一种负热膨胀材料的立方晶胞结构如图,晶胞密度为dg⋅cm-3,阿伏加德罗常数的值为N ,下列说法错误的是
A
A.沿晶胞体对角线方向的投影图为
B.Ag和B均为sp3杂化
C.晶体中与Ag最近且距离相等的Ag有6个
D.Ag和B的最短距离为√3 × √ 3 223 ×1010pm
2 NAd
【答案】A
【详解】
A.由晶胞图可知,晶胞中Ag位于体心,B位于顶点,C、N位于体对角线上,沿晶胞体对角线方向投影,体对角
线上的原子投影到中心(重叠),其余6个顶点原子分别投影到六元环的顶点上,其他体内的C、N原子抽影响到对
应顶点原子投影与体心的连线上,则投影图为 ,A错误;
B.Ag位于体心,与周围4个N原子原键,价层电子对数为4,且与4个N原子形成正四面体,则Ag为sp3杂化;
由晶胞中成键情况知,共用顶点B原子的8个晶胞中,有4个晶胞中存在1个C原子与该B原子成键,即B原子
的价层电子对数为4,为sp3杂化,B正确;C.晶胞中Ag位于体心,与Ag最近且距离相等的Ag就是该晶胞上、下、左、右、前、后6个相邻的晶胞体心中的Ag
原子,为6个,C正确;
D.B位于顶点,其个数为8× 1 =1,Ag、C、N均位于晶胞内,个数分别为1、4、4,由晶胞密度可知晶胞参数
8
a=√ 3 108+11+12×4+14×4 ×1010pm,Ag和B的最短距离为体对角线的一半,即√3 × √ 3 223 ×1010pm,D正确;
NAd 2 NAd
故选A。
9.一种高聚物(XYZ) 被称为“无机橡胶”,可由如图所示的环状三聚体制备。X、Y和Z都是短周期元素,X、Y价
n
电子数相等,X、Z电子层数相同,基态Y的2p轨道半充满,Z的最外层只有1个未成对电子,下列说法正确的是
A.X、Z的第一电离能:X>Z B.X、Y的简单氢化物的键角:X>Y
C.最高价含氧酸的酸性:Z>X>Y D.X、Y、Z均能形成多种氧化物
【答案】D
【分析】X、Y价电子数相等,X、Y属于同一主族,且X形成5个键,Y形成3个键,基态Y的2p轨道半充满,
则X为P元素,Y为N元素,X、Z电子层数相同, Z的最外层只有1个未成对电子,Z形成1个键,Z为Cl元
素,以此分析。
【详解】
A.第一电离能同周期从左到右有增大趋势,第一电离能:Cl>P,A错误;
B.X、Y的简单氢化物分别为:PH 和NH ,电负性:N>P,共用电子对距N近,成键电子对斥力N-H大于P-H,
3 3
键角:NH >PH ,B错误;
3 3
C.元素的非金属性越强,其最高价含氧酸酸性越强,非金属性:Cl>N>P,酸性:HClO >HNO >H PO ,C错误;
4 3 3 4
D.P、N、Cl均能形成多种氧化物,D正确;
故选D。
10.下列实验方案不能得出相应结论的是
A B
结论:金属活动性顺序为Zn>Fe>Cu 结论:氧化性顺序为Cl >Fe3+>I
2 2
C D
结论:甲基使苯环活化 结论:增大反应物浓度,该反应速率加快A.A B.B C.C D.D
【答案】C
【详解】
A.Fe、Cu、稀硫酸原电池中,电子由活泼金属Fe流向Cu,Fe、Zn、硫酸原电池中,电子有Zn流向Fe,活泼性:
Zn>Fe>Cu,A正确;
B.FeCl 与淀粉KI溶液反应,溶液变蓝色,则氧化性:Fe3+>I ,新制氯水加入含KSCN的FeCl 溶液中,溶液变
3 2 2
红色,生成了Fe3+,则氧化性:Cl >Fe3+,故氧化性:Cl >Fe3+>I ,B正确;
2 2 2
C.酸性高锰酸钾分别滴入苯和甲苯中,甲苯能使酸性高锰酸钾溶液褪色,说明了苯环使甲基活化,C错误;
D.不同浓度的Na S O 与相同浓度的稀硫酸反应,浓度大的Na S O 先出现浑浊,说明增大反应物浓度,反应速
2 2 3 2 2 3
率加快,D正确;
故选C。
11.某元素的单质及其化合物的转化关系如图。常温常压下G、J均为无色气体,J具有漂白性。阿伏加德罗常数的
值为N 。下列说法错误的是
A
A.G、K均能与NaOH溶液反应 B.H、N既具有氧化性也具有还原性
C.M和N溶液中的离子种类相同 D.1molG与足量的J反应,转移电子数为N
A
【答案】D
【分析】
根据转化关系: ,常温常压下G、J均为无色气体,J具有漂白
性,J为SO ,K为SO ,G为H S,H为S,M为NaHSO ,N为Na SO ,L为Na SO 。
2 3 2 3 2 3 2 4
【详解】
A.H S和SO 均能与NaOH溶液反应,A正确;
2 3
B.S和Na SO 中S的化合价处于S的中间价态,既具有氧化性又有还原性,B正确;
2 3
C.M为NaHSO ,N为Na SO ,二者的溶液中离子种类相同,C正确;
3 2 3
D.1mol H S和足量的SO 反应生成S单质和水,2H S+SO =3S↓+2H O,1mol H S参加反应,转移2mol电子,转
2 2 2 2 2 2
移2N 个电子,D错误;
A
故选D。
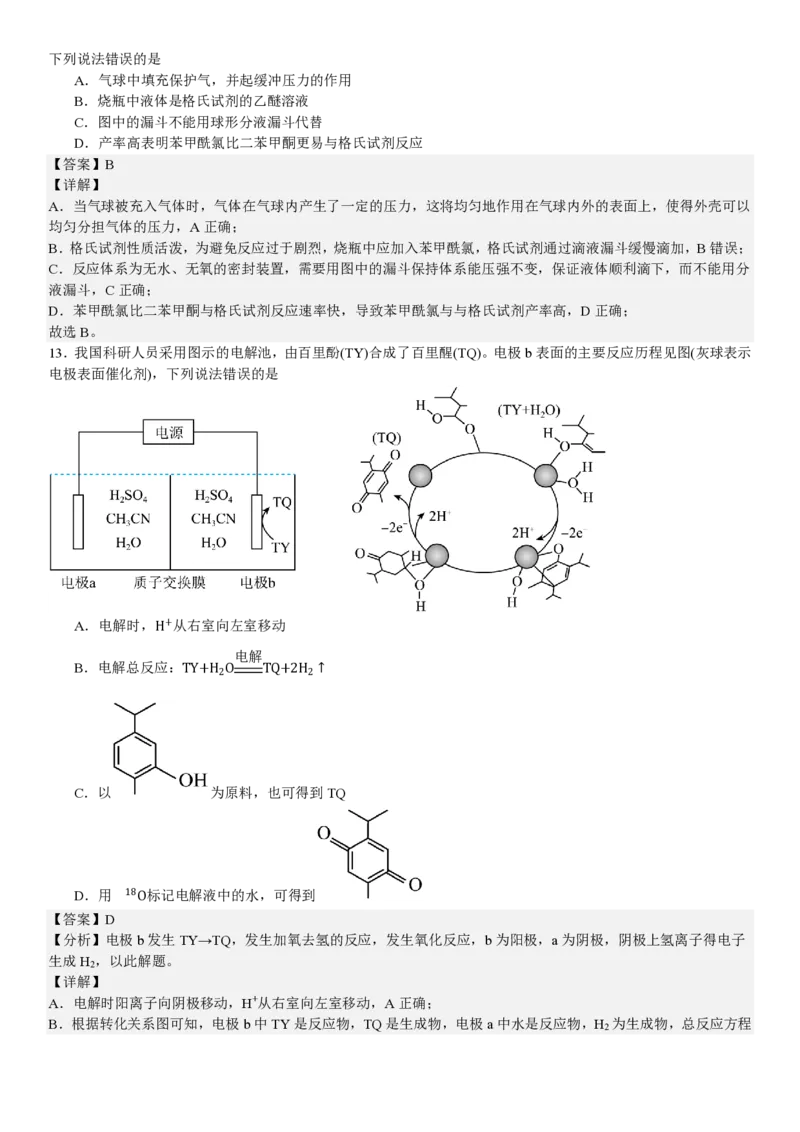
12.格氏试剂性质活泼,可与空气中的H O和O 等反应。某兴趣小组搭建了图示无水无氧装置(部分装置略),以乙
2 2
醚(沸点34.5°C)为溶剂,利用下述反应高产率地制备二苯甲酮。下列说法错误的是
A.气球中填充保护气,并起缓冲压力的作用
B.烧瓶中液体是格氏试剂的乙醚溶液
C.图中的漏斗不能用球形分液漏斗代替
D.产率高表明苯甲酰氯比二苯甲酮更易与格氏试剂反应
【答案】B
【详解】
A.当气球被充入气体时,气体在气球内产生了一定的压力,这将均匀地作用在气球内外的表面上,使得外壳可以
均匀分担气体的压力,A正确;
B.格氏试剂性质活泼,为避免反应过于剧烈,烧瓶中应加入苯甲酰氯,格氏试剂通过滴液漏斗缓慢滴加,B错误;
C.反应体系为无水、无氧的密封装置,需要用图中的漏斗保持体系能压强不变,保证液体顺利滴下,而不能用分
液漏斗,C正确;
D.苯甲酰氯比二苯甲酮与格氏试剂反应速率快,导致苯甲酰氯与与格氏试剂产率高,D正确;
故选B。
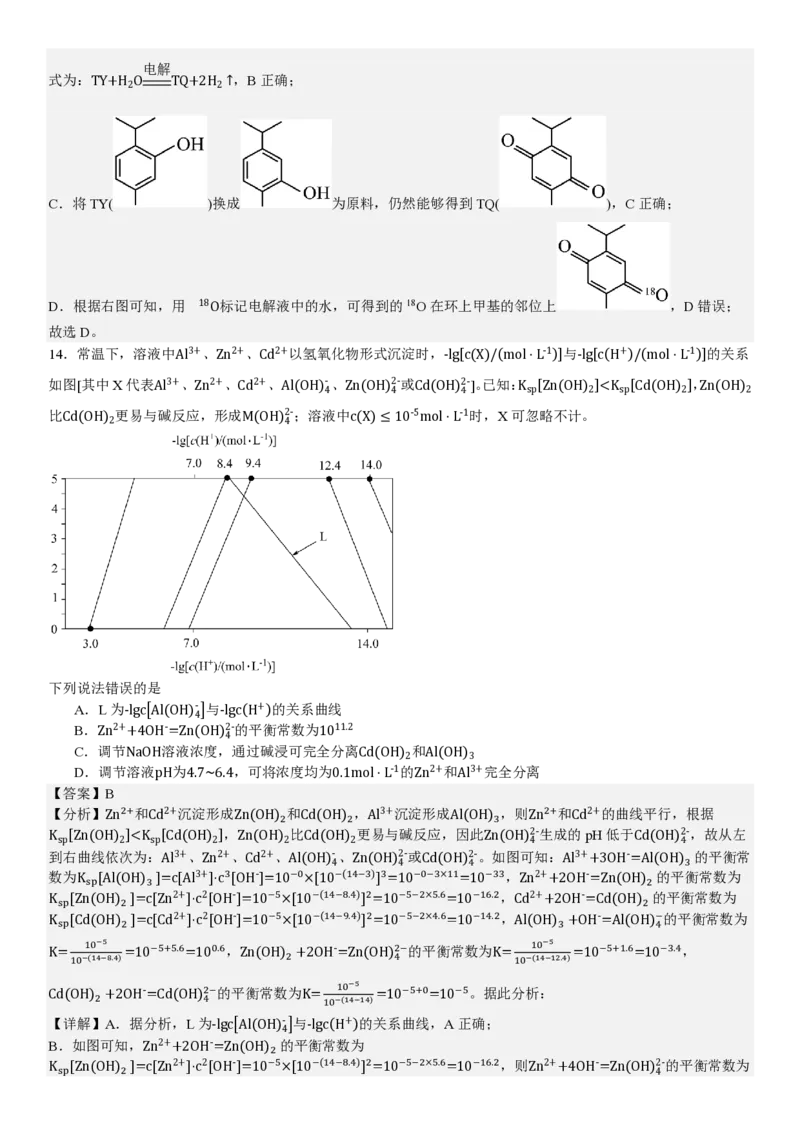
13.我国科研人员采用图示的电解池,由百里酚(TY)合成了百里醒(TQ)。电极b表面的主要反应历程见图(灰球表示
电极表面催化剂),下列说法错误的是
A.电解时,H+从右室向左室移动
电解
B.电解总反应:TY+H O TQ+2H ↑
2 2
C.以 为原料,也可得到TQ
D.用 18O标记电解液中的水,可得到
【答案】D
【分析】电极b发生TY→TQ,发生加氧去氢的反应,发生氧化反应,b为阳极,a为阴极,阴极上氢离子得电子
生成H ,以此解题。
2
【详解】
A.电解时阳离子向阴极移动,H+从右室向左室移动,A正确;
B.根据转化关系图可知,电极b中TY是反应物,TQ是生成物,电极a中水是反应物,H 为生成物,总反应方程
2电解
式为:TY+H O TQ+2H ↑,B正确;
2 2
C.将TY( )换成 为原料,仍然能够得到TQ( ),C正确;
D.根据右图可知,用 18O标记电解液中的水,可得到的18O在环上甲基的邻位上 ,D错误;
故选D。
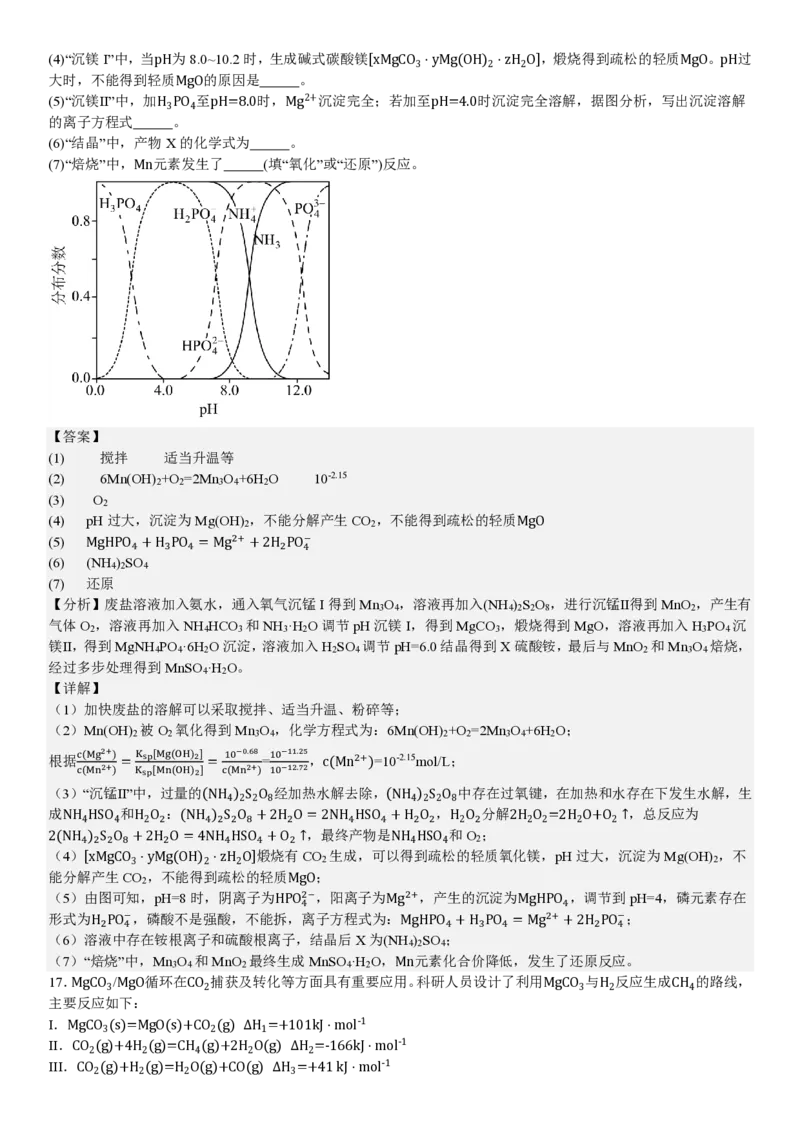
14.常温下,溶液中Al3+、Zn2+、Cd2+以氢氧化物形式沉淀时,-lg[c(X)/(mol⋅L-1)]与-lg[c(H+)/(mol⋅L-1)]的关系
如图[其中X代表Al3+、Zn2+、Cd2+、Al(OH)-、Zn(OH)2-或Cd(OH)2-]。已知:K [Zn(OH) ]1mol/L,即可
2 3 4
认为Al(OH) 完全溶解,并转化为Al(OH)-,因此调节NaOH溶液浓度,通过碱浸可完全分离Cd(OH) 和Al(OH) ,C
3 4 2 3
正确;
D.0.1mol⋅L-1的Zn2+开始沉淀pH为14+lg(√ 10−16.2 )=6.4,0.1mol⋅L-1的Al3+完全沉淀pH为14+lg( 3 √ 10−33 )=4.7,
0.1 10−5
因此调节溶液pH为4.7~6.4,可将浓度均为0.1mol⋅L-1的Zn2+和Al3+完全分离,D正确;
故选B。
二、解答题
15.某实验室制备糖精钴[Co(Sac) (H O) ]⋅xH O,并测定其结晶水含量。
2 2 4 2
已知:Sac-表示糖精根离子,其摩尔质量为182g⋅mol-1,糖精钴的溶解度在热水中较大,在冷水中较小;丙酮沸点
为56°C,与水互溶。
CoCl ⋅6H O+2NaSac⋅2H O=[Co(Sac) (H O) ]⋅xH O+(6-x)H O+2NaCl
2 2 2 2 2 4 2 2
(一)制备
I.称取1.0g CoCl ⋅6H O,加入18mL蒸馏水,搅拌溶解,得溶液1。
2 2
Ⅱ.称取2.6g(稍过量)糖精钠(NaSac⋅2H O),加入10mL蒸馏水,加热搅拌,得溶液2。
2
Ⅲ.将溶液2加入到接近沸腾的溶液1中,反应3分钟后停止加热,静置,冷却结晶。
Ⅳ.过滤,依次用三种不同试剂洗涤晶体,晾干得产品。
回答下列问题:
(1)I和Ⅱ中除烧杯外,还需用到的玻璃仪器有 、 (写出两种)
(2)Ⅲ中静置过程有少量晶体出现时,可将烧杯置于 中,以使大量晶体析出。
(3)Ⅳ中用①丙酮、②冷水、③冷的1% NaSac溶液洗涤晶体,正确顺序为 。
A.①③② B.③②① C.②①③
(4)Ⅳ中为了确认氯离子己经洗净,取水洗时的最后一次滤液于试管中, (将实验操作、现象和结论补充完整)。
(5)与本实验安全注意事项有关的图标有 。
(二)结晶水含量测定
EDTA和Co2+形成1:1配合物。准确称取m g糖精钴产品于锥形瓶中,加蒸馏水,加热溶解,再加入缓冲溶液和指示
剂,在50~60℃下,用c mol⋅L-1的EDTA标准溶液滴定。
(6)下列操作的正确顺序为 (用字母排序)。
a.用标准溶液润洗滴定管 b.加入标准溶液至“0”刻度以上2~3mL处
c.检查滴定管是否漏水并清洗 d.赶出气泡,调节液面,准确记录读数
(7)滴定终点时消耗标准溶液V mL,则产品[Co(Sac) (H O) ]⋅xH O中x的测定值为 (用含m、c、V的代数式
2 2 4 2
表示);若滴定前滴定管尖嘴处无气泡,滴定后有气泡,会导致x的测定值 (填“偏高”“偏低”或“无影响”)。
【答案】
(1) 玻璃棒 量筒(或胶头滴管等,合理即可)
(2) 冰水浴
(3) B
(4) 加稀硝酸酸化,再滴加AgNO 溶液,无白色沉淀生成,说明Cl-已洗净
3
(5) ABC(6) cabd
(7) 500m −27.5(或:m−cV×10−3×495) 偏高
9cV 18×cV×10−3
【分析】按照反应CoCl ⋅6H O+2NaSac⋅2H O=[Co(Sac) (H O) ]⋅xH O+(6-x)H O+2NaCl制备糖精钴,然后在冰
2 2 2 2 2 4 2 2
水浴中结晶,再按照“冷的1% NaSac溶液、冷水、丙酮”顺序进行洗涤,得到糖精钴晶体,最后将糖精钴晶体溶解
后用EDTA标准溶液滴定测定含有结晶水的数量。
【详解】
(1)步骤I、Ⅱ中需要使用量筒、胶头滴管量取蒸馏水,并用玻璃棒搅拌以加快固体溶解速率。
(2)因为糖精钴在冷水中溶解度较小,所以为了尽快让大量晶体析出,应降低溶液温度,可将烧杯置于冰水浴中。
(3)先用冷的1% NaSac溶液洗涤,可降低糖精钴溶解度,减少晶体损失,还能将晶体表面吸附的Co2+转化为晶体
析出,且不引人新的杂质,再用冷水洗涤,可降低晶体溶解度并洗去溶液中存在的可溶性离子,丙酮可以与水互溶
且沸点比关键水的低,故最后用丙酮洗涤以除去残留的水且能使晶体快速干燥,故选B。
(4)Ⅳ中为了确认氯离子己经洗净的步骤为:取水洗时的最后一次滤液于试管中,加稀硝酸酸化,再滴加AgNO
3
溶液,无白色沉淀生成,说明Cl-已洗净。
(5)进行化学实验需要佩戴护目镜,以保护眼睛,同时化学实验结束后,离开实验室前需用肥皂等清洗双手,该
实验涉及加热操作,因此需要防止热烫,要选择合适的工具进行操作,避免直接触碰,故A、B、C符合题意;该
实验中未涉及锐器的操作,D不符合题意,故选ABC。
(6)使用滴定管前首先要检漏,确定不漏液之后用蒸馏水清洗(c),再用待装的标准溶液进行润洗(a),待润洗完成
后 装入标准溶液至“0”刻度以上2~3 mL处(b),放液赶出气泡后调节液面至“0”刻度或“0”刻度下,准确记录标准溶
液体积的初始读数(d),故选cabd。
(7)滴定消耗的n(EDTA)= cV mol,EDTA与Co2+形成1:1配合物,则样品溶解后的n(Co2+)= cV mol,即样
1000 1000
品中的n{[Co(Sac) (H O) ]·xH O}= cV mol,而M{[Co(Sac) (H O) ]·xH O}=(495+18x)g·mol−1,所以
2 2 4 2 2 2 4 2
1000
cV mol×(495+18x)g·mol−1 =mg,解得x= 1000m − 495 = 500m −27.5(或= 1000m−495cV = m−495cV×10−3 );若滴
1000 18cV 18 9cV 18cV 18cV×10−3
定前滴定管尖嘴处无气泡,滴定后有气泡,测得消耗EDTA溶液体积偏小,即V偏小,根据x= 500m −27.5,则x
9cV
偏高。
16.一种综合回收电解锰工业废盐(主要成分为Mn2+、Mg2+、NH+的硫酸盐)的工艺流程如下。
4
已知:①常温下K (MgCO )=10-5.17,K [Mg(OH) ]=10-11.25,K [Mn(OH) ]=10-12.72;
sp 3 sp 2 sp 2
②S O2-结构式为 。
2 8
回答下列问题:
(1)制备废盐溶液时,为加快废盐溶解,可采取的措施有 、 。(写出两种)
(2)“沉锰I”中,写出形成的Mn(OH) 被氧化成Mn O 的化学方程式 。当Mg2+(c=10-0.68mol⋅L-1)将要开始沉淀
2 3 4
时,溶液中剩余Mn2+浓度为 mol⋅L-1。
(3)“沉锰Ⅱ”中,过量的(NH ) S O 经加热水解去除,最终产物是NH HSO 和 (填化学式)。
4 2 2 8 4 4(4)“沉镁I”中,当pH为8.0~10.2时,生成碱式碳酸镁[xMgCO ⋅yMg(OH) ⋅zH O],煅烧得到疏松的轻质MgO。pH过
3 2 2
大时,不能得到轻质MgO的原因是 。
(5)“沉镁Ⅱ”中,加H PO 至pH=8.0时,Mg2+沉淀完全;若加至pH=4.0时沉淀完全溶解,据图分析,写出沉淀溶解
3 4
的离子方程式 。
(6)“结晶”中,产物X的化学式为 。
(7)“焙烧”中,Mn元素发生了 (填“氧化”或“还原”)反应。
【答案】
(1) 搅拌 适当升温等
(2) 6Mn(OH) +O =2Mn O +6H O 10-2.15
2 2 3 4 2
(3) O
2
(4) pH过大,沉淀为Mg(OH) ,不能分解产生CO ,不能得到疏松的轻质MgO
2 2
(5) MgHPO +H PO =Mg2++2H PO−
4 3 4 2 4
(6) (NH ) SO
4 2 4
(7) 还原
【分析】废盐溶液加入氨水,通入氧气沉锰I得到Mn O ,溶液再加入(NH ) S O ,进行沉锰Ⅱ得到MnO ,产生有
3 4 4 2 2 8 2
气体O ,溶液再加入NH HCO 和NH ·H O调节pH沉镁I,得到MgCO ,煅烧得到MgO,溶液再加入H PO 沉
2 4 3 3 2 3 3 4
镁Ⅱ,得到MgNH PO ·6H O沉淀,溶液加入H SO 调节pH=6.0结晶得到X硫酸铵,最后与MnO 和Mn O 焙烧,
4 4 2 2 4 2 3 4
经过多步处理得到MnSO ·H O。
4 2
【详解】
(1)加快废盐的溶解可以采取搅拌、适当升温、粉碎等;
(2)Mn(OH) 被O 氧化得到Mn O ,化学方程式为:6Mn(OH) +O =2Mn O +6H O;
2 2 3 4 2 2 3 4 2
根据c(Mg2+) = Ksp[Mg(OH)2] = 10−0.68 = 10−11.25 ,c(Mn2+)=10-2.15mol/L;
c(Mn2+) Ksp[Mn(OH)2] c(Mn2+) 10−12.72
(3)“沉锰Ⅱ”中,过量的(NH ) S O 经加热水解去除,(NH ) S O 中存在过氧键,在加热和水存在下发生水解,生
4 2 2 8 4 2 2 8
成NH HSO 和H O :(NH ) S O +2H O=2NH HSO +H O ,H O 分解2H O =2H O+O ↑,总反应为
4 4 2 2 4 2 2 8 2 4 4 2 2 2 2 2 2 2 2
2(NH ) S O +2H O=4NH HSO +O ↑,最终产物是NH HSO 和O ;
4 2 2 8 2 4 4 2 4 4 2
(4)[xMgCO ⋅yMg(OH) ⋅zH O]煅烧有CO 生成,可以得到疏松的轻质氧化镁,pH过大,沉淀为Mg(OH) ,不
3 2 2 2 2
能分解产生CO ,不能得到疏松的轻质MgO;
2
(5)由图可知,pH=8时,阴离子为HPO2−,阳离子为Mg2+,产生的沉淀为MgHPO ,调节到pH=4,磷元素存在
4 4
形式为H PO−,磷酸不是强酸,不能拆,离子方程式为:MgHPO +H PO =Mg2++2H PO−;
2 4 4 3 4 2 4
(6)溶液中存在铵根离子和硫酸根离子,结晶后X为(NH ) SO ;
4 2 4
(7)“焙烧”中,Mn O 和MnO 最终生成MnSO ·H O,Mn元素化合价降低,发生了还原反应。
3 4 2 4 2
17.MgCO /MgO循环在CO 捕获及转化等方面具有重要应用。科研人员设计了利用MgCO 与H 反应生成CH 的路线,
3 2 3 2 4
主要反应如下:
I.MgCO (s)=MgO(s)+CO (g) ΔH =+101kJ⋅mol-1
3 2 1
II.CO (g)+4H (g)=CH (g)+2H O(g) ΔH =-166kJ⋅mol-1
2 2 4 2 2
III.CO (g)+H (g)=H O(g)+CO(g) ΔH =+41 kJ⋅mol-1
2 2 2 3回答下列问题,
(1)计算MgCO (s)+4H (g)=MgO(s)+2H O(g)+CH (g) ΔH = kJ⋅mol-1。
3 2 2 4 4
(2)提高CH 平衡产率的条件是_______。
4
A.高温高压 B.低温高压 C.高温低压 D.低温低压
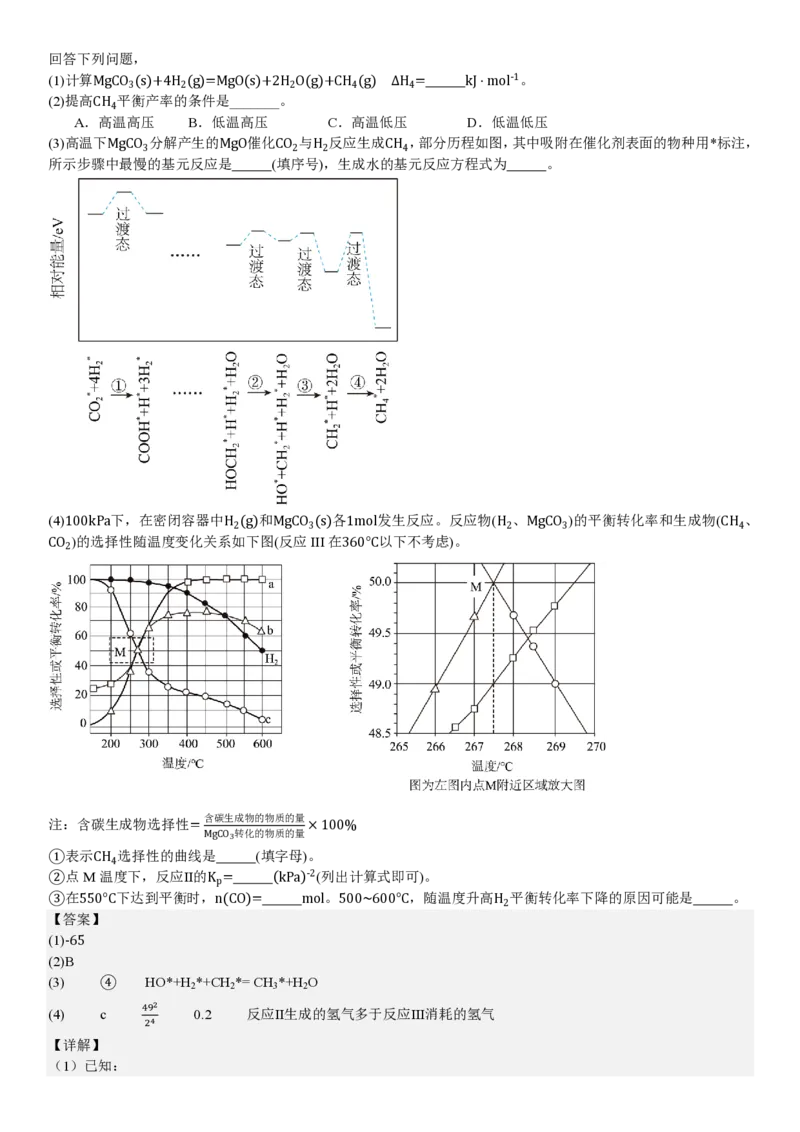
(3)高温下MgCO 分解产生的MgO催化CO 与H 反应生成CH ,部分历程如图,其中吸附在催化剂表面的物种用*标注,
3 2 2 4
所示步骤中最慢的基元反应是 (填序号),生成水的基元反应方程式为 。
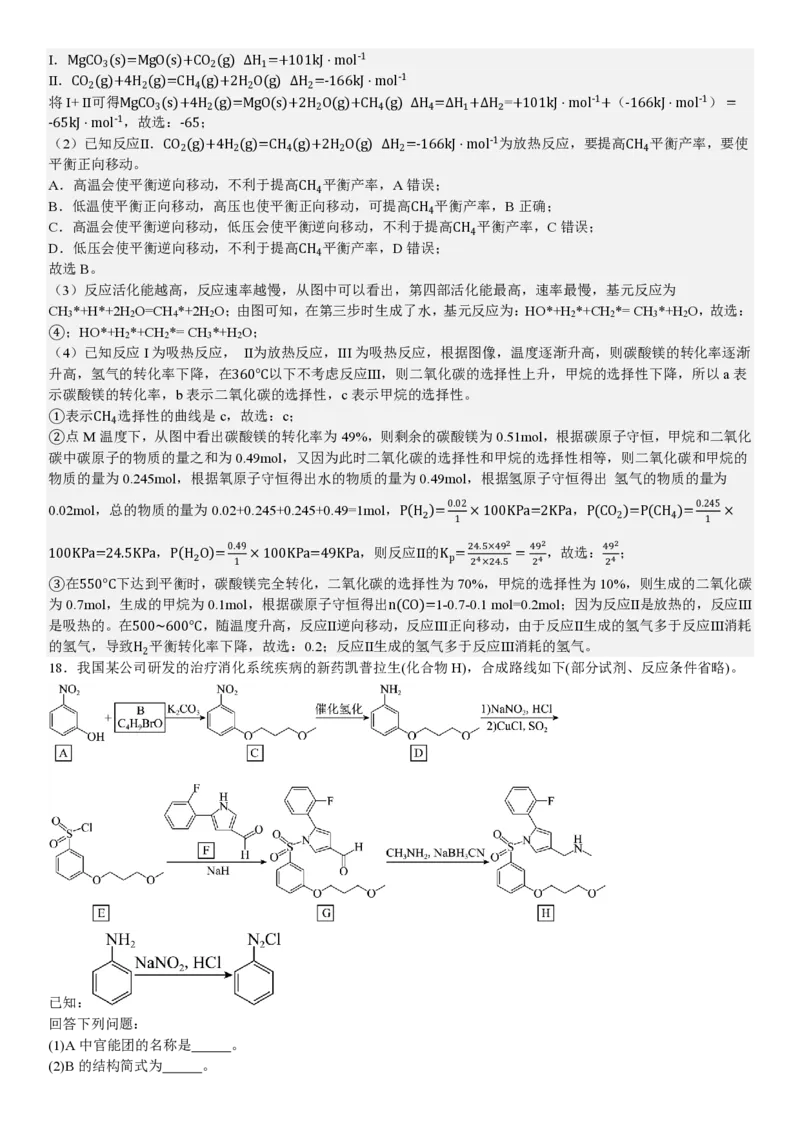
(4)100kPa下,在密闭容器中H (g)和MgCO (s)各1mol发生反应。反应物(H 、MgCO )的平衡转化率和生成物(CH 、
2 3 2 3 4
CO )的选择性随温度变化关系如下图(反应III在360°C以下不考虑)。
2
含碳生成物的物质的量
注:含碳生成物选择性= ×100%
MgCO3 转化的物质的量
①表示CH 选择性的曲线是 (填字母)。
4
②点M温度下,反应Ⅱ的K = (kPa)-2(列出计算式即可)。
p
③在550°C下达到平衡时,n(CO)= mol。500~600°C,随温度升高H 平衡转化率下降的原因可能是 。
2
【答案】
(1)-65
(2)B
(3) ④ HO*+H *+CH *= CH *+H O
2 2 3 2
(4) c
492
0.2 反应Ⅱ生成的氢气多于反应Ⅲ消耗的氢气
24
【详解】
(1)已知:I.MgCO (s)=MgO(s)+CO (g) ΔH =+101kJ⋅mol-1
3 2 1
Ⅱ.CO (g)+4H (g)=CH (g)+2H O(g) ΔH =-166kJ⋅mol-1
2 2 4 2 2
将I+ Ⅱ可得MgCO (s)+4H (g)=MgO(s)+2H O(g)+CH (g) ΔH =ΔH +ΔH =+101kJ⋅mol-1+(-166kJ⋅mol-1)=
3 2 2 4 4 1 2
-65kJ⋅mol-1,故选:-65;
(2)已知反应Ⅱ.CO (g)+4H (g)=CH (g)+2H O(g) ΔH =-166kJ⋅mol-1为放热反应,要提高CH 平衡产率,要使
2 2 4 2 2 4
平衡正向移动。
A.高温会使平衡逆向移动,不利于提高CH 平衡产率,A错误;
4
B.低温使平衡正向移动,高压也使平衡正向移动,可提高CH 平衡产率,B正确;
4
C.高温会使平衡逆向移动,低压会使平衡逆向移动,不利于提高CH 平衡产率,C错误;
4
D.低压会使平衡逆向移动,不利于提高CH 平衡产率,D错误;
4
故选B。
(3)反应活化能越高,反应速率越慢,从图中可以看出,第四部活化能最高,速率最慢,基元反应为
CH *+H*+2H O=CH *+2H O;由图可知,在第三步时生成了水,基元反应为:HO*+H *+CH *= CH *+H O,故选:
3 2 4 2 2 2 3 2
④;HO*+H *+CH *= CH *+H O;
2 2 3 2
(4)已知反应I为吸热反应, Ⅱ为放热反应,III为吸热反应,根据图像,温度逐渐升高,则碳酸镁的转化率逐渐
升高,氢气的转化率下降,在360°C以下不考虑反应Ⅲ,则二氧化碳的选择性上升,甲烷的选择性下降,所以a表
示碳酸镁的转化率,b表示二氧化碳的选择性,c表示甲烷的选择性。
①表示CH 选择性的曲线是c,故选:c;
4
②点M温度下,从图中看出碳酸镁的转化率为49%,则剩余的碳酸镁为0.51mol,根据碳原子守恒,甲烷和二氧化
碳中碳原子的物质的量之和为0.49mol,又因为此时二氧化碳的选择性和甲烷的选择性相等,则二氧化碳和甲烷的
物质的量为0.245mol,根据氧原子守恒得出水的物质的量为0.49mol,根据氢原子守恒得出 氢气的物质的量为
0.02mol,总的物质的量为0.02+0.245+0.245+0.49=1mol,P(H )= 0.02 ×100KPa=2KPa,P(CO )=P(CH )= 0.245 ×
2 2 4
1 1
100KPa=24.5KPa,P(H O)= 0.49 ×100KPa=49KPa,则反应Ⅱ的K = 24.5×492 = 492 ,故选:492 ;
2 1 p 24×24.5 24 24
③在550°C下达到平衡时,碳酸镁完全转化,二氧化碳的选择性为70%,甲烷的选择性为10%,则生成的二氧化碳
为0.7mol,生成的甲烷为0.1mol,根据碳原子守恒得出n(CO)=1-0.7-0.1 mol=0.2mol;因为反应Ⅱ是放热的,反应Ⅲ
是吸热的。在500~600°C,随温度升高,反应Ⅱ逆向移动,反应Ⅲ正向移动,由于反应Ⅱ生成的氢气多于反应Ⅲ消耗
的氢气,导致H 平衡转化率下降,故选:0.2;反应Ⅱ生成的氢气多于反应Ⅲ消耗的氢气。
2
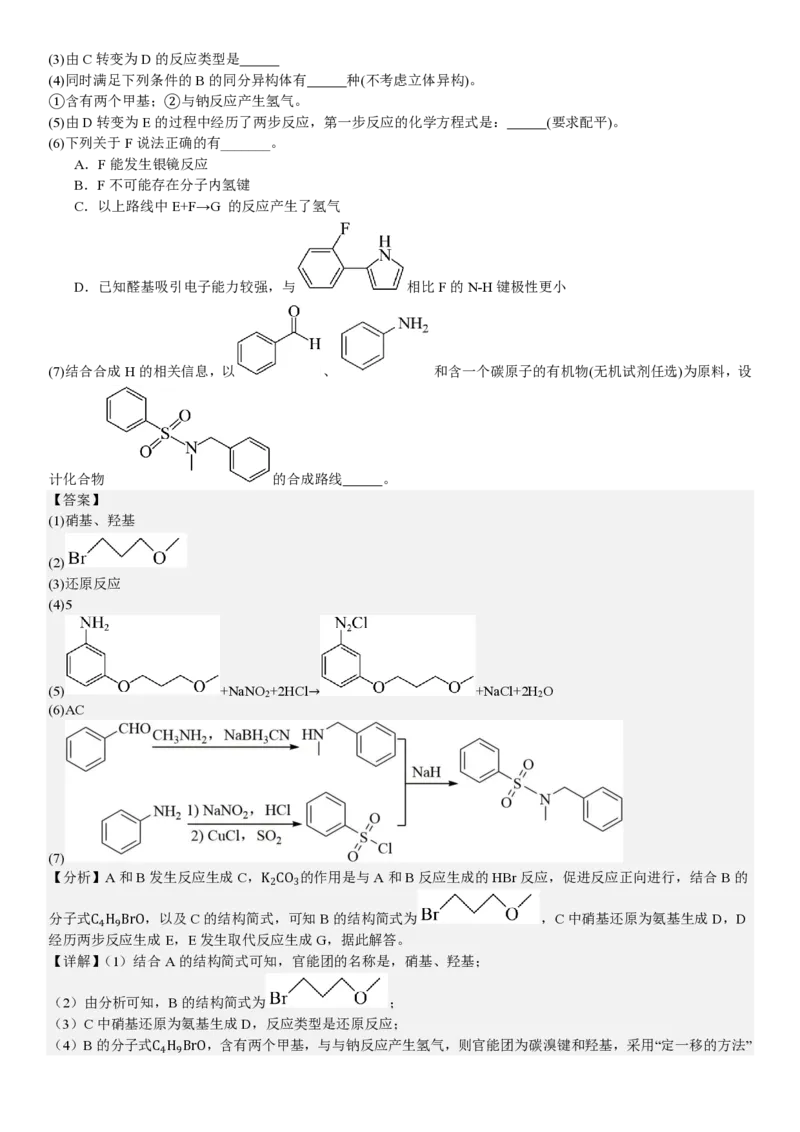
18.我国某公司研发的治疗消化系统疾病的新药凯普拉生(化合物H),合成路线如下(部分试剂、反应条件省略)。
已知:
回答下列问题:
(1)A中官能团的名称是 。
(2)B的结构简式为 。(3)由C转变为D的反应类型是
(4)同时满足下列条件的B的同分异构体有 种(不考虑立体异构)。
①含有两个甲基;②与钠反应产生氢气。
(5)由D转变为E的过程中经历了两步反应,第一步反应的化学方程式是: (要求配平)。
(6)下列关于F说法正确的有_______。
A.F能发生银镜反应
B.F不可能存在分子内氢键
C.以上路线中E+F→G 的反应产生了氢气
D.已知醛基吸引电子能力较强,与 相比F的N-H键极性更小
(7)结合合成H的相关信息,以 、 和含一个碳原子的有机物(无机试剂任选)为原料,设
计化合物 的合成路线 。
【答案】
(1)硝基、羟基
(2)
(3)还原反应
(4)5
(5) +NaNO +2HCl→ +NaCl+2H O
2 2
(6)AC
(7)
【分析】A和B发生反应生成C,K CO 的作用是与A和B反应生成的HBr反应,促进反应正向进行,结合B的
2 3
分子式C H BrO,以及C的结构简式,可知B的结构简式为 ,C中硝基还原为氨基生成D,D
4 9
经历两步反应生成E,E发生取代反应生成G,据此解答。
【详解】(1)结合A的结构简式可知,官能团的名称是,硝基、羟基;
(2)由分析可知,B的结构简式为 ;
(3)C中硝基还原为氨基生成D,反应类型是还原反应;
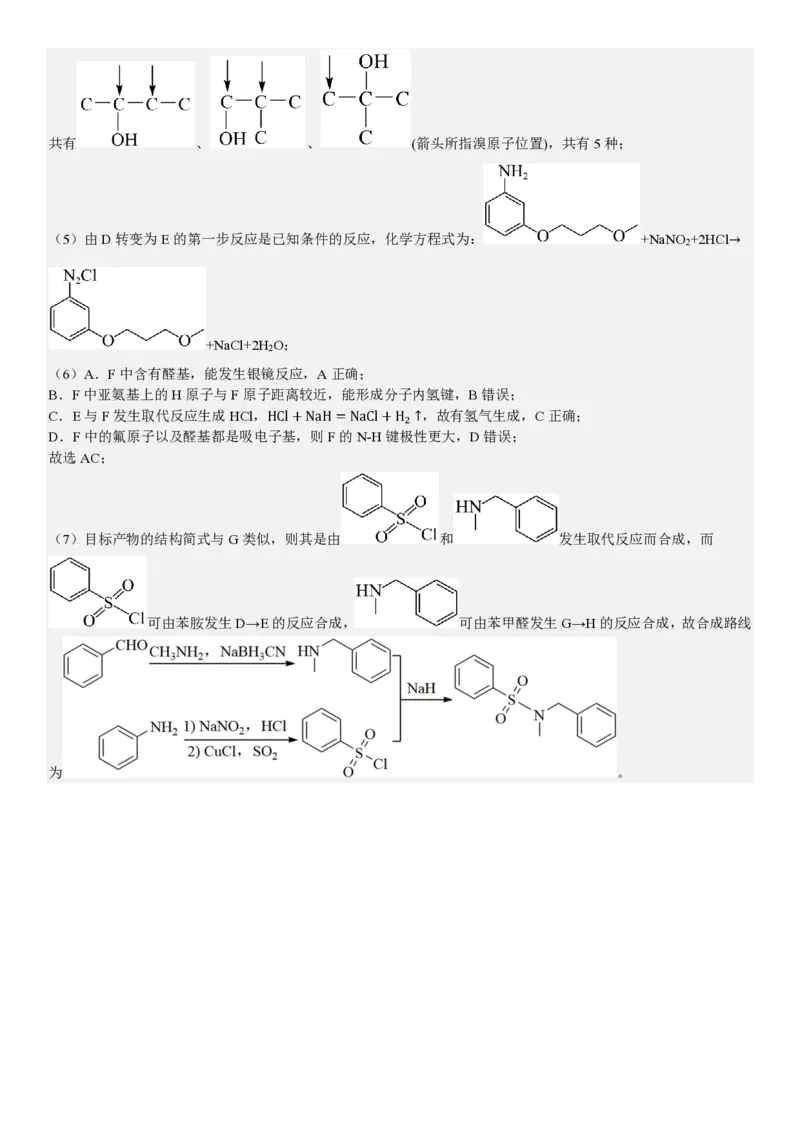
(4)B的分子式C H BrO,含有两个甲基,与与钠反应产生氢气,则官能团为碳溴键和羟基,采用“定一移的方法”
4 9共有 、 、 (箭头所指溴原子位置),共有5种;
(5)由D转变为E的第一步反应是已知条件的反应,化学方程式为: +NaNO +2HCl→
2
+NaCl+2H O;
2
(6)A.F中含有醛基,能发生银镜反应,A正确;
B.F中亚氨基上的H原子与F原子距离较近,能形成分子内氢键,B错误;
C.E与F发生取代反应生成HCl,HCl+NaH=NaCl+H ↑,故有氢气生成,C正确;
2
D.F中的氟原子以及醛基都是吸电子基,则F的N-H键极性更大,D错误;
故选AC;
(7)目标产物的结构简式与G类似,则其是由 和 发生取代反应而合成,而
可由苯胺发生D→E的反应合成, 可由苯甲醛发生G→H的反应合成,故合成路线
为 。