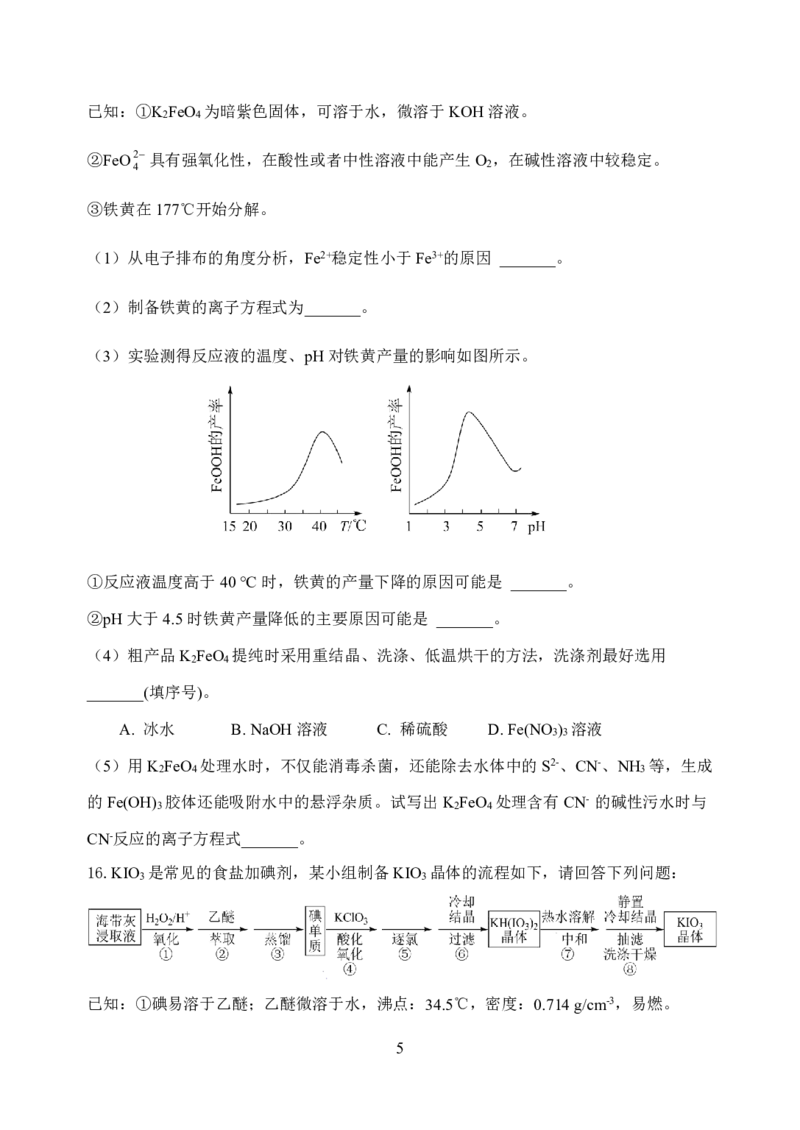文档内容
2023-2024 学年第一学期联盟校第一次学情调研检测
高三年级化学试题
命题人:潘小军 做题人、审题人:陶家骅
(总分 100分,考试时间 75分钟)
注意事项:
1.本试卷中所有试题必须作答在答题纸上规定的位置,否则不给分.
2.答题前,务必将自己的姓名、准考证号用0.5毫米黑色墨水签字笔填写在试卷及
答题纸上.
3.作答非选择题时必须用黑色字迹0.5毫米签字笔书写在答题纸的指定位置上,作答
选择题必须用2B铅笔在答题纸上将对应题目的选项涂黑。如需改动,请用橡皮擦
干净后,再选涂其它答案,请保持答题纸清洁,不折叠、不破损。
可能用到的相对原子质量:H 1 O 16 K 39 I 127
第 I 卷(选择题 共 42 分)
一、单项选择题:(本大题共14个小题,每小题3分,共42分.在每小题给出的四个选
项中,只有一项符合题目要求,请在答题纸的指定位置填涂答案选项.)
1. 科技改变生活。下列说法错误的是
A. 北京冬奥会火炬“飞扬”的外壳由碳纤维复合材料制成,具有“轻、固、美”的特点
B. 北京冬奥会的志愿者服装添加石墨烯是为了提高硬度
C.“雷霆之星”速滑服采用银离子抗菌技术,可有效防护细菌侵入
D.2022年4月16日神舟十三号返回舱成功着陆,使用的降落伞是用特殊的纺织材料做成
的,具有质轻、耐撕扯、耐高温的特性
2.Ca(OH) 与NH Cl反应生成CaCl 、NH 和H O。下列说法错误的是
2 4 2 3 2
A.CaCl 为离子化合物 B.Ca(OH) 中既含离子键又含共价键
2 2
C.NH Cl中N原子的杂化方式为sp3 D.NH 的空间构型为平面三角形
4 3
3. 明矾[KAl(SO ) •12H O]可用于净水。下列说法正确的是
4 2 2
A. 半径大小:r(K+)Br >I
2 2 2
粉KI溶液,溶液变蓝色
向盛有FeSO 溶液的试管中滴加几滴 KSCN溶液,振
4
D Fe2+具有还原性
荡,再滴加几滴新制氯水,观察溶液颜色变化
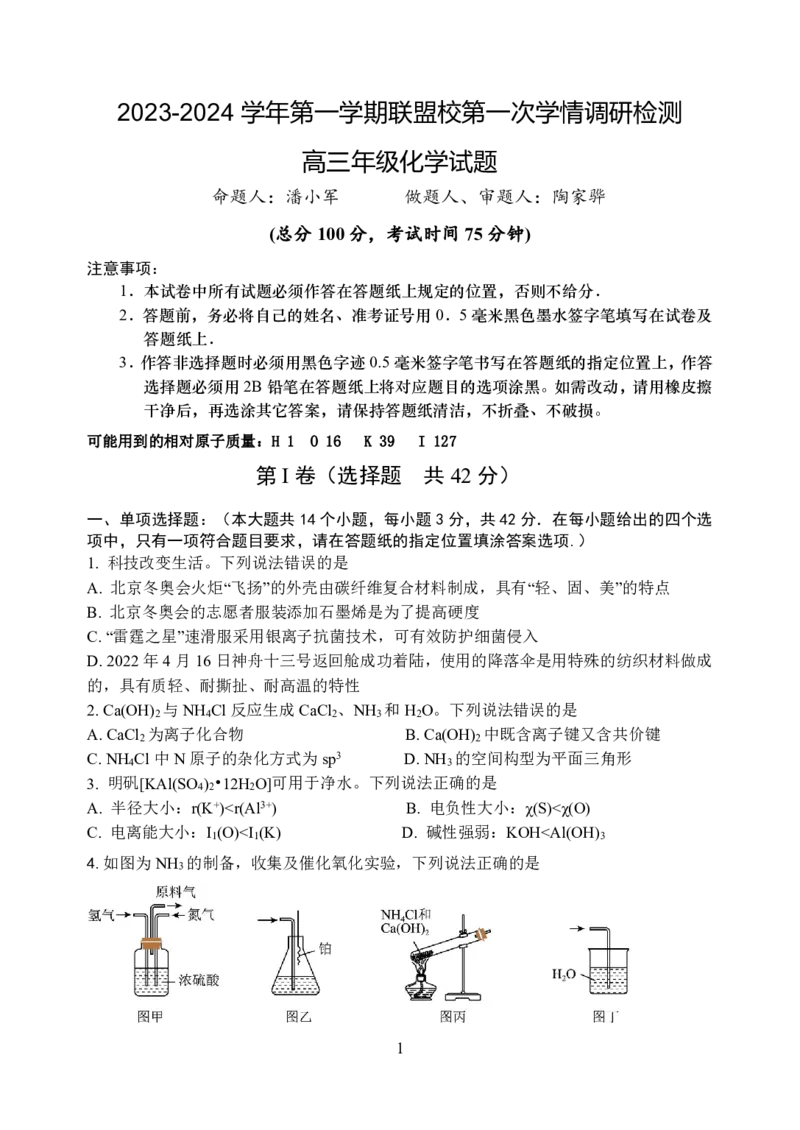
14.为探究某些硫的含氧酸盐的部分性质,进行如下实验,并记录实验现象。
①测量0.01mol·L-1NaHSO 溶液的pH,pH约为5;
3
②向0.01mol·L-1NaHSO 溶液中滴加少量酸性KMnO 溶液,KMnO 溶液的紫红色褪去;
3 4 4
③向0.1mol·L-1Na S O 溶液中滴加稀盐酸,产生无色有刺激性气味的气体,且出现淡黄
2 2 3
色沉淀,经测定溶液中无SO 2-;
4
④在Ag+催化下,向0.1mol·L-1Na S O 无色溶液中滴加MnSO 溶液,溶液中出现紫红色。
2 2 8 4
由上述实验现象能得出的结论是
A.实验①说明:K (H SO )·K (H SO )>K
a1 2 3 a2 2 3 w
B.实验②中发生反应:3HSO 3 -+2MnO 4 -+OH- === 3SO 4 2-+2MnO 2 ↓+2H 2 O
C.实验③中的淡黄色沉淀为S,无色有刺激性气味的气体为H S
2
D.实验④说明:该条件下,MnO -的氧化性强于S O 2-
4 2 8
第 II 卷(非选择题 共 58 分)
二、非选择题:(本大题共4小题,共58分)
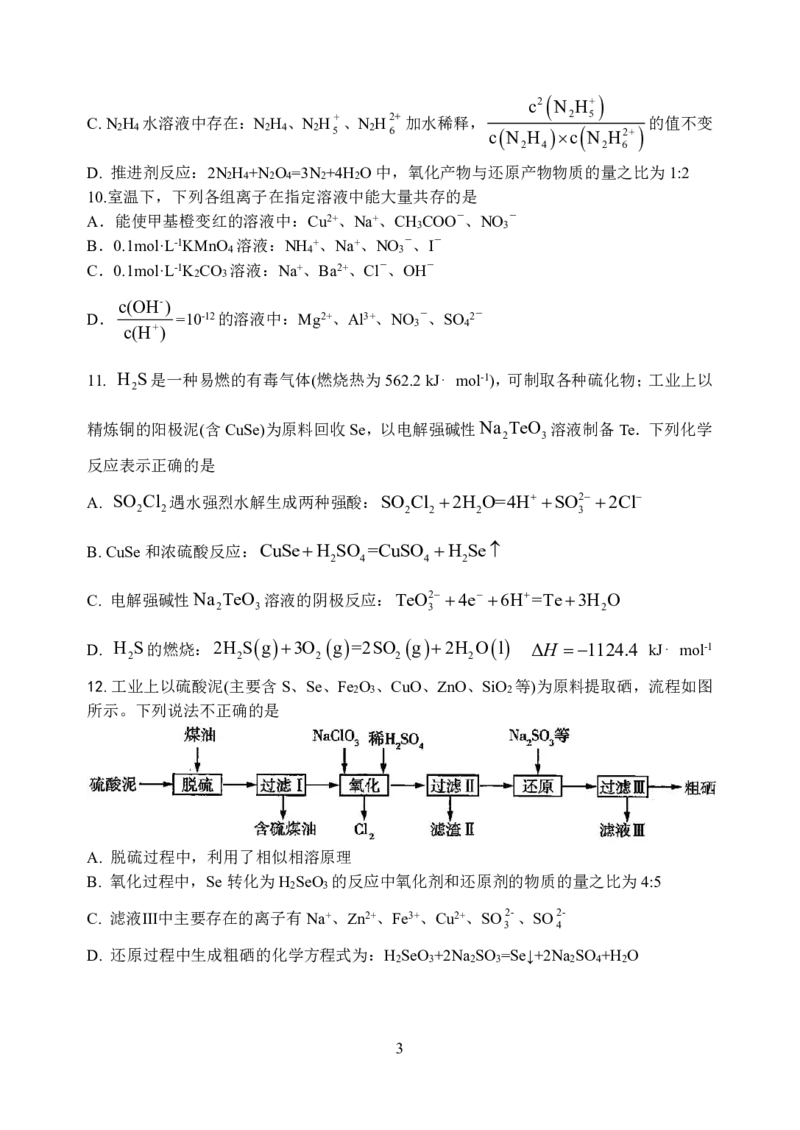
15.工业上,以钛白副产品硫酸亚铁制备的铁黄(FeOOH)代替硝酸铁等可溶性铁盐制备高铁
酸钾,可降低生产工艺成本且产品质量好。工艺流程如图所示:
4
{#{QQABBYyEggggABAAAAgCAw2gCAOQkBEACAoGwAAMMAIBwAFABAA=}#}已知:①K FeO 为暗紫色固体,可溶于水,微溶于KOH溶液。
2 4
②FeO 2具有强氧化性,在酸性或者中性溶液中能产生O ,在碱性溶液中较稳定。
4 2
③铁黄在177℃开始分解。
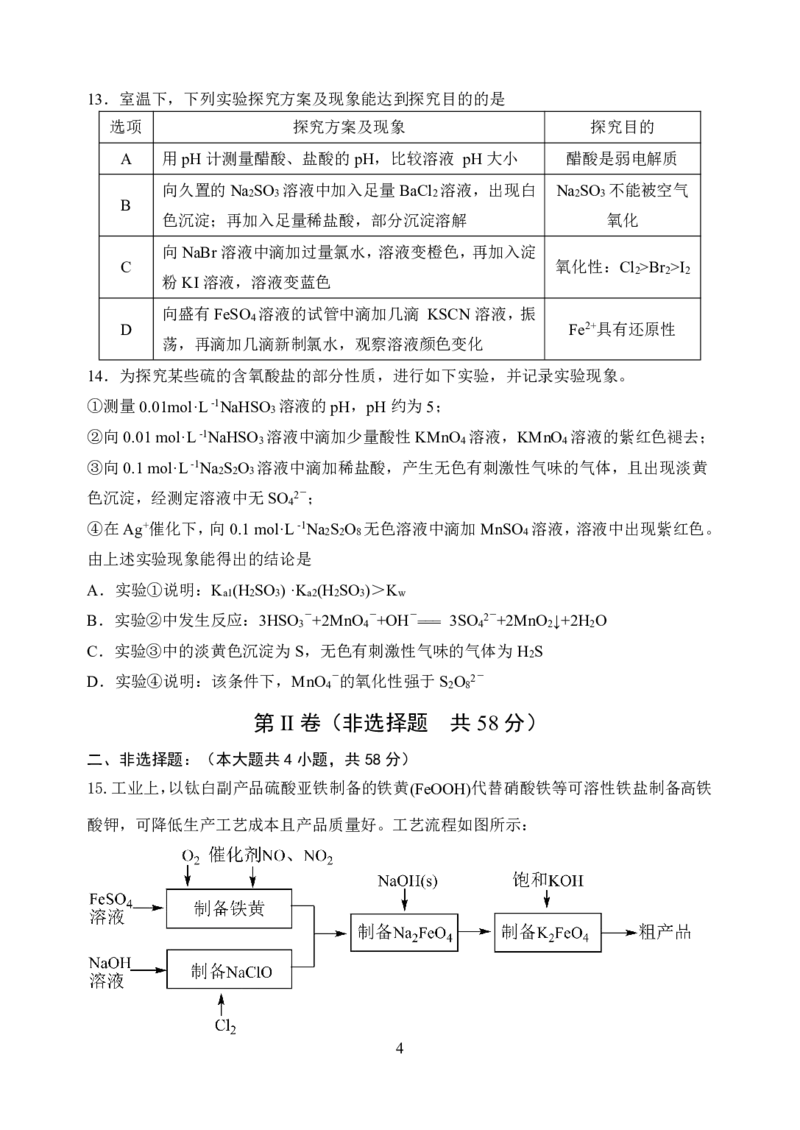
(1)从电子排布的角度分析,Fe2+稳定性小于Fe3+的原因 _______。
(2)制备铁黄的离子方程式为_______。
(3)实验测得反应液的温度、pH对铁黄产量的影响如图所示。
①反应液温度高于40°C时,铁黄的产量下降的原因可能是 _______。
②pH大于4.5时铁黄产量降低的主要原因可能是 _______。
(4)粗产品K FeO 提纯时采用重结晶、洗涤、低温烘干的方法,洗涤剂最好选用
2 4
_______(填序号)。
A. 冰水 B.NaOH溶液 C. 稀硫酸 D.Fe(NO ) 溶液
3 3
(5)用K FeO 处理水时,不仅能消毒杀菌,还能除去水体中的S2-、CN-、NH 等,生成
2 4 3
的Fe(OH) 胶体还能吸附水中的悬浮杂质。试写出K FeO 处理含有CN- 的碱性污水时与
3 2 4
CN-反应的离子方程式_______。
16.KIO 是常见的食盐加碘剂,某小组制备KIO 晶体的流程如下,请回答下列问题:
3 3
已知:①碘易溶于乙醚;乙醚微溶于水,沸点:34.5℃,密度:0.714g/cm-3,易燃。
5
{#{QQABBYyEggggABAAAAgCAw2gCAOQkBEACAoGwAAMMAIBwAFABAA=}#}②KIO 在水中的溶解度:20℃为8.1g,80℃为21.8g;KIO 难溶于乙醇。
3 3
(1)步骤①“氧化”的离子方程式为 。
(2)步骤②进行萃取操作时,需要放气,下图中正确的放气图示是 (填字母)。
a. b. c.
(3)步骤④用带磁力搅拌的电热套控温85℃加热约1h,判断氧化反应已完全的方法是
。
(4)步骤⑧后,往滤液中加入一定量 ,再次抽滤,可提高产品收率。
(5)为了测定KIO 产品的纯度,可采用碘量法滴定。准确称取1.000g产品,配制成250mL
3
溶液,用移液管移取25.00mL溶液于锥形瓶中,加稀硫酸酸化,再加入足量KI溶液充分
反应,加淀粉指示剂,用0.1000mol·L-1Na S O 标准溶液滴定,平行测定3次,平均消耗
2 2 3
标准溶液29.40mL。已知: I +2S O 2-=2I-+S O 2-
2 2 3 4 6
①滴定管需要用标准溶液润洗,润洗滴定管的具体操作为
。
②KIO 在酸性条件下氧化KI的离子方程式为 。
3
③产品的质量分数为 (写出计算过程,保留4位有效数字)。
④在确认滴定操作无误的情况下,质量分数异常的原因可能是 。
17.我国在应对气候变化工作中取得显著成效,并向国际社会承诺2030年实现“碳达峰”,
2060年实现“碳中和”。因此将CO 转化为高附加值化学品成为科学家研究的重要课题。
2
工业上在Cu-ZnO催化下利用CO 发生如下反应I生产甲醇,同时伴有反应II发生。
2
I.CO (g)+3H (g) CH OH(g)+H O(g)ΔH
2 2 3 2 1
II.CO (g)+H (g) CO(g)+H O(g)ΔH =+41.2kJ·mol-1
2 2 2 2
回答下列问题:
6
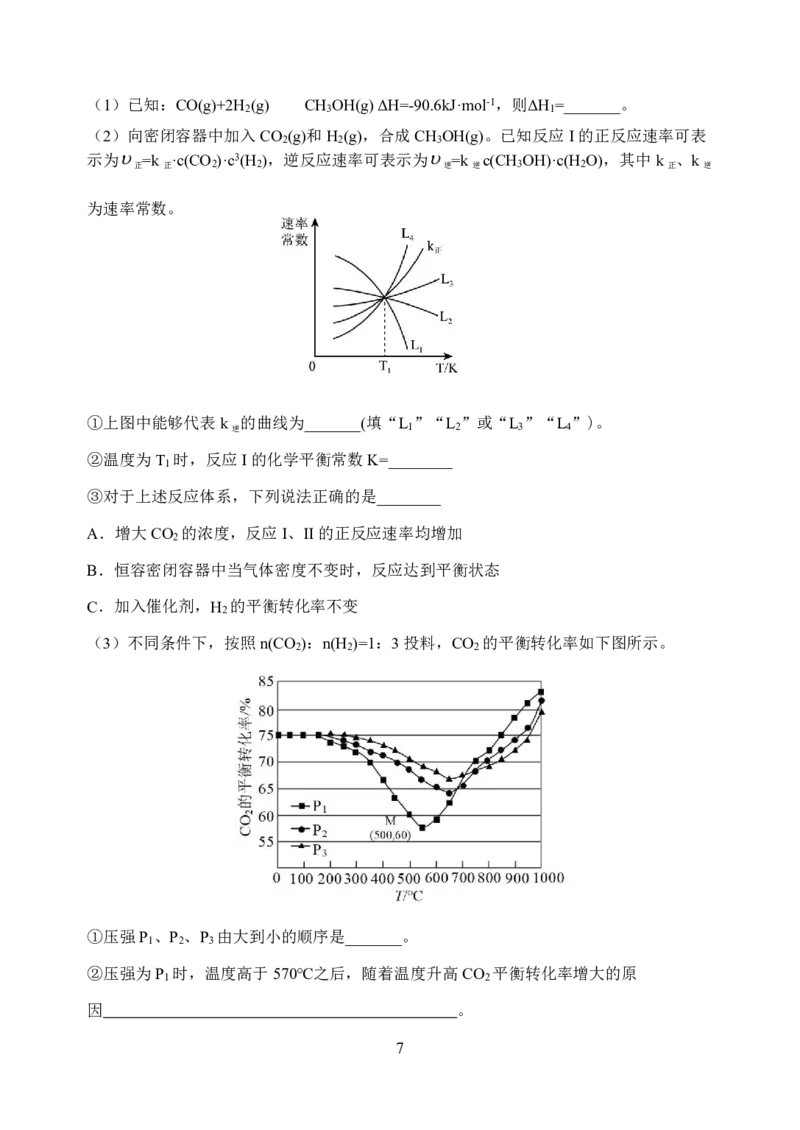
{#{QQABBYyEggggABAAAAgCAw2gCAOQkBEACAoGwAAMMAIBwAFABAA=}#}(1)已知:CO(g)+2H (g) CH OH(g)ΔH=-90.6kJ·mol-1,则ΔH =_______。
2 3 1
(2)向密闭容器中加入CO (g)和H (g),合成CH OH(g)。已知反应I的正反应速率可表
2 2 3
示为 =k ·c(CO )·c3(H ),逆反应速率可表示为 =k c(CH OH)·c(H O),其中k 、k
正 正 2 2 逆 逆 3 2 正 逆
为速率常数。
①上图中能够代表k 的曲线为_______(填“L ”“L ”或“L ”“L ”)。
逆 1 2 3 4
②温度为T 时,反应I的化学平衡常数K=________
1
③对于上述反应体系,下列说法正确的是________
A.增大CO 的浓度,反应I、II的正反应速率均增加
2
B.恒容密闭容器中当气体密度不变时,反应达到平衡状态
C.加入催化剂,H 的平衡转化率不变
2
(3)不同条件下,按照n(CO ):n(H )=1:3投料,CO 的平衡转化率如下图所示。
2 2 2
①压强P 、P 、P 由大到小的顺序是_______。
1 2 3
②压强为P 时,温度高于570℃之后,随着温度升高CO 平衡转化率增大的原
1 2
因 。
7
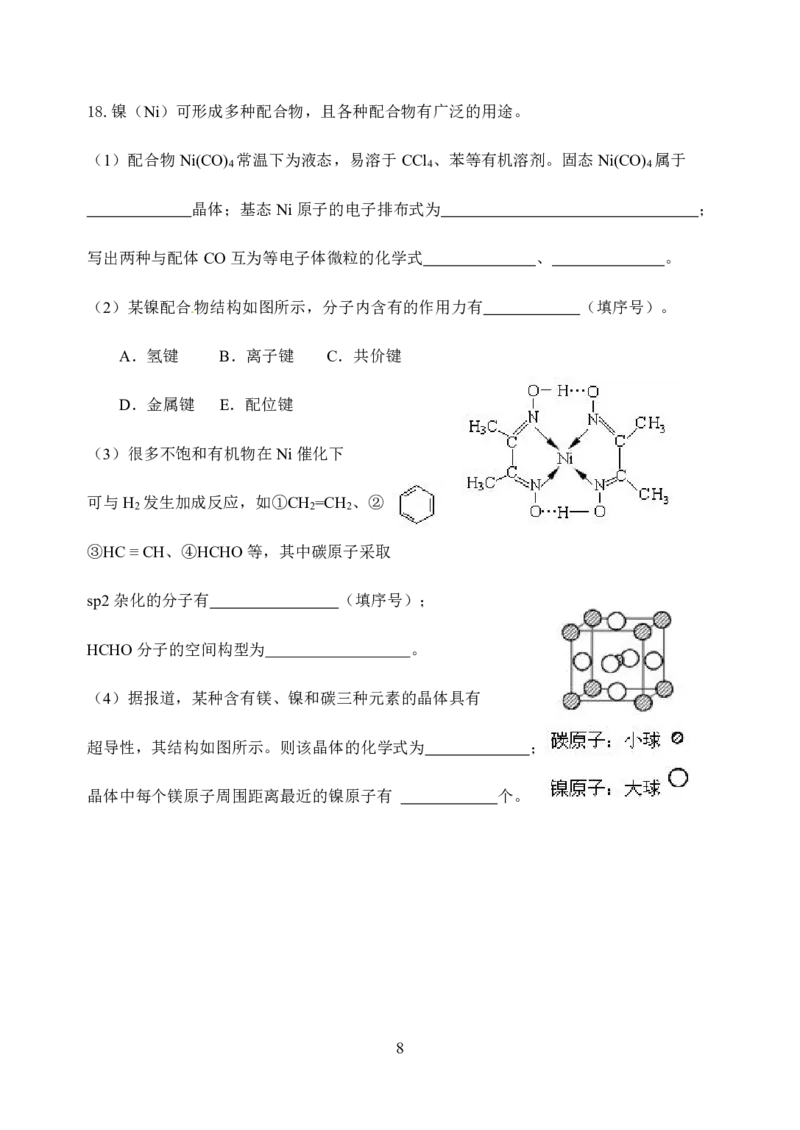
{#{QQABBYyEggggABAAAAgCAw2gCAOQkBEACAoGwAAMMAIBwAFABAA=}#}18.镍(Ni)可形成多种配合物,且各种配合物有广泛的用途。
(1)配合物Ni(CO) 常温下为液态,易溶于CCl 、苯等有机溶剂。固态Ni(CO) 属于
4 4 4
晶体;基态Ni原子的电子排布式为 ;
写出两种与配体CO互为等电子体微粒的化学式 、 。
(2)某镍配合物结构如图所示,分子内含有的作用力有 (填序号)。
A.氢键 B.离子键 C.共价键
D.金属键 E.配位键
(3)很多不饱和有机物在Ni催化下
可与H 发生加成反应,如①CH =CH 、②
2 2 2
③HC≡CH、④HCHO等,其中碳原子采取
sp2杂化的分子有 (填序号);
HCHO分子的空间构型为 。
(4)据报道,某种含有镁、镍和碳三种元素的晶体具有
超导性,其结构如图所示。则该晶体的化学式为 ;
晶体中每个镁原子周围距离最近的镍原子有 个。
8
{#{QQABBYyEggggABAAAAgCAw2gCAOQkBEACAoGwAAMMAIBwAFABAA=}#}