文档内容
2024 届云南三校高考备考实用性联考卷(六)
理科综合参考答案
一、选择题:本题共13小题,每小题6分。
题号 1 2 3 4 5 6 7 8 9 10 11 12 13
答案 C B D C A C A B C D C B D
二、选择题:本题共8小题,每小题6分。在每小题给出的四个选项中,第14~18题只有一
项符合题目要求;第 19~21 题有多项符合题目要求,全部选对的给 6 分,选对但不全的给 3
分,有选错的给0分。
题号 14 15 16 17 18 19 20 21
答案 A D B D C CD BD ACD
【解析】
1.大肠杆菌拟核中的DNA分子为环状DNA,无游离的磷酸基团,经复制后形成的2个DNA
分子也无游离的磷酸基团,A错误。支原体是原核生物,感染宿主细胞后,利用自身核糖
体合成自身的蛋白质,B 错误。当细胞摄取大分子物质时,首先是大分子与膜上的蛋白质
结合,从而引起这部分细胞膜内陷形成小囊,包围着大分子,据此可知,变形虫在水环境
中摄取大分子物质时是需要膜上蛋白质参与的,C 正确。细胞进行主动运输的过程中不一
定会消耗ATP,主动运输利用的能量形式可以是光能,或离子的浓度梯度形成的化学势能,
或ATP,D错误。
2.若图示现象发生的原因是基因突变,则未标出的基因分别是A和A或a和a,基因突变为
分子水平,无法通过显微镜观察,A错误。若发生基因重组,则未标出的基因为基因A和
基因a,因此,该初级精母细胞产生配子的基因型为AB、aB、Ab、ab,共4种,B正确。
图示细胞中含有2个染色体组,每个染色体组由2条非同源染色体组成,C错误。精子和
卵细胞结合是生殖细胞间的随机结合,不是基因重组,D错误。
3.支原体没有细胞壁,A错误。反射过程中,兴奋只能来源于感受器,在神经纤维上的传导
是单向的,B错误。辅助性T细胞表面特定分子发生变化并与B细胞结合,为激活B细胞
的第二个信号,C错误。mRNA疫苗由脂质体包裹可通过胞吞进入到人体细胞内,体现了
细胞膜的流动性,D正确。
理科综合参考答案·第1页(共14页)
{#{QQABKYAAggCgAAIAAAhCAwXoCECQkAEAAAoGxEAAoAIBCQFABAA=}#}4.由分析可知,①是赤霉素,②是生长素,③是乙烯,用适宜浓度的生长素处理未授粉的番
茄雌蕊柱头,可直接刺激子房发育成果实,获得无子番茄,由于该过程遗传物质没有改变,
属于不可遗传变异,A 正确。赤霉素、生长素都能促进细胞伸长,表现出协同作用,B 正
确。生长素浓度增高到一定值时,会促进乙烯的合成,而乙烯含量的增高,反过来会抑制
生长素的作用,C 错误。不同激素的相对含量是决定植物器官生长发育的因素之一,此外
还受基因表达,环境因素等的影响,D正确。
5.该过程体现了在生态工程中需有效选择生物组分并合理布设的特点,主要遵循了生态工程
的自生原理,B 错误。生态系统具有自我调节能力,所以早期微囊藻产生的微量的藻毒素
可以被分解,微囊藻的增殖不一定导致湖泊的生物多样性降低,C 错误。微囊藻等蓝细菌
产生的藻毒素难以降解,则会沿着食物链富集,翘嘴红鲌体内的藻毒素含量最高,则所调
查水域的最高营养级生物,体内藻毒素浓度超过环境浓度,D错误。
6.单克隆抗体的化学本质为蛋白质,若口服会被消化水解为氨基酸再被人体吸收,失去原有
功能,故使用该药时可静脉注射,不能口服,A正确。单克隆抗体除用于治疗疾病外,在
多种疾病的诊断和病原体鉴定中也发挥着重要作用,例如,利用同位素或荧光标记的单克
隆抗体在特定组织中成像的技术,可定位诊断肿瘤、心血管畸形等疾病,B 正确。制备单
克隆抗体时,可利用选择培养基筛选出融合的杂交瘤细胞,再进行克隆化培养和抗体检测,
筛选能产生所需抗体的杂交瘤细胞,C错误。制备单克隆抗体需诱导骨髓瘤细胞和B淋巴
细胞融合,可采用PEG融合法、电融合法和灭活病毒诱导法诱导融合,D正确。
7.碳纳米管中存在自由移动的电子,故可用作电极材料,A正确。基态碳原子价电子排布的
轨道表示式为 ,若为核外电子排布图则还需将1s画出,B错误。石墨烯量
子点的制备过程有新物质生成,涉及化学反应,C 错误。石墨烯量子点一般由若干层叠加
而成,层间以分子间作用力相连,D错误。
8.S吡啶酰胺与足量H 完全加成后的产物中有4个手性碳,A正确。1mol S吡啶酰胺与足量
2
NaOH溶液反应,最多消耗7mol NaOH,B错误。 S吡啶酰胺中含有酰胺基,既能与酸反
应又能与碱反应,C 正确。 该分子中酰胺基中的 N 原子为 sp3杂化、吡啶环上的 N 原子
为sp2杂化,D正确。
9.检验卤原子的种类一般采用卤代烃的水解反应,将 2−甲基−2−溴丙烷与氢氧化钠水溶液混
合加热,冷却后,取上层清液加稀硝酸酸化再加入AgNO 溶液,A错误。不同浓度的高锰
3
酸钾颜色深浅不一样,B 错误。将乙醇和浓硫酸共热至 170℃所得气体先通入 NaOH 溶液
理科综合参考答案·第2页(共14页)
{#{QQABKYAAggCgAAIAAAhCAwXoCECQkAEAAAoGxEAAoAIBCQFABAA=}#}中除去乙烯中混有的 SO 气体,再通入溴水中,若溴水褪色,则说明乙醇发生消去反应
2
生成了乙烯,C 正确。向 2mL 0.1mol/L NaOH 溶液中滴加 3 滴 0.1mol/L MgCl 溶液,
2
则NaOH 过量,滴加CuSO 溶液后,Cu2+直接与溶液中过量的OH−反应,未发生沉淀转
4
化,D错误。
10. 该新型ZnNO 电池中,a为负极,b为正极,c为阴极,d为阳极。c电极为阴极电势低
2
于阳极 d 电极,A 正确。电子的移动方向为 a→c,d→b,B 正确。d 电极的电极反应为
2H O−4e−=O +4H+,C正确。装置工作时,若消耗13g Zn则转移电子为0.4mol,理
2 2
论上能得到0.1mol O ,标准状况下为2.24L,D错误。
2
11.a的核外电子总数与其周期数相同,说明a为H;b的价电子层中的未成对电子有3个,
说明b为N;c的最外层电子数为其内层电子数的3倍,c为O;d与c同主族,d为S;
e的最外层只有一个电子,但次外层有18个电子,说明e为Cu。H O分子间存在氢键,
2
故沸点大于H S。A正确。该离子化合物为Cu O,d的最高价含氧酸为H SO ,Cu O与
2 2 2 4 2
H SO 混合会发生歧化反应生成 Cu、CuSO 、H O。B 正确。该阴离子为 SO2,其中 S
2 4 4 2 3
为 sp3杂化,有一对孤电子,故其空间构型为三角锥形。C 错误。N 的 2p 轨道半充满较
稳定,故第一电离能大于同周期相邻元素,第一电离能:b > c > d ,D正确。
12.该过程中的化合价从零价升到+1价,则1mol H 参与反应理论上失去2mol电子,A错误。
2
由图可知,吸附在 Fe O 上的两个氢原子分别与铁、氧结合,故带不同电荷,B 正确。
3 4−x
步骤Ⅰ中HCO中失去了氧,发生了还原反应,故C的化合价发生了改变,C错误。由图
3
可知 H 和 HCO反应转化为 HCOO−和水,反应中存在氢氢键、氢氧键、碳氧键断裂,
2 3
氢氧键、碳氢键的形成,未涉及到非极性键的形成,D错误
13. 用0.1000molL1盐酸滴定20.00mL Na A溶液,pH 较大时A2的分布分数最大,随着
2
pH的减小,A2的分布分数逐渐减小,HA的分布分数逐渐增大,恰好生成NaHA之
后,HA的分布分数逐渐减小,H A的分布分数逐渐增大,表示H A、HA、A2的
2 2
分布分数的曲线如图所示,据此分析选择。
向 Na A 中加盐酸,水的电离程度逐渐减小,
2
故水电离程度 d 点大于 e 点,A 正确。b 点溶
质 为 NaHA , 根 据 质 子 守 恒 存 在 :
c(H+)+c(H A)=c(OH−)+c(A2−),B正确。根据图
2
像 e 点可知,当加入盐酸 40mL 时,全部生成
H A,根据 Na A+2HCl=2NaCl+H A,计
2 2 2
算可知 c(Na A)=0.100mol/L,C 正确。由图可
2
知a点c(A2−)=c(HA−),此时的c(H+)=K =10−10.25,D错误。
a2
理科综合参考答案·第3页(共14页)
{#{QQABKYAAggCgAAIAAAhCAwXoCECQkAEAAAoGxEAAoAIBCQFABAA=}#}14.活塞向上运动,不计活塞与气缸间的摩擦,外界大气压强保持不变,整个过程气体压强
与外界大气压强之差保持不变,属于等压变化,故 A 正确。由于气体温度升高,气体内
能升高,则气体分子的平均动能升高,但不是每个分子的动能都增加,故 B 错误。活塞
向上移动,气体对外做功,根据热力学第一定律W QU ,气体内能升高,可知气体
从电热丝处吸收的热量大于气体对活塞做的功,故 C 错误。气体分子的平均动能升高,
撞击活塞的平均作用力增大,而气体压强不变,则气体分子在单位时间内撞击活塞单位
面积的次数减少,故D错误。
15.正、负电荷在 O 点处的电场强度方向均水平向右,根据场强叠加可知,O 点电场强度不
为零,故A错误。根据对称性可知,a、b处的电场强度大小相等,方向相同,均水平向
右,故 C 错误。根据安培定则以及磁场叠加可知,c、d 处的磁感应强度大小相等,方向
均沿cd向下,O点处的磁感应强度不为零,也沿cd向下,故B错误,D正确。
1 x a a
16.由初速度为0的匀加速直线运动规律可得x at2,则有 t,图像的斜率为k ,
2 t 2 2
由图像得k 4m/s2, 解得a8m/s2,t 2s时物体的速度为vat 16m/s,故B正确。
由v2 2ax,可得x1m时物体的速度为4m/s,故C、D错误。
17.光进入圆锥后速度变小,波长变短,故A错误。圆锥中的光
c (ra)tan
速v 3108m/s,故B错误。传播时间t ,
n v
解得t 6.01010s,故C错误。光线从底面垂直入射后沿直
线射到圆锥侧面上的O点发生折射,光路如图所示, 由几何关系可知入射角为 θ,设折
sin a
射角为α,则 n,解得a60, 由几何关系可知2lcos ,解得l0.12m,
sin cos
故D正确。
18.对轻杆、铰链及重物所组成的系统进行受力分析可知,该系统受到三个外力,
分别是竖直墙对A、B两铰链的作用力及重物重力,由三力平衡可知竖直墙
对A、B两铰链的总作用力方向竖直向上,大小等于mg,故A错误。对O
3
点受力分析如图,F mgcos30 mg,故 B 错误。由相似三角形得
1 2
F F mg
1 2 ,若将铰链A竖直向下缓慢移动少许,OA、OB不变,AB变小,轻杆1
OA OB AB
对O的弹力变大,故C正确。同理可知,若将铰链B竖直向上缓慢移动少许,轻杆2对
O的弹力变大,故D错误。
理科综合参考答案·第4页(共14页)
{#{QQABKYAAggCgAAIAAAhCAwXoCECQkAEAAAoGxEAAoAIBCQFABAA=}#}GMm GMm v2 1 mgR2
19.根据 0 m g, m ,又E mv2,解得E , 故A错误。
R2 0 (Rh)2 Rh k 2 k 2(Rh)
2π (Rh)3 2π R g
又v (Rh),解得T 2π ,故 B 错误。角速度为 ,
T gR2 T Rh Rh
gR2
故C正确。向心加速度为a2(Rh) ,故D正确。
(Rh)2
S Q
20.将绝缘介质抽出,由电容的决定式C ,可知 C 变小,C 不变,其中C 1 ,
4πkd 2 1 1 U
1
Q
C 2 , U U ,Q Q Q ,Q 不变,综合以上分析可知:Q 增加,Q 减小,
2 U 1 2 1 2 总 总 1 2
2
U 、U 均增大,故选BD。
1 2
21.根据右手定则可知金属棒运动过程中 e 端电势小于 f 端电势,故 A 正确。金属棒运动到
cd处的速度vat ,当金属棒在cd 时,其产生的感应电动势为E BLv,产生的电流为
0 1
E
I 1 ,金属棒所受的安培力为F BIL,据牛顿第二定律得F F ma,联立以
RR A 0 A
0
BLv at
上代入数据解得t1s,故B错误。通过金属棒的电荷量为qIt ,I ,v ,
0 RR 2
0
联立解得q0.5C,故C正确。设金属棒做匀速圆周运动的速度v与磁场正方向的夹角为
BLv
,则垂直磁场方向的分速度v vsina ,则 E BLvsin,有效值 E ,则
2 2
E2 πr R 3π
Q t,其中t ,电阻R中产生的热量为Q Q , 解得Q J,故D
RR 2v R R R R 40
0 0
正确。
三、非选择题:共14题,共174分。
22.(每空2分,共8分)
d d
(1)1.050
t 2t
(m 4m )d2
(2)(2m m)gh 1 2
2 1 4t2
【解析】(1)游标卡尺的示数d 10mm100.05mm10.50mm1.050cm;重物 B 速度
d v d
的大小v ,重物A速度的大小v B 。
B t A 2 2t
理科综合参考答案·第5页(共14页)
{#{QQABKYAAggCgAAIAAAhCAwXoCECQkAEAAAoGxEAAoAIBCQFABAA=}#}mgh
(2)系统(重物 A、B)减少的重力势能为 m gh 1 ;系统增加的动能为
2 2
1 d 2 1 d 2 (m 4m )d2 (m 4m )d2
m + m 1 2 ,若两者相等,有(2m m)gh 1 2 。
2 2 t 2 1 2t 8t2 2 1 4t2
23.(每空2分,共8分)
(1)250(或0~250)
(2)40
(3)12.5 12.5(12.5±0.3)
I R
【解析】(1)由欧姆定律可得I I g g 250mA。
g R
0
(2)U I R IR ,解得R 40。
g g 2 2
(3)欧姆表的内阻等于此时电阻箱读数, R 50 ,根据闭合电路欧姆定律
内
E
E IR 12.5V;图乙所示位置电流为200mA,根据闭合电路欧姆定律可得I ,
内 R R
内 x
解得R 12.5。
x
24. (12分)
解:设原来P、Q运动时加速度大小为a ,轻绳张力为T,分别对P、Q用牛顿第二定
1
律得
T m g m a ①
P P 1
m gT m a ②
Q Q 1
解得T 2.25N ③
在P上固定一物块K后,再分别对P、Q用牛顿第二定律得
2T (m m )g (m m )a ④
P K P K 2
m g2T m a ⑤
Q Q 2
联立解得m 0.4kg ⑥
K
评分标准:本题共12分。正确得出①~⑥式各给2分。
理科综合参考答案·第6页(共14页)
{#{QQABKYAAggCgAAIAAAhCAwXoCECQkAEAAAoGxEAAoAIBCQFABAA=}#}25.(14分)
解:(1)设小球运动到最低点时的速度大小为v,在小球释放后至运动到最低点的过程中,
1
根据动能定理有mgl(1cos) mv2 ①
2
设碰撞后瞬间小球与物块的速度分别为v 、v ,取向右为正方向,根据动量守恒定律有
1 2
mvmv Mv ②
1 2
根据机械能守恒定律有
1 1 1
mv2 mv2 Mv2 ③
2 2 1 2 2
解得v 2 2m/s ④
2
(2)E−x图像与x轴围成图形的面积乘以电荷量表示电场力做的功,则由题图乙可知碰后
到物块第一次运动到x1.2m过程中
电场力做的功W 0.4J ⑤
F
1
由动能定理可得W MgxE Mv2 ⑥
F k 2 2
代入数据解得E 1.28J ⑦
k
评分标准:本题共14分。正确得出①~⑦式各给2分。
26.(20分)
解:(1)从A点到P点
水平方向:
2 3
d v t ①
3 x
v v cos ②
x 0
竖直方向:v at ③
y
v v sin ④
y 0
根据牛顿第二定律Eqma ⑤
3mv2
解得E 0 ⑥
8dq
理科综合参考答案·第7页(共14页)
{#{QQABKYAAggCgAAIAAAhCAwXoCECQkAEAAAoGxEAAoAIBCQFABAA=}#}v
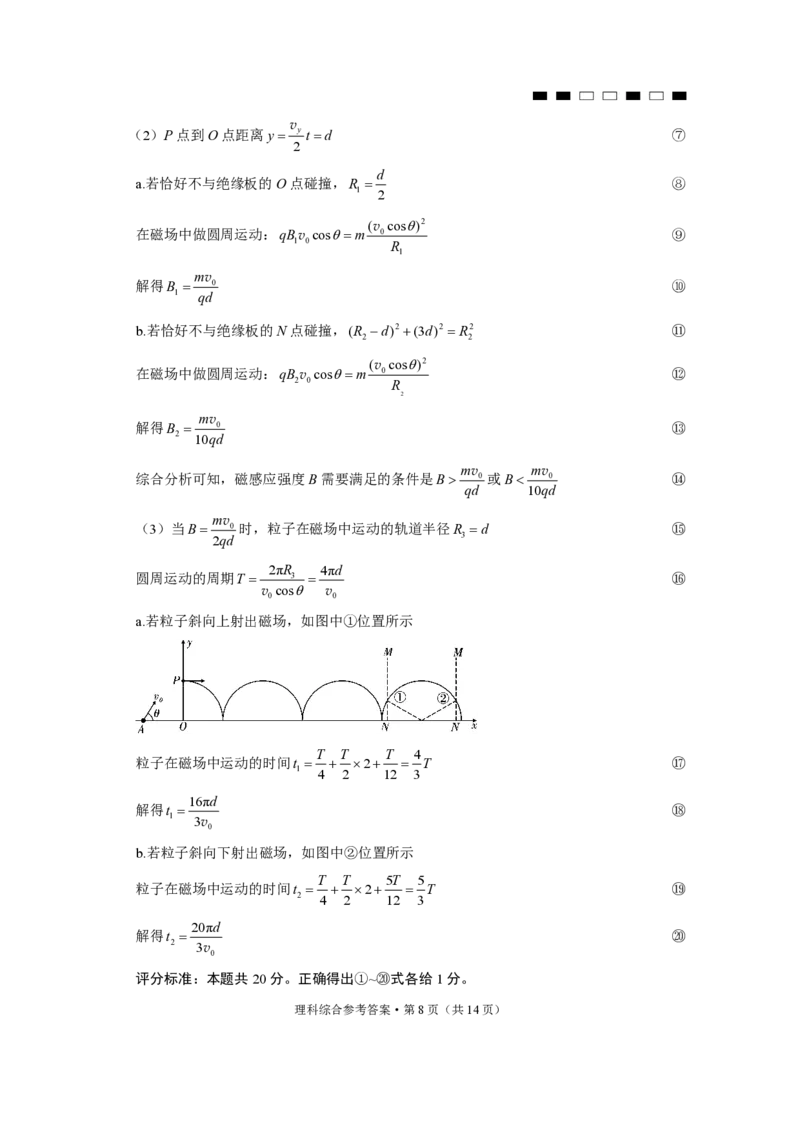
(2)P点到O点距离y y t d ⑦
2
d
a.若恰好不与绝缘板的O点碰撞,R ⑧
1 2
(v cos)2
在磁场中做圆周运动:qBv cosm 0 ⑨
1 0 R
1
mv
解得B 0 ⑩
1 qd
b.若恰好不与绝缘板的N点碰撞,(R d)2 (3d)2 R2 ⑪
2 2
(v cos)2
在磁场中做圆周运动:qB v cosm 0 ⑫
2 0 R
2
mv
解得B 0 ⑬
2 10qd
mv mv
综合分析可知,磁感应强度B需要满足的条件是B 0 或B 0 ⑭
qd 10qd
mv
(3)当B 0 时,粒子在磁场中运动的轨道半径R d ⑮
2qd 3
2πR 4πd
圆周运动的周期T 3 ⑯
v cos v
0 0
a.若粒子斜向上射出磁场,如图中①位置所示
T T T 4
粒子在磁场中运动的时间t 2 T ⑰
1 4 2 12 3
16πd
解得t ⑱
1 3v
0
b.若粒子斜向下射出磁场,如图中②位置所示
T T 5T 5
粒子在磁场中运动的时间t 2 T ⑲
2 4 2 12 3
20πd
解得t ⑳
2 3v
0
评分标准:本题共20分。正确得出①~⑳式各给1分。
理科综合参考答案·第8页(共14页)
{#{QQABKYAAggCgAAIAAAhCAwXoCECQkAEAAAoGxEAAoAIBCQFABAA=}#}27.(除特殊标注外,每空2分,共15分)
(1)6s26p3
(2)Bi S +6FeCl =3S+2BiCl +6FeCl
2 3 3 3 2
(3)3.1~4.0
(4)溴水褪色 SO +Br +2H O=SO2+2Br−+4H+
2 2 2 4
(5)取最后一次洗涤液,加硝酸酸化,再加硝酸银,若不产生白色沉淀,则固体已洗涤
干净
(6)蒸发浓缩(1分) 冷却结晶(1分) 8(1分)
【解析】(1)Bi的价电子排布式为6s26p3。
(2)浸取过程中主要反应是Bi S 与 FeCl 发生的氧化还原反应,方程式为Bi S +6FeCl
2 3 3 2 3 3
=3S↓+2BiCl +6FeCl 。
3 2
(3)氧化调pH工序中,调pH的目的是除去Fe3+,所以要保证Fe3+沉淀完全,同时Bi3+
不能沉淀,故调pH的范围是3.1~4.0。
(4)气体X为SO ,将足量的SO 通入溴水中现象为溴水褪色,发生反应SO +Br +2H O
2 2 2 2 2
=SO2+2Br−+4H+。
4
(5)合成工序中生成的固体为BiVO ,用水洗去表面的NH Cl,判断固体已经洗涤干净可
4 4
以取最后一次洗涤液检验氯离子,故答案为取最后一次洗涤液,加硝酸酸化,再加硝酸
银,若不产生白色沉淀,则固体已洗涤干净。
(6)NH Cl热稳定性差,要从NH Cl溶液中获得NH Cl晶体采用:蒸发浓缩、冷却结晶、
4 4 4
过滤等操作。由图可知NH Cl晶胞中。与Cl−最近且等距离的NH位于体心,每个Cl−有
4 4
8个晶胞共用,故与Cl−最近且等距离的NH有8个。
4
28.(除特殊标注外,每空2分,共14分)
(1) (1分) 长颈漏斗(1分)
(2)ClO+5Cl− +6H+=3Cl ↑+3H O
3 2 2
(3)防止生成的肼被过量的次氯酸钠氧化
(4)在BC之间增加盛有饱和食盐水的洗气瓶
(5) 80%
(6)①2N H +H SO =(N H ) SO ②109
2 4 2 4 2 5 2 4
理科综合参考答案·第9页(共14页)
{#{QQABKYAAggCgAAIAAAhCAwXoCECQkAEAAAoGxEAAoAIBCQFABAA=}#}【解析】(1)肼的分子式为N H ,结构式为 ;仪器a的名称为长颈漏斗。
2 4
(2)装置 C 是氯气的发生装置,利用浓盐酸和氯酸钾发生归中反应制备氯气,发生反应
的离子方程式为ClO+5Cl− +6H+=3Cl ↑+3H O。
3 2 2
(3)由于肼具有强还原性,易被次氯酸钠氧化,故通入B中的Cl 不能过量。
2
(4)由于浓盐酸易挥发,制得的氯气中混有氯化氢气体,为避免氯化氢与氢氧化钠反应,
应该在BC之间增加盛有饱和食盐水的洗气瓶用来除去氯气中混有的氯化氢。
1
(5)滴定过程中发生反应:N H +2I =N +4I− +4H+该反应中n(N H )= n(I ),N H
2 4 2 2 2 4 2 2 4
2
250 1
0.52010332
的质量分数为w(N H ) 25 2 100%80%。
2 4 2
(6)由图可知向 N H 的水溶液中滴加稀硫酸,c(N H )=c(N H)时的pH大于c(N H)=
2 4 2 4 2 5 2 5
c(N H2) c(N H)
c(N H2)时的 pH,故 N 代表lg 2 6 与 pH 的变化关系,直线 M 代表lg 2 5 与
2 6 c(N H) c(N H )
2 5 2 4
pH的变化关系。肼的第一步电离方程式为N H +H O=N H+OH− , K =10−6,第
2 4 2 2 5 b1
二步电离方程式为N H+H O=N H2+OH−,K =10−15 ,N H 与少量稀硫酸反应
2 5 2 2 6 b2 2 4
的化学方程式为 2N H +H SO =(N H ) SO ,第一步电离方程式减第二步电离方程
2 4 2 4 2 5 2 4
K
式得到:N H +N H2=2N H,故平衡常数为 b1 109。
2 4 2 6 2 5 K
b2
29.(每空2分,共14分)
(1)低温
(2)2(ΔH +ΔH +ΔH ) CuCl、CuO
1 2 3
(3)①M ②0.4 ③增大压强;增大氧气浓度(任写一条)
(4)2HCl−2e−=Cl ↑+2H+
2
【解析】(1)已知反应4HCl(g)+O (g)=2Cl (g)+2H O(g) ΔS<0,要使反应自发进行,
2 2 2
则ΔG<0,必须满足ΔH<0,反应在低温下可自发进行。
(2)根据盖斯定律知,(反应Ⅰ+反应Ⅱ+反应Ⅲ)×2得4HCl(g)O (g)=2Cl (g)
2 2
2H O(g) ∆H=(∆H +∆H +∆H )×2,由反应机理可知,中间产物为CuCl、CuO。
2 1 2 3
理科综合参考答案·第10页(共14页)
{#{QQABKYAAggCgAAIAAAhCAwXoCECQkAEAAAoGxEAAoAIBCQFABAA=}#}(3)①4HCl(g)+O (g)=2Cl (g)+2H O(g),进料比 c(HCl)∶c(O )比值越低,HCl 平衡
2 2 2 2
转化率越高,由图像可知,温度相同时,曲线M对应的HCl平衡转化率更高,故进料比
c(HCl)∶c(O )=1∶1的曲线为M。
2
②某温度下,若起始压强为100kP, HCl和O 起始浓度均为1mol/L,HCl的平衡转化率
2
为80%,根据反应方程式知,用三段式法对数据进行处理得:
4HCl(g) + O (g)=2Cl (g) + 2H O(g)
2 2 2
起始(浓度) 1 1 0 0
变化(浓度) 0.8 0.2 0.4 0.4
平衡(浓度) 0.2 0.8 0.4 0.4
1 4 2 2
体积分数
9 9 9 9
2
( p )4
n 0 p 0 ,求出 p 90Kp,则K 9 平 0.4;
n p 平 p 1 4
平 平 ( p )4( p )
9 平 9 平
③若想提高 HCl 的转化率,应该促使平衡正向移动,该反应为气体体积减小的反应,根
据勒夏特列原理,可以增大压强或增大氧气浓度,使平衡正向移动,同时增大反应速率。
(4)电解过程中,正极区即阳极上发生的是失电子反应,元素化合价升高,属于氧化反
应,则图中右侧为阳极反应,电极反应为2HCl−2e−=Cl +2H+。
2
30.(除特殊标注外,每空2分,共15分)
(1)3−氯−1−丙烯 CH CHCHO(1分)
2
(2)羟基、硝基
(3)6N
A
(4)加成反应(1分)
(5)
(6)12
(7) (3分)
理科综合参考答案·第11页(共14页)
{#{QQABKYAAggCgAAIAAAhCAwXoCECQkAEAAAoGxEAAoAIBCQFABAA=}#}【解析】分析:A 的分子式为 C H ,A 的不饱和度为 1,A 与 Cl 高温反应生成 B,B 与
3 6 2
HOCl发生加成反应生成C,C的分子式为C H OCl ,B的分子式为C H Cl,B中含碳碳
3 6 2 3 5
双键,A→B为取代反应,则A的结构简式为CH CH=CH ;根据C、D的分子式,C→D
3 2
为氯原子的取代反应,结合题给已知②,C 中两个 Cl 原子连接在两个不同的碳原子上,
则A与Cl 高温下发生饱和碳上氢原子的取代反应,B的结构简式为CH CHCH Cl,名
2 2 2
称为3−氯−1−丙烯、C的结构简式为HOCH CHClCH Cl或ClCH CH(OH)CH Cl、D的
2 2 2 2
结构简式为 HOCH CH(OH)CH OH;D 在浓硫酸、加热时消去 2 个“H O”生成 E;
2 2 2
根据F→G→J和E+J→K,结合F、G、J的分子式以及K的结构简式,E+J→K为加成反
应,则E的结构简式为CH CHCHO,F的结构简式为 、G的结构简式为 、
2
J的结构简式为 ;K的分子式为C H NO ,L的分子式为C H NO,K→L的过
9 11 2 9 9
程中脱去 1 个“H O”,结合 K→L 的反应条件和题给已知①,K→L 先发生加成反应、
2
后发生消去反应,L的结构简式为 。
(1)B 的结构简式为 CH CHCH Cl,名称为 3−氯−1−丙烯,E 的结构简式为
2 2
CH CHCHO。
2
(2)G的结构简式为 ,G中官能团的名称为羟基、硝基。
(3)G的结构简式为 、J的结构简式为 ,则1mol G被还原为J,转移
电子数目为6N 。
A
(4)K的分子式为C H NO ,L的分子式为C H NO,对比K和L的分子式,K→L的过
9 11 2 9 9
程中脱去 1 个“H O”,结合 K→L 的反应条件和题给已知①,K 先发生加成反应生成
2
, 发生消去反应生成L。
理科综合参考答案·第12页(共14页)
{#{QQABKYAAggCgAAIAAAhCAwXoCECQkAEAAAoGxEAAoAIBCQFABAA=}#}(5)根据流程L+G→J+8−羟基喹啉+H O,即
2
,对比L和8−羟基喹啉的结构简
式,L发生了去氢的氧化反应。根据原子守恒,反应过程中L与G物质的量之比为3∶1。
(6)K的同分异构体①遇FeCl 显紫色说明含有酚羟基;②能水解,结合分子式说明含有
3
酰胺基,能与溴水发生加成反应,说明含有碳碳双键;③苯环上只有两个取代基即骨架
为: ,含有酰胺基,若为—CONH 、 取代在侧
2
链上,共有6种,若为 则考虑插空,有6种,所以同分异构体共12种。
(7)参考题中流程及已知信息可知,可知由苯和乙醇为原料合成苯乙烯的路线为:
。
31.(除特殊标注外,每空2分,共11分)
(1)线粒体基质(无拓展答案) 叶绿素(答叶绿素a和叶绿素b一个给1分,有错误
答案不给分) 作为活泼的还原剂,参与暗反应阶段的化学反应,同时也储存部分能量
供暗反应阶段利用(或答:为暗反应过程提供能量,并作为还原剂。2个给分点“还原剂”、
“提供能量”各1分,叙述上有知识性错误的点不给分)
(2)当温度低于一定值时,玉米植株光合作用合成的有机物量等于或小于细胞呼吸消耗
的有机物量(给分点“等于”“小于”各1分,答“呼吸速率大于或等于光合速率也给
2分”)
(3)分别取正常玉米植株和突变体植株的等量绿叶,对这两组绿叶进行色素的提取和分
离操作,对比两组滤纸条上蓝绿色的色素带宽度(3分,三个给分点“设置对照”、“色
素的提取和分离”、“对比两组滤纸条上蓝绿色的色素带宽度”各 1 分,第一个给分点
没强调“等量”不给分,第2个给分点写具体的正确操作也可,第3个给分点需强调“对
比[比较]、蓝绿色色素带[或写叶绿素 a、从上往下数第 3 条色素带、从下往上数第 2 条
色素带]、宽度[或写含量、深浅]”。给分0,1,2,3)
32.(除特殊标注外,每空2分,共12分)
(1)决定性状的基因位于性染色体上(1 分),在遗传上总是和性别相关联(1 分)(共 2
理科综合参考答案·第13页(共14页)
{#{QQABKYAAggCgAAIAAAhCAwXoCECQkAEAAAoGxEAAoAIBCQFABAA=}#}分,答到一点给1分) 星眼(1分) 常(1分)
(2)aaXbXb和AAXBY 3/4
(3)让正常眼正常翅雌果蝇与 F 中正常翅雄果蝇(或小翅雄果蝇)杂交(1 分,雄蝇的
2
选择带上眼形不扣分),观察子代中是否出现小翅果蝇(1 分,观察子代中的表型及比例
也可以)(共2分,答到一点给1分)
子代果蝇(雄蝇或雌雄果蝇)中出现小翅(2分,若杂交选择正常翅雄蝇,则子代中正常
翅∶小翅=3∶1;若杂交选择小翅雄蝇,则子代中正常翅∶小翅=1∶1)
33.(除特殊标注外,每空1分,共10分)
(1)3.9~6.1mmol/L 胰岛 A 细胞、胰岛 B 细胞(2 分,答出一个给 1 分) 激素发
挥作用后就被灭活了(2分)
(2)血浆渗透压低于组织液渗透压(2分)
(3)大脑皮层 没有经过完整的反射弧 升高
34.(除特殊标注外,每空2分,共11分)
(1)生产者(1 分) 生产者通过光合作用将太阳能固定在制造的有机物中,太阳能转
化成化学能,从而可以被生物所利用,是生态系统的基石 某杂草的种群密度、在果园
中出现的频率、植株的高度、以及它与其他物种的关系等
(2)人们将生物在时间和空间上合理配置,增大流入生态系统的总能量
(3)生物(1 分) 从豚草原产地引入天敌可以抑制豚草种群数量的增加,属于生物防
治。但是引入外来物种的同时,要考虑当地是否存在抑制豚草天敌的物种,否则盲目引
入外来物种会导致当地其他物种的灭绝,使生物多样性丧失等(1 分)(写出 1 点即可,
合理即可)
(4)后一个群落中的物种竞争能力强;前一个群落为后一个群落的产生提供了良好的
环境(任意答到一点即可给 2分,答案合理即可)
35.(除特殊标注外,每空1分,共10分)
(1)幼嫩的叶、发育中的种子(2分,一点1分) 色氨酸
(2)a. 重铬酸钾 使用强烈的理化方法杀死物体内外所有的微生物,包括芽孢和孢子
(2分)
b.将聚集的菌种逐步稀释,以便获得单个菌落(2分)
c.(快速)增加菌种数量 微生物数量、产物浓度(答出其中一点即可)
理科综合参考答案·第14页(共14页)
{#{QQABKYAAggCgAAIAAAhCAwXoCECQkAEAAAoGxEAAoAIBCQFABAA=}#}