文档内容
石家庄实验中学 2025 届高三年级第一次调研考试
化 学
命题:高三化学 考试时间:75分钟
注意事项:
1.答卷前,考生务必将自己的姓名、准考证号等填写在答题卡和试卷指定位置上。
2.回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑。如需
改动,用橡皮擦干净后,再选涂其他答案标号。回答非选择题时,将答案写在答题卡上。
写在本试卷上无效。
3.考试结束后,将本试卷和答题卡一并交回。
4.可能用到的相对原子质量:H 1 C 12 O 16 F 19 Fe 56 Cu 64 Zn 65 Ag 108
一、选择题:本题共 14 小题,每小题3分,共 42分。每小题只有一个选项符合题目要求。
1.文房四宝是中华传统文化的瑰宝。下列有关叙述错误的是
A.羊毛可用于制毛笔,主要成分为蛋白质
B.松木可用于制墨,墨的主要成分是单质碳
C.竹子可用于造纸,纸的主要成分是纤维素
D.大理石可用于制砚台,主要成分为硅酸盐
2.下列化学用语表达正确的是
A. HCl的形成过程是
¿
B.—NH 的电子式是·N∶H
2
¿
C.基态氮原子的轨道表示式为
D.化学式为EF的晶胞结构可能是
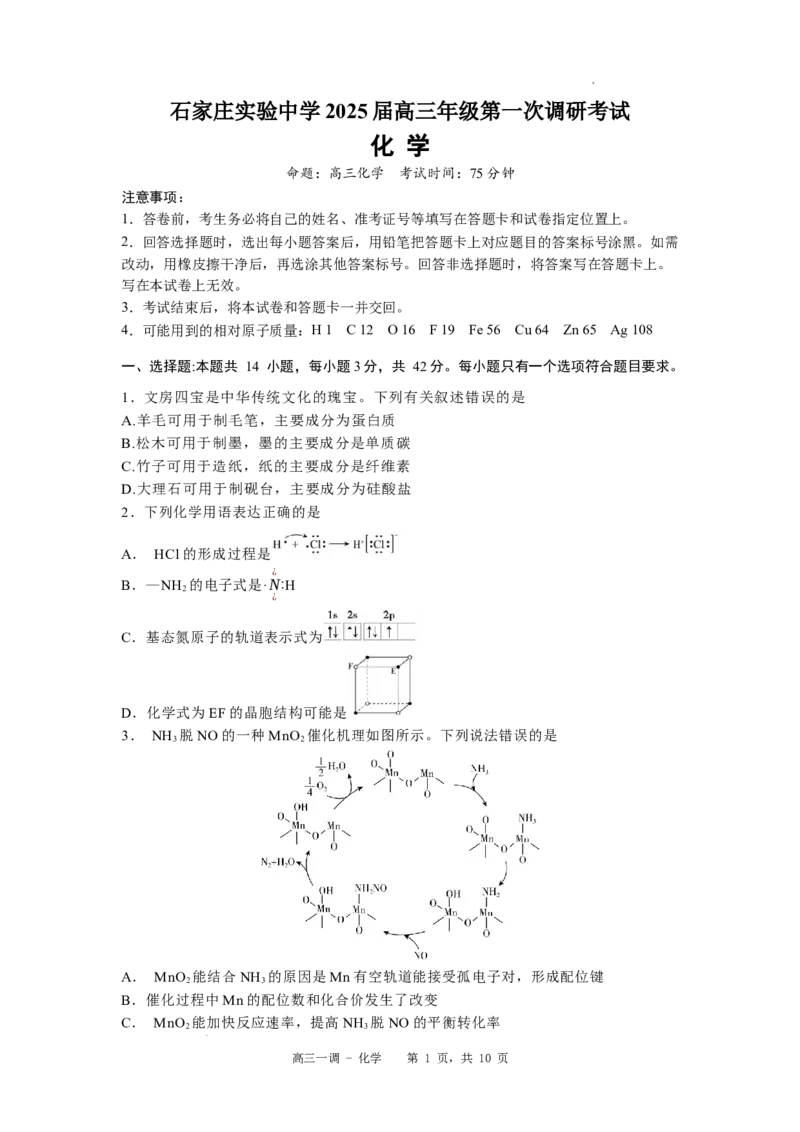
3. NH 脱NO的一种MnO 催化机理如图所示。下列说法错误的是
3 2
A. MnO 能结合NH 的原因是Mn有空轨道能接受孤电子对,形成配位键
2 3
B.催化过程中Mn的配位数和化合价发生了改变
C. MnO 能加快反应速率,提高NH 脱NO的平衡转化率
2 3
高三一调 - 化学 第 1 页,共 10 页
学科网(北京)股份有限公司催化剂
D.总反应化学方程式为4NH +4NO+O 4N +6H O
3 2 2 2
4.部分含碳或含硫物质的分类与相应化合价关系如图所示。下列推断合理的是
A.一定条件下,a→b→e→g均可实现一步转化
B.向h中加入稀盐酸产生的气体使澄清石灰水变浑浊,则h为碳酸盐
C.用氯化钡溶液可验证f中是否含有g
D.c、d均有毒,易造成大气污染
5.肉桂酸甲酯具有可可香味,主要用于日化和食品工业,是常用的定香剂或食用香
料,同时也是重要的有机合成原料,其结构简式如图。下列关于肉桂酸甲酯的说法错
误的是
A.在光照条件下可以与Cl 发生取代反应
2
B.分子式为C H O ,可使溴的四氯化碳溶液褪色
9 8 2
C.存在顺反异构体
D.分子中含有2种官能团
6.下述装置或操作能实现相应实验目的的是
装置或操作
实验目的 铁钉表面镀铜 配制银氨溶液
选项 A B
高三一调 - 化学 第 2 页,共 10 页
学科网(北京)股份有限公司装置或操作
实验目的 验证氧化性:Cl >Br >I 检验1-溴丙烷的消去反应产物丙烯
2 2 2
选项 C D
A.A B.B C.C D.D
7.下列有关离子方程式错误的是
A.向AgCl沉淀中加入过量氨水使AgCl溶解:
B.用 溶液处理锅炉水垢中的 :
C.已知: 为二元弱碱,与足量浓 反应:
D.苯酚钠溶液中通入少量 气体:
8.“中国天眼”建造的关键材料之一是SiC,工业制备SiC的原理:Ⅰ.
,Ⅱ. 。 为阿伏加德罗常数的值。下列叙述正
确的是
A.6.0g 含Si-O键数目为0.4
B.高温下,生成11.2LCO时转移的电子数为
C. 中氧化剂、还原剂质量比为1:1
D.每生成1molSiC,总反应中转移的电子数为2
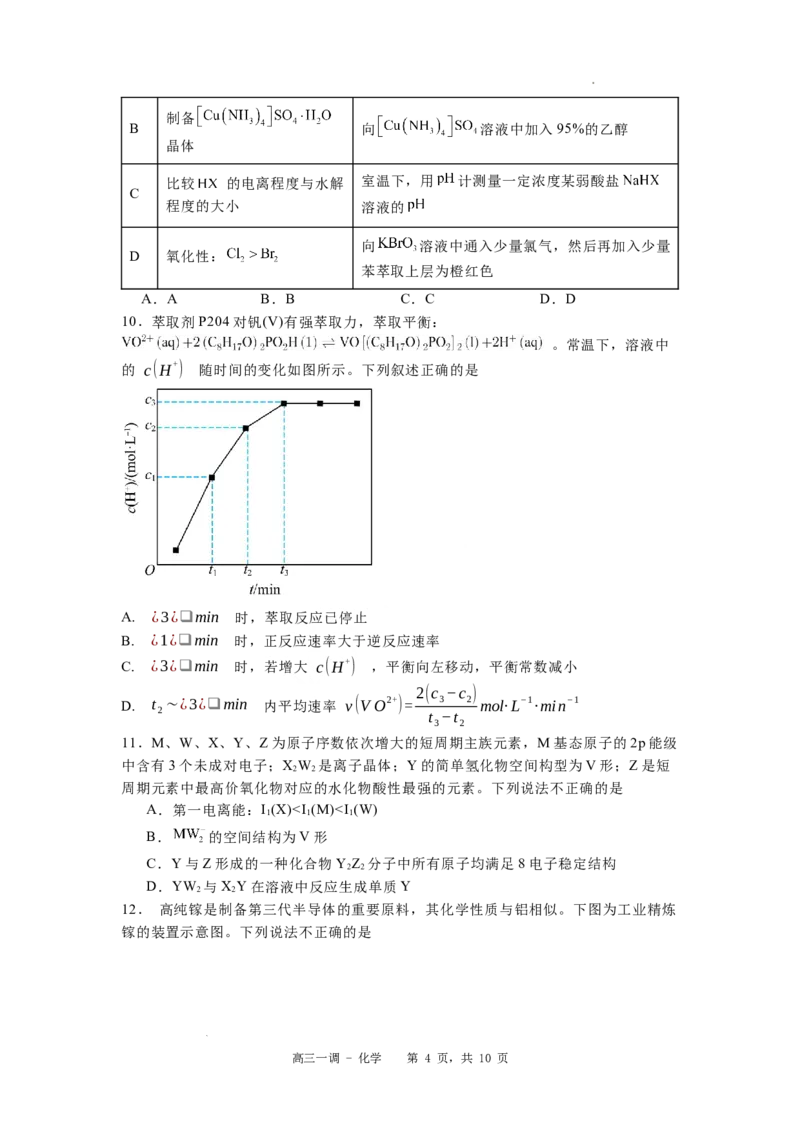
9.下列实验方案不能达到实验目的的是
选
实验目的 实验方案
项
向盛有浓度均为 的 和 混合溶
A 证明 液的试管中滴加几滴 溶液,振荡,观察
沉淀颜色
高三一调 - 化学 第 3 页,共 10 页
学科网(北京)股份有限公司制备
B 向 溶液中加入95%的乙醇
晶体
比较 的电离程度与水解 室温下,用 计测量一定浓度某弱酸盐
C
程度的大小 溶液的
向 溶液中通入少量氯气,然后再加入少量
D 氧化性:
苯萃取上层为橙红色
A.A B.B C.C D.D
10.萃取剂P204对钒(V)有强萃取力,萃取平衡:
。常温下,溶液中
的 c(H+) 随时间的变化如图所示。下列叙述正确的是
A. ¿3¿❑min 时,萃取反应已停止
B. ¿1¿❑min 时,正反应速率大于逆反应速率
C. ¿3¿❑min 时,若增大 c(H+) ,平衡向左移动,平衡常数减小
2(c −c )
D. t ∼¿3¿❑min 内平均速率 v(V O2+)= 3 2 mol·L−1·min−1
2 t −t
3 2
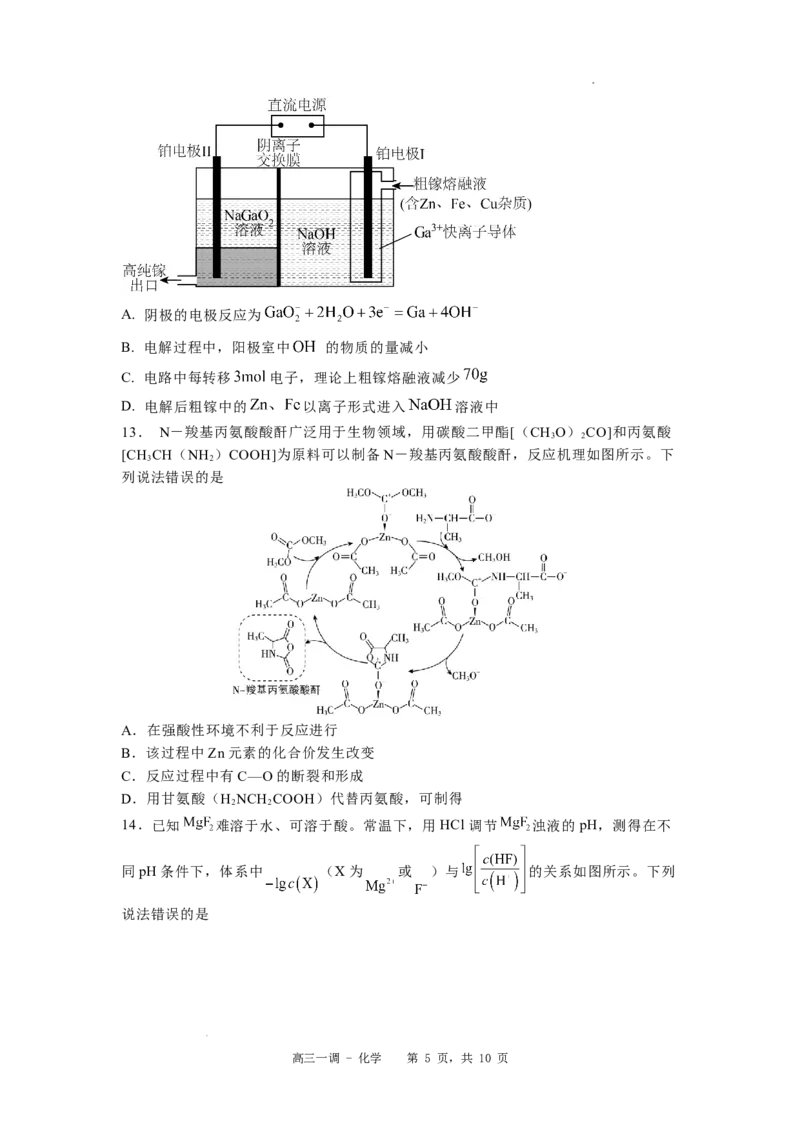
11.M、W、X、Y、Z为原子序数依次增大的短周期主族元素,M基态原子的2p能级
中含有3个未成对电子;X W 是离子晶体;Y的简单氢化物空间构型为V形;Z是短
2 2
周期元素中最高价氧化物对应的水化物酸性最强的元素。下列说法不正确的是
A.第一电离能:I (X)0,
2 2 2
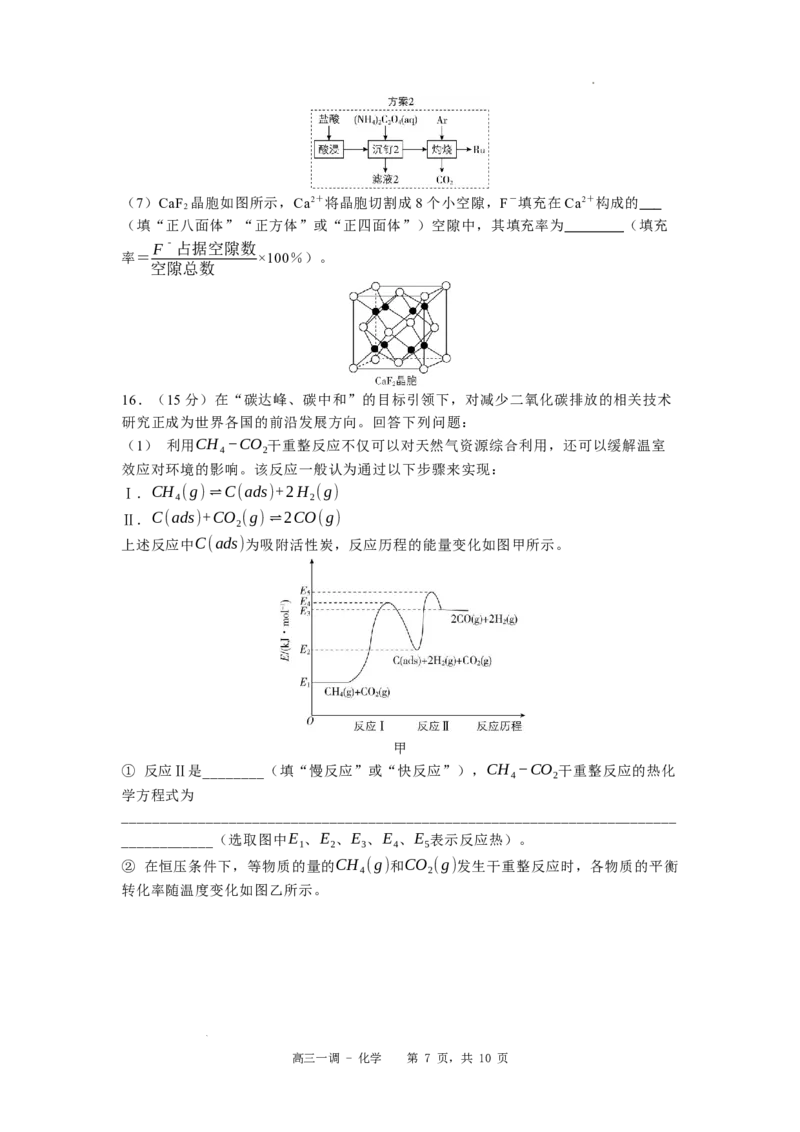
则表示CH 平衡转化率的是曲线______(填“A”或“B”),判断的依据是
4
________________________________________________________________________
________________________________________________________________________
__________________。
③ 在压强恒为p、温度为800K条件下,在密闭容器中充入等物质的量的CH (g)和
4
CO (g),若曲线A对应物质的平衡转化率为40%,曲线B对应物质的平衡转化率为
2
20%,则以上反应平衡体系中n(CO):n(H O)= ________,干重整反应的平衡常数
2
K = ________________________________________________________________(用
p
平衡分压代替平衡浓度,分压=总压×物质的量分数,列出计算式,无需化简)。
(2) 二氧化碳电还原反应提供了一种生产乙醇的方法,已知反应过程中在三种不同
催化剂表面(Cu、C/Cu、N−C/Cu)的某个基元反应的能量变化如图丙所示(IS表示
始态,TS表示过渡态,FS表示终态,∗表示催化剂活性中心原子)。科学家研究发现铜
表面涂覆一层氮掺杂的碳(N−C)可以提高乙醇的选择性,其原因可能是
________________________________________________________________________
________________________________________________。
丙
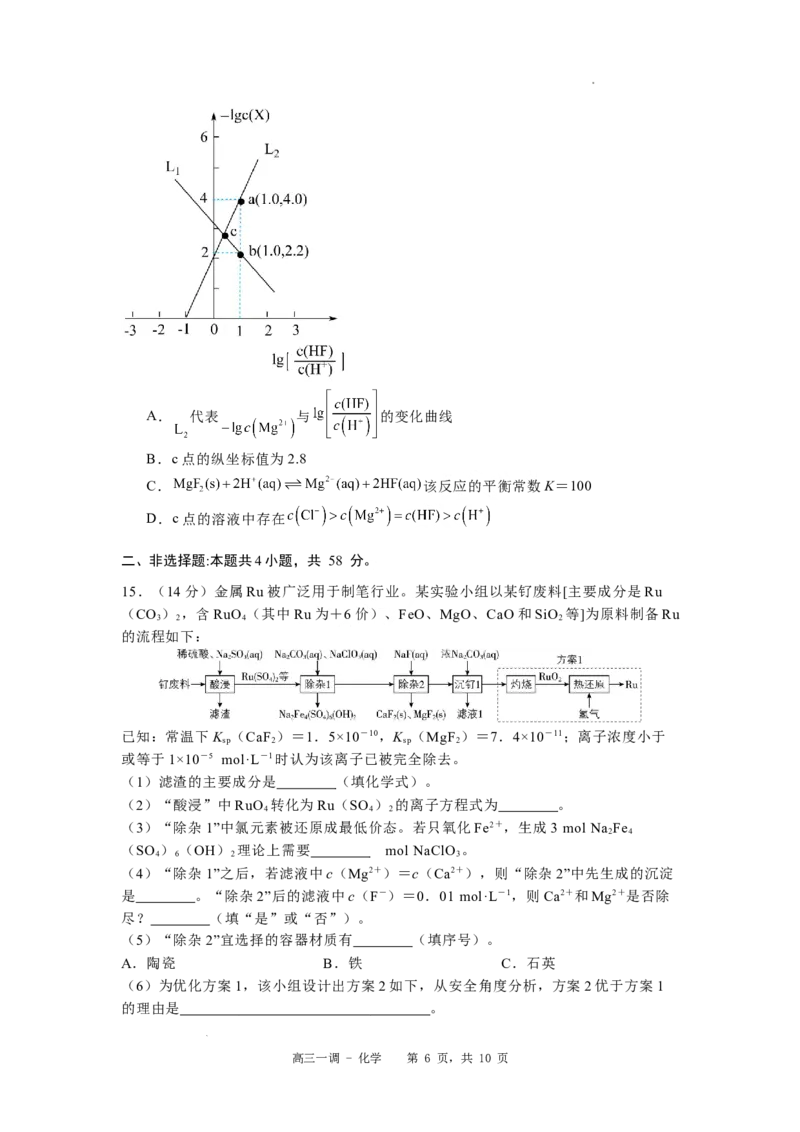
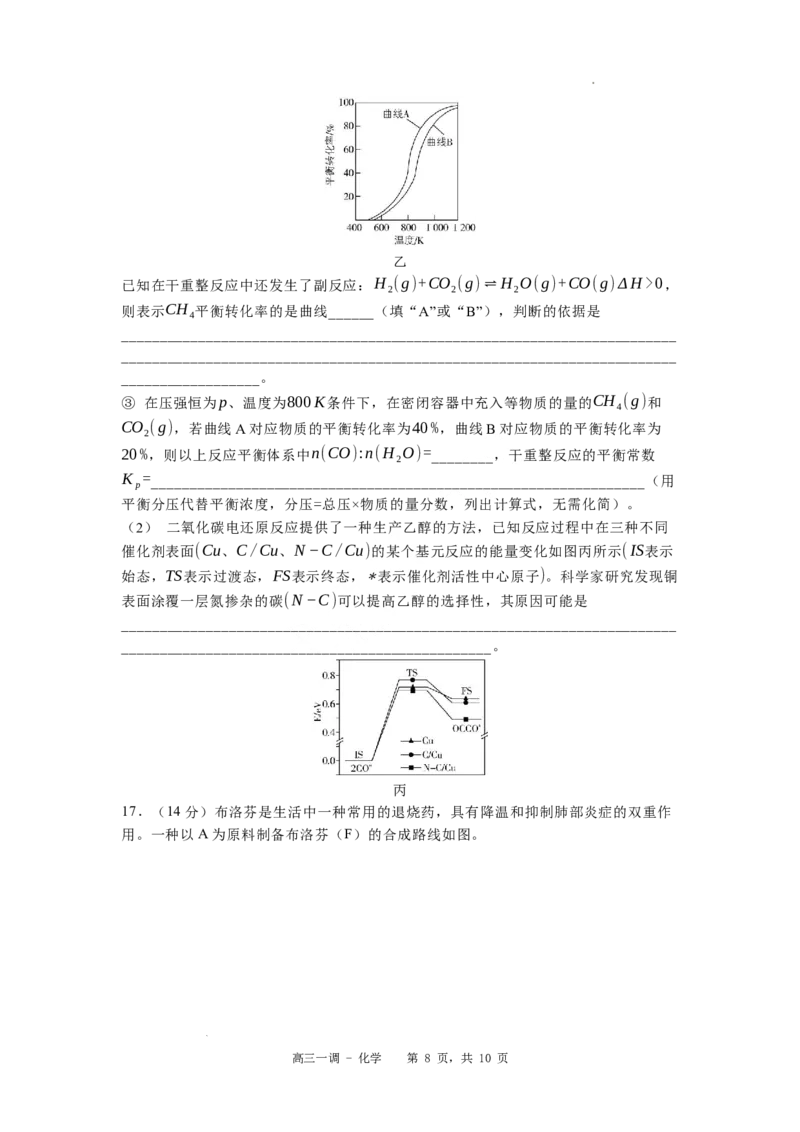
17.(14分)布洛芬是生活中一种常用的退烧药,具有降温和抑制肺部炎症的双重作
用。一种以A为原料制备布洛芬(F)的合成路线如图。
高三一调 - 化学 第 8 页,共 10 页
学科网(北京)股份有限公司已知:
(1) 的反应类型为 。
(2)写出D中含氧官能团的名称: ,每个D分子中手性碳原子数为 。
(3) 的化学方程式为 。
(4)写出E的结构简式: 。
(5)布洛芬的某种同系物X的分子式为 ,其符合下列条件的X的同分异构体Y
共有 种(不考虑立体异构)。其中核磁共振氢谱有5组吸收峰的Y的结构简式为
。
①苯环上有两个取代基;②能发生银镜反应;③1molY最多能与1molNaOH溶液反
应。
(6)缓释布洛芬( )可长时间维持退
烧、镇痛效果,请以布洛芬、乙二醇、2-甲基丙烯酸为原料,设计路线合成缓释布洛
芬 (无机试剂任选)。
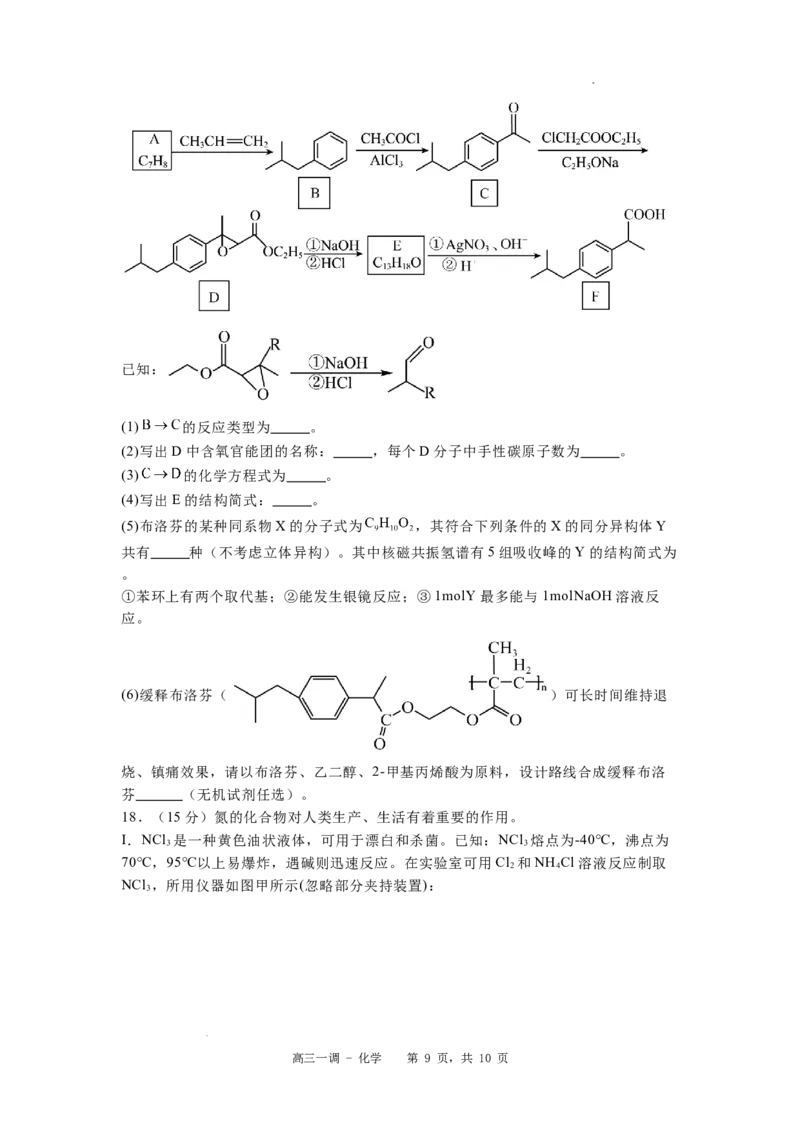
18.(15分)氮的化合物对人类生产、生活有着重要的作用。
I.NCl 是一种黄色油状液体,可用于漂白和杀菌。已知:NCl 熔点为-40℃,沸点为
3 3
70℃,95℃以上易爆炸,遇碱则迅速反应。在实验室可用Cl 和NH Cl溶液反应制取
2 4
NCl ,所用仪器如图甲所示(忽略部分夹持装置):
3
高三一调 - 化学 第 9 页,共 10 页
学科网(北京)股份有限公司Ⅱ.肼(N H )是一种重要的工业产品,实验室用NH 与Cl 合成(N H )并探究肼的性质。
2 4 3 2 2 4
实验装置如图乙所示:
回答下列问题:
(1)NCl 分子的空间结构为 。
3
(2)图A和图G中盛装浓盐酸的仪器名称为 ;若药品X为氯酸钾;则A中
反应的离子方程式为 ;根据气流方向,各仪器的连接顺序为
(用各接口字母表示,各接口所需橡胶塞已省略)。
(3)N H 的制备实验中,装置存在一处缺陷会使N H 产率降低,请提出改进方法
2 4 2 4
。
(4)探究N H 的性质:取装置F中溶液,加入适量稀硫酸振荡,置于冰水浴冷却,试管
2 4
底部得到无色晶体。经分析知该晶体为N H SO 和(N H ) SO ,可推出N H ·H O呈
2 6 4 2 5 2 4 2 4 2
(填“酸性”或“碱性”),其主要电离方程式为 。
(5)测定NCl (摩尔质量为120.5g·mol-1)的纯度:已知NCl 的制取是可逆反应,根据反
3 3
应NCl +4HCl=NH Cl+3Cl ↑,利用间接碘量法测定氯气的量即可测定NCl 的纯度。
3 4 2 3
实验步骤:
ⅰ.准确称量C中的产物1.00g置于三颈烧瓶中,加入足量浓盐酸,使用磁力搅拌器搅
拌,并鼓入氮气;
ⅱ.将混合气通入300mL0.10mol/LKI溶液中,待试管中无色液体变成黄色且颜色不再变
化,关闭氮气(溶液体积变化忽略不计);
ⅲ.量取30.00mL吸收液,加入淀粉指示剂,用0.15mol/LNa S O 标准液进行滴定,滴
2 2 3
定至终点时消耗Na S O 溶液20.00mL。(已知:反应原理为
2 2 3
I +2Na S O =Na S O +2NaI)则NCl 的纯度为 。(保留三位有效数字)
2 2 2 3 2 4 6 3
高三一调 - 化学 第 10 页,共 10 页
学科网(北京)股份有限公司