文档内容
五年(2019-2023)年高考真题分项汇编
专题 03 离子反应
〖2023年高考真题〗
考点一 离子方程式判断正误
1.(2023·湖南卷)下列有关电极方程式或离子方程式错误的是
A.碱性锌锰电池的正极反应:MnO +H O+e-=MnO(OH)+OH-
2 2
B.铅酸蓄电池充电时的阳极反应:Pb2++2H O-2e-=PbO+4H+
2 2
C.K[Fe(CN) ]溶液滴入FeCl 溶液中:K++Fe2++[Fe(CN)]3-=KFe[Fe(CN) ]↓
3 6 2 6 6
D.TiCl 加入水中:TiCl +(x+2)H O=TiO·xHO↓+4H++4Cl-
4 4 2 2 2
【答案】B
【解析】A.碱性锌锰电池放电时正极得到电子生成MnO(OH),电极方程式为MnO +H O+e-=MnO(OH)
2 2
+OH-,A正确;
B.铅酸电池在充电时阳极失电子,其电极式为:PbSO -2e-+2H O=PbO +4H++SO ,B错误;
4 2 2
C.K[Fe(CN) ]用来鉴别Fe2+生成滕氏蓝沉淀,反应的离子方程式为K++Fe2++[Fe(CN)]3-=KFe[Fe(CN) ]↓,C
3 6 6 6
正确;
D.TiCl 容易与水反应发生水解,反应的离子方程式为TiCl +(x+2)H O=TiO·xHO↓+4H++4Cl-,D正确;
4 4 2 2 2
故答案选B。
2.(2023·浙江卷)下列反应的离子方程式正确的是
A.碘化亚铁溶液与等物质的量的氯气:
B.向次氯酸钙溶液通入足量二氧化碳:
C.铜与稀硝酸:
D.向硫化钠溶液通入足量二氧化硫:
【答案】B
【解析】A.碘化亚铁溶液与等物质的量的氯气,碘离子与氯气恰好完全反应,: ,故A
错误;
B.向次氯酸钙溶液通入足量二氧化碳,反应生成碳酸氢钙和次氯酸: ,
故B正确;
C.铜与稀硝酸反应生成硝酸铜、一氧化氮和水: ,故C错误;
D.向硫化钠溶液通入足量二氧化硫,溶液变浑浊,溶液中生成亚硫酸氢钠:
,故D错误;
答案为B。考点二 离子的检验与推断
3.(2023·湖南卷)取一定体积的两种试剂进行反应,改变两种试剂的滴加顺序(试剂浓度均为 ),
反应现象没有明显差别的是
选
试剂① 试剂②
项
A 氨水 溶液
B 溶液 溶液
C 溶液 酸性 溶液
D 溶液 溶液
【答案】D
【解析】A.向氨水中滴加 溶液并振荡,由于开始时氨水过量,振荡后没有沉淀产生,发生的反应
为 ;向 溶液中滴加氨水并振荡,开始时生成白色沉淀且
沉淀逐渐增多,发生的反应为 ;当氨水过量后,继续滴加氨水沉淀逐
渐减少直至沉淀完全溶解,发生的反应为 ,因此,改变两种试剂
的滴加顺序后反应现象有明显差别,A不符合题意;
B.向 中滴加 溶液并振荡,由于开始时 过量,振荡后没有沉淀产生,发生的反应
为 ;向 溶液中滴加 并振荡,开始时生成
白色沉淀且沉淀逐渐增多,发生的反应为 ;当 过量后,继
续滴加 沉淀逐渐减少直至沉淀完全溶解,发生的反应为 ,因此,
改变两种试剂的滴加顺序后反应现象有明显差别,B不符合题意;
C.向 溶液中滴加酸性 溶液并振荡,由于开始时 是过量的, 可以被
完全还原,可以看到紫红色的溶液褪为无色,发生的反应为
;向 溶液中滴加酸性 溶液
并振荡,由于开始时 是过量的, 逐渐被 还原,可以看到紫红色的溶液逐渐变浅,
最后变为无色,因此,改变两种试剂的滴加顺序后反应现象有明显差别,C不符合题意;
D.向 溶液中滴加 溶液,溶液立即变为血红色;向 溶液中滴加 溶液,溶液同样立
即变为血红色,因此,改变两种试剂的滴加顺序后反应现象没有明显差别,D符合题意;
综上所述,本题选D。〖2022年高考真题〗
考点一 电解质与电离的概念
4.(2022·北京卷)2022年3月神舟十三号航天员在中国空间站进行了“天宫课堂”授课活动。其中太空
“冰雪实验”演示了过饱和醋酸钠溶液的结晶现象。下列说法不正确的是
A.醋酸钠是强电解质
B.醋酸钠晶体与冰都是离子晶体
C.常温下,醋酸钠溶液的
D.该溶液中加入少量醋酸钠固体可以促进醋酸钠晶体析出
【答案】B
【详解】A.醋酸钠在水溶液中能完全电离,醋酸钠是强电解质,故A正确;
B.醋酸钠晶体是离子晶体,冰是分子晶体,故B错误;
C.醋酸钠是强碱弱酸盐,常温下,醋酸钠溶液的 ,故C正确;
D.过饱和醋酸钠溶液处于亚稳态,加入少量醋酸钠固体可以促进醋酸钠晶体析出,形成饱和溶液,故D
正确;
选B。
考点二 离子共存
5.(2022·天津卷)25℃时,下列各组离子中可以在水溶液中大量共存的是
A. 、 、 、 B. 、 、 、
C. 、 、 、 D. 、 、 、
【答案】D
【详解】A. 与 反应生成次氯酸而不能大量共存,故A不符合题意;
B. 、 、 发生氧化还原反应而不能大量共存,故B不符合题意;
C. 与 反应生成氢氧化铝沉淀和二氧化碳气体而不能大量共存,故C不符合题意;
D. 、 、 、 是大量共存,故D符合题意。
综上所述,答案为D。
6.(2022·重庆卷)下列操作中,不会影响溶液中K+、Al3+、Fe3+、Ba2+、Cl-、NO 等离子大量共存的是
A.加入ZnSO B.加入Fe粉 C.通入NH D.通入CO
4 3 2
【答案】D
【详解】A.向溶液中加入硫酸锌溶液,硫酸根离子会与溶液中的钡离子反应,会影响溶液中离子的大量
共存,故A不符合题意;
B.向溶液中加入铁粉,铁离子会与铁反应生成亚铁离子,会影响溶液中离子的大量共存,故B不符合题
意;
C.向溶液中通入氨气,铝离子、铁离子会与氨水反应生成氢氧化铝、氢氧化铁沉淀,会影响溶液中离子
的大量共存,故C不符合题意;D.向溶液中通入二氧化碳,二氧化碳与溶液中离子不发生任何反应,不会影响溶液中离子的大量共存,
故D符合题意;
故选D。
考点三 离子方程式判断正误
7.(2022·全国甲卷)能正确表示下列反应的离子方程式为
A.硫化钠溶液和硝酸混合:S2-+2H+=H S↑
2
B.明矾溶液与过量氨水混合:Al3++4NH+2H O=AlO +4NH
3 2
C.硅酸钠溶液中通入二氧化碳:SiO +CO +H O=HSiO +HCO
2 2
D.将等物质的量浓度的Ba(OH) 和NH HSO 溶液以体积比1∶2混合:Ba2++2OH-+2H++SO
2 4 4
=BaSO ↓+2H O
4 2
【答案】D
【解析】A.硝酸具有强氧化性,可以将S2-氧化为S单质,自身根据其浓度大小还原为NO或NO ,反应
2
的离子方程式为4H++2NO +S2-=S↓+2NO↑+2H O(浓)或8H++2NO +3S2-=3S↓+2NO↑+4H O(稀),A错误;
2 2 2
B.明矾在水中可以电离出Al3+,可以与氨水中电离出的OH-发生反应生成Al(OH) ,但由于氨水的碱性较
3
弱,生成的Al(OH) 不能继续与弱碱发生反应,故反应的离子方程式为Al3++3NH·H O=Al(OH) ↓+3NH ,
3 3 2 3
B错误;
C.硅酸的酸性小于碳酸,向硅酸钠溶液中通入二氧化碳时,生成硅酸沉淀,二氧化碳则根据其通入的量
的多少反应为碳酸根或碳酸氢根,反应的离子方程式为SiO +H O+CO=H SiO↓+CO (CO 少量)或SiO
2 2 2 3 2
+2H O+2CO=H SiO↓+2HCO (CO 过量),C错误;
2 2 2 3 2
D.将等物质的量浓度的Ba(OH) 与NH HSO 溶液以体积比1:2混合,Ba(OH) 电离出的OH-与NH HSO
2 4 4 2 4 4
电离出的H+反应生成水,Ba(OH) 电离出的Ba2+与NH HSO 电离出的SO 反应生成BaSO 沉淀,反应的
2 4 4 4
离子方程为为Ba2++2OH-+2H++SO =BaSO ↓+2H O,D正确;
4 2
故答案选D。
8.(2022·北京卷)下列方程式与所给事实不相符的是
A.加热 固体,产生无色气体:
B.过量铁粉与稀硝酸反应,产生无色气体:
C.苯酚钠溶液中通入 ,出现白色浑浊:
D.乙醇、乙酸和浓硫酸混合加热,产生有香味的油状液体:【答案】B
【详解】A.碳酸氢钠受热之后分解生成碳酸钠、水和二氧化碳,A正确;
B.过量的铁粉与稀硝酸反应,应该生成Fe2+,B错误;
C.苯酚钠溶液中通入二氧化碳利用强酸制取弱酸生成苯酚和碳酸氢钠,C正确;
D.乙醇和乙酸在浓硫酸混合加热的条件下发生酯化反应产生有香味的油状液体乙酸乙酯和水,D正确;
故选B。
9.(2022·广东卷)下列关于 的化合物之间转化反应的离子方程式书写正确的是
A.碱转化为酸式盐:
B.碱转化为两种盐:
C.过氧化物转化为碱:
D.盐转化为另一种盐:
【答案】B
【解析】A.向氢氧化钠溶液中通入足量的二氧化碳,碱可以转化成酸式盐,离子方程式为:CO+OH-=
2
,故A错误;
B.氯气通入NaOH溶液中可以生成氯化钠和次氯酸钠两种盐,其离子方程式为:Cl+2OH-=Cl-+ClO-
2
+H O,故B正确;
2
C.钠的过氧化物为NaO,可以和水反应生成氢氧化钠,但在离子方程式里NaO 不能拆成离子,故C错
2 2 2 2
误;
D.硅酸钠溶于水,在离子方程式里要写成离子,故D错误;
故选B。
10.(2022·福建卷)实验室需对少量污染物进行处理。以下处理方法和对应的反应方程式均错误的是
A.用硫磺处理洒落在地上的水银:
B.用盐酸处理银镜反应后试管内壁的金属银:
C.用烧碱溶液吸收蔗糖与浓硫酸反应产生的刺激性气体:
D.用烧碱溶液吸收电解饱和食盐水时阳极产生的气体:
【答案】B
【详解】A.S和Hg发生化合反应生成HgS,可以用硫磺处理洒落在地上的水银,方程式为:
,处理方法和对应的反应方程式正确,不合题意;
B.Ag不活泼,不能和盐酸反应生成氢气,处理方法和对应的反应方程式均错误,符合题意;
C.蔗糖与浓硫酸反应产生的刺激性气体为SO ,可以用NaOH溶液吸收SO ,离子方程式为:
2 2
,处理方法正确,对应的反应方程式错误,不符合题意;
D.电解饱和食盐水时阳极产生的气体为Cl,可以用NaOH溶液吸收Cl,离子方程式为:
2 2
,处理方法和对应的反应方程式均正确,不符合题意;故选B。
11.(2022·浙江卷)下列反应的离子方程式不正确的是
A.盐酸中滴加 溶液:
B. 溶液中通入过量 :
C.乙醇与 酸性溶液反应:
D.溴与冷的 溶液反应:
【答案】D
【解析】A.盐酸中滴加 溶液,发生离子反应生成硅酸沉淀,该反应的离子方程式为
,A正确;
B.亚硫酸的酸性强于碳酸,因此, 溶液中通入过量 发生离子反应生成亚硫酸氢钠和二氧化碳,
该反应的离子方程式为 ,B正确;
C.乙醇与 酸性溶液反应发生反应,乙醇被氧化为乙酸, 被还原为 ,该反应的离子方程
式为 ,C正确;
D.类比氯气与碱反应可知,溴与冷的 溶液反应生成溴化钠、次溴酸钠和水,该反应的离子方程式
为 ,D不正确。
综上所述,本题选D。
12.(2022·湖南卷)下列离子方程式正确的是
A. 通入冷的 溶液:
B.用醋酸和淀粉 溶液检验加碘盐中的 :
C. 溶液中加入 产生沉淀:
D. 溶液与少量的 溶液混合:
【答案】AC
【解析】A.Cl 通入冷的 NaOH溶液中发生反应生成氯化钠和次氯酸钠,该反应的离子方程式为
2
Cl+2OH-=Cl-+ClO-+H O,A正确;
2 2
B.用醋酸和淀粉-KI溶液检验加碘盐中的 的原理是 在酸性条件下与I-发生归中反应生成I 而遇淀
2
粉变蓝,由于醋酸是弱酸,在离子方程式中不能用H+表示,因此B不正确;
C.HO 具有较强的氧化性,FeSO 溶液中加入HO 产生的沉淀是氢氧化铁,该反应的离子方程式为2Fe2+
2 2 4 2 2
+ H O+4H O=2Fe(OH) ↓+4H+,C正确;
2 2 2 3
D.NaHCO 溶液与少量的Ba(OH) 溶液混合后发生反应生成碳酸钡沉淀、碳酸钠和水,NaHCO 过量,
3 2 3
Ba(OH) 全部参加反应,因此该反应的离子方程式为2 +Ba2++2OH-=BaCO ↓+ +2H O,D不正确;
2 3 2
综上所述,本题选AC。考点四 离子的检验与推断
13.(2022·广东卷)实验室进行粗盐提纯时,需除去 和 ,所用试剂包括 以及
A. B.
C. D.
【答案】A
【解析】除杂过程中不能引入新杂质,同时为保证除杂完全,所加除杂试剂一般过量,然后选择合适的试
剂将所加过量的物质除去。
粗盐中主要成分为NaCl。除去Ca2+选用 将其转化为沉淀,为了不引入新杂质,所加物质的阳离子为
Na+,即选用NaCO 除去Ca2+,同理可知,除去Mg2+需选用NaOH,除去 需选用BaCl ,因所加除杂
2 3 2
试剂均过量,因此向粗盐样品中加入除杂试剂的顺序中,BaCl 先于NaCO 加入,利用NaCO 除去Ca2+和
2 2 3 2 3
多余的BaCl ,因NaCO、NaOH均过量,成为新杂质,需要过滤后向滤液中加入HCl,至溶液中不再有
2 2 3
气泡产生,以此除去NaCO、NaOH,然后将溶液蒸干得到较为纯净的食盐产品,综上所述,答案为A。
2 3
14.(2022·全国乙卷)某白色粉末样品,可能含有 、 、 和 。取少量样品
进行如下实验:
①溶于水,得到无色透明溶液
②向①的溶液中滴加过量稀盐酸,溶液变浑浊,有刺激性气体逸出。离心分离。
③取②的上层清液,向其中滴加 溶液有沉淀生成。
该样品中确定存在的是
A. B.
C. D.
【答案】A
【解析】由题意可知,①取少量样品溶于水得到无色透明溶液,说明固体溶于水且相互之间能共存,②向
①的溶液中滴加过量稀盐酸,溶液变浑浊,有刺激性气体放出,说明固体中存在NaSO,发生反应SO
2 2 3 2
+2H+=S↓+H O+SO ↑,离心分离,③取②的上层清液,向其中滴加BaCl 溶液,有沉淀生成,则沉淀为
2 2 2
BaSO,说明固体中存在NaSO ,不能确定是否有NaSO 和NaCO,NaSO 与过量盐酸反应生成二氧化
4 2 4 2 3 2 3 2 3
硫,NaCO 与过量盐酸反应生成二氧化碳,而这些现象可以被NaSO 与过量盐酸反应的现象覆盖掉,综
2 3 2 2 3
上分析,该样品中确定存在的是:NaSO 、NaSO,
2 4 2 2 3
答案选A。
〖2021年高考真题〗
考点一 离子共存
15.(2021·湖南)对下列粒子组在溶液中能否大量共存的判断和分析均正确的是
粒子组 判断和分析不能大量共存,因发生反应:
A 、 、 、
不能大量共存,因发生反应:
B 、 、 、
C 、 、 、 能大量共存,粒子间不反应
D 、 、 、 能大量共存,粒子间不反应
【答案】B
【详解】
A.Al3+和NH HO生成Al(OH) 沉淀而不是生成Al ,故A错误;
3 2 3
B.S 和H+反应生成单质硫、二氧化硫和水,离子方程式为:2H++ S =S↓+SO↑+H O,故B正确;
2 2 2 2
C.Fe3+可以将HO 氧化得Fe2+和O,不能大量共存,故C错误;
2 2 2
D.在酸性条件下Mn 能将Cl-氧化为Cl,不能大量共存,故D错误;
2
答案选B。
考点二 离子方程式判断正误
16.(2021·浙江)不能正确表示下列变化的离子方程式是
A.碳酸镁与稀盐酸反应:
B.亚硫酸氢钠的水解:
C.锌溶于氢氧化钠溶液:
D.亚硝酸钠与氯化铵溶液受热反应:
【答案】A
【详解】
A.碳酸镁与稀盐酸反应生成氯化镁、二氧化碳和水,反应的离子方程式为MgCO +2H+=Mg2+
3
+H O+CO↑,故A错误;
2 2
B.亚硫酸氢钠是弱酸的酸式盐,在溶液中水解生成亚硫酸和氢氧化钠,水解的离子方程式为HSO +H O
2
HSO +OH-,故B正确;
2 3
C.锌与氢氧化钠溶液反应生成偏锌酸钠和氢气,反应的离子方程式为Zn+2OH-+2H O=[Zn(OH) ]-+H ↑,
2 4 2
故C正确;
D.亚硝酸钠溶液与氯化铵溶液共热反应生成氯化钠、氮气和水,反应的离子方程式为NO +NH
N↑+2H O,故D正确;
2 2故选A。
17.(2021·广东)宏观辨识与微观探析是化学学科核心素养之一。下列物质性质实验对应的反应方程式书
写正确的是
A. 放入水中:
B. 通过灼热铁粉:
C.铜丝插入热的浓硫酸中:
D. 通入酸性 溶液中:
【答案】D
【详解】
A. 放入水中化学方程式应该是: ,A选项中氧元素不守恒,A
错误;
B. 通过灼热铁粉应高温条件下生成四氧化三铁和氢气,B错误;
C.铜丝插入热的浓硫酸中生成的气体不是氢气,应是二氧化硫,C错误;
D. 通入酸性 溶液中, 被 氧化为 , 被 还原为 ,再根据得失
电子守恒、电荷守恒和元素守恒可得离子方程式为 ,D
正确;
故选D。
18.(2021·全国乙)下列过程中的化学反应,相应的离子方程式正确的是
A.用碳酸钠溶液处理水垢中的硫酸钙:
B.过量铁粉加入稀硝酸中:
C.硫酸铝溶液中滴加少量氢氧化钾溶液:
D.氯化铜溶液中通入硫化氢:
【答案】A
【详解】
A.硫酸钙微溶,用碳酸钠溶液处理水垢中的硫酸钙转化为难溶的碳酸钙,离子方程式为:C
+CaSO =CaCO +S ,故A正确;
4 3
B.过量的铁粉与稀硝酸反应生成硝酸亚铁、一氧化氮和水,离子方程式应为:3Fe+8H++2N =3Fe2+
+2NO↑+4H O,故B错误;
2
C.硫酸铝溶液与少量氢氧化钾溶液反应生成氢氧化铝沉淀和硫酸钾,离子方程式应为:Al3++3OH-
=Al(OH) ↓,故C错误;
3
D.硫化氢为弱电解质,书写离子方程式时不能拆,离子方程式应为:Cu2++H S=CuS↓+2H+,故D错误;
2答案选A。
〖2020年高考真题〗
考点一 电解质与电离的概念
19.(2020·新课标Ⅱ)二氧化碳的过量排放可对海洋生物的生存环境造成很大影响,其原理如下图所示。
下列叙述错误的是
A.海水酸化能引起 浓度增大、 浓度减小
B.海水酸化能促进CaCO 的溶解,导致珊瑚礁减少
3
C.CO 能引起海水酸化,其原理为 H++
2
D.使用太阳能、氢能等新能源可改善珊瑚的生存环境
【答案】C
【解析】海水酸化,H+浓度增大,平衡H++ 正向移动, 浓度减小, 浓度增大,
⇌
A正确;海水酸化, 浓度减小,导致CaCO 溶解平衡正向移动,促进了CaCO 溶解,导致珊瑚礁减
3 3
少,B正确;CO 引起海水酸化的原理为:CO+H O HCO H++ , H++ ,导致H+浓
2 2 2 2 3 ⇌
度增大,C错误;使用太阳能、氢能等新能源,可以⇌减少化石⇌能源的燃烧,从而减少 CO 的排放,减弱海
2
水酸化,从而改善珊瑚礁的生存环境,D正确;答案选C。
考点二 离子共存
20.(2020·江苏卷)常温下,下列各组离子在指定溶液中能大量共存的是
A. 氨水溶液:Na+、K+、OH-、NO
B. 盐酸溶液:Na+、K+、SO 、SiO
C. KMnO 溶液:NH 、Na+、NO 、I-
4
D. AgNO 溶液:NH 、Mg2+、Cl-、SO
3
【答案】A
【解析】在0.1mol/L氨水中,四种离子可以大量共存,A选;在0.1mol/L盐酸中含有大量氢离子,四种离子中硅酸根可以与氢离子反应生成硅酸沉淀,故不能共存,B不选;MnO -具有强氧化性,可以将碘离子
4
氧化成碘单质,故不能共存,C不选;在0.1mol/L硝酸银溶液中,银离子可以与氯离子、硫酸根离子反应
生成氯化银、硫酸银沉淀,不能共存,D不选;故选A。
考点三 离子方程式判断正误
21.(2020·新课标Ⅲ)对于下列实验,能正确描述其反应的离子方程式是
A.用NaSO 溶液吸收少量Cl:
2 3 2
B.向CaCl 溶液中通入CO:
2 2
C.向HO 溶液中滴加少量FeCl :
2 2 3
D.同浓度同体积NH HSO 溶液与NaOH溶液混合:
4 4
【答案】A
【解析】用NaSO 溶液吸收少量的Cl,Cl 具有强氧化性,可将部分SO氧化为SO,同时产生的氢离子与
2 3 2 2
剩余部分SO结合生成HSO,Cl 被还原为Cl-,反应的离子反应方程式为:3SO+Cl+H O=2HSO+2Cl-
2 2 2
+SO,A正确;向CaCl 溶液中通入CO,HCO 是弱酸,HCl是强酸,弱酸不能制强酸,故不发生反应,
2 2 2 3
B错误;向HO 中滴加少量的FeCl ,Fe3+的氧化性弱于HO,不能氧化HO,但Fe3+能催化HO 的分解,
2 2 3 2 2 2 2 2 2
正确的离子方程式应为2HO 2HO+O↑,C错误;NH HSO 电离出的H+优先和NaOH溶液反应,同
2 2 2 2 4 4
浓度同体积的NH HSO 溶液与NaOH溶液混合,氢离子和氢氧根恰好完全反应,正确的离子反应方程式应
4 4
为:H++OHˉ=HO,D错误。
2
22.(2020·江苏卷)下列指定反应的离子方程式正确的是
A.Cl 通入水中制氯水:
2
B.NO 通入水中制硝酸:
2
C. NaAlO 溶液中通入过量CO:
2 2
D. AgNO 溶液中加入过量浓氨水:
3
【答案】C
【解析】次氯酸为弱酸,书写离子方程式时应以分子形式体现,正确的是Cl+HO H++Cl-+
2 2
HClO,故A错误;NO 与HO反应:3NO +HO=2HNO +NO,离子方程式为3NO +HO=2H++2NO -+
2 2 2 2 3 2 2 3
NO,故B错误;碳酸的酸性强于偏铝酸,因此NaAlO 溶液通入过量的CO,发生的离子方程式为AlO-+
2 2 2
CO+2HO=Al(OH) ↓+HCO -,故C正确;AgOH能与过量的NH ·H O反应生成[Ag(NH)]OH,故D错误;
2 2 3 3 3 2 3 2
答案为C。
23.(2020·天津卷)下列离子方程式书写正确的是
A.CaCO 与稀硝酸反应:
3
B.FeSO 溶液与溴水反应:
4C.NaOH溶液与过量HC O 溶液反应:
2 2 4
D.C HONa溶液中通入少量CO:
6 5 2
【答案】B
【解析】CaCO 与稀硝酸反应生成硝酸钙和水和二氧化碳,碳酸钙是固体难溶物,写离子方程式时不能拆
3
成离子形式,正确的离子方程式为: ,故A错误;FeSO 溶液与溴
4
水反应时,溴单质氧化了亚铁离子,将亚铁离子氧化成铁离子,正确的离子方程式为:
,故B正确;氢氧化钠与过量的草酸反应,说明氢氧化钠的量不足,生成草
酸氢钠,正确的离子方程式为 ,故C错误;苯酚钠中通入少量或过量二氧化碳
都生成苯酚和碳酸氢钠,苯酚的酸性弱于碳酸强于碳酸氢根,故正确的离子方程式为:
,故D错误;答案选B。
24.(2020·浙江卷)能正确表示下列反应的离子方程式是( )
A. 溶液与少量 溶液反应:
B.电解 水溶液:
C.乙酸乙酯与 溶液共热:
D. 溶液中滴加稀氨水:
【答案】C
【解析】(NH )Fe(SO ) 可以写成(NH )SO ‧FeSO ,(NH )Fe(SO ) 溶液与少量Ba(OH) 溶液反应, OH-先
4 2 4 2 4 2 4 4 4 2 4 2 2
与Fe2+反应,再和NH +反应,由于Ba(OH) 较少,NH +不会参与反应,离子方程式为:Fe2++SO2-+ Ba2++
4 2 4 4
2OH-=Fe(OH) ↓+BaSO ↓,A错误;用惰性材料为电极电解MgCl 溶液,阳极反应为:2Cl--2e-=Cl↑,阴极
2 4 2 2
反应为:2HO+2e-+Mg2+=Mg(OH) ↓+H ↑,总反应的离子方程式为:Mg2++2Cl-+2H O= Mg(OH) ↓+H ↑+
2 2 2 2 2 2
Cl↑,B 错误;乙酸乙酯与氢氧化钠溶液共热时发生水解,生成乙酸钠和乙醇,离子方程式为:
2
CHCOOCH CH+OH- CHCOO-+CH CHOH,C正确;向硫酸铜溶液中滴加氨水,氨水与硫酸铜发
3 2 3 3 3 2
生复分解反应生成氢氧化铜沉淀和硫酸铵,一水合氨为弱电解质,在离子反应中不能拆开,离子方程式为:
Cu2++2NH•H O=2NH ++Cu(OH) ↓,D错误。答案选C。
3 2 4 2
〖2019年高考真题〗
考点一 离子共存
25.[2019江苏] 室温下,下列各组离子在指定溶液中能大量共存的是
A.0.1 mol·L−1NaOH溶液:Na+、K+、 、B.0.1 mol·L−1FeCl 溶液:K+、Mg2+、 、
2
C.0.1 mol·L−1KCO 溶液:Na+、Ba2+、Cl−、OH−
2 3
D.0.1 mol·L−1HSO 溶液:K+、 、 、
2 4
【答案】A
【解析】A.是一个碱性环境,离子相互间不反应,且与OH-不反应,能大量共存;B.MnO -具有强氧化
4
性,Fe2+具有还原性,两者会发生氧化还原反应而不能大量共存;C.Ba2+可以与CO2-发生反应生成沉淀而
3
不能大量存在;D.酸性条件下H+与HSO -不能大量共存,同时酸性条件下NO -表现强氧化性会将HSO -氧
3 3 3
化而不能大量共存;故选A。
考点二 离子方程式判断正误
26.[2019新课标Ⅱ] 下列化学方程式中,不能正确表达反应颜色变化的是( )
A.向CuSO 溶液中加入足量Zn粉,溶液蓝色消失:Zn+CuSO Cu+ZnSO
4 4 4
B.澄清的石灰水久置后出现白色固体:Ca(OH) +CO CaCO ↓+H O
2 2 3 2
C.NaO 在空气中放置后由淡黄色变为白色:2NaO 2NaO+O↑
2 2 2 2 2 2
D.向Mg(OH) 悬浊液中滴加足量FeCl 溶液出现红褐色沉淀:3Mg(OH) +2FeCl 2Fe(OH) +3MgCl
2 3 2 3 3 2
【答案】C
【解析】金属活动性顺序:Zn>Cu,则向硫酸铜溶液中加入足量锌粉,会发生置换反应,其反应的方程式
为:Zn+CuSO =ZnSO+Cu,使溶液的蓝色消失,A正确;澄清石灰水久置以后会与空气中的二氧化碳反
4 4
应而生产碳酸钙白色沉淀,其反应的方程式为:CO+Ca(OH) =CaCO ↓+H O,B正确;过氧化钠在空气中
2 2 3 2
放置,会与空气中的水蒸气及二氧化碳发生反应,最终生成白色且稳定的碳酸钠,涉及的转化关系有:
NaO→NaOH→Na CO·10H O→Na CO ,C错误;向氢氧化镁悬浊液中滴加足量氯化铁溶液,会发生沉淀
2 2 2 3 2 2 3
的转化,化学方程式为:3Mg(OH) + 2FeCl = 2Fe(OH) + 3MgCl ,D项正确;答案选C。
2 3 3 2
27.[2019江苏] 下列指定反应的离子方程式正确的是
A.室温下用稀NaOH溶液吸收Cl:Cl+2OH− ClO−+Cl−+H O
2 2 2
B.用铝粉和NaOH溶液反应制取少量H:Al+2OH− +H ↑
2 2
C.室温下用稀HNO 溶解铜:Cu+2 +2H+ Cu2++2NO↑+H O
3 2 2
D.向NaSiO 溶液中滴加稀盐酸:NaSiO+2H+ HSiO↓+2Na+
2 3 2 3 2 3
【答案】A
【解析】NaOH为强碱,可以拆成离子形式,氯气单质不能拆,产物中 NaCl和NaClO为可溶性盐,可拆
成离子形式,水为弱电解质,不能拆,A正确;该离子方程式反应前后电荷不守恒,正确的离子方程式为:
2Al+2OH-+2H O =2AlO -+3H ↑,B错误;室温下,铜与稀硝酸反应生成 NO ,正确的离子方程式为:
2 2 2
3Cu+2NO-+8H+=2NO↑+3Cu2++4H O,C错误;NaSiO 为可溶性盐,可以拆成离子形式,正确的离子方程
3 2 2 3
式为:SiO2-+2H+=H SiO↓,D错误;综上所述,本题应选A.
3 2 3
28.[2019天津] 下列离子方程式能用来解释相应实验现象的是
实验现象 离子方程式向氢氧化镁悬浊液中滴加氯化铵溶液,
A
沉淀溶解
向沸水中滴加饱和氯化铁溶液得到红褐
B
色液体
C 二氧化硫使酸性高锰酸钾溶液褪色
D 氧化亚铁溶于稀硝酸
【答案】A
【解析】A、氢氧化镁碱性强于氨水,故A能用来解释相应实验现象;B、制氢氧化铁胶体条件是加热,
在化学式后注明胶体,得不到沉淀,离子方程式为:Fe3++3HO Fe(OH) (胶体)+3H+,故B不能
2 3
用来解释相应实验现象;C、电荷不守恒,正确的离子方程式为:5SO +2MnO -+2HO=2Mn2++4H++
2 4 2
5SO 2-,故C不能用来解释相应实验现象;D、硝酸具有强氧化性,其可将亚铁氧化成铁离子,正确的离
4
子方程式为:3FeO+10H++NO -=3Fe3++NO↑+5HO,故D不能用来解释相应实验现象;故选A。
3 2
29.[2019年4月浙江选考]不能正确表示下列变化的离子方程式是
A.二氧化硫与酸性高锰酸钾溶液反应:5SO +2HO+2MnO - 2Mn2++5SO +4H+
2 2 4
B.酸性碘化钾溶液中滴加适量双氧水:2I−+2H++HO I+2HO
2 2 2 2
C.硅酸钠溶液和盐酸反应:SiO2-+2H+ HSiO↓
3 2 3
D.硫酸铜溶液中加少量的铁粉:3Cu2++2Fe 2Fe3++3Cu
【答案】D
【解析】Fe3+氧化性大于Cu2+,所以Cu2+只能将Fe氧化到Fe2+,因而硫酸铜溶液中加少量的铁粉的离子方
程式为Cu2++Fe Fe2++Cu,D项错误。其他3个选项的离子方程式都是正确的。
故答案选D。
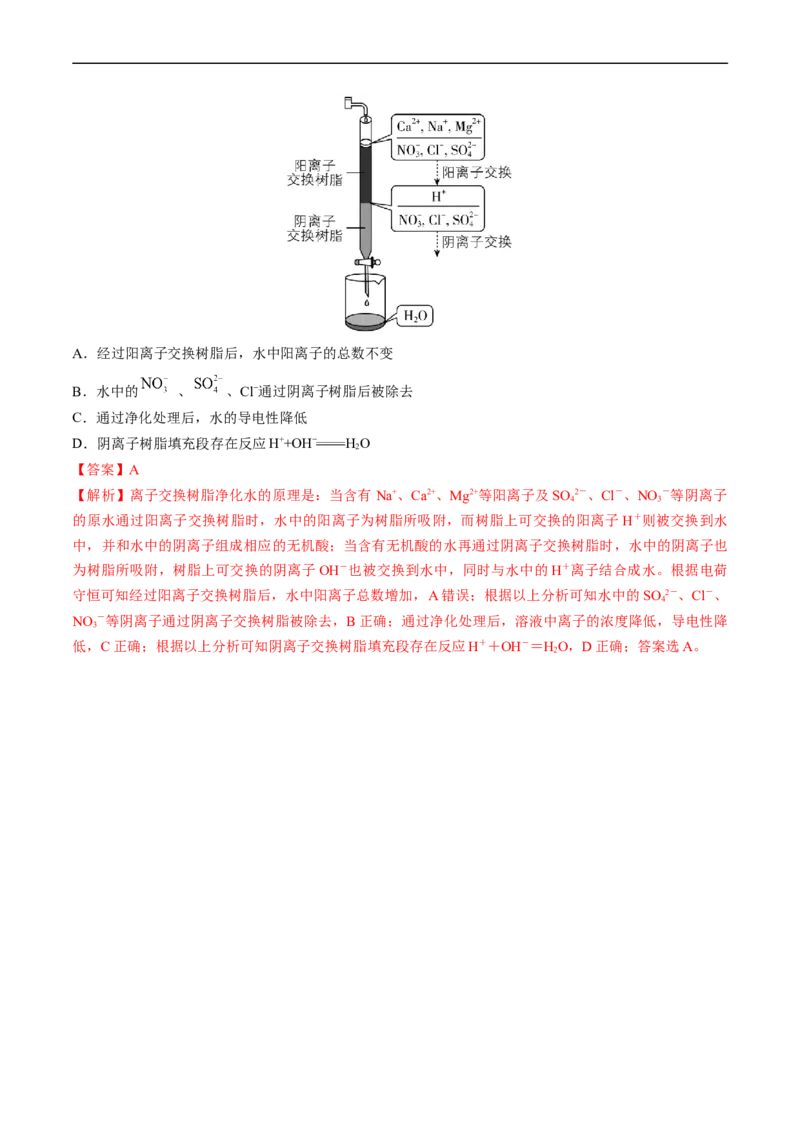
考点三 离子的检验与推断
30.[2019新课标Ⅲ]离子交换法净化水过程如图所示。下列说法中错误的是A.经过阳离子交换树脂后,水中阳离子的总数不变
B.水中的 、 、Cl−通过阴离子树脂后被除去
C.通过净化处理后,水的导电性降低
D.阴离子树脂填充段存在反应H++OH− HO
2
【答案】A
【解析】离子交换树脂净化水的原理是:当含有 Na+、Ca2+、Mg2+等阳离子及SO 2-、Cl-、NO -等阴离子
4 3
的原水通过阳离子交换树脂时,水中的阳离子为树脂所吸附,而树脂上可交换的阳离子 H+则被交换到水
中,并和水中的阴离子组成相应的无机酸;当含有无机酸的水再通过阴离子交换树脂时,水中的阴离子也
为树脂所吸附,树脂上可交换的阴离子OH-也被交换到水中,同时与水中的H+离子结合成水。根据电荷
守恒可知经过阳离子交换树脂后,水中阳离子总数增加,A错误;根据以上分析可知水中的SO 2-、Cl-、
4
NO -等阴离子通过阴离子交换树脂被除去,B正确;通过净化处理后,溶液中离子的浓度降低,导电性降
3
低,C正确;根据以上分析可知阴离子交换树脂填充段存在反应H++OH-=HO,D正确;答案选A。
2