文档内容
湘 豫 名 校 联 考
#$#"届春季学期高三第二次模拟考试
化学参考答案
题号 % & ’ !$ !! !# !(
答案 ) * + , ) * )
一!选择题"本题包括%小题#每小题-分#共"#分$每小题只有一个选项符合
题意$
%.)!%解析&采用数字烟花!可以减少实体烟花燃放!节省能源!减少/0
#
等大气污染物排放!保护环境!,项正
确"#玉琮$的主要成分是含镁%钙%铝等元素的硅酸盐!+项正确")101是极性分子!)项错误"聚乳酸%碳
(
酸酯材料在自然界中均可水解生成可溶性小分子!以达到降解的目的!*项正确&
&.*!%解析&氢键不是化学键!是特殊的分子间作用力!,项错误"氧原子若采取23( 杂化!则不能形成磷氧双
键!+项错误"与4连接的羟基%磷酸酯基均能与5601溶液反应!碳原子上连接的羟基不能与5601溶液
反应!故!789果糖二磷酸钠最多能与(7895601溶液反应!)项错误"氧%氮%磷的电负性依次减小!同周
期非金属元素的电负性大于金属元素的电负性!故氧%磷%钠的电负性依次减小!*项正确&
’.+!%解析&四环素分子中含氧官能团有醇羟基%酚羟基%酮羰基和酰胺基!,项正确&!个四环素分子中含:
个手性碳原子!如图 ’标 的碳原子为手性碳原子(!+项错误&四环素分子
中含有碳碳双键!能与溴发生加成反应"苯环上酚羟基邻%对位有氢原子!能与溴发生邻%对位取代反应!)项
正确&四环素分子含有酚羟基%醇羟基!它们都能与0 发生反应!所以四环素分子具有抗氧化性!*项正确&
#
!$.,!%解析&基态;原子电子排布式为!2##2##3#!;为碳元素"基态<原子电子排布式为!2##2##3-(2#!<为
镁元素"/0
#
能使品红溶液褪色!加热褪色后的溶液又恢复红色!故=为氧元素!>为硫元素&电负性)0"
/"?@!故?@0中离子键百分数比?@/大!,项错误"杂化类型相同的分子!中心原子上孤电子对数越多!
键角越小"杂化类型相同%孤电子对数相等的分子!中心原子电负性越大!成键电子对之间排斥力越大!键角
越大!故键角))1 ""1
#
0"1
#
/!+项正确"0的原子半径小于/的原子半径!故1*0的键能大于1*/的
键能!)项正确"在)%0%/%?@中!0的第一电离能最大!*项正确&
!!.)!%解析&放电时!电极!为负极!电极#为正极!正极电势高于负极电势!,项错误"充电时!电极#为阳
极!)A/发生氧化反应!+项错误"放电时!电极!发生氧化反应!锌生成四羟基合锌离子!)项正确"充电
#
时!电极#发生反应))A
#
/B"CB####)A#DD/!充电时!阳极材料有#789)A由D!价升高至D#价进入溶
液!转移"789电子!故电极#净减-"@时转移#789电子!*项错误&
!#.*!%解析&铜%银都不能溶于氨水!,项错误"溴能与5601溶液发生歧化反应!生成56+E%56+E0溶于水
形成无色溶液!因此水层无色!+项错误"碘水也显棕黄色!不能证明10 氧化FC#D还是GB!)项错误"生
# #
石灰吸水放出大量的热!并生成了碱!促进51 逸出!通过碱石灰可干燥氨气!*项正确&
(
化学参考答案!第!!!!!页!共"页"
{#{QQABCQAUggCIAIAAABgCAQniCAGQkAAACCoOAAAIoAAAyBFABAA=}#}
书书书!(.)!%解析&+1@)9
"
,#B与+4H)9
"
,#B组成类型相同!则直线斜率相同!由6%I点数据可求出稳定常数)
!稳 -+1@)9
"
,#B.J!.$K!$!:!!稳 -+4H)9
"
,#B.J!.$K!$!-!由L点数据可求出稳定常数)!稳 -+,@)9
#
,B.J
#.$K!$:!,%+项错误"+1@)9
"
,#BD4H#D$%+4H)9
"
,#BD1@#D的平衡常数)!J "
"
-
-
+
+
4
1
H
@
)
)
9
9
"
"
,#
,#
B
B
.
.
/
/
"
"
’
’
1
4
@
H
#
#
D
D
(
(
J
!稳 -+4H)9
"
,#B.
J
!.$K!$!-
J!$!)项正确"根据稳定常数可知!组成类型相同的配合物!稳定常数越大!
!稳 -+1@)9
"
,#B. !.$K!$!:
越难解离!金属离子浓度越小!故金属离子浓度)+,@)9
#
,B"+1@)9
"
,#B"+4H)9
"
,#B!*项错误&
三!非选择题"本题包括"小题#共:&分$
#%.!!:分"#答案$!!"取:$7M蒸馏水注入合适烧杯中%另取:$7M!:789&MB!浓硝酸沿烧杯内壁缓慢注入
水中%并用玻璃棒不断搅拌至均匀!#分%合理即可"
&$$!’$$N
!#",@# /D0 #########,@D/0
#
!#分"
!("(,@D50
(
BD"1D###(,@DD50&D#1
#
0!#分"
!""用磁铁反复接近银粉表面!!分"!过滤!!分"
!:"!.’K!$##!#分"
"’-"#
!-"
$
O!#分"!产品含有的56
#
/等杂质与G
#
反应!!分"
!%")!#分"
%解析&’!(!P!为体积比!直接将等体积两种液体混合即可!但需要将浓硝酸加入水中!并用玻璃棒不断
搅拌&
’#(硫化银在焙烧中生成银和/0 &
#
’((银溶于硝酸生成硝酸银%水和50&
’"(先用磁铁吸附混合物中的铁粉!再将含少量铁粉的银粉用盐酸溶解除去&
! !
’:(#+,@’/ # 0 ( ( # ,(BD/#B###,@# /’D"/ # 0# ( B的平衡常数! # J ! K!# J ’(.$K!$!((#K-.$K!$B:$ (
23 !
!.’K!$##&
#:$7M
"789/MB!K’#K!$B((MK K#K#"&@/78MB!
#:.$$7M
’-(根据反应的化学方程式可知!产品纯度!J K
$@
"’-"#
!$$OJ
$
O&硫化钠与碘发生反应)/#BDG ####/D#GB!使消耗的G
#
增多!测得结果偏高&
槡#
’%(面心立方最密堆积晶胞的面对角线(个原子相切!设晶胞参数为%!原子半径为&!得’"&(#J#%#!&J %!
"
"
"&(K"
( 槡#
"J
%(
J
-
"&故选)&
#&.!!(分"#答案$!!"作溶剂!或降低产品溶解度"!!分"
!#"避免产品分解’避免产品被氧化’避免产品被引燃!#分%任写两条%合理即可"
!("#三颈烧瓶!或三口烧瓶"!!分"!吸收尾气中的/0
#
%防止污染空气(防止倒吸!#分"
$排尽装置内空气!!分"!1)0056D5601D#/0 ####56
#
/
#
0
"
D)0
#
D1
#
0!或1)0056D561/0
(
D
化学参考答案!第!!!!#页!共"页"
{#{QQABCQAUggCIAIAAABgCAQniCAGQkAAACCoOAAAIoAAAyBFABAA=}#}/0 ####56
#
/
#
0
"
D)0
#
D1
#
0"!#分"
!""过滤速率快或得到的固体产物较干燥!!分"!打开安全阀!!分%合理即可"
!:"56/0 ’56/0!#分"
# ( # # (
%解析&’!(依题意!1)0056用甲醇溶解!及产品难溶于甲醇!遇水易分解!由此可推知甲醇的作用&
’#(温度较高!产品易分解"连二亚硫酸钠中硫显D(价!具有强还原性!实验操作中应避免与空气长时间
接触&
’(($通入)0
#
排尽装置内的空气!避免0
#
氧化产品!反应物有1)0056%5601和/0
#
!产物有56
#
/
#
0
"
%
)0 和10&
# #
’"(抽滤就是减压过滤!过滤速率较快%得到的固体产物较干燥等"如果安全瓶中出现液体倒吸!打开安全
阀!平衡瓶内气压&
’:(依题意!56
#
/
#
0
(
D1
#
/0 "###56
#
/0
"
D/’D/0 #&D1
#
0!56
#
/
#
0
"
分解生成了/0
#
!56
#
/
#
0
(
和=&
根据原子守恒!=为56/0 &
# (
#’.!!:分"#答案$!!"四面体形!!分"!*!#分"
’B%
!#"B !#分"
"
!("#)6H!!!分"!改变相同温度%(9Q)变化值较小%*
6
较小!#分"!$)!#分"
!""#升高温度!!分"!加催化剂!!分"
$$.$#:!R46"B!!(分%不带单位扣!分"
%解析&’!(4)9分子中4原子价层电子对数为"!其中孤电子对数为!!S/T4;模型为四面体形!注意)不是
(
正四面体形&4)9
:
分子含:个单键!需要:个杂化轨道&基态4原子电子排布式为!2##2##3-(2#(3:!(2%
(3%(U能量相近!可以参与杂化!杂化类型为23(U&
’#(根据盖斯定律可知!’$B#(V"得目标热化学方程式!由于’"%!则%B’)$!三氯化磷与氯气反应生
成五氯化磷是放热反应&
’((#根据表达式可知!温度变化相同时!*
6
值越小!(9Q)变化值’绝对值(越小!直线斜率越小!催化剂催化
效能越大&由图乙可知!)6H!对应直线的斜率较小&$移走一半反应物!相当于原体系体积增大至原来的
#倍!减压平衡逆向移动!即平衡时4)9的物质的量小于原平衡的一半!故选)&
:
’"(#曲线6%I起始状态时!容器体积相同!反应物的物质的量相同!温度越高!压强越大!即温度)6"I&曲
线L和I达到相同的平衡状态!只是前者先达到平衡!L反应速率较大!该反应是气体分子数不相等的反应!
故L改变条件是加入催化剂!或加入效率更高的催化剂&$同温同容条件下!压强之比等于物质的量之比&
!!!!!!! !!4)9 ( ’@(D)9 # ’@($%4)9 : ’@(
起始物质的量0789!!$+#!!$+#!!!!$
变化物质的量0789!!!,!!!,!!!!,
平衡物质的量0789!$+#B,!$+#B,!!!,
$."789 !-$R46 !
$."789B,789
J
!#$R46
!,J$.!!-’4)9
(
(J-’)9
#
(J-’4)9
:
(J!#$R46K
(
J"$R46!
!J
-’4)9
:
(
J
"$R46
J$.$#:’R46(B!&
3 -’4)9
(
(/-’)9
#
( "$R46K"$R46
化学参考答案!第!!!!(页!共"页"
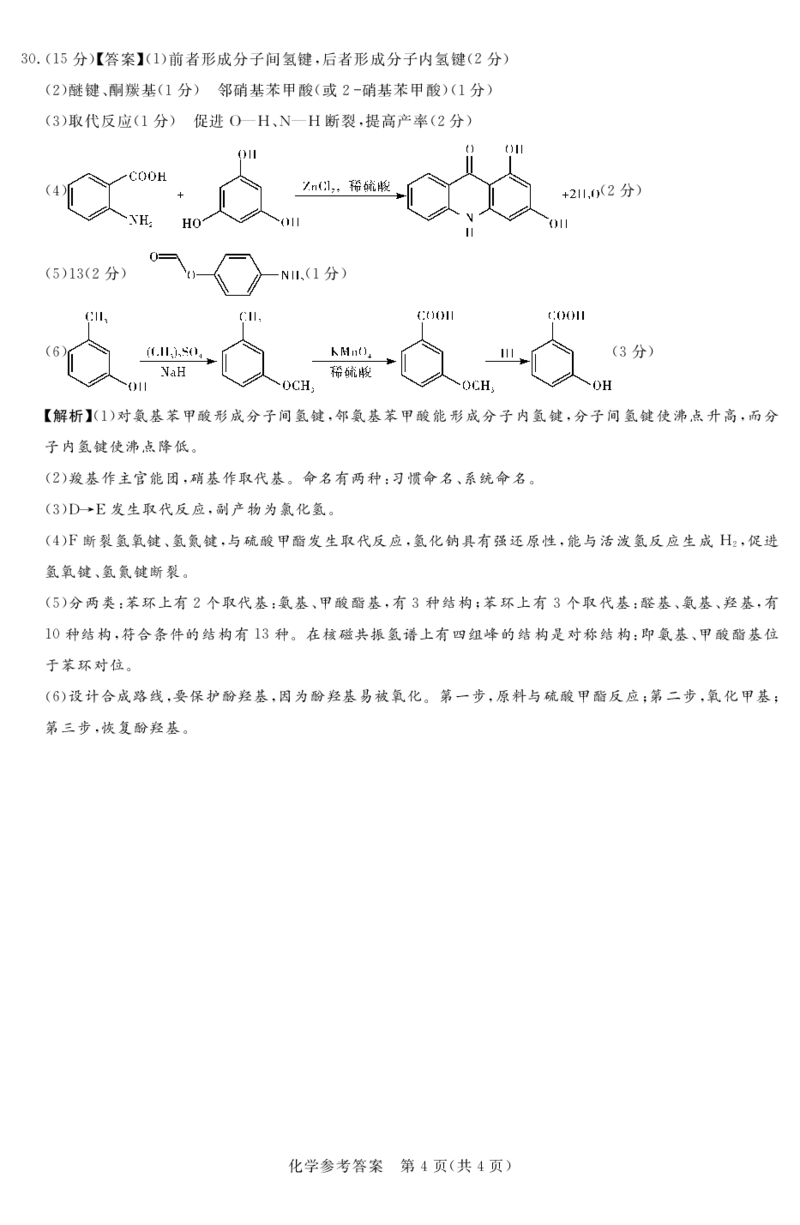
{#{QQABCQAUggCIAIAAABgCAQniCAGQkAAACCoOAAAIoAAAyBFABAA=}#}($.!!:分"#答案$!!"前者形成分子间氢键%后者形成分子内氢键!#分"
!#"醚键’酮羰基!!分"!邻硝基苯甲酸!或# 硝基苯甲酸"!!分"
!("取代反应!!分"!促进0)1’5)1断裂%提高产率!#分"
!"" !#分"
!:"!(!#分"! !!分"
!-" !(分"
%解析&’!(对氨基苯甲酸形成分子间氢键!邻氨基苯甲酸能形成分子内氢键!分子间氢键使沸点升高!而分
子内氢键使沸点降低&
’#(羧基作主官能团!硝基作取代基&命名有两种)习惯命名%系统命名&
’((**T发生取代反应!副产物为氯化氢&
’"(F断裂氢氧键%氢氮键!与硫酸甲酯发生取代反应!氢化钠具有强还原性!能与活泼氢反应生成1 !促进
#
氢氧键%氢氮键断裂&
’:(分两类)苯环上有#个取代基)氨基%甲酸酯基!有(种结构"苯环上有(个取代基)醛基%氨基%羟基!有
!$种结构!符合条件的结构有!(种&在核磁共振氢谱上有四组峰的结构是对称结构)即氨基%甲酸酯基位
于苯环对位&
’-(设计合成路线!要保护酚羟基!因为酚羟基易被氧化&第一步!原料与硫酸甲酯反应"第二步!氧化甲基"
第三步!恢复酚羟基&
化学参考答案!第!!!!"页!共"页"
{#{QQABCQAUggCIAIAAABgCAQniCAGQkAAACCoOAAAIoAAAyBFABAA=}#}