文档内容
常州市联盟学校2023—2024学年度第一学期学情调研
高三年级化学试卷
2023.10
出卷老师: 审卷老师: 满分100分 考试时间:75分钟
可能用到的相对原子质量:H-1 C-12 O-16 S-32 Br-80 I-127 Mn-55
第Ⅰ卷 选择题(共42分)
一、单项选择题:本题包括14小题,每小题3分,共计42分。每小题只有一个选项符合题
意。
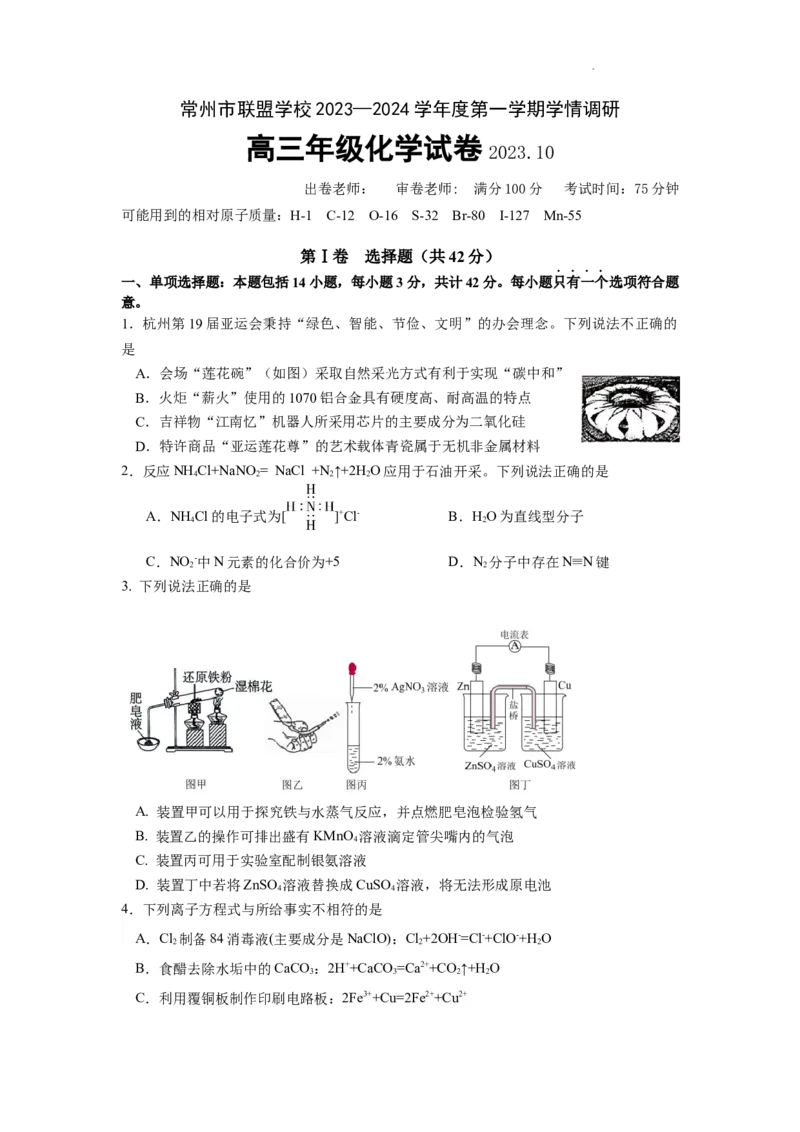
1.杭州第19届亚运会秉持“绿色、智能、节俭、文明”的办会理念。下列说法不正确的
是
A.会场“莲花碗”(如图)采取自然采光方式有利于实现“碳中和”
B.火炬“薪火”使用的1070铝合金具有硬度高、耐高温的特点
C.吉祥物“江南忆”机器人所采用芯片的主要成分为二氧化硅
D.特许商品“亚运莲花尊”的艺术载体青瓷属于无机非金属材料
2.反应NH Cl+NaNO = NaCl +N ↑+2H O应用于石油开采。下列说法正确的是
4 2 2 2
A.NH Cl的电子式为[ ]+Cl- B.HO为直线型分子
4 2
C.NO -中N元素的化合价为+5 D.N 分子中存在N≡N键
2 2
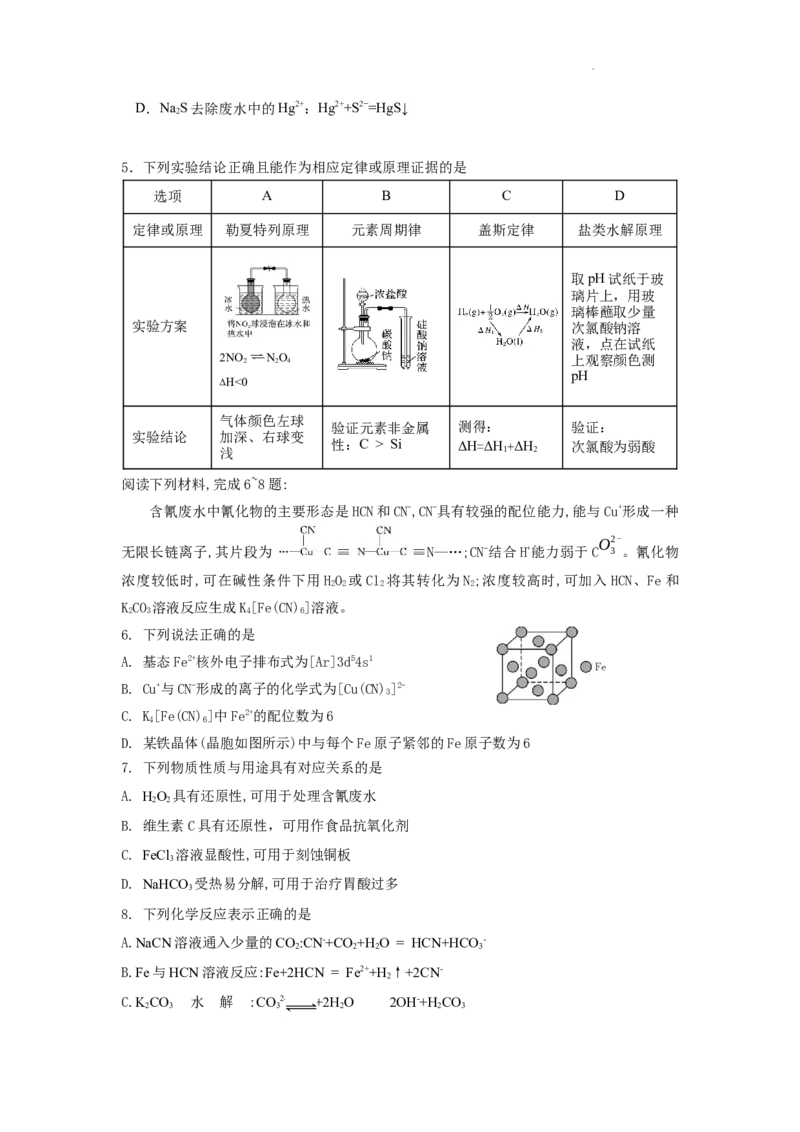
3. 下列说法正确的是
A. 装置甲可以用于探究铁与水蒸气反应,并点燃肥皂泡检验氢气
B. 装置乙的操作可排出盛有KMnO 溶液滴定管尖嘴内的气泡
4
C. 装置丙可用于实验室配制银氨溶液
D. 装置丁中若将ZnSO 溶液替换成CuSO 溶液,将无法形成原电池
4 4
4.下列离子方程式与所给事实不相符的是
A.Cl 制备84消毒液(主要成分是NaClO):Cl+2OH-=Cl-+ClO-+H O
2 2 2
B.食醋去除水垢中的CaCO :2H++CaCO =Ca2++CO ↑+H O
3 3 2 2
C.利用覆铜板制作印刷电路板:2Fe3++Cu=2Fe2++Cu2+
学科网(北京)股份有限公司D.NaS去除废水中的Hg2+:Hg2++S2−=HgS↓
2
5.下列实验结论正确且能作为相应定律或原理证据的是
选项 A B C D
定律或原理 勒夏特列原理 元素周期律 盖斯定律 盐类水解原理
取pH试纸于玻
璃片上,用玻
璃棒蘸取少量
实验方案 次氯酸钠溶
液,点在试纸
2NO 2 N 2 O 4 上观察颜色测
pH
ΔH<0
气体颜色左球
验证元素非金属 测得: 验证:
实验结论 加深、右球变
性:C > Si ΔH=ΔH+ΔH 次氯酸为弱酸
浅 1 2
阅读下列材料,完成6~8题:
含氰废水中氰化物的主要形态是HCN和CN-,CN-具有较强的配位能力,能与Cu+形成一种
O2-
无限长链离子,其片段为 ≡ ≡N—…;CN-结合H+能力弱于C 3 。氰化物
浓度较低时,可在碱性条件下用HO 或Cl 将其转化为N;浓度较高时,可加入HCN、Fe和
2 2 2 2
KCO 溶液反应生成K[Fe(CN)]溶液。
2 3 4 6
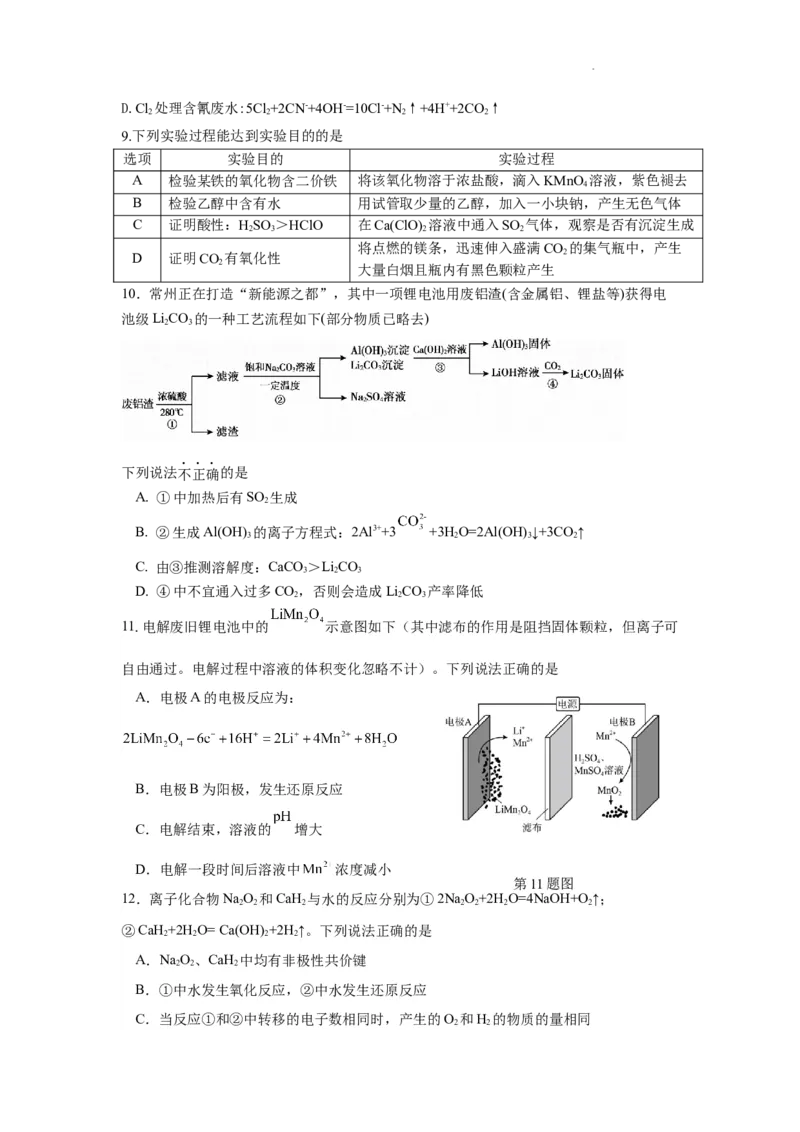
6. 下列说法正确的是
A. 基态Fe2+核外电子排布式为[Ar]3d54s1
B. Cu+与CN-形成的离子的化学式为[Cu(CN)]2-
3
C. K[Fe(CN)]中Fe2+的配位数为6
4 6
D. 某铁晶体(晶胞如图所示)中与每个Fe原子紧邻的Fe原子数为6
7. 下列物质性质与用途具有对应关系的是
A. HO 具有还原性,可用于处理含氰废水
2 2
B. 维生素C具有还原性,可用作食品抗氧化剂
C. FeCl 溶液显酸性,可用于刻蚀铜板
3
D. NaHCO 受热易分解,可用于治疗胃酸过多
3
8. 下列化学反应表示正确的是
A.NaCN溶液通入少量的CO:CN-+CO +H O = HCN+HCO -
2 2 2 3
B.Fe与HCN溶液反应:Fe+2HCN = Fe2++H ↑+2CN-
2
C.KCO 水 解 :CO2- +2H O 2OH-+H CO
2 3 3 2 2 3
学科网(北京)股份有限公司D.Cl 处理含氰废水:5Cl+2CN-+4OH-=10Cl-+N ↑+4H++2CO ↑
2 2 2 2
9.下列实验过程能达到实验目的的是
选项 实验目的 实验过程
A 检验某铁的氧化物含二价铁 将该氧化物溶于浓盐酸,滴入KMnO 溶液,紫色褪去
4
B 检验乙醇中含有水 用试管取少量的乙醇,加入一小块钠,产生无色气体
C 证明酸性:HSO >HClO 在Ca(ClO) 溶液中通入SO 气体,观察是否有沉淀生成
2 3 2 2
将点燃的镁条,迅速伸入盛满CO 的集气瓶中,产生
D 证明CO 有氧化性 2
2
大量白烟且瓶内有黑色颗粒产生
10.常州正在打造“新能源之都”,其中一项锂电池用废铝渣(含金属铝、锂盐等)获得电
池级LiCO 的一种工艺流程如下(部分物质已略去)
2 3
下列说法不正确的是
A. ①中加热后有SO 生成
2
B. ②生成Al(OH) 的离子方程式:2Al3++3 +3H O=2Al(OH) ↓+3CO ↑
3 2 3 2
C. 由③推测溶解度:CaCO >LiCO
3 2 3
D. ④中不宜通入过多CO,否则会造成LiCO 产率降低
2 2 3
11.电解废旧锂电池中的 示意图如下(其中滤布的作用是阻挡固体颗粒,但离子可
自由通过。电解过程中溶液的体积变化忽略不计)。下列说法正确的是
A.电极A的电极反应为:
B.电极B为阳极,发生还原反应
C.电解结束,溶液的 增大
D.电解一段时间后溶液中 浓度减小
第11题图
12.离子化合物NaO 和CaH 与水的反应分别为①2NaO+2H O=4NaOH+O ↑;
2 2 2 2 2 2 2
②CaH+2H O= Ca(OH) +2H ↑。下列说法正确的是
2 2 2 2
A.NaO、CaH 中均有非极性共价键
2 2 2
B.①中水发生氧化反应,②中水发生还原反应
C.当反应①和②中转移的电子数相同时,产生的O 和H 的物质的量相同
2 2
学科网(北京)股份有限公司D.NaO 中阴、阳离子个数比为 ,CaH 中阴、阳离子个数比为
2 2 2
13.向吸收液中通入过量的SO 制备无水NaHSO 的主要流程如下,通入SO 所引起的溶液
2 3 2
体积变化和HO挥发可忽略,下列说法不正确的是
2
(已知:室温下,HCO:K =4.30×10-7,K =5.61×10-11;HSO :K =1.54×10-2,
2 3 a1 a2 2 3 a1
K =1.02×10-7)
a2
A.母液中:c(Na+)c(SO2-)
3 3
C.吸收过程中有CO 气体产生
2
D. 溶液中:
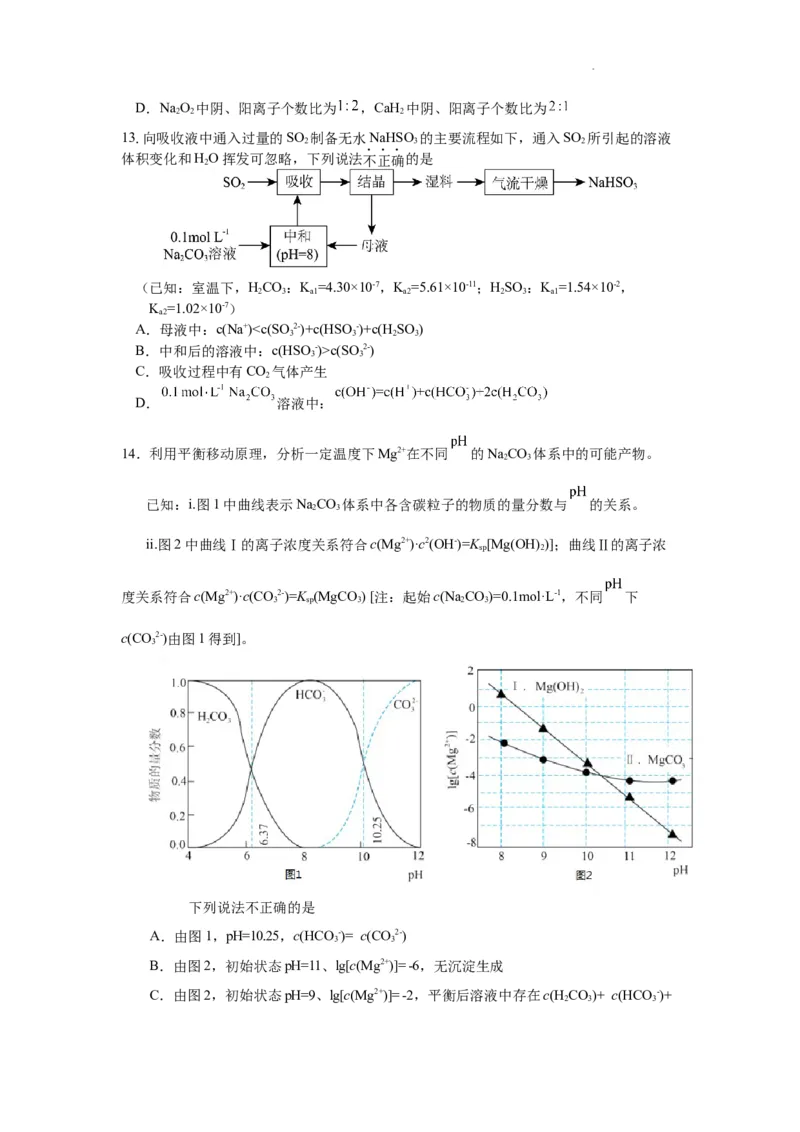
14.利用平衡移动原理,分析一定温度下Mg2+在不同 的NaCO 体系中的可能产物。
2 3
已知:i.图1中曲线表示NaCO 体系中各含碳粒子的物质的量分数与 的关系。
2 3
ii.图2中曲线Ⅰ的离子浓度关系符合c(Mg2+)·c2(OH-)=K [Mg(OH) )];曲线Ⅱ的离子浓
sp 2
度关系符合c(Mg2+)·c(CO2-)=K (MgCO ) [注:起始c(Na CO)=0.1mol·L-1,不同 下
3 sp 3 2 3
c(CO2-)由图1得到]。
3
下列说法不正确的是
A.由图1,pH=10.25,c(HCO -)= c(CO2-)
3 3
B.由图2,初始状态pH=11、lg[c(Mg2+)]= -6,无沉淀生成
C.由图2,初始状态pH=9、lg[c(Mg2+)]= -2,平衡后溶液中存在c(H CO)+ c(HCO -)+
2 3 3
学科网(北京)股份有限公司c(CO2-)=0.1mol·L-1
3
D.由图1和图2,初始状态pH=8、lg[c(Mg2+)]= -1,发生反应:Mg2++2HCO-=
3
MgCO ↓+CO ↑+H O
3 2 2
二、非选择题:本大题共4小题,共计58分。
15.(14分)以银锰精矿(主要含Ag S、MnS、FeS)和氧化锰矿(主要含MnO)为原料联合提
2 2 2
取银和锰的一种流程示意图如下。
已知:酸性条件下,MnO 的氧化性强于Fe3+。
2
(1) “浸锰”过程是在HSO 溶液中使矿石中的锰元素浸出,同时去除FeS,有利于后续
2 4 2
银的浸出:矿石中的银以Ag S的形式残留于浸锰渣中。
2
①“浸锰”过程中,发生反应MnS+2H+= Mn2++H S↑,则可推断:K (MnS)
2 sp
(填“>”或“<”) K (Ag S)。
sp 2
②在HSO 溶液中,银锰精矿中的FeS 和氧化锰矿中的 发生反应,则浸锰液中
2 4 2
主要的金属阳离子有 。
(2) “浸银”时,使用过量FeCl、HCl和CaCl 的混合液作为浸出剂,将Ag S中的银以
3 2 2
[AgCl]-形式浸出。
2
①将“浸银”反应的离子方程式补充完整:
Fe3++Ag S+ +2[AgCl]- +S
2 2
②结合平衡移动原理,解释浸出剂中Cl-、H+的作用: 。
(3) “沉银”过程中需要过量的铁粉作为还原剂。
①该步反应的离子方程式有 。
②一定温度下,Ag的沉淀率随反应时间的变化如图所示。
解释 分钟后Ag的沉淀率逐渐减小的原因: 。
(4)结合“浸锰”过程,从两种矿石中各物质利用的角度,分析联
合提取银和锰的优势: 。
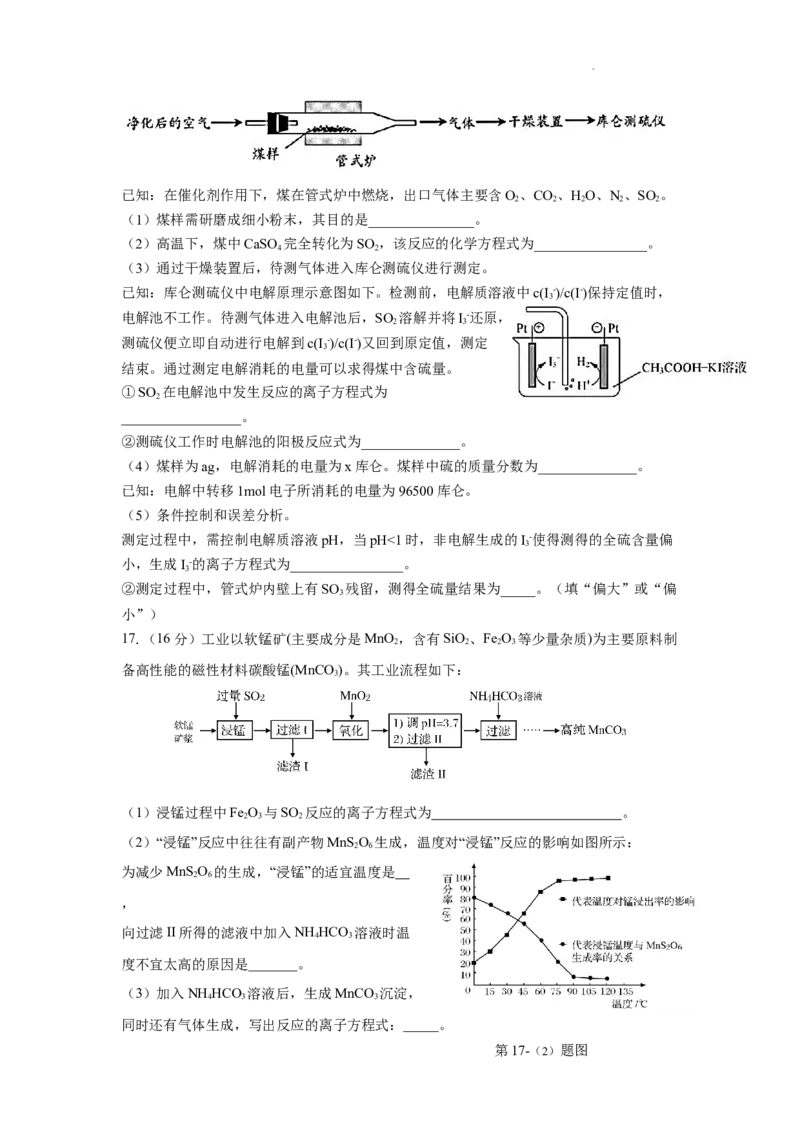
16.(14分)煤中硫的存在形态分为有机硫和无机硫(CaSO、硫化物及微量单质硫等)。
4
库仑滴定法是常用的快捷检测煤中全硫含量的方法。其主要过程如下图所示。
学科网(北京)股份有限公司已知:在催化剂作用下,煤在管式炉中燃烧,出口气体主要含O、CO、HO、N、SO 。
2 2 2 2 2
(1)煤样需研磨成细小粉末,其目的是_______________。
(2)高温下,煤中CaSO 完全转化为SO ,该反应的化学方程式为________________。
4 2
(3)通过干燥装置后,待测气体进入库仑测硫仪进行测定。
已知:库仑测硫仪中电解原理示意图如下。检测前,电解质溶液中c(I -)/c(I-)保持定值时,
3
电解池不工作。待测气体进入电解池后,SO 溶解并将I-还原,
2 3
测硫仪便立即自动进行电解到c(I -)/c(I-)又回到原定值,测定
3
结束。通过测定电解消耗的电量可以求得煤中含硫量。
①SO 在电解池中发生反应的离子方程式为
2
_________________。
②测硫仪工作时电解池的阳极反应式为______________。
(4)煤样为ag,电解消耗的电量为x库仑。煤样中硫的质量分数为______________。
已知:电解中转移1mol电子所消耗的电量为96500库仑。
(5)条件控制和误差分析。
测定过程中,需控制电解质溶液pH,当pH<1时,非电解生成的I-使得测得的全硫含量偏
3
小,生成I-的离子方程式为________________。
3
②测定过程中,管式炉内壁上有SO 残留,测得全硫量结果为_____。(填“偏大”或“偏
3
小”)
17.(16分)工业以软锰矿(主要成分是MnO ,含有SiO、Fe O 等少量杂质)为主要原料制
2 2 2 3
备高性能的磁性材料碳酸锰(MnCO )。其工业流程如下:
3
(1)浸锰过程中Fe O 与SO 反应的离子方程式为 。
2 3 2
(2)“浸锰”反应中往往有副产物MnS O 生成,温度对“浸锰”反应的影响如图所示:
2 6
为减少MnS O 的生成,“浸锰”的适宜温度是
2 6
,
向过滤II所得的滤液中加入NH HCO 溶液时温
4 3
度不宜太高的原因是_______。
(3)加入NH HCO 溶液后,生成MnCO 沉淀,
4 3 3
同时还有气体生成,写出反应的离子方程式:_____。
第17-(2)题图
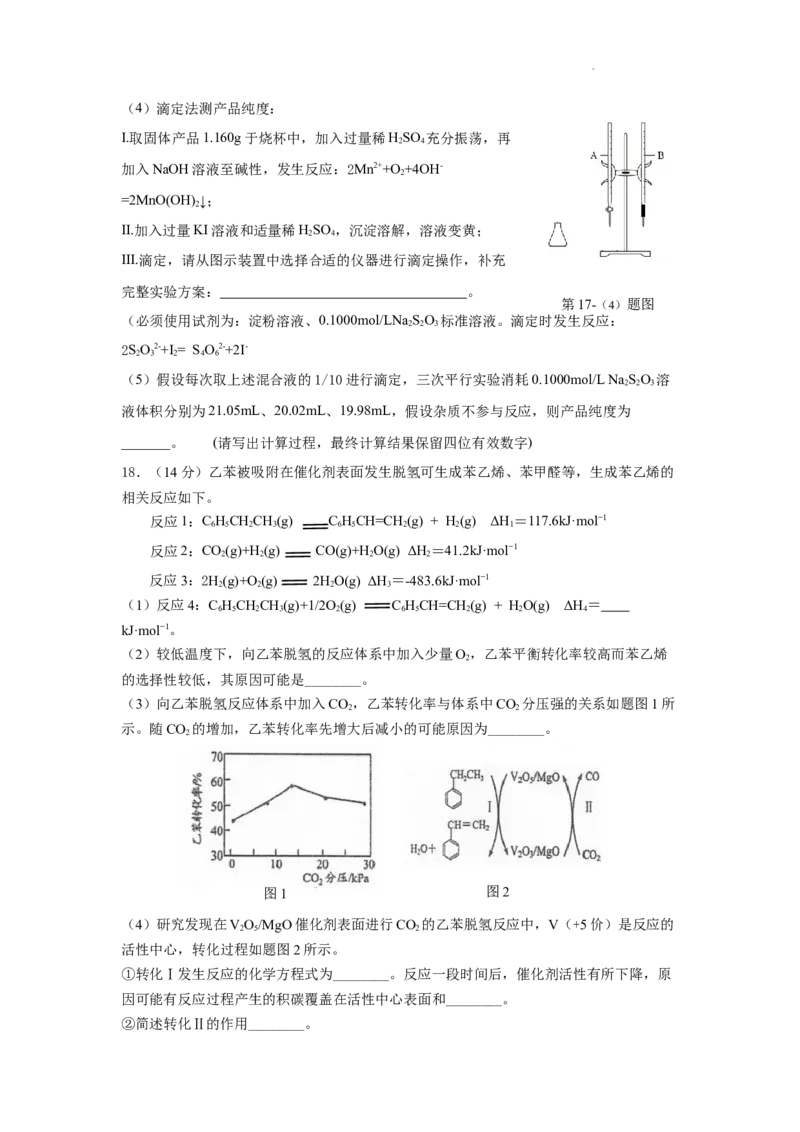
学科网(北京)股份有限公司(4)滴定法测产品纯度:
I.取固体产品1.160g于烧杯中,加入过量稀HSO 充分振荡,再
2 4
加入NaOH溶液至碱性,发生反应:2Mn2++O+4OH-
2
=2MnO(OH) ↓;
2
II.加入过量KI溶液和适量稀HSO ,沉淀溶解,溶液变黄;
2 4
III.滴定,请从图示装置中选择合适的仪器进行滴定操作,补充
完整实验方案: 。
第17-(4)题图
(必须使用试剂为:淀粉溶液、0.1000mol/LNa SO 标准溶液。滴定时发生反应:
2 2 3
2SO2-+I = SO2-+2I-
2 3 2 4 6
(5)假设每次取上述混合液的1/10进行滴定,三次平行实验消耗0.1000mol/L Na SO 溶
2 2 3
液体积分别为21.05mL、20.02mL、19.98mL,假设杂质不参与反应,则产品纯度为
_______。 (请写出计算过程,最终计算结果保留四位有效数字)
18.(14分)乙苯被吸附在催化剂表面发生脱氢可生成苯乙烯、苯甲醛等,生成苯乙烯的
相关反应如下。
反应1:C HCHCH(g) C HCH=CH(g) + H(g) ΔH=117.6kJ·mol−1
6 5 2 3 6 5 2 2 1
反应2:CO(g)+H(g) CO(g)+HO(g) ΔH=41.2kJ·mol−1
2 2 2 2
反应3:2H(g)+O(g) 2HO(g) ΔH=-483.6kJ·mol−1
2 2 2 3
(1)反应4:C HCHCH(g)+1/2O(g) C HCH=CH(g) + HO(g) ΔH=
6 5 2 3 2 6 5 2 2 4
kJ·mol−1。
(2)较低温度下,向乙苯脱氢的反应体系中加入少量O,乙苯平衡转化率较高而苯乙烯
2
的选择性较低,其原因可能是________。
(3)向乙苯脱氢反应体系中加入CO,乙苯转化率与体系中CO 分压强的关系如题图1所
2 2
示。随CO 的增加,乙苯转化率先增大后减小的可能原因为________。
2
图1 图2
(4)研究发现在VO/MgO催化剂表面进行CO 的乙苯脱氢反应中,V(+5价)是反应的
2 5 2
活性中心,转化过程如题图2所示。
①转化Ⅰ发生反应的化学方程式为________。反应一段时间后,催化剂活性有所下降,原
因可能有反应过程产生的积碳覆盖在活性中心表面和________。
②简述转化Ⅱ的作用________。
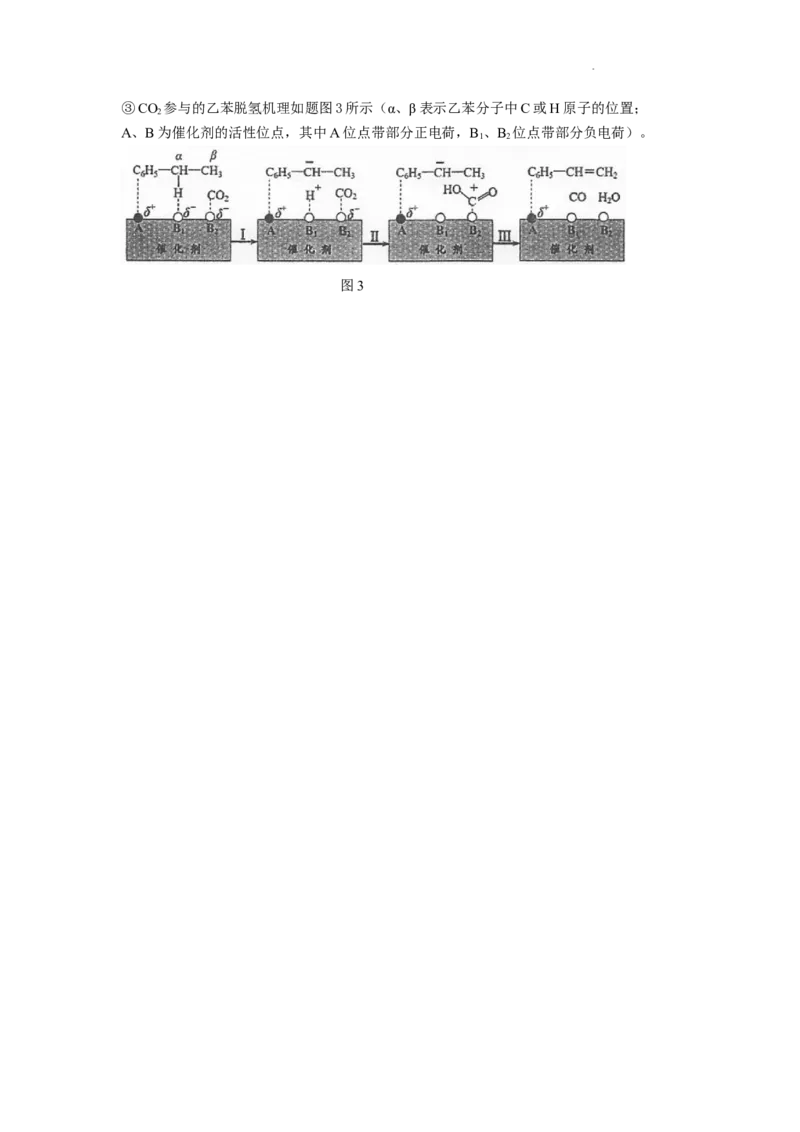
学科网(北京)股份有限公司③CO 参与的乙苯脱氢机理如题图3所示(α、β表示乙苯分子中C或H原子的位置;
2
A、B为催化剂的活性位点,其中A位点带部分正电荷,B 、B 位点带部分负电荷)。
1 2
图3
学科网(北京)股份有限公司