文档内容
鄂南高中 黄冈中学 黄石二中 荆州中学 龙泉中学 武汉二中 催化剂或可逆符号扣1分,不累积扣分)
(3) 6
孝感高中 襄阳四中 襄阳五中 宜昌一中 夷陵中学
(4) 加成反应 (掉“反应”扣1分)
2024 届高三湖北十一校第二次联考
(5) 7
化学参考答案及评分标准
(6)
1—15 DCBAD CDCCB CBDBC
19.(14分 除标注外其余每空2分)
16.(13分 除标注外其余每空2分)
(1)ΔH=+35.6kJ·mol-1(不写+号也给分)
(1)四 ⅦA (每空各1分)
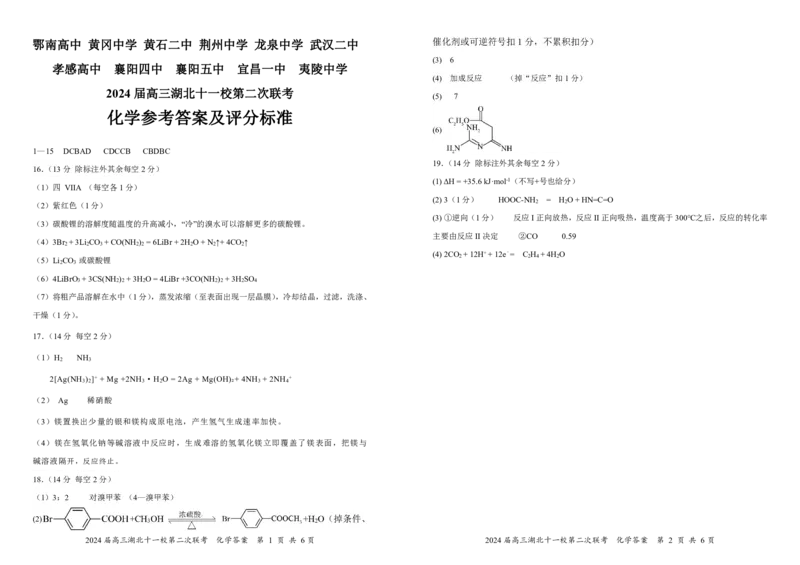
(2)3(1分) HOOC-NH = H O+HN=C=O
(2)紫红色(1分) 2 2
(3)①逆向(1分) 反应I正向放热,反应II正向吸热,温度高于300℃之后,反应的转化率
(3)碳酸锂的溶解度随温度的升高减小,“冷”的溴水可以溶解更多的碳酸锂。
主要由反应II决定 ②CO 0.59
(4)3Br +3Li CO +CO(NH ) =6LiBr+2H O+N ↑+4CO ↑
2 2 3 2 2 2 2 2
(4)2CO +12H++12e﹣= C H +4H O
(5)Li CO 或碳酸锂 2 2 4 2
2 3
(6)4LiBrO +3CS(NH ) +3H O=4LiBr+3CO(NH ) +3H SO
3 2 2 2 2 2 2 4
(7)将粗产品溶解在水中(1分),蒸发浓缩(至表面出现一层晶膜),冷却结晶,过滤,洗涤、
干燥(1分)。
17.(14分 每空2分)
(1)H NH
2 3
2[Ag(NH ) ]+ + Mg +2NH ·H O = 2Ag + Mg(OH)₂+ 4NH + 2NH +
3 2 3 2 3 4
(2) Ag 稀硝酸
(3)镁置换出少量的银和镁构成原电池,产生氢气生成速率加快。
(4)镁在氢氧化钠等碱溶液中反应时,生成难溶的氢氧化镁立即覆盖了镁表面,把镁与
碱溶液隔开,反应终止。
18.(14分 每空2分)
(1)3:2 对溴甲苯 (4—溴甲苯)
(2) +CH OH +H O(掉条件、
3 2
2024届高三湖北十一校第二次联考 化学答案 第 1 页 共 6页 2024届高三湖北十一校第二次联考 化学答案 第 2 页 共 6页2024 届高三湖北十一校第二次联考 的反应是:N 2 O 4 (l)+2N 2 H 4 (l)=3N 2 (g)+4H 2 O(g) ,若该反应中有4molN—H键断裂,生成1.5molN 2 ,
则形成的π键有3mol,本题答案选C.
化学试题解析
9、“熔融”时,应先将MnO 和KClO 混合加热一段时间会反应产生氧气和氯化钾,再加入KOH
2 3
选择题解析: 与氯化钾不反应。B.通入CO “歧化”时的反应为2CO +3MnO 2-=2MnO -+MnO +2CO 2-,氧
2 2 4 4 2 3
1、次氯酸钠、高锰酸钾、双氧水是常见的三种杀菌消毒剂,对氨基苯甲酸是细菌必需的营养物, 化剂与还原剂的物质的量之比为1:2。C.“过滤”时,为加快分离速率可采用减压过滤为正确。
详见选择性必修2的第3页序言部分,答案选D。 D.制得的KMnO 粗品可能会含有K CO ,可以向粗品中滴加盐酸即使没有K CO 也会产生氯
4 2 3 2 3
高温
气,本题答案为C。
2、A.根据反应SiO
2
2C Si2CO只能证明碳的还原性性大于硅的还原性。B.分子式 10、B.用惰性电极电解MgCl
2
溶液会产生氢氧化镁沉淀,离子方程式中会出现氢氧化镁故错误,
本题答案选B。
为C
7
H
8
O的芳香族化合物的同分异构体有5种,增加一种醚的结构。C.CO
2
、SO
2
的水溶液均 11、C.H
2
O与SO
2
均为V形结构,但是中心原子的杂化方式不同,前者为sp3杂化,后者为sp2
呈酸性可以使滴有酚酞的NaOH溶液颜色变浅。D.乙二醇与足量的酸性高锰酸钾溶液反应生成 杂化。本题答案选C。
乙二酸,乙二酸还可以与酸性高锰酸钾溶液反应生成二氧化碳。本题答案为C。 12、A.N极放电时生成氧气,则N为负极,充电时N为阴极,因此N极的电势低于M极的电
3、A中基态Fe2+离子的价电子排布式为3d6,失去4s2电子。BN,N-二甲基苯甲酰胺的结构简式
势。B.充电时双极膜中OH-向阳极即M极移动,放电时双极膜中H+向正极即M极移动,B选项
正确。C为O 3 分子的VSEPR模型。D.CaO 2 的电子式: ,答案选B。 错误。C.N极的电极反应式为:2CH 2 =CHCN+2e-+2H+=NC(CH 2 ) 4 CN,若充电时制得
4、X原子有两个单电子且电负性是四种元素中最大的即X为氧,Y原子的最外层电子数是X原 1molNC(CH 2 ) 4 CN,则转移2mole-,所以放电时需生成0.5molO 2 ,才能使左室溶液恢复至初始状
子内层电子数的2倍即为硅,Z原子s能级上电子数与p能级上电子数之比为2:3则为磷,W第 态D.充电时,N极的电极反应式为:2CH 2 =CHCN+2e-+2H+=NC(CH 2 ) 4 CN为正确选项。本题
一电离能大于磷则W为氯。A.电负性为Si0,则 1
c(H+) c(H+)
或一个-OOCH和溴原子消耗NaOH;
即c(HF)c(H+) ,故溶液中存在c(Cl-)>c(Mg2+)=c(HF)>c(H+),故D正确;本题答案为C。 ③与溴原子相连的碳原子为sp3杂化,即为饱和碳原子;
16.题【解析】(1)Br原子序数35,位于周期表第四周期,第ⅦA族。
若为羧基,则在碳环上的位置有:NCCH COOCH CH 共3种,若为-OOCH,则在碳环上的位置
2 2 3
(2)焰色试验鉴别碳酸锂,火焰呈现紫红色。
有:NCCH COOCH CH 共4种,共计7种,故答案为:7;
2 2 3
(3)依据题中碳酸锂的溶解度表,其溶解度随温度的升高减小,“冷”的溴水可以溶解更多的碳
酸锂。
(6)Q经脱乙醇生成 ,可知Q为 ; 与P反应生
(4)依据题中 “无有毒气体排放”,CO(NH ) 被氧化为N 和 CO ,其化学方程式为
2 2 2 2
3Br +3Li CO +CO(NH ) =6LiBr+2H O+N ↑+4CO ↑。
2 2 3 2 2 2 2 2
(5)从生产实际出发,依据题中“生产成本低”,物质X最佳为Li CO 或碳酸锂。
2 3
(6)加入CS(NH 2 ) 2 还原BrO 3 -,同时CS(NH 2 ) 2 被氧化为SO 4 2-,其化学方程式为 成Q,结合Q与 结构可知P为NCCH COOCH CH ,故答案为:; 。
2 2 3
4LiBrO +3CS(NH ) +3H O=4LiBr+3CO(NH ) +3H SO 。
3 2 2 2 2 2 2 4
(7)重结晶是将晶体溶于溶剂或熔融以后,又重新从溶液或熔体中结晶的过程。故本题重结晶的
19题【解析】(1)反应热等于生成物的生成焓减去反应物的生成焓,CO (g)+2H (g) HCHO(g)
2 2
操作为将粗产品溶解在水中,蒸发浓缩(至表面出现一层晶膜),冷却结晶,过滤,洗涤、干燥。
+H O(g)的逆反应的ΔH=-242kJ·mol-1-115.9kJ·mol-1+393.5kJ·mol-1=+35.6kJ·mol-1,则其反应的
17题【解析】(1)根据气体体积先增大后减小然后不变,可知有一种气体不溶或微溶于水, 2
ΔH=+35.6kJ·mol-1
结合氧化还原反应原理镁作还原剂,被还原的元素除+1 价的银元素还有+1 价的氢元素,
可推知不溶于水的气体是 H 。根据问题(1)检验气体的方法可知是氨气。[Ag(NH ) ]+中 (2)根据图示,历程包含了3 个基元反应,能垒最大的即为决速步骤,故该步骤的方程式为:
2 3 2
+1 价银被还原,配体和中心离子 Ag+解离,产生氨气,Mg 被氧化,因溶液呈碱性,对应 HOOC−NH ==HN=C=O+H 。
2 2
的产物是 Mg(OH) 2 ,所以反应化学方程式为: (3)①反应I的正反应为气体分子数减小的反应,反应II气体分子数不变,相同温度下,增大压
2[Ag(NH 3 ) 2 ]+ + Mg +2NH 3 .H 2 O=2Ag↓+Mg(OH)₂↓+4NH₃ + 2NH 4 +。 强后(缩小体积),反应I平衡正向移动,反应II的平衡因为平衡I的正向移动而逆向移动;反应
(2)[Ag(NH₃) 2 ] +中+1 价银被 Mg 还原成银单质。灰白色固体成分是 Ag 和 Ag 2 O,加入盐酸 I的正反应为放热反应,反应II的正反应为吸热反应,温度高于300℃之后,反应转化率主要由
灰白色固体中 Ag 和盐酸不反应,Ag O 和盐酸反应生成不溶物 AgCl,再加稀硝酸,Ag 溶
2 反应II决定。
于硝酸,AgCl 不溶,最后还有不溶物就证明了 Ag O 的存在。
2
②根据图乙中曲线变化的趋势和斜率的大小,可以确定H 的起始分压为1.5MPa,CO 的起始分
(3)生成氢气的本质都是水电离的氢离子被镁还原为氢气。但镁跟碱性银氨溶液反应还 2 2
能生成的银,银和镁构成原电池,产生氢气速率加快。
压为0.5MPa。根据阿伏加德罗定律的推论可知,恒容密闭的容器中,温度不变,气体压强与气
(4)pH=12 的氢氧化钠溶液,水和镁反应生成的 Mg2+,立即和 OH-结合成难溶物 体物质的量成正比,平衡时,p(H
2
)=0.8MPa,p(CO
2
)=0.2MPa。再根据C、H、O原子个数守恒,
Mg(OH)
2
,Mg(OH)
2
瞬即覆盖了镁表面,把镁与碱溶液隔开,反应终止。 不难推出p(H
2
O)=0.3MPa,p(CH
3
OH)=0.2MPa,p(CO)=0.1MPa,故图乙中缺少的组分为CO。
18题【解析】(1)A为CHCH,碳碳三键为1个σ键和3个π键,还有两个碳氢σ键,所以σ p(CH OH) p(H O) 0.2MPa0.3MPa
则反应I的K = 3 2 0.59(MPa)2。
键和π键数目之比为3:2。 p p(CO ) p3(H ) 0.2MPa(0.8MPa)3
2 2
(4)电解池的阴极发生得到电子的还原反应,即 CO 得到电子转化为乙烯,电极反应式为
(2)E的结构简式为 ,名称为对溴甲苯。 2
2CO +12H++12e﹣==C H +4H O。
2 2 4 2
(3)如图所示,考虑三键和苯环,在一条直线上的碳原子数为6。
2024届高三湖北十一校第二次联考 化学答案 第 5 页 共 6页 2024届高三湖北十一校第二次联考 化学答案 第 6 页 共 6页