文档内容
专题 02 氮及其化合物
知识梳理
【氮气 氮的氧化物】
氮的原子结构
氮元素位于第二周期、 第 V A 族。氮原子最外电子层有5个电子,既不容易得到3个电子,也不容易失去5
个电子。因此氮原子一般通过共用电子对与其它原子相互结合构成物质。
氮的原子结构
常见的化合价有 + 1 、 + 2 、 + 3 、 + 4 、 + 5 、 - 3 ,
其氧化物有 N O 、 NO 、 N O 、 NO 、 N O 、 N O 共有六种,
2 2 3 2 2 4 2 5
其中 N O 是HNO 的酸酐, N O 是HNO 的酸酐(氮的氧化物都有毒)。
2 5 3 2 3 2
2.自然界中的存在形态
a.游离态:以氮分子的形式存在于空气中。
b.化合态:存在于动植物体内的蛋白质中,以及土壤、海洋里的硝酸盐和铵盐中。
一.氮气
1.物理性质
纯净的N 是一种无色无味的气体,难溶于水,在空气中约占五分之四左右。
2
2.化学性质
(1)常温下,N 的化学性质不活泼,可代替稀有气体作保护气体。
2
原因:氮分子内两个氮原子间以共价三键结合,断开该化学键需要较多的能量,所以氮气的化学性质很稳
定,通常难以与其它物质反应。
(2)在放电条件或高温下 氮气 跟氧气化合生成 一氧化氮
N + O ===== 2NO
2 2
(3)镁在氮气中燃烧: 3Mg + N ===== Mg N;
2 3 2
(4)人工合成氨:N + 3H (((( 2NH ;
2 2 3
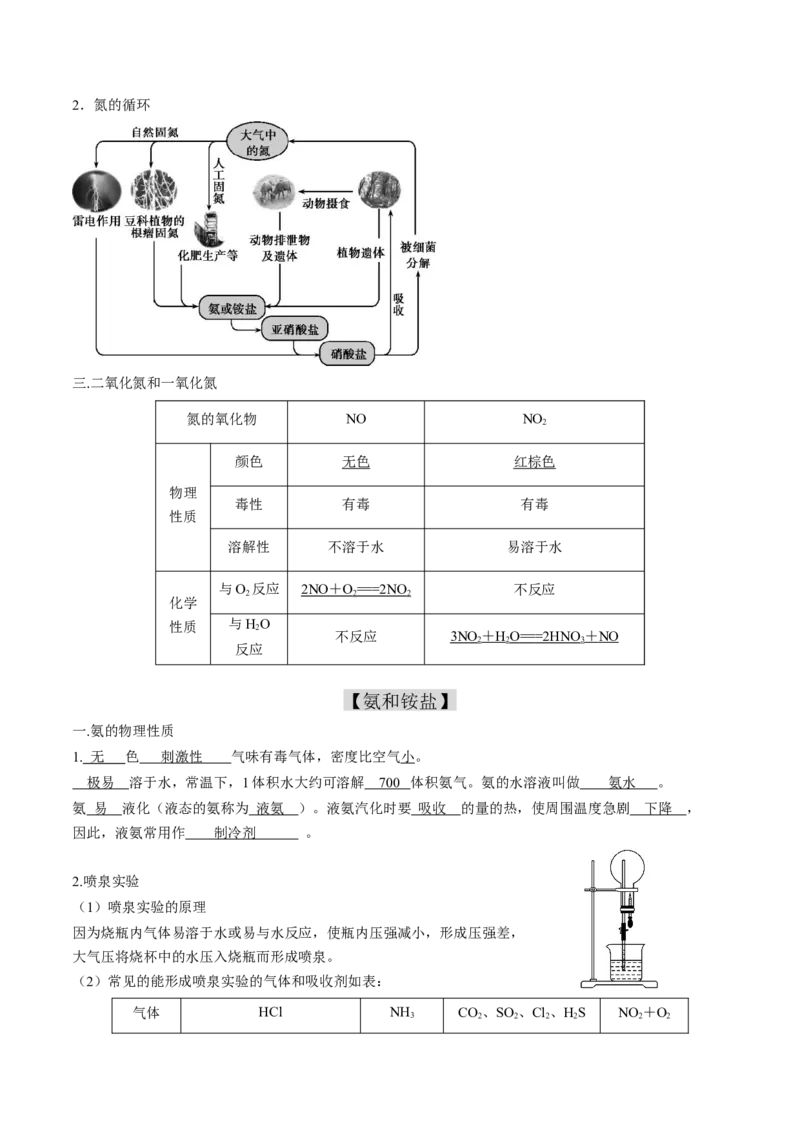
二.氮的固定和循环
1.氮的固定
将游离态氮转变为化合态氮的过程叫氮的固定。
(1)自然固氮
(2)人工固氮:工业合成氨。2.氮的循环
三.二氧化氮和一氧化氮
氮的氧化物 NO NO
2
颜色 无色 红棕色
物理
毒性 有毒 有毒
性质
溶解性 不溶于水 易溶于水
与O 反应 2NO + O == =2NO 不反应
2 2 2
化学
性质 与H 2 O
不反应 3NO + H O == =2HNO + NO
2 2 3
反应
【氨和铵盐】
一.氨的物理性质
1. 无 色 刺激性 气味有毒气体,密度比空气小。
极易 溶于水,常温下,1体积水大约可溶解 700 体积氨气。氨的水溶液叫做 氨水 。
氨 易 液化(液态的氨称为 液氨 )。液氨汽化时要 吸收 的量的热,使周围温度急剧 下降 ,
因此,液氨常用作 制冷剂 。
2.喷泉实验
(1)喷泉实验的原理
因为烧瓶内气体易溶于水或易与水反应,使瓶内压强减小,形成压强差,
大气压将烧杯中的水压入烧瓶而形成喷泉。
(2)常见的能形成喷泉实验的气体和吸收剂如表:
气体 HCl NH CO、SO 、Cl、HS NO +O
3 2 2 2 2 2 2吸收剂 水或NaOH溶液 水或盐酸 浓NaOH溶液 水
二.氨气的化学性质
1.与水反应
反应原理为NH + H O NH ·H O NH + + OH - 。
3 2 3 2 4
氨气溶于水得氨水,显碱性,氨水中含有的粒子有:NH ·H O 、 H O 、 NH 、 NH + 、 OH - 、 H + 。
⇌ ⇌ 3 2 2 3 4
NH ·H O为可溶性一元弱碱,不稳定,易分解,化学方程式为NH ·H O ===== NH ↑ + H O。
3 2 3 2 3 2
【注意】
①NH 是中学化学中唯一的碱性气体,能使湿润的红色石蕊试纸变蓝,在推断题中作为解题突破口。
3
②氨水呈碱性,NH ·H O属于一元弱碱,计算氨水的浓度时,溶质按NH 进行计算。
3 2 3
2.氨气与酸的反应
蘸有浓盐酸的玻璃棒与蘸有浓氨水的玻璃棒靠近,其现象为有白烟生成,将浓盐酸改为浓硝酸,也会出现
相同的现象。
化学方程式为 HCl + NH == =NH Cl、 NH + HNO == =NH NO 。
3 4 3 3 4 3
3.与盐溶液的反应
过量氨水与AlCl 溶液反应的离子方程式:
3
Al 3 + + 3NH ·H O == =Al(OH) ↓ + 3NH +。(氢氧化铝不溶于氨水)
3 2 3 4
4.氨气的还原性
①催化氧化:4NH + 5O ===== 4NO + 6H O。
3 2 2
②被CuO氧化:2NH + 3CuO ===== 3C u + N + 3H O。
3 2 2
③被氯气氧化:2NH + 3C l == =N + 6HC l或8NH + 3C l == =N + 6NH Cl。
3 2 2 3 2 2 4
5.氨的用途
①液氨汽化时吸收大量的热,故用作制冷剂。②制氮肥、硝酸、铵盐、纯碱等。
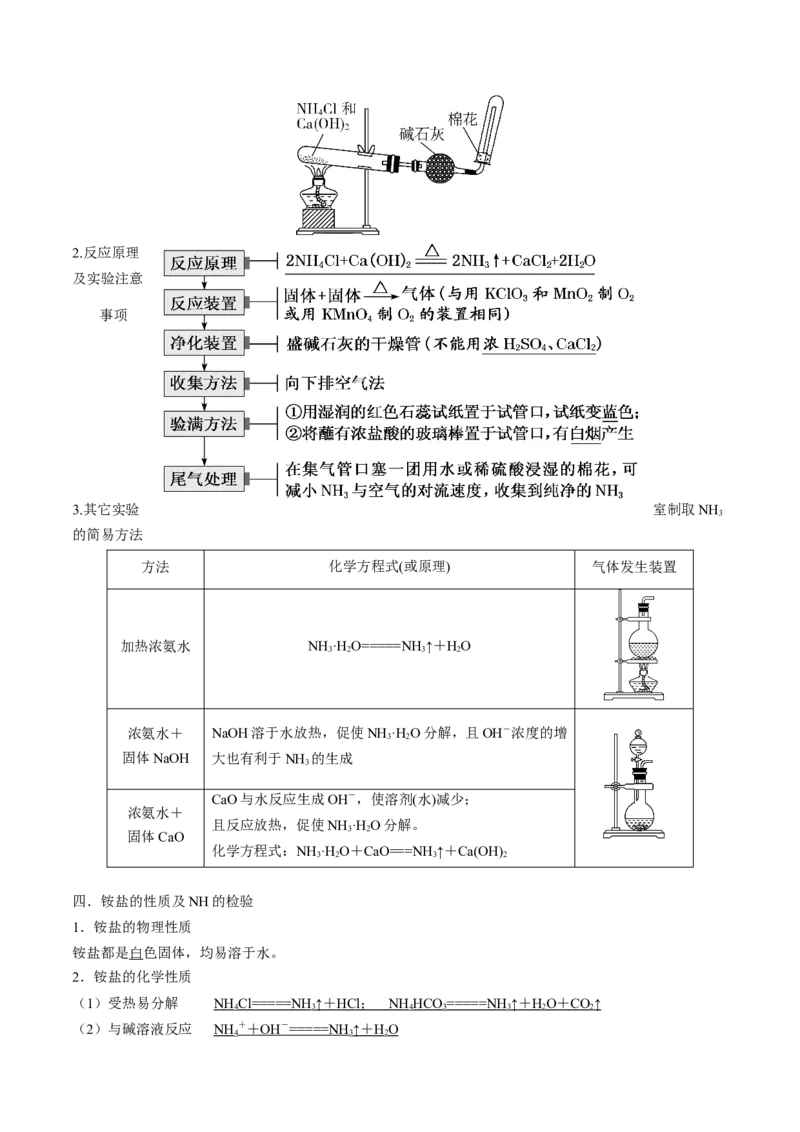
三.氨的实验室制法
1.制备装置2.反应原理
及实验注意
事项
3.其它实验 室制取NH
3
的简易方法
方法 化学方程式(或原理) 气体发生装置
加热浓氨水 NH ·H O=====NH ↑+HO
3 2 3 2
浓氨水+ NaOH溶于水放热,促使NH ·H O分解,且OH-浓度的增
3 2
固体NaOH 大也有利于NH 的生成
3
CaO与水反应生成OH-,使溶剂(水)减少;
浓氨水+
且反应放热,促使NH ·H O分解。
3 2
固体CaO
化学方程式:NH ·H O+CaO===NH↑+Ca(OH)
3 2 3 2
四.铵盐的性质及NH的检验
1.铵盐的物理性质
铵盐都是白色固体,均易溶于水。
2.铵盐的化学性质
(1)受热易分解 NH Cl ===== NH ↑ + HCl ; NH HCO ===== NH ↑ + H O + CO ↑
4 3 4 3 3 2 2
(2)与碱溶液反应 NH + + OH - ===== NH ↑ + H O
4 3 23.NH的检验
未知液加入强碱共热,产生使湿润的红色石蕊试纸变蓝色的气体,则证明含 NH +。
4
【硝酸 酸雨及防治】
一.硝酸
1.物理性质:无色、易挥发、有刺激性气味的液体。
2.化学性质
(1)不稳定性
化学方程式:4HNO ( 浓 ) ===== 2H O + 4NO ↑ + O ↑。
3 2 2 2
(2)强氧化性
硝酸无论浓、稀都有强氧化性,而且浓度越大,氧化性越强。
a.与金属反应
稀硝酸与铜反应: 3Cu + 8HNO ( 稀 ) == =3Cu(NO ) + 2NO ↑ + 4H O(填化学方程式,下同)。
3 3 2 2
浓硝酸与铜反应: Cu + 4HNO ( 浓 ) == =Cu(NO ) + 2NO ↑ + 2H O。
3 3 2 2 2
【注意】常温下,铁、铝遇浓HNO 会发生钝化,所以可用铁或铝制容器来盛装浓HNO。
3 3
b.与非金属反应
浓硝酸与C反应: C + 4HNO ( 浓 ) =====CO ↑ + 4NO ↑ + 2H O。
3 2 2 2
c.与还原性化合物反应
硝酸可氧化HS、SO 、NaSO 、HI、Fe2+等还原性物质。
2 2 2 3
稀硝酸与FeSO 溶液反应的离子方程式: 3Fe 2 + + 4H + + NO == =3Fe 3 + + NO↑ + 2H O。
4 2
3.硝酸的工业制备
写出下列反应的化学方程式:
(1)氨在催化剂、加热条件下氧化为NO:4NH + 5O ===== 4NO + 6H O。
3 2 2
(2)NO被空气氧化为NO :2NO+O===2NO。
2 2 2
(3)NO 溶于水制备HNO:3NO +HO===2HNO +NO。
2 3 2 2 3
4.用途硝酸是一种重要的化工原料,可用于制造化肥、农药、炸药、染料、盐类等。
二.二氧化硫和二氧化氮对大气的污染
1.空气中SO 和NO 的主要来源
2 2
(1)煤、石油和某些金属矿物中含有硫或含硫化合物;
(2)汽车尾气中除含有氮氧化物外,还含有一氧化碳、未燃烧的碳氢化合物、含铅化合物和颗粒等,严重污染大气,破坏环境。
2.危害
(1)SO 和NO 是主要的大气污染物,它们能直接危害人体健康,引起呼吸道疾病;
2 2
(2)溶于水形成酸雨;
(3)氮氧化物的危害
①光化学烟雾:NO 在紫外线作用下,与碳氢化合物发生一系列光化学反应,产生了一种有毒的烟雾。
x
②酸雨:NO 排入大气中,与水反应生成HNO 和HNO,随雨雪降到地面。
x 3 2
③破坏臭氧层:NO 可使平流层中的臭氧减少,导致地面紫外线辐射量增加。
2
④NO与血红蛋白结合使人中毒。
3.酸雨的危害及防治措施
(1)酸雨是指 pH 〈 5.6 的雨、雾等形式的降水,主要由大气污染物中硫、氮的氧化物所致。
(2)形成原理
①硫酸型酸雨
②硝酸型酸雨
3NO + H O == =2HNO + NO
2 2 3
(3)危害
①直接破坏农作物、草原、森林,使土壤、湖泊酸化;
②加速建筑物、桥梁、工业设备、运输工具及电信电缆的腐蚀。
(4)防治措施
a.调整能源结构,发展清洁能源;
b.研究煤的脱硫技术,改进燃烧装置和燃烧技术,减少二氧化硫和氮氧化物的排放;
c.加强工厂废气的回收处理;
d.改进汽车尾气的处理技术,控制汽车尾气的排放标准。