文档内容
专题 05 化学反应与电能
专项训练
1.下列我国科技创新的产品设备在工作时由化学能转化成电能的是( )
A.长征5号火箭使用 B.北斗导航卫星的太 C.位于江苏的海上风 D.由橙子制成的简易
的液氧煤油发动机 阳能电池板 力电动机 电池
2.下列关于原电池的叙述中正确的是( )
A.正极和负极必须是两种不同的金属
B.原电池是把化学能转化成电能的装置
C.原电池工作时,正极和负极上发生的都是氧化还原反应
D.锌、铜和盐酸构成的原电池工作时,锌片上有6.5g锌溶解,正极就有0.1g氢气生成
3.下列有关原电池的说法中正确的是( )
A.在外电路中,电子由负极经导线流向正极
B.在内电路中,电子由正极经电解质溶液流向负极
C.原电池工作时,正极表面一定有气泡产生
D.原电池工作时,一定不会伴随着热能变化
4.下列有关电池的说法正确的是
A.手机上用的锂离子电池属于一次电池
B.铅蓄电池是可充电电池,电池的负极材料为PbO
2
C.燃料电池是一种高效且对环境友好的新型电池
D.铜锌原电池工作时,电子沿外电路从铜电极流向锌电极
5.过量铁与少量稀硫酸反应,为了加快反应速率,但是又不影响生成氢气的总量,可以采取的措施是 (
)
A.加入适量NaCl溶液 B.加入适量的水
C.加入几滴硫酸铜溶液 D.再加入少量稀硫酸
6.X、Y、Z、M、N代表五种金属,有以下反应:
①Y与M用导线连接放入稀硫酸中,M上冒气泡;
②M、N为电极,与N的盐溶液组成原电池,电子从M极流出,经过外电路,流入N极;
③Z+2H O(冷水)=Z(OH) +H ↑;
2 2 2
④水溶液中,X+Y2+=X2++Y。则这五种金属的活动性由强到弱的顺序为( )
A.Z>X>Y>M>N B.Z>Y>X>M>N
C.Z>X>Y>N>M D.X>Y>M>N>Z
7.“盐水动力”玩具车的电池以镁片、活性炭为电极,向极板上滴加食盐水后电池便可工作,电池反应
为2Mg+O+2H O=2Mg(OH)。下列关于该电池的说法错误的是 ( )
2 2 2
A.镁片作为正极
B.食盐水作为电解质溶液
C.电池工作时镁片逐渐被消耗
D.电池工作时实现了化学能向电能的转化
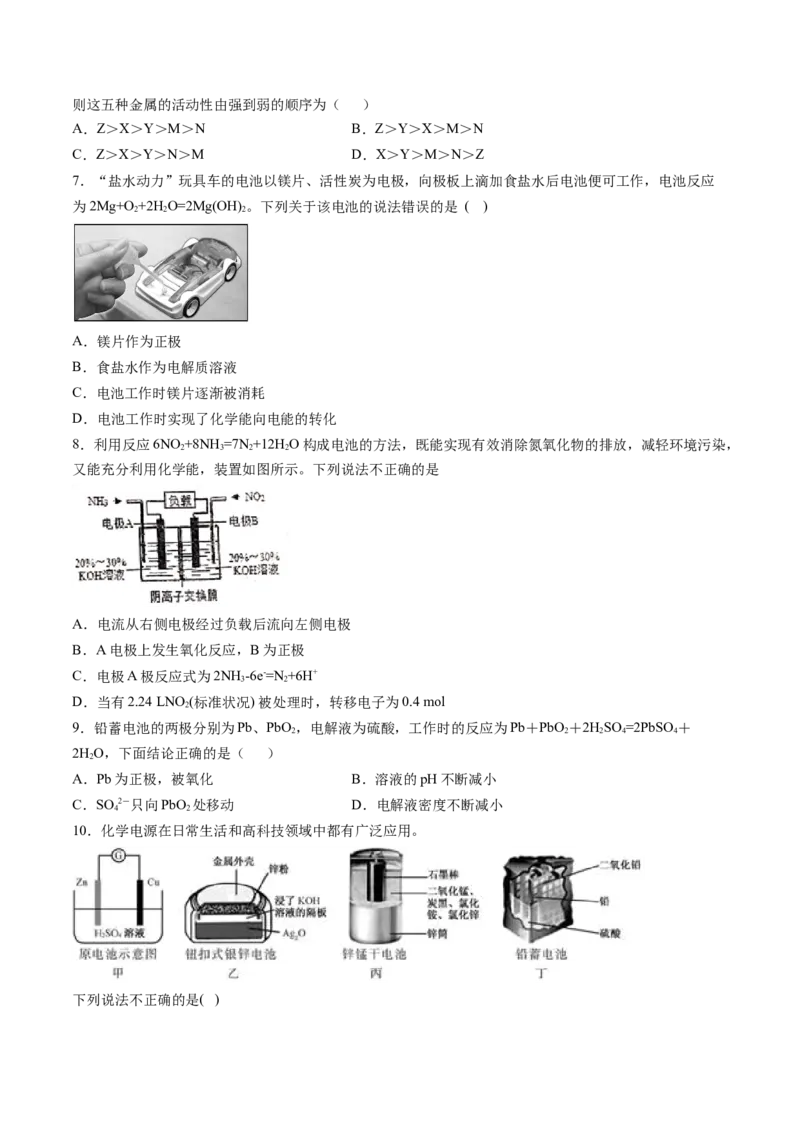
8.利用反应6NO +8NH=7N +12H O构成电池的方法,既能实现有效消除氮氧化物的排放,减轻环境污染,
2 3 2 2
又能充分利用化学能,装置如图所示。下列说法不正确的是
A.电流从右侧电极经过负载后流向左侧电极
B.A电极上发生氧化反应,B为正极
C.电极A极反应式为2NH -6e-=N +6H+
3 2
D.当有2.24 LNO (标准状况) 被处理时,转移电子为0.4 mol
2
9.铅蓄电池的两极分别为Pb、PbO ,电解液为硫酸,工作时的反应为Pb+PbO +2HSO =2PbSO+
2 2 2 4 4
2HO,下面结论正确的是( )
2
A.Pb为正极,被氧化 B.溶液的pH不断减小
C.SO 2-只向PbO 处移动 D.电解液密度不断减小
4 2
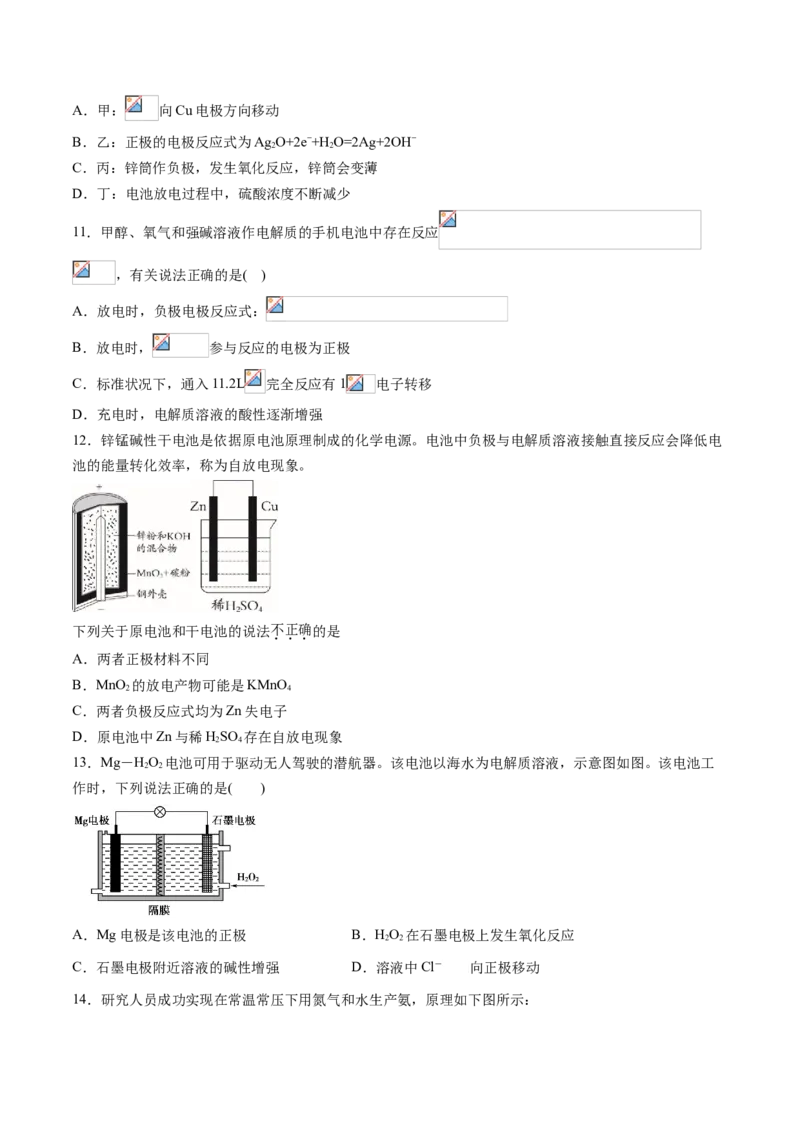
10.化学电源在日常生活和高科技领域中都有广泛应用。
下列说法不正确的是( )A.甲: 向Cu电极方向移动
B.乙:正极的电极反应式为Ag O+2e−+H O=2Ag+2OH−
2 2
C.丙:锌筒作负极,发生氧化反应,锌筒会变薄
D.丁:电池放电过程中,硫酸浓度不断减少
11.甲醇、氧气和强碱溶液作电解质的手机电池中存在反应
,有关说法正确的是( )
A.放电时,负极电极反应式:
B.放电时, 参与反应的电极为正极
C.标准状况下,通入11.2L 完全反应有1 电子转移
D.充电时,电解质溶液的酸性逐渐增强
12.锌锰碱性干电池是依据原电池原理制成的化学电源。电池中负极与电解质溶液接触直接反应会降低电
池的能量转化效率,称为自放电现象。
下列关于原电池和干电池的说法不正确的是
A.两者正极材料不同
B.MnO 的放电产物可能是KMnO
2 4
C.两者负极反应式均为Zn失电子
D.原电池中Zn与稀HSO 存在自放电现象
2 4
13.Mg-HO 电池可用于驱动无人驾驶的潜航器。该电池以海水为电解质溶液,示意图如图。该电池工
2 2
作时,下列说法正确的是( )
A.Mg电极是该电池的正极 B.HO 在石墨电极上发生氧化反应
2 2
C.石墨电极附近溶液的碱性增强 D.溶液中Cl- 向正极移动
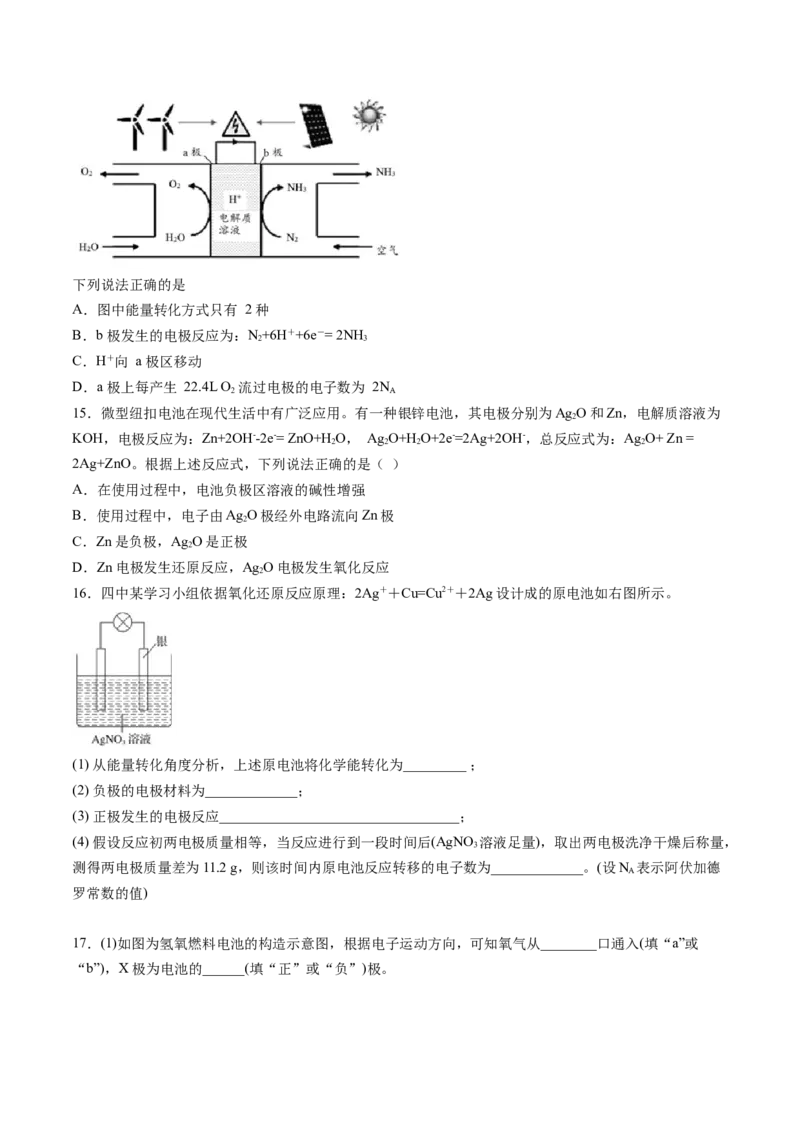
14.研究人员成功实现在常温常压下用氮气和水生产氨,原理如下图所示:下列说法正确的是
A.图中能量转化方式只有 2 种
B.b 极发生的电极反应为:N+6H++6e-= 2NH
2 3
C.H+向 a 极区移动
D.a 极上每产生 22.4L O 流过电极的电子数为 2N
2 A
15.微型纽扣电池在现代生活中有广泛应用。有一种银锌电池,其电极分别为Ag O和Zn,电解质溶液为
2
KOH,电极反应为:Zn+2OH--2e-= ZnO+HO, Ag O+HO+2e-=2Ag+2OH-,总反应式为:Ag O+ Zn =
2 2 2 2
2Ag+ZnO。根据上述反应式,下列说法正确的是( )
A.在使用过程中,电池负极区溶液的碱性增强
B.使用过程中,电子由Ag O极经外电路流向Zn极
2
C.Zn是负极,Ag O是正极
2
D.Zn电极发生还原反应,Ag O电极发生氧化反应
2
16.四中某学习小组依据氧化还原反应原理:2Ag++Cu=Cu2++2Ag设计成的原电池如右图所示。
(1) 从能量转化角度分析,上述原电池将化学能转化为_________ ;
(2) 负极的电极材料为_____________;
(3) 正极发生的电极反应__________________________________;
(4) 假设反应初两电极质量相等,当反应进行到一段时间后(AgNO 溶液足量),取出两电极洗净干燥后称量,
3
测得两电极质量差为11.2 g,则该时间内原电池反应转移的电子数为_____________。(设N 表示阿伏加德
A
罗常数的值)
17.(1)如图为氢氧燃料电池的构造示意图,根据电子运动方向,可知氧气从________口通入(填“a”或
“b”),X极为电池的______(填“正”或“负”)极。(2)某种氢氧燃料电池是用固体金属氧化物陶瓷作电解质,两极上发生的电极反应分别为
A极:2H+2O2--4e-=2H O
2 2
B极:O+4e-=2O2-
2
则A极是电池的______极;电子从该极________(填“流入”或“流出”)。
(3)微型纽扣电池在现代生活中有广泛应用,有一种银锌电池,其电极分别是Ag O和Zn,电解质溶液为
2
KOH溶液,电极反应为:
Zn+2OH--2e-=ZnO+HO
2
Ag O+HO+2e-=2Ag+2OH-
2 2
总反应为Ag O+Zn=ZnO+2Ag
2
①Zn是_______极,Ag O发生________反应。
2
②电子由_____极流向_____极(填“Zn”或“Ag O”),当电路通过1 mol电子时,负极消耗物质的质量是
2
________g。
③在使用过程中,电解质溶液中KOH的物质的量_____(填“增大”“减小”或“不变”)。
18.根据化学能转化电能的相关知识,回答下列问题:
Ⅰ.理论上讲,任何自发的氧化还原反应都可以设计成原电池。请利用反应“Cu+2Ag+=2Ag+Cu2+”设计一
个化学电池(正极材料用碳棒),回答下列问题:
(1)该电池的负极材料是_______,发生_______(填“氧化”或“还原”)反应,电解质溶液是_______。
(2)正极上出现的现象是_______。
(3)若导线上转移电子1 mol,则生成银_______g。
Ⅱ.有甲、乙两位同学均想利用原电池反应检测金属的活动性顺序,两人均用镁片和铝片作电极,但甲同
学将电极放入6 mol·L-1的HSO 溶液中,乙同学将电极放入6 mol·L-1的NaOH溶液中,如图所示。
2 4
(1)写出甲中正极的电极反应式:_______。
(2)乙中负极为_______,总反应的离子方程式:_______。
(3)如果甲与乙同学均认为“构成原电池的电极材料都是金属时,则构成负极材料的金属应比构成正极材料
的金属活泼”,由此他们会得出不同的实验结论,依据该实验实验得出的下列结论中,正确的有_______。A.利用原电池反应判断金属活动性顺序时应注意选择合适的介质
B.镁的金属性不一定比铝的金属性强
C.该实验说明金属活动性顺序表已过时,没有实用价值了
D.该实验说明化学研究对象复杂、反应受条件影响较大,因此具体问题应具体分析
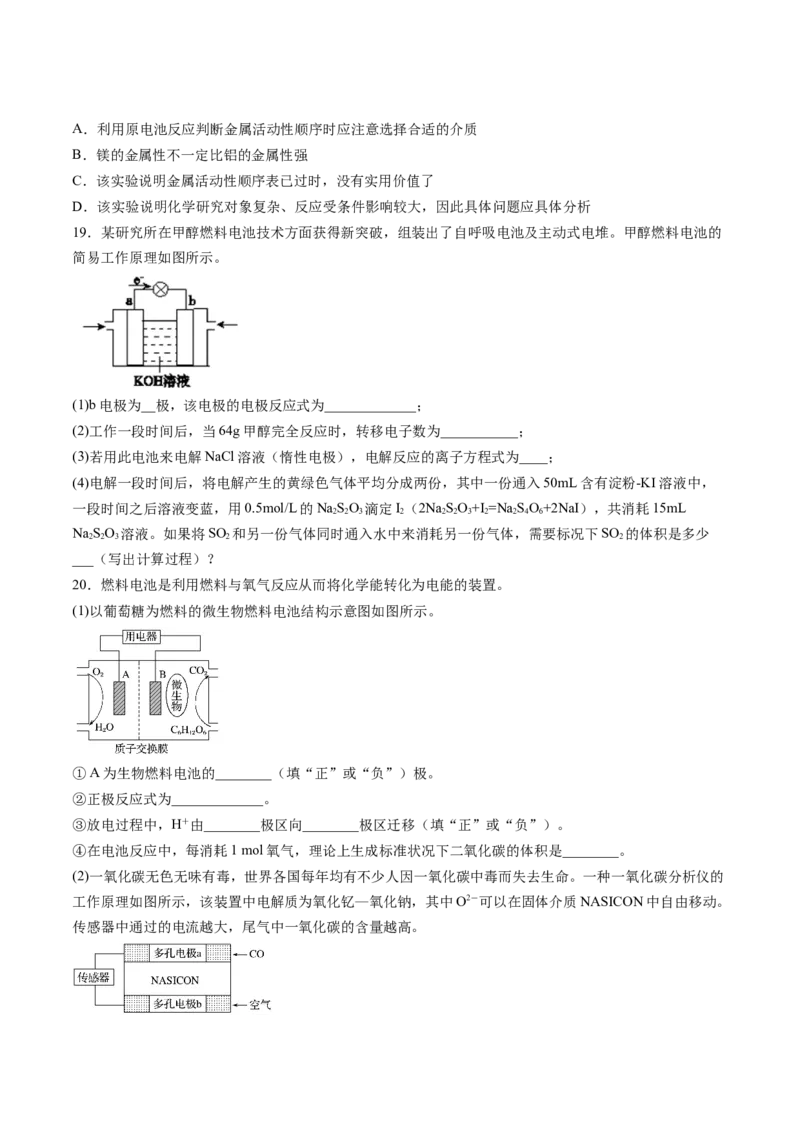
19.某研究所在甲醇燃料电池技术方面获得新突破,组装出了自呼吸电池及主动式电堆。甲醇燃料电池的
简易工作原理如图所示。
(1)b电极为__极,该电极的电极反应式为_____________;
(2)工作一段时间后,当64g甲醇完全反应时,转移电子数为___________;
(3)若用此电池来电解NaCl溶液(惰性电极),电解反应的离子方程式为____;
(4)电解一段时间后,将电解产生的黄绿色气体平均分成两份,其中一份通入50mL含有淀粉-KI溶液中,
一段时间之后溶液变蓝,用0.5mol/L的NaSO 滴定I(2NaSO+I =Na SO+2NaI),共消耗15mL
2 2 3 2 2 2 3 2 2 4 6
NaSO 溶液。如果将SO 和另一份气体同时通入水中来消耗另一份气体,需要标况下SO 的体积是多少
2 2 3 2 2
___(写出计算过程)?
20.燃料电池是利用燃料与氧气反应从而将化学能转化为电能的装置。
(1)以葡萄糖为燃料的微生物燃料电池结构示意图如图所示。
①A为生物燃料电池的________(填“正”或“负”)极。
②正极反应式为_____________。
③放电过程中,H+由________极区向________极区迁移(填“正”或“负”)。
④在电池反应中,每消耗1 mol氧气,理论上生成标准状况下二氧化碳的体积是________。
(2)一氧化碳无色无味有毒,世界各国每年均有不少人因一氧化碳中毒而失去生命。一种一氧化碳分析仪的
工作原理如图所示,该装置中电解质为氧化钇—氧化钠,其中O2-可以在固体介质NASICON中自由移动。
传感器中通过的电流越大,尾气中一氧化碳的含量越高。请回答:
①a极电极反应式为______________;
②工作时,O2-由电极________向电极________移动(填“a”或“b”);
③电子由电极________通过传感器流向电极________(填“a”或“b”)。