文档内容
专题 05 化学反应与电能
知识梳理
【化学反应与电能】
一.能源分类
1.一次能源: 直接从自然界取得的能源
例如: 流水、风力、原油、原煤、太阳能、天然气、天然铀矿等
2.二次能源: 一次能源经过加工转换得到的能源 例如: 电力、蒸汽等
二.化学能与电能的相互转化
1.火力发电的能量转化关系
化学能 热能 机械能 电能
火力发电的缺点:
① 化石燃料属于不可再生资源,用化石燃料发电会造成资源的浪费。
② 火力发电的过程中,能量经过多次转化,利用率低,能量损失大。
③ 化石燃料燃烧会产生大量的有害物质 ( 如 SO 、 CO 、 NO 、粉尘等 ) ,污染环境。
2 2
2.原电池
原电池是一种 将化学能转化为电能的 装置。
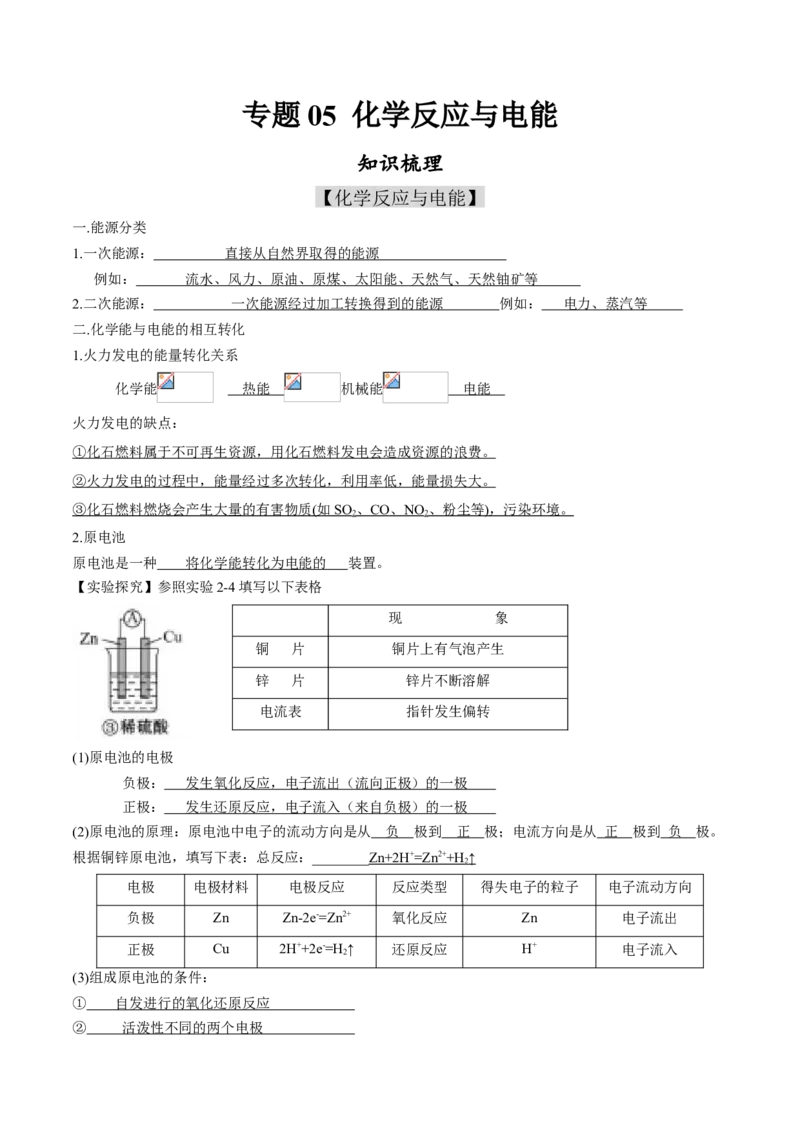
【实验探究】参照实验2-4填写以下表格
现 象
铜 片 铜片上有气泡产生
锌 片 锌片不断溶解
电流表 指针发生偏转
(1)原电池的电极
负极: 发生氧化反应,电子流出(流向正极)的一极
正极: 发生还原反应,电子流入(来自负极)的一极
(2)原电池的原理:原电池中电子的流动方向是从 负 极到 正 极;电流方向是从 正 极到 负 极。
根据铜锌原电池,填写下表:总反应:________ Zn+2H + =Zn 2+ +H ↑
2
电极 电极材料 电极反应 反应类型 得失电子的粒子 电子流动方向
负极 Zn Zn-2e-=Zn2+ 氧化反应 Zn 电子流出
正极 Cu 2H++2e-=H ↑ 还原反应 H+ 电子流入
2
(3)组成原电池的条件:
① 自发进行的氧化还原反应
② 活泼性不同的两个电极③ 闭合回路
④ 电解质溶液(熔融电解质)
(4)原电池正、负极的判断
(5)原电池原理的应用
①比较金属活动性强弱。一般作负极的金属比作正极的金属活泼。
一般原电池中,活泼金属作负极,发生氧化反应,不活泼金属作正极,发生还原反应。
②金属的防护。使被保护的金属制品作原电池正极而得到保护。
③设计制作化学电源。化学能转化为电能。
④加快化学反应速率。自发进行的氧化还原反应,形成原电池时会使反应速率加快。
原电池中,氧化反应和还原反应分别在两极进行,使溶液中离子运动时相互的干扰减小,使反应速率增大。
三.原电池电极反应式的书写
(1)一般电极反应式的书写,以离子方程式形式表示。
①书写步骤
A.列物质,标得失:按照负极氧化反应,正极还原反应,判断电极反应物、生成物,标出电子得失。
B.看环境,配守恒:电极产物在电解质溶液的环境中应能稳定存在,如酸性介质中,OH-不能存在,应生
成水;碱性介质中,H+不能存在,应生成水;电极反应式同样要遵循电荷守恒、原子守恒、得失电子守恒。
C.两式加,验总式:正负极反应式相加,与总反应离子方程式验证。
②常见介质
常见介质 注意事项
中性溶液 反应物若是H+得电子或OH-失电子,则H+或OH-均来自于水的电离
酸性溶液 反应物或生成物中均没有OH-
碱性溶液 反应物或生成物中均没有H+
水溶液 不能出现O2-
(2)利用总反应式书写电极反应式
①根据总反应式,找出氧化剂、还原剂、氧化产物和还原产物。
②确定介质的酸碱性或者其它特性。
③按照负极反应:还原剂-ne-=氧化产物
正极反应:氧化剂+ne-=还原产物,书写电极反应式。
④书写技巧:若某电极反应式较难写出时,可先写出较易写的电极反应式,然后根据得失电子守恒,用总反应式减去较易写的电极反应式,即可得出较难写的电极反应式。
【发展中的化学电源】
一.一次电池
1.碱性锌锰干电池
正极反应: 2MnO + 2H O + 2e - == =2MnOOH + 2OH - ;
2 2
负极反应: Z n + 2OH - - 2 e - == =Zn(OH ) ;
2
总反应: Z n + 2MnO + 2H O == =2MnOOH + Zn(OH) 。
2 2 2
2.锌银电池
负极反应: Z n + 2OH - - 2 e - == =Zn(OH ) ;
2
正极反应: A g O + H O + 2e - == =2Ag + 2OH - ;
2 2
总反应: Z n + A g O + H O == =Zn(OH) + 2Ag 。
2 2 2
二.充电电池
1.充电电池的特点
充电电池又称 二次电池 ,在放电时 化学能转化为电能 ;
充电时 电能转化为化学能 。
2.几种常见的充电电池
(1)铅蓄电池
铅蓄电池可放电亦可充电,它是用硬橡胶和透明塑料制成长方形外壳,在正极板上有一层棕褐色的 PbO ,
2
负极是海棉状的金属铅,两极均浸入硫酸溶液中,且两极间用橡胶或微孔塑料隔开。放电时起原电池的作
用。
①放电时的反应
负极: Pb(s ) + SO(aq ) - 2 e - == =PbSO (s)( 氧化反应 )
4
正极: PbO (s) + 4H + (aq) + SO(aq) + 2e - == =PbSO (s) + 2H O(l)( 还原反应 )
2 4 2
放电总化学方程式为: Pb(s ) + PbO (s) + 2H SO (aq) == =2PbSO (s) + 2H O(l)
2 2 4 4 2
②充电时的反应
阴极: PbSO (s) + 2e - == =Pb(s) + SO(aq)( 还原反应 ) 。
4
阳极: PbSO (s) + 2H O(l) - 2e - == =PbO (s) + 4H + (aq) + SO(aq)( 氧化反应 ) 。
4 2 2
充电总化学方程式为: 2PbSO (s) + 2H O(l) ===== Pb(s) + PbO (s) + 2H SO (aq) 。
4 2 2 2 4
放电
Pb(s)+PbO (s)+2HSO (aq) 2PbSO (s)+2HO(l)
2 2 4 充电 4 2
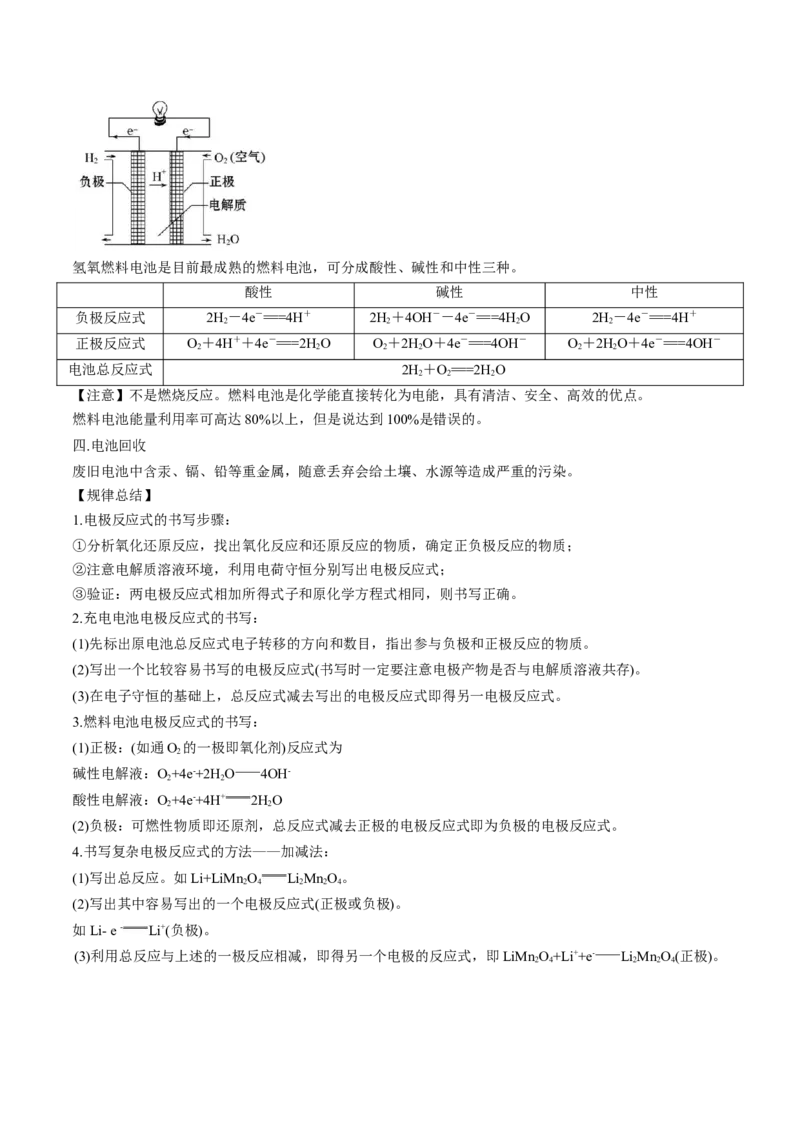
三.燃料电池(碱性)
燃料电池与一般的电池不同的是,反应物不是储存在 电池内部 ,而是由外部提供,电池装置起着类似
于试管、烧杯等反应容器的作用。
工作原理:利用原电池的工作原理将燃料(如H)和氧化剂(如O)分别在两个电极上反应所放出的化学能直
2 2
接转化为 电能 。(实验装置如下)氢氧燃料电池是目前最成熟的燃料电池,可分成酸性、碱性和中性三种。
酸性 碱性 中性
负极反应式 2H-4e-===4H+ 2H+4OH--4e-===4H O 2H-4e-===4H+
2 2 2 2
正极反应式 O+4H++4e-===2H O O+2HO+4e-===4OH- O+2HO+4e-===4OH-
2 2 2 2 2 2
电池总反应式 2H+O===2H O
2 2 2
【注意】不是燃烧反应。燃料电池是化学能直接转化为电能,具有清洁、安全、高效的优点。
燃料电池能量利用率可高达80%以上,但是说达到100%是错误的。
四.电池回收
废旧电池中含汞、镉、铅等重金属,随意丢弃会给土壤、水源等造成严重的污染。
【规律总结】
1.电极反应式的书写步骤:
①分析氧化还原反应,找出氧化反应和还原反应的物质,确定正负极反应的物质;
②注意电解质溶液环境,利用电荷守恒分别写出电极反应式;
③验证:两电极反应式相加所得式子和原化学方程式相同,则书写正确。
2.充电电池电极反应式的书写:
(1)先标出原电池总反应式电子转移的方向和数目,指出参与负极和正极反应的物质。
(2)写出一个比较容易书写的电极反应式(书写时一定要注意电极产物是否与电解质溶液共存)。
(3)在电子守恒的基础上,总反应式减去写出的电极反应式即得另一电极反应式。
3.燃料电池电极反应式的书写:
(1)正极:(如通O 的一极即氧化剂)反应式为
2
碱性电解液:O+4e-+2H O 4OH-
2 2
酸性电解液:O+4e-+4H+ 2HO
2 2
(2)负极:可燃性物质即还原剂,总反应式减去正极的电极反应式即为负极的电极反应式。
4.书写复杂电极反应式的方法——加减法:
(1)写出总反应。如Li+LiMn O LiMnO。
2 4 2 2 4
(2)写出其中容易写出的一个电极反应式(正极或负极)。
如Li- e - Li+(负极)。
(3)利用总反应与上述的一极反应相减,即得另一个电极的反应式,即LiMn O+Li++e- LiMnO(正极)。
2 4 2 2 4