文档内容
专题 07 硫、氮元素及其化合物选择题
专项训练
1.对下列事实的解释错误的是
A.葡萄酒中添加适量SO 可以起到抗氧化作用
2
B.碳酸钡可用作消化X射线检查的内服药剂
C.浓硝酸久置显黄色,说明浓硝酸具有不稳定性
D.实验室用稀硝酸清洗附着在试管内壁的银,说明稀硝酸具有强氧化性
2.你认为减少酸雨产生的途径可以采取的措施是
①少用煤做燃料;②把工厂的烟囱造高;③燃料脱硫;④在已经酸化的土壤中加石灰;⑤开发新能源。
A.①②③ B.②③④⑤ C.①③⑤ D.①②④⑤
3.某同学通过系列实验探究硫及其化合物的性质,实验现象正确且能达到目的的是
A.点燃硫磺,产生刺激性气味气体,该气体可以漂白纸浆
B.向蔗糖中加入浓硫酸,蔗糖变黑色,说明浓硫酸具有强的吸水性
C.将 气体通入 溶液生成 沉淀
D.将Al片加入浓硫酸中,反应剧烈,说明浓硫酸具有强的氧化性
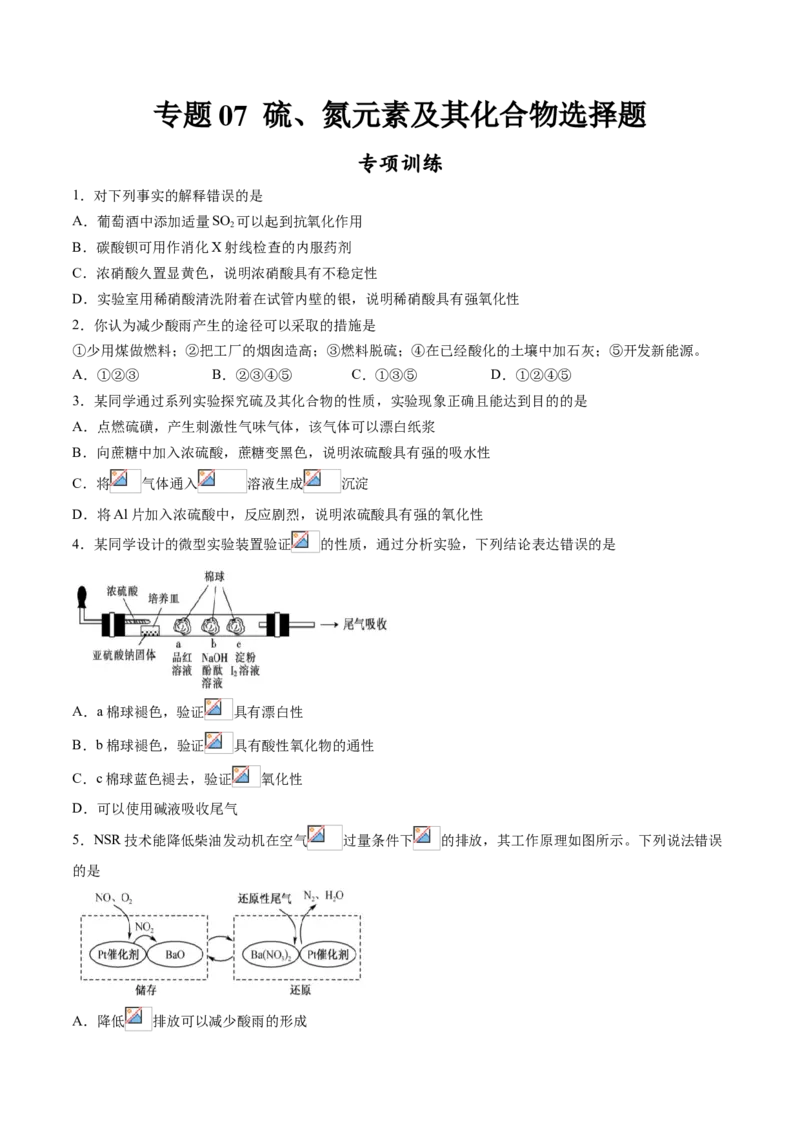
4.某同学设计的微型实验装置验证 的性质,通过分析实验,下列结论表达错误的是
A.a棉球褪色,验证 具有漂白性
B.b棉球褪色,验证 具有酸性氧化物的通性
C.c棉球蓝色褪去,验证 氧化性
D.可以使用碱液吸收尾气
5.NSR技术能降低柴油发动机在空气 过量条件下 的排放,其工作原理如图所示。下列说法错误
的是
A.降低 排放可以减少酸雨的形成B.储存过程中 被还原
C.还原过程中消耗1mol 转移的电子数为10 ( 为阿伏加德罗常数的值)
D.通过BaO和 的相互转化实现 的储存和还原
6.已知某物质X能发生如图转化,其中物质X、Y、Z、A均含有同一种元素。下列有关转化关系中物质
及其反应的叙述错误的是
X Y Z A
A.若X为 或 ,则A为硝酸
B.若X为S,则A为硫酸
C.反应①和②一定为氧化还原反应,反应③一定为非氧化还原反应
D.若X为非金属单质或非金属氢化物,则A不一定能与金属铜反应生成Y
7.下列说法正确的是
A.浓硫酸与浓硝酸敞口放置都会变稀,两者原理相同
B.因为 有漂白性,所以它能使品红溶液和溴水褪色
C.氨易液化,汽化时会吸收大量热,可作制冷剂
D.某溶液中滴加 溶液﹐生成不溶于稀硝酸的白色沉淀,证明一定含有
8.下列的说法正确的是
A.0.1 mol Fe在0.l mol Cl 中充分燃烧,转移电子数为0.2N
2 A
B.12 mol/L的浓硫酸 50 mL与足量的Cu加热反应,得到SO 为0.3N
2 A
C.3 mol NO 与足量的水反应转移的电子数为N
2 A
D.1 mol/L Na SO 溶液中,阴、阳离子总数为3N
2 4 A
9.下列事实与带点物质表现出的性质(括号中)对应关系不正确的是
A.SO 能使酸性高锰酸钾溶液褪色(漂白性)
2
B.常温下,铁遇浓硫酸、浓硝酸发生钝化(强氧化性)
C.久置的浓硝酸,颜色略显黄色(不稳定性)
D.蔗糖与浓硫酸反应中有黑色物质生成(脱水性)
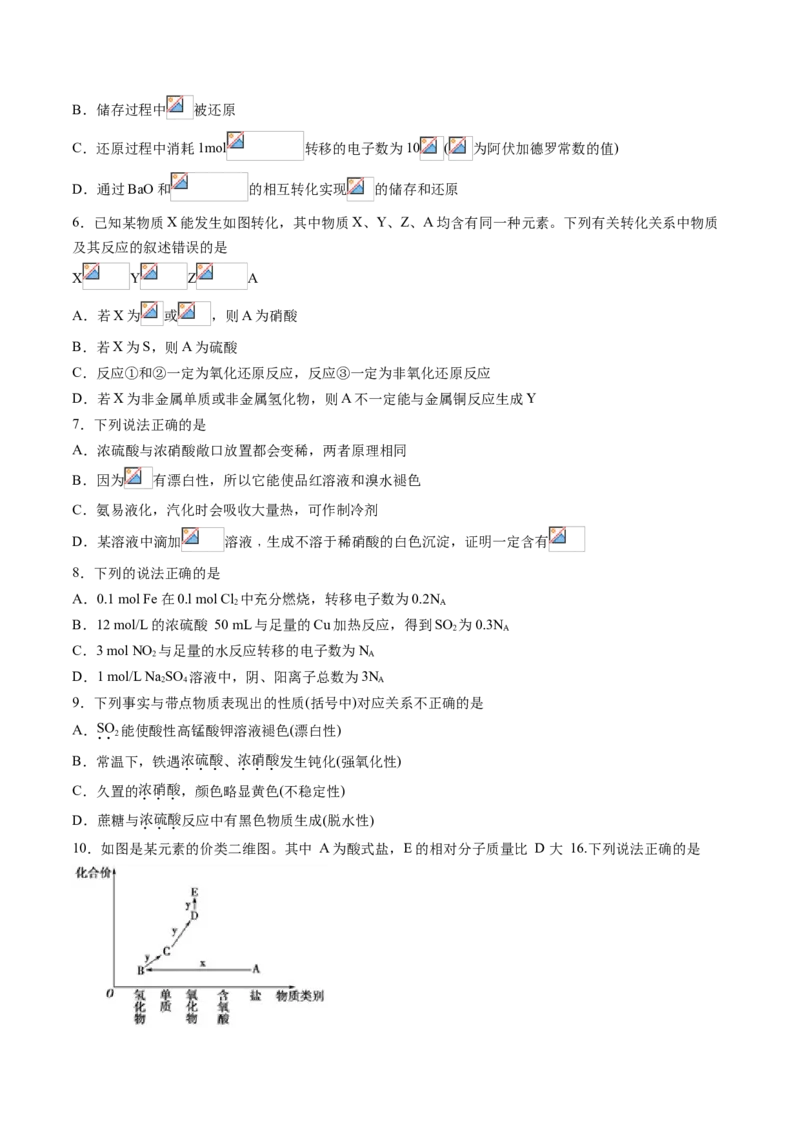
10.如图是某元素的价类二维图。其中 A 为酸式盐,E 的相对分子质量比 D 大 16.下列说法正确的是A.E 与水反应一定能生成一种强酸
B.若 X 为强酸,则物质 D 可使石蕊溶液先变红后褪色
C.若 X 为强酸,则 D→E 的反应可用于检验 D
D.若 X 为强碱,则物质 A ~ E 中均含有硫元素
11.X、Y、Z、W是原子序数依次增大的短周期主族元素,K、L、M均是由这些元素组成的二元化合物,
甲是Y元素的固体单质,乙是Z元素的气体单质,K是主要的大气污染物之一,室温下0.05 mol·L-1丙溶液
的pH为1,上述物质的转化关系如下图所示。下列说法正确的是
A.氢化物的沸点:Z>W>Y
B.原子半径:W>Z>Y>X
C.X、Y、Z三种元素可以形成二元酸,但不能形成一元酸
D.X与Z可以形成原子个数比为1:1和2:1的共价化合物
12.已知NaSO(连二亚硫酸钠)是一种重要的化学用品,不溶于乙醇,溶于氢氧化钠溶液,遇少量水发生
2 2 4
强烈反应,甚至会引发燃烧,其相关性质说法不正确的是
A.NaSO 具有还原性,可用做抗氧化剂
2 2 4
B.NaSO 应干燥密封保存在低温处
2 2 4
C.能在空气中反应生成两种新盐:NaSO+O +H O = NaHSO +NaHSO ,生成1mol NaHSO 转移电子
2 2 4 2 2 3 4 4
2mol
D.锌粉法是制备NaSO 的常用方法,原料为锌粉悬浊液、二氧化硫和氢氧化钠溶液,反应中二氧化硫被
2 2 4
还原
13.下列说法不正确的是
A.某气体能使湿润的红色石蕊试纸变蓝,该气体的水溶液一定显碱性
B.在稀硫酸中加入铜粉,铜粉不溶解,再加入Cu(NO ) 固体,铜粉仍不溶解
3 2
C.铜与浓硝酸反应的离子方程式为Cu+4H++2 =Cu2++2NO↑+2H O
2 2
D.HNO→NO→NO ,以上各步变化均能通过一步实现
3 2
14.用浓氯化铵溶液处理过的舞台幕布不易着火。其原因是
①幕布的着火点升高
②幕布的质量增加
③氯化铵分解吸收热量,降低了温度
④氯化铵分解产生的气体隔绝了空气
A.①② B.①④ C.③④ D.②④
15.下列有关元素及其化合物的叙述正确的是A.采用加热升华的方法除去 体中混有的
B.除去 中的 可将气体通入饱和的 溶液
C.将稀硫酸滴加到 溶液中无明显现象
D. 、 、 三种气体都可以用浓硫酸干燥
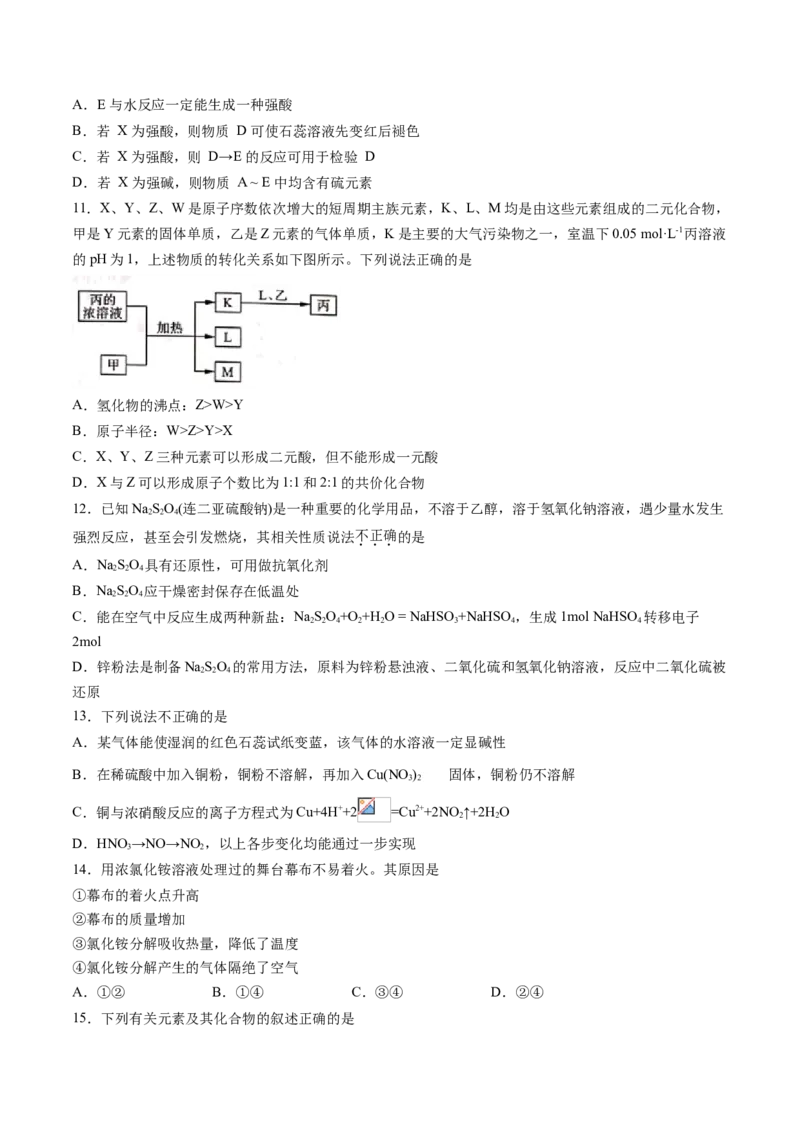
16.物质间的变化(其中A、B、C、D含同种元素,某些条件和产物已略去)如图所示。下列有关描述中不
正确的是
A.若A为硫单质,则Y可能是氯水
B.若A为氮气,则D是硝酸
C.若B为一氧化氮,则A一定是氮气
D.若B为氧化钠,则D一定是氢氧化钠
17.下列关于氮及其化合物的说法错误的是
A.NO 是无色,有刺激性气味的有毒气体
2
B.浓硝酸与铜反应,体现浓硝酸的酸性和强氧化性
C.常温下可以用铁或铝制容器盛装浓硝酸
D.液氨汽化时要吸收大量的热,可用作制冷剂
18.下列有关离子检验的操作、现象及结论均正确的是
A.用洁净的铂丝蘸取少量溶液在酒精灯火焰上灼烧,火焰呈黄色,则该溶液中一定是钠盐溶液
B.向某溶液中加入 溶液后加热,用湿润无色酚酞试纸靠近试管口,呈红色,则该溶液中一定有
NH
C.向无色溶液中加入盐酸酸化的 溶液有白色沉淀出现,则该溶液中一定含有
D.向无色溶液中加入盐酸产生能使澄清石灰水变浑浊的气体,则该溶液中一定含有
19.下列离子方程式书写正确的是
A.氯化铵固体和熟石灰混合加热: +OH- NH ↑+HO
3 2
B.NaOH溶液与NH Cl溶液混合加热: +OH- NH ·H O
4 3 2
C.氨水中加入盐酸:NH ·H O+H+= +HO
3 2 2
D.氯化铝溶液中加入过量的氨水:Al3++3OH-=Al(OH) ↓
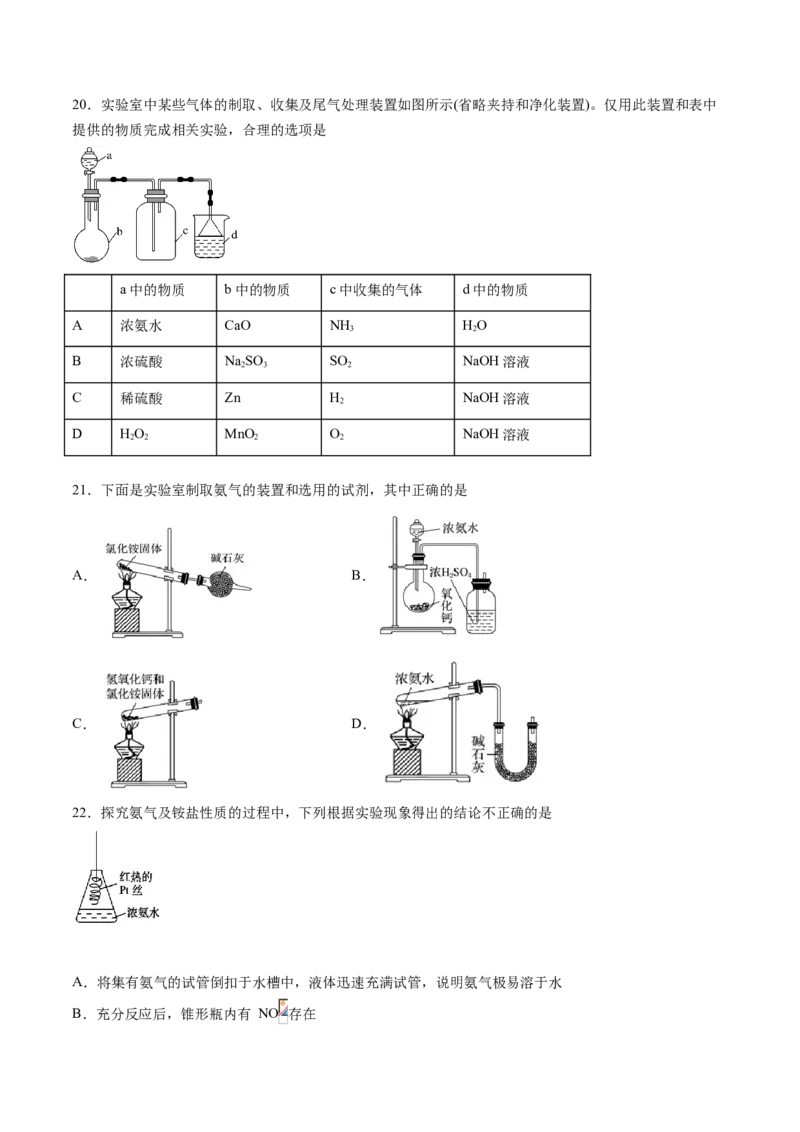
320.实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置)。仅用此装置和表中
提供的物质完成相关实验,合理的选项是
a中的物质 b中的物质 c中收集的气体 d中的物质
A 浓氨水 CaO NH HO
3 2
B 浓硫酸 NaSO SO NaOH溶液
2 3 2
C 稀硫酸 Zn H NaOH溶液
2
D HO MnO O NaOH溶液
2 2 2 2
21.下面是实验室制取氨气的装置和选用的试剂,其中正确的是
A. B.
C. D.
22.探究氨气及铵盐性质的过程中,下列根据实验现象得出的结论不正确的是
A.将集有氨气的试管倒扣于水槽中,液体迅速充满试管,说明氨气极易溶于水
B.充分反应后,锥形瓶内有 NO 存在C.加热NH HCO 固体,观察到固体逐渐减少,试管口有液滴产生,说明NH HCO 具有热不稳定性
4 3 4 3
D.将红热的Pt丝伸入如上图所示的锥形瓶中,瓶口出现少量的红棕色气体,说明氨气催化氧化的产物中
有NO
2
23.1.92g铜投入一定量浓HNO 中,铜完全溶解,生成气体颜色越来越浅,共收集到672mL气体(标准情
3
况)。将盛有此气体的容器倒扣在水中,通入标准情况下一定体积的O,恰好使气体完全溶于水中,则通
2
入O 的体积为
2
A.672mL B.168mL C.504mL D.336mL
24.将9 g铜和铁的混合物投入到100 mL稀硝酸中,充分反应后得到标准状况下1.12LNO,剩余4.8 g金
属;继续加入100 mL等浓度的稀硝酸,金属完全溶解,又得到标准状况下1.12 L NO。若向反应后的溶液
中加入KSCN溶液,溶液不变红,则下列说法正确的是
A.原混合物中铜和铁各0.15 mol
B.稀硝酸的物质的量浓度为2 mol·L-1
C.第一次剩余4.8 g 金属为铜和铁
D.再加入上述100 mL稀硝酸,还会得到标准状况下1.12 LNO
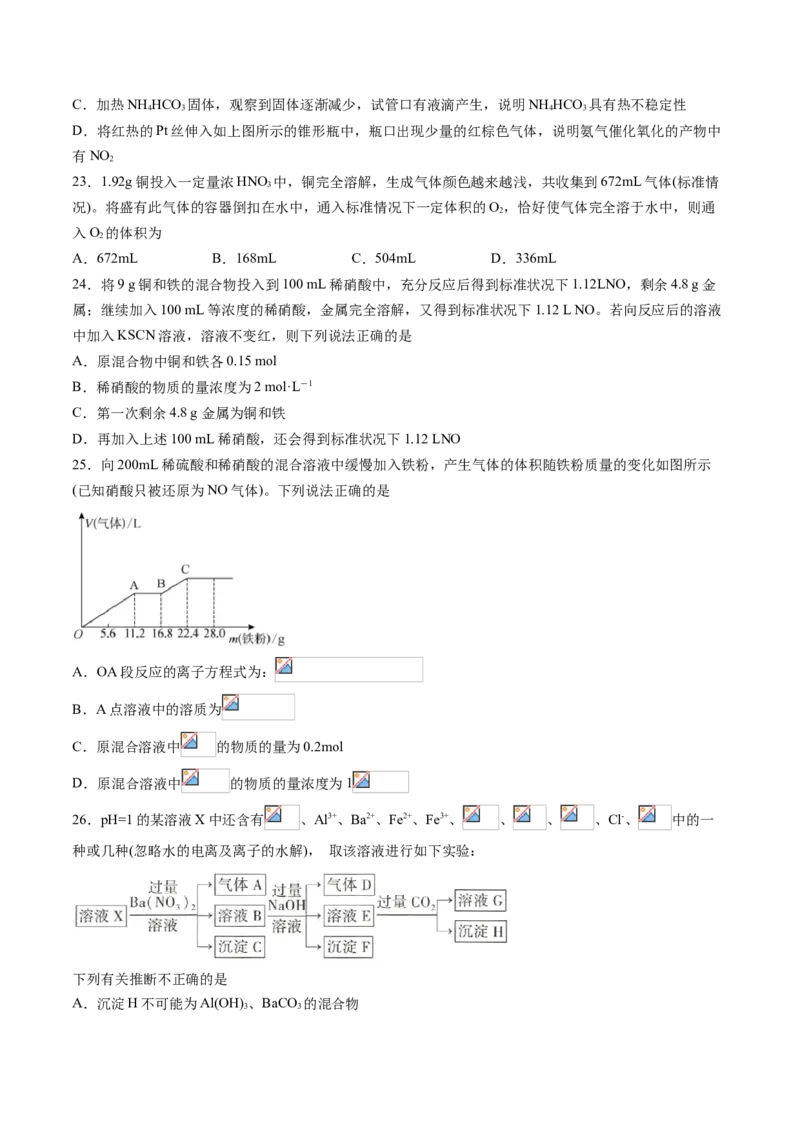
25.向200mL稀硫酸和稀硝酸的混合溶液中缓慢加入铁粉,产生气体的体积随铁粉质量的变化如图所示
(已知硝酸只被还原为NO气体)。下列说法正确的是
A.OA段反应的离子方程式为:
B.A点溶液中的溶质为
C.原混合溶液中 的物质的量为0.2mol
D.原混合溶液中 的物质的量浓度为1
26.pH=1的某溶液X中还含有 、Al3+、Ba2+、Fe2+、Fe3+、 、 、 、Cl-、 中的一
种或几种(忽略水的电离及离子的水解), 取该溶液进行如下实验:
下列有关推断不正确的是
A.沉淀H不可能为Al(OH) 、BaCO 的混合物
3 3B.根据上述连续实验不能确定溶液X中是否含有Fe3+、Cl-
C.溶液X中一定含有 、Al3+、Fe2+、 、H+
D.若溶液X为100mL,产生的气体A为112ml(标况),则X中c(Fe2+)=0.05mol/L