文档内容
专题 08 化学反应原理选择题
专项训练
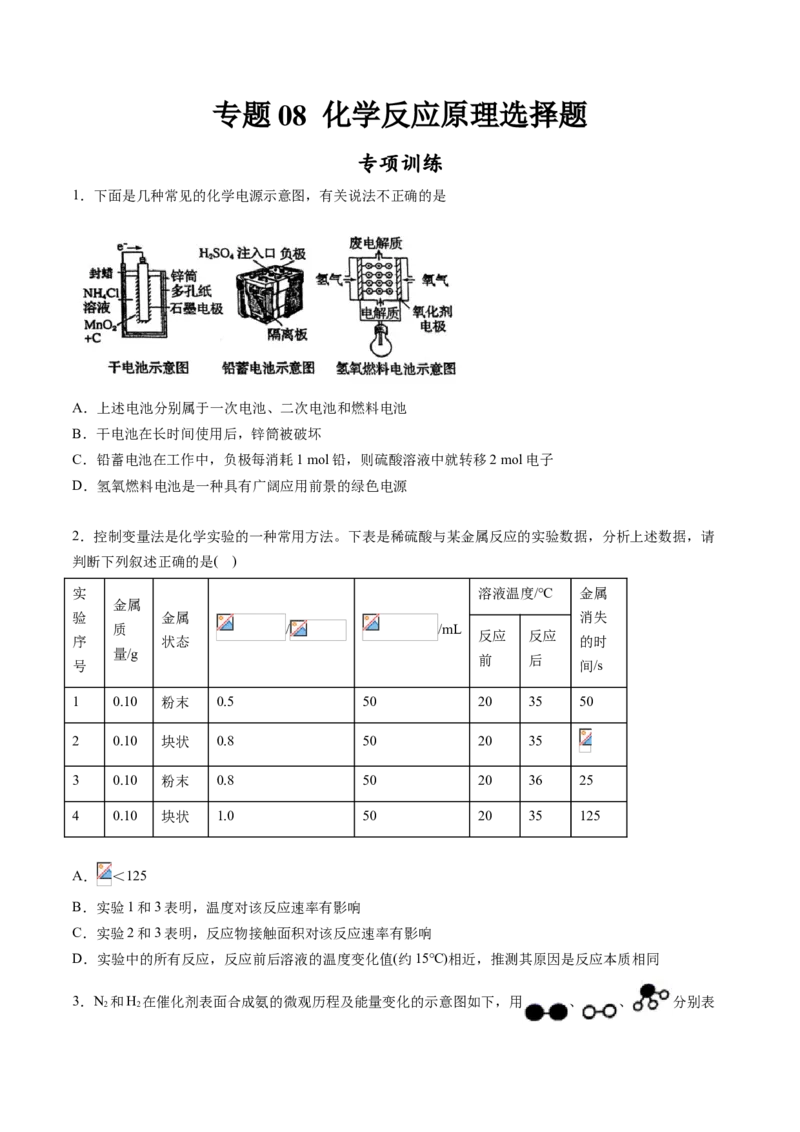
1.下面是几种常见的化学电源示意图,有关说法不正确的是
A.上述电池分别属于一次电池、二次电池和燃料电池
B.干电池在长时间使用后,锌筒被破坏
C.铅蓄电池在工作中,负极每消耗1 mol铅,则硫酸溶液中就转移2 mol电子
D.氢氧燃料电池是一种具有广阔应用前景的绿色电源
2.控制变量法是化学实验的一种常用方法。下表是稀硫酸与某金属反应的实验数据,分析上述数据,请
判断下列叙述正确的是( )
实 溶液温度/℃ 金属
金属
验 金属 消失
质 / /mL
反应 反应
序 状态 的时
量/g
前 后
号 间/s
1 0.10 粉末 0.5 50 20 35 50
2 0.10 块状 0.8 50 20 35
3 0.10 粉末 0.8 50 20 36 25
4 0.10 块状 1.0 50 20 35 125
A. <125
B.实验1和3表明,温度对该反应速率有影响
C.实验2和3表明,反应物接触面积对该反应速率有影响
D.实验中的所有反应,反应前后溶液的温度变化值(约15℃)相近,推测其原因是反应本质相同
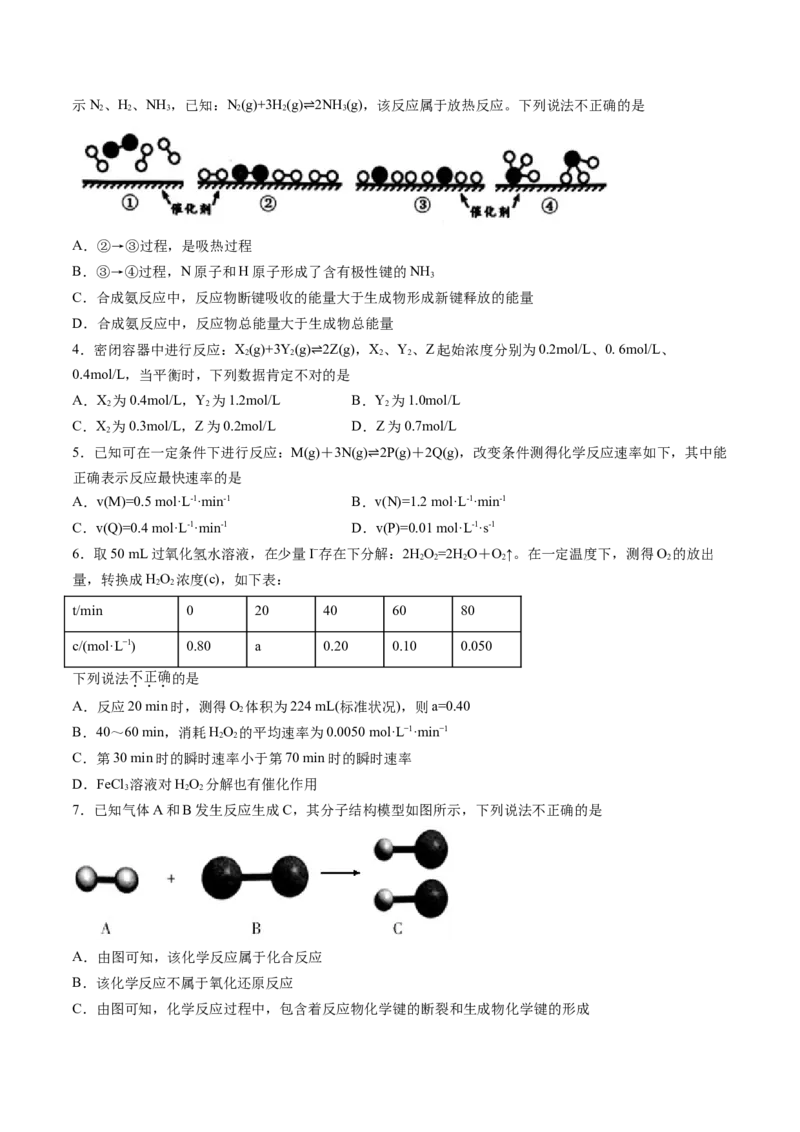
3.N 和H 在催化剂表面合成氨的微观历程及能量变化的示意图如下,用 、 、 分别表
2 2示N、H、NH ,已知:N(g)+3H(g) 2NH (g),该反应属于放热反应。下列说法不正确的是
2 2 3 2 2 3
⇌
A.②→③过程,是吸热过程
B.③→④过程,N原子和H原子形成了含有极性键的NH
3
C.合成氨反应中,反应物断键吸收的能量大于生成物形成新键释放的能量
D.合成氨反应中,反应物总能量大于生成物总能量
4.密闭容器中进行反应:X(g)+3Y(g) 2Z(g),X、Y、Z起始浓度分别为0.2mol/L、0. 6mol/L、
2 2 2 2
0.4mol/L,当平衡时,下列数据肯定不对的是
⇌
A.X 为0.4mol/L,Y 为1.2mol/L B.Y 为1.0mol/L
2 2 2
C.X 为0.3mol/L,Z为0.2mol/L D.Z为0.7mol/L
2
5.已知可在一定条件下进行反应:M(g)+3N(g) 2P(g)+2Q(g),改变条件测得化学反应速率如下,其中能
正确表示反应最快速率的是
⇌
A.v(M)=0.5 mol·L-1·min-1 B.v(N)=1.2 mol·L-1·min-1
C.v(Q)=0.4 mol·L-1·min-1 D.v(P)=0.01 mol·L-1·s-1
6.取50 mL过氧化氢水溶液,在少量I−存在下分解:2HO=2H O+O↑。在一定温度下,测得O 的放出
2 2 2 2 2
量,转换成HO 浓度(c),如下表:
2 2
t/min 0 20 40 60 80
c/(mol·L−1) 0.80 a 0.20 0.10 0.050
下列说法不正确的是
A.反应20 min时,测得O 体积为224 mL(标准状况),则a=0.40
2
B.40~60 min,消耗HO 的平均速率为0.0050 mol·L−1·min−1
2 2
C.第30 min时的瞬时速率小于第70 min时的瞬时速率
D.FeCl 溶液对HO 分解也有催化作用
3 2 2
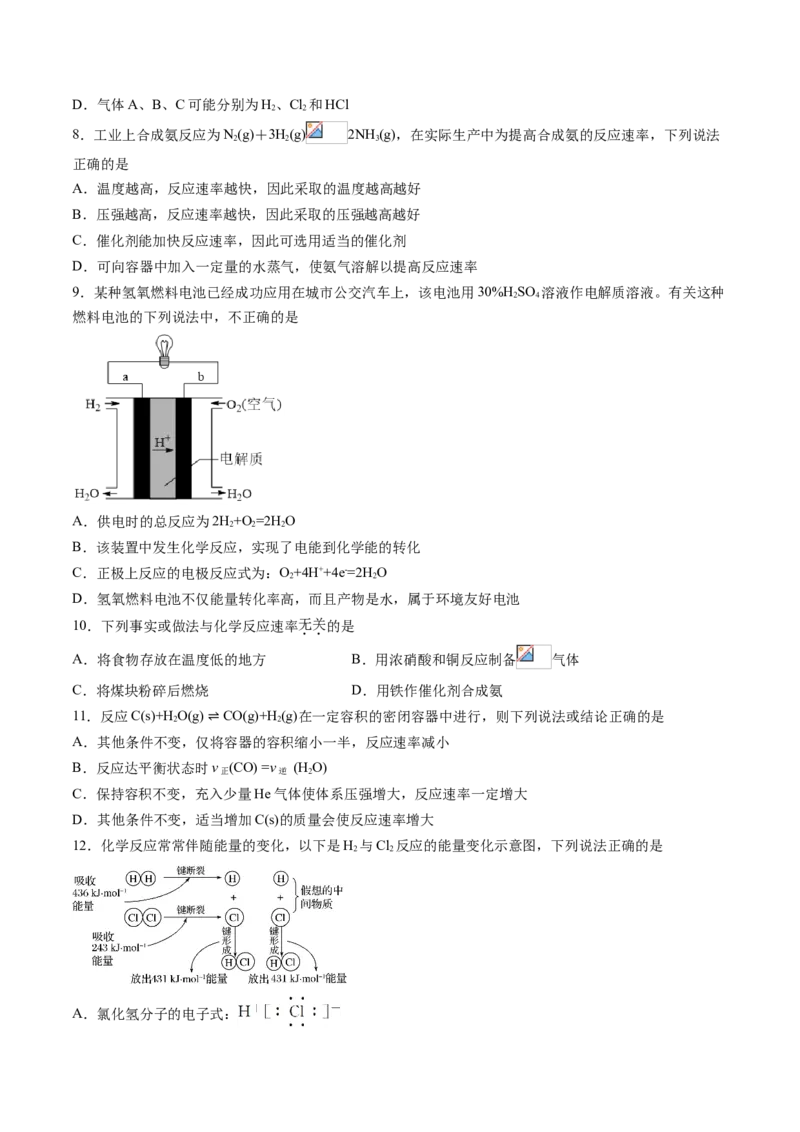
7.已知气体A和B发生反应生成C,其分子结构模型如图所示,下列说法不正确的是
A.由图可知,该化学反应属于化合反应
B.该化学反应不属于氧化还原反应
C.由图可知,化学反应过程中,包含着反应物化学键的断裂和生成物化学键的形成D.气体A、B、C可能分别为H、Cl 和HCl
2 2
8.工业上合成氨反应为N(g)+3H(g) 2NH (g),在实际生产中为提高合成氨的反应速率,下列说法
2 2 3
正确的是
A.温度越高,反应速率越快,因此采取的温度越高越好
B.压强越高,反应速率越快,因此采取的压强越高越好
C.催化剂能加快反应速率,因此可选用适当的催化剂
D.可向容器中加入一定量的水蒸气,使氨气溶解以提高反应速率
9.某种氢氧燃料电池已经成功应用在城市公交汽车上,该电池用30%H SO 溶液作电解质溶液。有关这种
2 4
燃料电池的下列说法中,不正确的是
A.供电时的总反应为2H+O =2H O
2 2 2
B.该装置中发生化学反应,实现了电能到化学能的转化
C.正极上反应的电极反应式为:O+4H++4e-=2H O
2 2
D.氢氧燃料电池不仅能量转化率高,而且产物是水,属于环境友好电池
10.下列事实或做法与化学反应速率无关的是
A.将食物存放在温度低的地方 B.用浓硝酸和铜反应制备 气体
C.将煤块粉碎后燃烧 D.用铁作催化剂合成氨
11.反应C(s)+HO(g) CO(g)+H (g)在一定容积的密闭容器中进行,则下列说法或结论正确的是
2 2
A.其他条件不变,仅将容器的容积缩小一半,反应速率减小
⇌
B.反应达平衡状态时v (CO) =v (H O)
正 逆 2
C.保持容积不变,充入少量He气体使体系压强增大,反应速率一定增大
D.其他条件不变,适当增加C(s)的质量会使反应速率增大
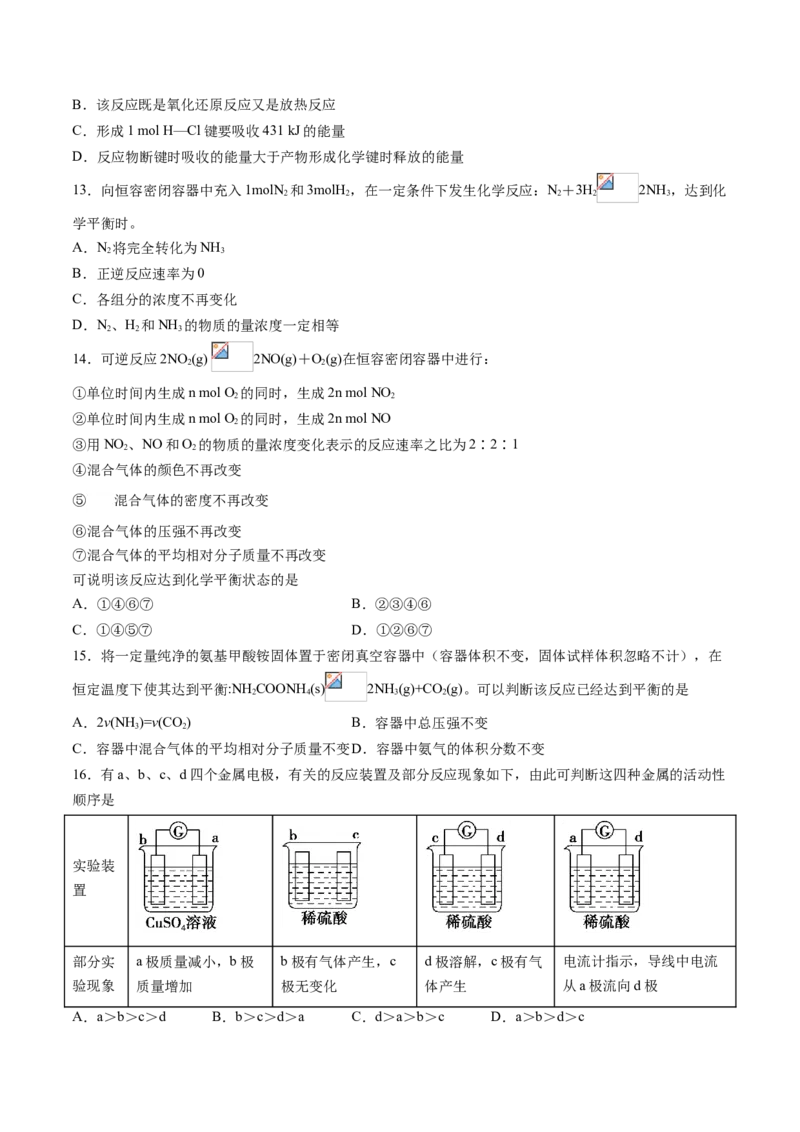
12.化学反应常常伴随能量的变化,以下是H 与Cl 反应的能量变化示意图,下列说法正确的是
2 2
A.氯化氢分子的电子式:B.该反应既是氧化还原反应又是放热反应
C.形成1 mol H—Cl键要吸收431 kJ的能量
D.反应物断键时吸收的能量大于产物形成化学键时释放的能量
13.向恒容密闭容器中充入1molN 和3molH ,在一定条件下发生化学反应:N+3H 2NH ,达到化
2 2 2 2 3
学平衡时。
A.N 将完全转化为NH
2 3
B.正逆反应速率为0
C.各组分的浓度不再变化
D.N、H 和NH 的物质的量浓度一定相等
2 2 3
14.可逆反应2NO (g) 2NO(g)+O(g)在恒容密闭容器中进行:
2 2
①单位时间内生成n mol O 的同时,生成2n mol NO
2 2
②单位时间内生成n mol O 的同时,生成2n mol NO
2
③用NO 、NO和O 的物质的量浓度变化表示的反应速率之比为2∶2∶1
2 2
④混合气体的颜色不再改变
⑤ 混合气体的密度不再改变
⑥混合气体的压强不再改变
⑦混合气体的平均相对分子质量不再改变
可说明该反应达到化学平衡状态的是
A.①④⑥⑦ B.②③④⑥
C.①④⑤⑦ D.①②⑥⑦
15.将一定量纯净的氨基甲酸铵固体置于密闭真空容器中(容器体积不变,固体试样体积忽略不计),在
恒定温度下使其达到平衡:NHCOONH(s) 2NH (g)+CO (g)。可以判断该反应已经达到平衡的是
2 4 3 2
A.2v(NH )=v(CO) B.容器中总压强不变
3 2
C.容器中混合气体的平均相对分子质量不变D.容器中氨气的体积分数不变
16.有a、b、c、d四个金属电极,有关的反应装置及部分反应现象如下,由此可判断这四种金属的活动性
顺序是
实验装
置
部分实 a极质量减小,b极 b极有气体产生,c d极溶解,c极有气 电流计指示,导线中电流
验现象 质量增加 极无变化 体产生 从a极流向d极
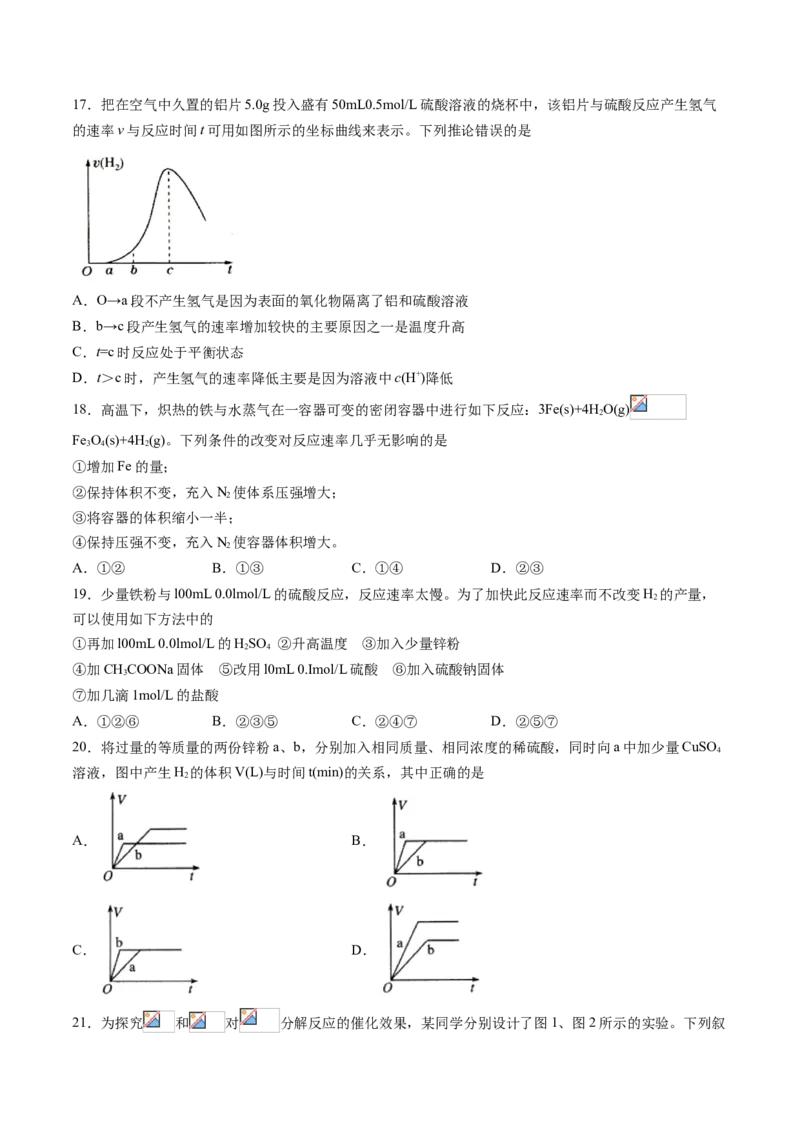
A.a>b>c>d B.b>c>d>a C.d>a>b>c D.a>b>d>c17.把在空气中久置的铝片5.0g投入盛有50mL0.5mol/L硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气
的速率v与反应时间t可用如图所示的坐标曲线来表示。下列推论错误的是
A.O→a段不产生氢气是因为表面的氧化物隔离了铝和硫酸溶液
B.b→c段产生氢气的速率增加较快的主要原因之一是温度升高
C.t=c时反应处于平衡状态
D.t>c时,产生氢气的速率降低主要是因为溶液中c(H+)降低
18.高温下,炽热的铁与水蒸气在一容器可变的密闭容器中进行如下反应:3Fe(s)+4H O(g)
2
Fe O(s)+4H(g)。下列条件的改变对反应速率几乎无影响的是
3 4 2
①增加Fe的量;
②保持体积不变,充入N 使体系压强增大;
2
③将容器的体积缩小一半;
④保持压强不变,充入N 使容器体积增大。
2
A.①② B.①③ C.①④ D.②③
19.少量铁粉与l00mL 0.0lmol/L的硫酸反应,反应速率太慢。为了加快此反应速率而不改变H 的产量,
2
可以使用如下方法中的
①再加l00mL 0.0lmol/L的HSO ②升高温度 ③加入少量锌粉
2 4
④加CHCOONa固体 ⑤改用l0mL 0.Imol/L硫酸 ⑥加入硫酸钠固体
3
⑦加几滴1mol/L的盐酸
A.①②⑥ B.②③⑤ C.②④⑦ D.②⑤⑦
20.将过量的等质量的两份锌粉a、b,分别加入相同质量、相同浓度的稀硫酸,同时向a中加少量CuSO
4
溶液,图中产生H 的体积V(L)与时间t(min)的关系,其中正确的是
2
A. B.
C. D.
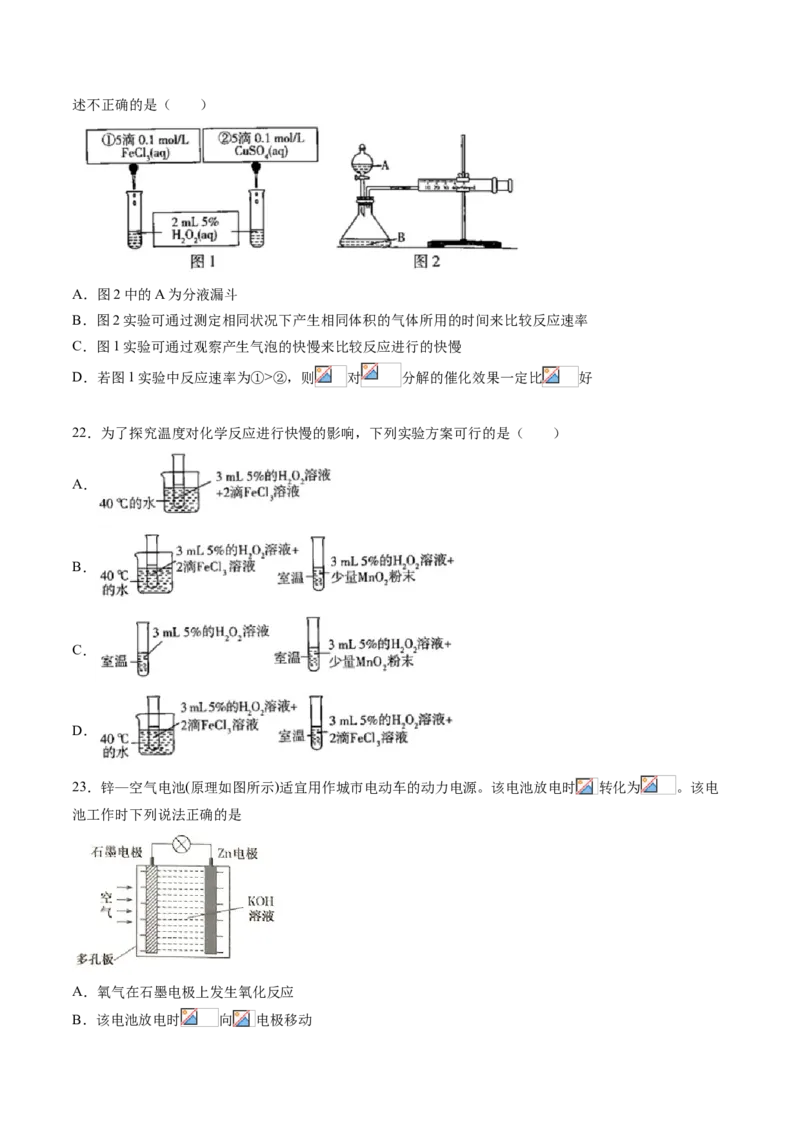
21.为探究 和 对 分解反应的催化效果,某同学分别设计了图1、图2所示的实验。下列叙述不正确的是( )
A.图2中的A为分液漏斗
B.图2实验可通过测定相同状况下产生相同体积的气体所用的时间来比较反应速率
C.图1实验可通过观察产生气泡的快慢来比较反应进行的快慢
D.若图1实验中反应速率为①>②,则 对 分解的催化效果一定比 好
22.为了探究温度对化学反应进行快慢的影响,下列实验方案可行的是( )
A.
B.
C.
D.
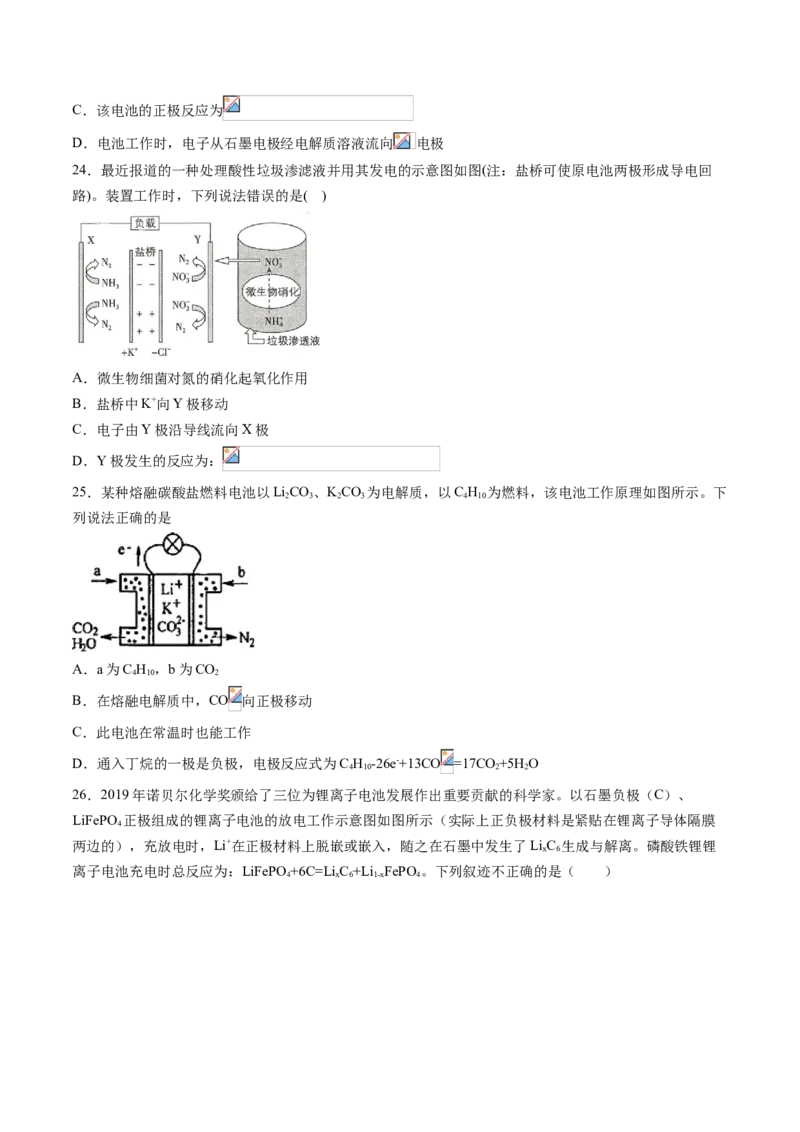
23.锌—空气电池(原理如图所示)适宜用作城市电动车的动力电源。该电池放电时 转化为 。该电
池工作时下列说法正确的是
A.氧气在石墨电极上发生氧化反应
B.该电池放电时 向 电极移动C.该电池的正极反应为
D.电池工作时,电子从石墨电极经电解质溶液流向 电极
24.最近报道的一种处理酸性垃圾渗滤液并用其发电的示意图如图(注:盐桥可使原电池两极形成导电回
路)。装置工作时,下列说法错误的是( )
A.微生物细菌对氮的硝化起氧化作用
B.盐桥中K+向Y极移动
C.电子由Y极沿导线流向X极
D.Y极发生的反应为:
25.某种熔融碳酸盐燃料电池以LiCO、KCO 为电解质,以C H 为燃料,该电池工作原理如图所示。下
2 3 2 3 4 10
列说法正确的是
A.a为C H ,b为CO
4 10 2
B.在熔融电解质中,CO 向正极移动
C.此电池在常温时也能工作
D.通入丁烷的一极是负极,电极反应式为C H -26e-+13CO =17CO +5H O
4 10 2 2
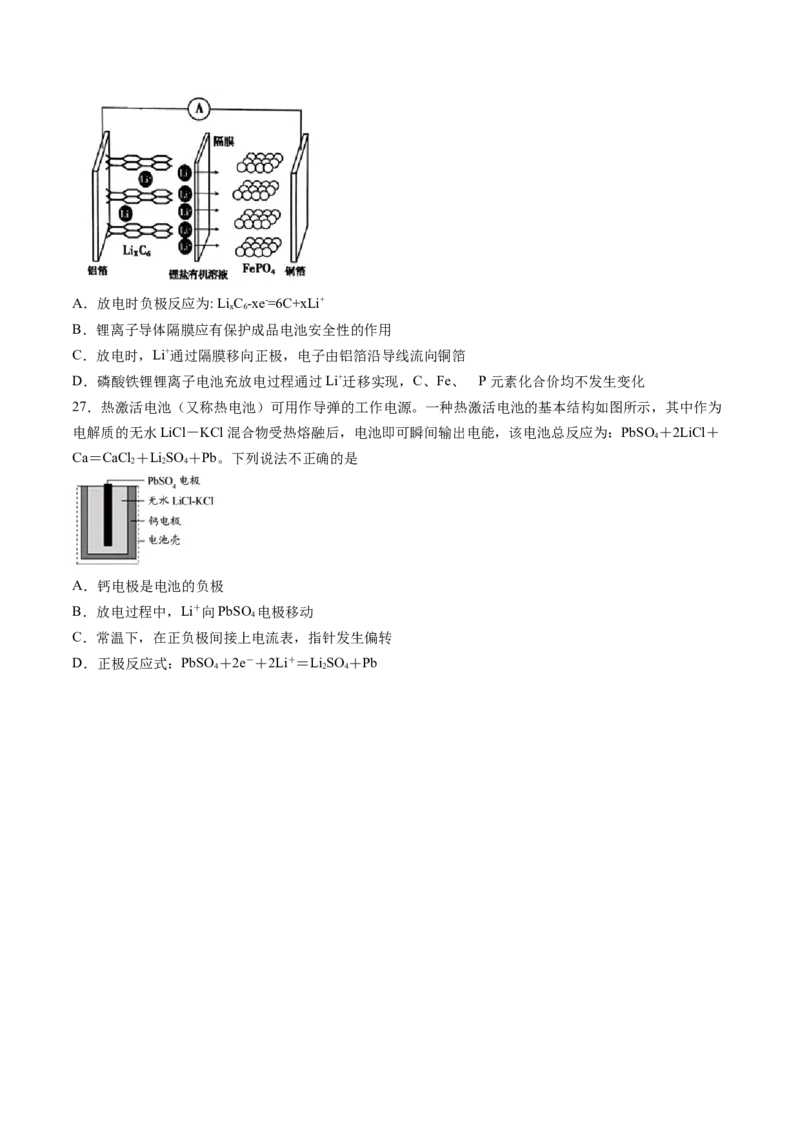
26.2019年诺贝尔化学奖颁给了三位为锂离子电池发展作出重要贡献的科学家。以石墨负极(C)、
LiFePO 正极组成的锂离子电池的放电工作示意图如图所示(实际上正负极材料是紧贴在锂离子导体隔膜
4
两边的),充放电时,Li+在正极材料上脱嵌或嵌入,随之在石墨中发生了LiC 生成与解离。磷酸铁锂锂
x 6
离子电池充电时总反应为:LiFePO +6C=Li C +Li FePO 。下列叙迹不正确的是( )
4 x 6 1-x 4A.放电时负极反应为: LiC -xe-=6C+xLi+
x 6
B.锂离子导体隔膜应有保护成品电池安全性的作用
C.放电时,Li+通过隔膜移向正极,电子由铝箔沿导线流向铜箔
D.磷酸铁锂锂离子电池充放电过程通过Li+迁移实现,C、Fe、 P元素化合价均不发生变化
27.热激活电池(又称热电池)可用作导弹的工作电源。一种热激活电池的基本结构如图所示,其中作为
电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能,该电池总反应为:PbSO +2LiCl+
4
Ca=CaCl +LiSO +Pb。下列说法不正确的是
2 2 4
A.钙电极是电池的负极
B.放电过程中,Li+向PbSO 电极移动
4
C.常温下,在正负极间接上电流表,指针发生偏转
D.正极反应式:PbSO +2e-+2Li+=LiSO +Pb
4 2 4