文档内容
第五章 化工生产中的重要非金属元素
第 2 节 氮及其化合物
第 1 课时 氮气与氮的固定 一氧化氮和二氧化氮
1.下列关于氮气的说法中错误的是( )
A.通常情况下N 性质很稳定,所以N 可以在电焊时作保护气
2 2
B.N+O=====2NO,该反应是汽车尾气造成污染的主要因素之一
2 2
C.N 在空气中约占的质量比为
2
D.在反应3Mg+N=====MgN 中,N 作氧化剂
2 3 2 2
【答案】C
【解析】N 很稳定,常用作保护气;但在高温下N 与O 产生的NO易被氧化为NO ,故汽车尾气
2 2 2 2
会造成环境污染;N 在空气中的体积含量约为;N 与金属、H 反应时作氧化剂。
2 2 2
2.下列说法中,正确的是( )
A.NO 能与水反应生成硝酸,故NO 为酸性氧化物
2 2
B.除去O 中混有的NO ,可将混合气体通过水,将NO 溶解
2 2 2
C.NO 与溴蒸气的鉴别可用NaOH溶液,溶于NaOH溶液得无色溶液的是NO ,得橙色溶液的为
2 2
溴蒸气
D.NO 是大气污染物之一
2
【答案】D
【解析】A项前后无因果关系,故A项错误;除去O 中混有的NO ,将混合气体通过水,NO 溶解
2 2 2
的同时又生成新的杂质NO且NO又能与O 反应,故B项错误;NO 、溴蒸气分别与NaOH溶液作
2 2
用均得无色溶液,所以NaOH溶液无法将NO 与溴蒸气区别开,C项错误。
2
3.一氧化氮对“非典”病毒的抑制作用明显。下列关于NO的说法正确的是( )
A.NO是酸性氧化物
B.NO只能通过人工合成
C.NO是大气污染物,会形成酸雨
D.NO可以用向下排空气法收集
【答案】C
【解析】A中,NO是不成盐氧化物,它不能与水反应生成酸;B中,NO可由N 和O 在雷雨天气
2 2
获得;C中,由于2NO+O===2NO ,3NO +HO===2HNO +NO,故NO是大气污染物,能形成
2 2 2 2 3
酸雨;D中,因NO易与O 反应,且密度和空气接近,不可用排空气法收集。
2
4.诺贝尔化学奖曾授予德国化学家Gerhard Ertl,以表彰他对固体表面化学研究过程中的重大发现。使CO、NO 等在铂表面发生化学反应转变成无毒气体,以减少汽车尾气中有毒气体的排放,正是
x
此项研究的重要应用之一。下列有关说法不正确的是( )
A.CO在铂表面被氧化生成CO,铂起催化作用
2
B.汽车尾气中的NO 在铂表面发生反应的产物是N
x 2
C.CO在铂表面可能和O、NO 反应
2 x
D.NO、CO、CO 均能与人体中的血红蛋白结合
x 2
【答案】D
【解析】CO、NO 在铂表面发生的反应为CO+NOCO +N(未配平),也可能是CO与O 反应,此
x x 2 2 2
过程中铂作催化剂;CO 不能与人体中的血红蛋白结合。
2
5.科学的假设与猜想是科学探究的先导和价值所在。在下列假设或猜想引导下的探究肯定没有意
义的是( )
A.探究SO 和NaO 反应可能有NaSO 生成
2 2 2 2 4
B.探究NO和NO可能化合生成NO
2 2
C.探究NO 可能被NaOH溶液完全吸收生成NaNO 和NaNO
2 2 3
D.探究向滴有酚酞溶液的NaOH溶液中通入Cl ,酚酞红色褪去的原因是溶液的酸碱性改变还是
2
HClO的漂白作用
【答案】B
【解析】NO和NO反应不可能生成NO ,因为氮元素的化合价均升高,没有元素化合价的降低。
2 2
6.发射卫星的运载火箭,其推进剂引燃后发生剧烈反应,产生大量高温气体从火箭尾部喷出。引
燃后产生的高温气体主要是CO、HO、N、NO,这些气体均为无色,但在卫星发射场看到火箭喷
2 2 2
出大量红烟,产生红烟的原因是 ( )
A.高温下N 遇空气生成NO
2 2
B.NO遇空气生成NO
2
C.CO 与NO反应生成CO和NO
2 2
D.NO与HO反应生成H 和NO
2 2 2
【答案】B
【解析】NO是一种极易被空气中O 氧化的气体,产物是红棕色气体NO 。
2 2
7.将a mL NO、b mL NO 、x mL O 混合于同一试管里,将试管口倒插于水中,充分反应后试管
2 2
内气体全部消失,则用a、b表示的x的代数式是 ( )
A.(a+b)/2 B.(2a+b)/3
C.(3a+b)/4 D.(4a+b)/5
【答案】C
【解析】氮的氧化物与O 和HO反应生成HNO 时,只要满足氮的氧化物中的N与氮的氧化物中
2 2 3
的O和O 中O之和的物质的量比为2∶5即可全部转化,没有气体剩余。即:=,解得x=。
2
8.按图进行实验。试管中装有12 mL NO,然后间歇而又缓慢地通入8 mL O ,下列是有关最终状
2
态的描述:①试管内气体呈红棕色 ②试管内气体呈无色 ③试管内液面不变 ④试管内液面上升
⑤试管内气体是O ⑥试管内气体是NO。其中正确的是 ( )
2
A.①③ B.②④⑤
C.②④⑥ D.②③⑤
【答案】C
【解析】根据4NO+3O+2HO===4HNO 可得,剩余气体应为NO,体积为 mL,试管内液面上升。
2 2 3
9.在标准状况下,将O 和NO 按1∶4体积比充满干燥烧瓶,把烧瓶倒置于水中,瓶内液体逐渐
2 2
上升,假设烧瓶内溶液不扩散,最终烧瓶内溶液里溶质的物质的量浓度为( )
A. mol·L-1 B. mol·L-1
C. mol·L-1 D. mol·L-1
【答案】C
【解析】设烧瓶的体积为V L,由4NO +O +2HO===4HNO 又O 和NO 的体积比为1∶4,知
2 2 2 3 2 2
NO 的体积为V L,所以最终液体充满整个烧瓶,溶液的体积为 V L,NO 的物质的量为V L÷22.4
2 2
L·mol-1=V mol,所以硝酸的物质的量浓度为V mol÷V L= mol·L-1。
10.同温同压下,在3支相同体积的试管中分别充有等体积混合的两种气体,它们是①NO和
NO ,②NO 和O ,③NO和N 。现将3支试管均倒置于水槽中,充分反应后,试管中剩余气体的
2 2 2 2
体积分别为V、V、V,则下列关系正确的是( )
1 2 3
A.V>V>V B.V>V>V
1 2 3 1 3 2
C.V>V>V D.V>V>V
2 3 1 3 1 2
【答案】D
【解析】可假设试管体积均为2V,则每种气体的体积均为V;当倒置于水槽中时:①中有反应:
3NO +HO===2HNO +NO,则剩余气体的体积 V =V;②中有反应:4NO +O +
2 2 3 1 2 2
2HO===4HNO ,则剩余O 的体积V =V;③中气体与水不反应,故试管中气体体积V =2V。综上
2 3 2 2 3
所述,V>V>V。
3 1 2
11.汽车尾气(含烃类、CO、SO 与NO等物质)是城市空气的污染源之一。治理的方法之一是在汽
2
车的排气管上装一个催化转换器(用Pt、Pd合金作催化剂),它的特点是使CO和NO反应,生成可
参与大气生态环境循环的无毒气体,并促使汽油充分燃烧及SO 的转化。
2
(1)写出NO与CO通过催化转换器发生反应的化学方程式:_____________________。
(2)催化转换器的缺点是在一定程度上提高了空气的酸度。其原因是________________。
(3)控制城市空气污染源的方法有________(填选项编号)。
a.植树造林 b.开发氢能源 c.使用电动车 d.控制汽车进城 e.使用无铅汽油
【答案】(1)2CO+2NO=====N+2CO
2 2
(2)反应除生成了N 外,还生成了增加空气酸度的CO 和SO (3)bc
2 2 3
【解析】 汽车尾部排出的废气中主要含CO、NO 及碳氢化合物。CO是汽油不完全燃烧的产物,
x
NO 是汽油爆裂时,由空气中的氮和氧化合而成。碳氢化合物中含有烃类,有的是汽油原有成分,
x有的是氧化产物。大城市中汽车多,大气中NO含量较高,这是因为汽车引擎在工作时产生高温使
之发生如下反应:N +O=====2NO,矿物油中硫在燃烧过程中产生SO ,治理方法是在汽车排气
2 2 2
管上装一个用铂、钯合金做的催化转化器,使 NO与CO反应生成N 和CO ,SO 被催化氧化为
2 2 2
SO 。控制城市空气污染方法中,植树造林这一选项具有一定的迷惑性,植树造林能控制CO 量的
3 2
增加,但对消除汽车尾气中的烃类、CO、SO 与NO等物质没有直接的效果,选bc。
2
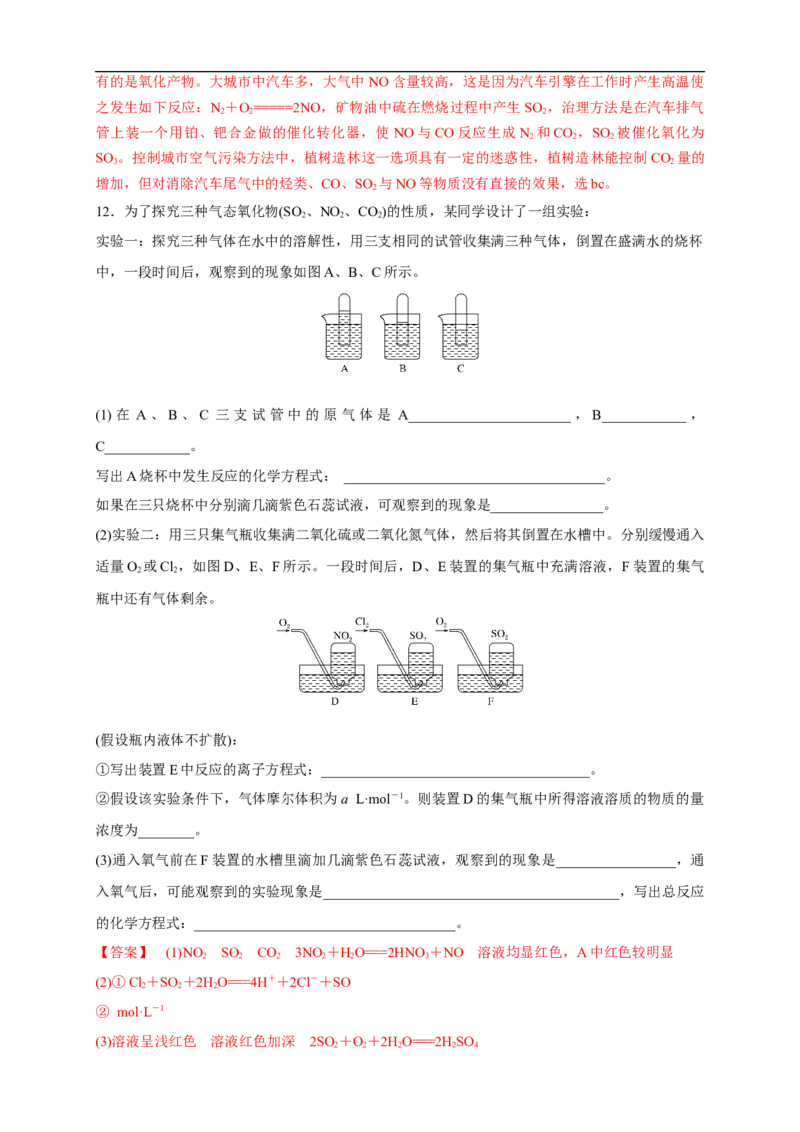
12.为了探究三种气态氧化物(SO 、NO 、CO)的性质,某同学设计了一组实验:
2 2 2
实验一:探究三种气体在水中的溶解性,用三支相同的试管收集满三种气体,倒置在盛满水的烧杯
中,一段时间后,观察到的现象如图A、B、C所示。
(1)在 A、B、C 三支试管中的原气体是 A_______________________,B____________,
C____________。
写出A烧杯中发生反应的化学方程式: _____________________________________。
如果在三只烧杯中分别滴几滴紫色石蕊试液,可观察到的现象是________________。
(2)实验二:用三只集气瓶收集满二氧化硫或二氧化氮气体,然后将其倒置在水槽中。分别缓慢通入
适量O 或Cl ,如图D、E、F所示。一段时间后,D、E装置的集气瓶中充满溶液,F装置的集气
2 2
瓶中还有气体剩余。
(假设瓶内液体不扩散):
①写出装置E中反应的离子方程式:______________________________________。
②假设该实验条件下,气体摩尔体积为a L·mol-1。则装置D的集气瓶中所得溶液溶质的物质的量
浓度为________。
(3)通入氧气前在F装置的水槽里滴加几滴紫色石蕊试液,观察到的现象是_________________,通
入氧气后,可能观察到的实验现象是__________________________________________,写出总反应
的化学方程式:_____________________________________。
【答案】 (1)NO SO CO 3NO +HO===2HNO +NO 溶液均显红色,A中红色较明显
2 2 2 2 2 3
(2)①Cl+SO +2HO===4H++2Cl-+SO
2 2 2
② mol·L-1
(3)溶液呈浅红色 溶液红色加深 2SO +O+2HO===2H SO
2 2 2 2 4【解析】 (1)SO 易溶于水,CO 微溶于水,溶解的SO 、CO 部分与水反应分别生成HSO 和
2 2 2 2 2 3
HCO 。NO 与水反应3NO +HO===2HNO +NO,进入试管的溶液体积为试管容积的=,A试管
2 3 2 2 2 3
中原气体是NO ,B试管中是SO ,C试管中是CO ,试管中的溶液向烧杯中扩散,溶液均呈酸性,
2 2 2
都能使紫色石蕊试液变红色。
(2)NO 和O ,SO 和Cl 按一定比例可完全溶解于水中形成溶液 4NO +O +2HO===4HNO ,SO
2 2 2 2 2 2 2 3 2
+Cl+2HO===2HCl+HSO ,而SO 溶于水只有部分SO 与水反应SO +HOH SO ,很少量的
2 2 2 4 2 2 2 2 2 3
HSO 消耗很少量的O,2HSO +O===2H SO 。
2 3 2 2 3 2 2 4
设充满NO 的集气瓶容积为V L,n(NO )== mol,倒置于水槽中通入O 形成 mol HNO ,溶液体
2 2 2 3
积也为V L,故集气瓶中HNO 浓度为c(HNO)== mol·L-1。
3 3
(3)H SO 是中强酸,且浓度很小时酸性很弱,滴加紫色石蕊试液显浅红色,通入氧气后,HSO 被
2 3 2 3
氧化为HSO ,酸性增强,石蕊试液所显红色变深。总反应为2SO +O+2HO===2H SO 。
2 4 2 2 2 2 4
13.如图所示:在B水槽中装有500 mL水,容积为a mL的试管A充满了NO 和NO的混合气体
2
(标准状况),将试管A倒插入B水槽的水中。充分反应后,试管A中余下气体的体积为0.5a mL。
(1)将A倒插入B槽中发生的反应为_______________________________________________,
该反应中氧化剂与还原剂的质量比为________,原混合气体中 NO 和 NO 的物质的量之比为
2
________。
(2)通过导气管 C 向余下 0.5a mL 气体的试管 A 中持续通入氧气,A 中可能观察到的现象是
_______________________________________________________________________。
(3)当试管A中充满气体时停止通入氧气,然后将试管取出水槽,水槽B中溶液的物质的量浓度为
________ mol·L-1(设溶液的体积仍为500 mL)。
【答案】 (1)3NO +HO===2HNO +NO 1∶2 3∶1
2 2 3
(2)无色气体变为红棕色,试管中液面不断上升至全充满。继续通入氧气后,试管中液面下降,最后
充满无色气体
(3)
【解析】 (1)试管A倒插入B水槽水中后,发生反应3NO +HO===2HNO +NO,氧化剂与还原
2 2 3
剂均为NO ,质量比为1∶2。根据题意有n(NO )+n(NO)=[n(NO )+n(NO)],n(NO )∶n(NO)=
2 2 2 2
3∶1。(2)试管A中剩余0.5a mL气体为NO,通入氧气后,发生反应
2NO+O===2NO 4NO +O +2HO===4HNO ,可写为4NO+3O +2HO===4HNO ,无色气体变
2 2, 2 2 2 3 2 2 3
为红棕色气体,试管中液面不断上升至全充满,继续通入氧气后,试管中液面下降,最后充满无色
气体(O )。(3)试管中充满气体时,根据氮原子守恒,n(HNO)=n(气体)=×
2 3
10-3 mol,c(HNO)== mol·L-1。
3
14.将10 mL充满NO 和O 的混合气体的试管,倒置在水槽中,反应停止后试管内剩余2 mL的无
2 2
色气体,求原混合气体中NO 和O 各多少毫升?
2 2【答案】 若剩余的气体是NO,则NO 和O 的体积分别为9.2 mL和0.8 mL;若剩余的气体是
2 2
O,则NO 和O 的体积分别为6.4 mL和3.6 mL。
2 2 2
【解析】 剩余2 mL气体可能是NO或O,分两种情况讨论:
2
(1)剩余的是NO,可以看成先发生了反应:4NO +O +2HO===4HNO 剩余的NO 又与水作用,最
2 2 2 3 2
终有2 mL NO 产生。由反应3NO +HO===2HNO +NO得,剩余的NO 体积为2 mL×3=6 mL。
2 2 3 2
则原有O 体积为(10 mL-6 mL)×=0.8 mL,NO 体积为10 mL-0.8 mL=9.2 mL。
2 2
(2)剩余的是O,则有10 mL-2 mL=8 mL NO 和O 的混合气体按反应4NO +O+2HO===4HNO
2 2 2 2 2 2 3
进行。所以NO 的体积为8 mL×=6.4 mL,O 体积为10 mL-6.4 mL=3.6 mL。
2 2