文档内容
高河中学2025-2026学年度第一学期12月月考 B.比较 、 的热稳定
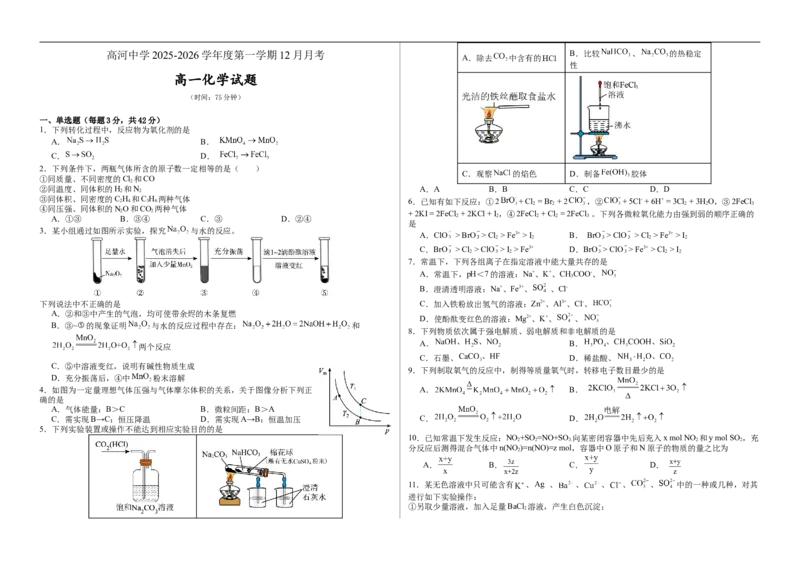
A.除去 中含有的
性
高一化学试题
(时间:75分钟)
一、单选题(每题3分,共42分)
1.下列转化过程中,反应物为氧化剂的是
A. B.
C. D.
2.下列条件下,两瓶气体所含的原子数一定相等的是( )
C.观察 的焰色 D.制备 胶体
①同质量、不同密度的Cl 和CO
2
②同温度、同体积的H 和N A.A B.B C.C D.D
2 2
③同体积、同密度的C 2 H 4 和C 3 H 6 两种气体 6.已知有如下反应:①2 + Cl = Br + 2 ,② + 5Cl- + 6H+ = 3Cl + 3H O,③2FeCl
2 2 2 2 3
④同压强、同体积的NO和CO 两种气体
2 2 + 2KI = 2FeCl + 2KCl + I ,④2FeCl + Cl = 2FeCl 。下列各微粒氧化能力由强到弱的顺序正确的
A.①③ B.③④ C.③ D.②④ 2 2 2 2 3
是
3.某小组通过如图所示实验,探究 与水的反应。
A.ClO > BrO > Cl > Fe3+ > I B. BrO > ClO > Cl > Fe3+ > I
2 2 2 2
C.BrO > Cl > ClO > I > Fe3+ D.BrO > ClO > Fe3+ > Cl > I
2 2 2 2
7.常温下,下列各组离子在指定溶液中能大量共存的是
A.常温下,pH<7的溶液:Na+、K+、CHCOO-、
3
B.澄清透明溶液:Na+、Fe3+、 、Cl-
下列说法中不正确的是 C.加入铁粉放出氢气的溶液:Zn2+、Al3+、Cl-、
A.②和③中产生的气泡,均可使带余烬的木条复燃
D.使酚酞变红色的溶液:Mg2+、K+、 、
B.③~⑤的现象证明 与水的反应过程中存在: 和
8.下列物质依次属于强电解质、弱电解质和非电解质的是
A. B.
两个反应
C.石墨、 D.稀盐酸、
C.⑤中溶液变红,说明有碱性物质生成
9.下列制取氧气的反应中,制得等质量氧气时,转移电子数目最少的是
D.充分振荡后,④中 粉末溶解
4.如图为一定量理想气体压强与气体摩尔体积的关系,关于图像分析下列正 A. B.
确的是
A.气体能量:B>C B.微粒间距:B>A
C.需实现B→C:恒压降温 D.需实现A→B:恒温加压 C. D.
5.下列实验装置或操作不能达到相应实验目的的是
10.已知常温下发生反应:NO +SO=NO+SO 向某密闭容器中先后充入x mol NO 和y mol SO ,充
2 2 3. 2 2
分反应后测得混合气体中n(NO )=n(NO)=z mol,容器中O原子和N原子的物质的量之比为
2
A. B. C. D.
11.某无色溶液中只可能含有 、 、 、 、 、 、 中的一种或几种,对其
进行如下实验操作:
①另取少量溶液,加入足量BaCl 溶液,产生白色沉淀;
2②向①所得混合物中加足量盐酸,沉淀部分溶解,并有气泡生成; ③混合气体在标准状况下的密度是 。(计算结果保留两位小数)
③将②所得混合物过滤,向滤液中加入AgNO 溶液,有白色沉淀生成。
3
下列对该溶液的说法正确的是
17.有A、B、C、D四种易溶于水的固体,它们分别由 、
A.一定不含有 、 、 、 B.可能含有 、
中的一种阳离子和一种阴离子构成(同一种离子只存在一种物质中)。某课外小组做了以
C.一定含有 、 、 D.可能含有 、
下实验:①将四种盐各取少量,分别溶于盛有一定量蒸馏水的4支试管中,只有B盐溶液呈蓝色;
12. 已知 与 溶液发生反应Ⅰ: ; 与酸化的
②分别向4支试管中加入足量稀盐酸,发现A盐溶液中产生白色沉淀,C盐溶液中有较多气泡产
溶液发生反应Ⅱ: 。下列推断正确 生,而D盐溶液无明显现象。
的是 (1)根据上述实验事实,推断A、D两种盐的化学式:A ;D 。
A.由反应Ⅰ可知, 中二价铅和四价铅含量之比为 (2)写出下列反应的离子方程式:
B.由反应Ⅰ、Ⅱ可知,氧化性: ① : 。
② 气体: 。
C.Pb可与稀硝酸发生反应:
(3)实验反思时,有同学提出:如果溶液中同时存在 和 会对 的检验产生干扰。为
D. 可与盐酸发生反应:
了确定该溶液中是否存在 ,该小组同学进行了如下探究实验:
13.设 表示阿伏加德罗常数的值,下列叙述不正确的是
实验步
A.常温常压下,16 g氧气所含的原子数为 实验操作 实验目的
骤
B. 与过量 反应时,转移的电子数为
除去 ** 错误的表达
C. 标准状况下,22.4 L氯气溶于足量的水所得溶液中含HClO分子数为 第一步 向溶液中滴加过量的 溶液
式 ** 的干扰
D.两份等质量的钠分别与足量氧气反应,生成氧化钠和过氧化钠转移的电子一样多
14. 下列操作会引起所配NaCl溶液物质的量浓度偏高的是 向第一步实验后的溶液中滴加----** 检验 ** 错误的
第二步
A.定容时,俯视容量瓶颈部的刻度线 错误的表达式 ** 表达式 ** 的存在
B.未将洗涤烧杯和玻璃棒的溶液一并转移至容量瓶 -
C.配制溶液所用的容量瓶洗净后,有蒸馏水残留未烘干 18.实际生产中常利用氯碱工业得到的氯气和氢氧化钠反应制取漂白剂(有效成分为次氯酸钠)。
D.摇匀后,发现溶液的凹液面低于刻度线,又滴加几滴蒸馏水 Ⅰ.在疫情防控中,常使用次氯酸钠溶液对环境消毒。已知某“84消毒液”瓶体部分标签如图所示。
二、填空题(每空2分,共58分) 请回答下列问题:
15.请回答下列问题:
(1)下列物质:①HCl气体 ②Ca(OH) 固体 ③稀硫酸 ④SO ⑤硫酸钡固体 ⑥氨水 ⑦KNO
2 2 3
溶液 ⑧石墨 ⑨蔗糖 ⑩Cu
能导电的是 ;属于电解质的是 ;属于非电解质的是 (填编号)。
(2)56g氮气在标准状况下的体积为 。
(3)3.9gNa O 中Na+的数目为 。
2 2
(4)现有标准状况下CO和CO 混合气体6.72L,其质量为11.6g,则此混合气体中,CO和CO 的物
2 2
质的量之比是 。
16.请回答下列问题:
(1)该“84 消毒液”中 NaClO 的物质的量浓度为 。
(1)若某原子的摩尔质量是 ,则一个该原子的真实质量是 g。
(2) 臭氧( )中含有 的分子数目是 ,含有O的原子数目是 。 (2)小明某次实验需要使用该浓度的“84 消毒液”900 mL,他在实验室配制该浓度溶液时需用托盘
(3) 和 的混合气体20g,完全燃烧后测得 体积为11.2L(标准状况), 天平称量NaClO 固体的质量为 g。
①混合气体中 的质量是 g; (3)定容时向容量瓶中加蒸馏水至液面距离刻度线 时,改用 滴加蒸馏水至溶液的凹液
②混合气体中 在标准状况下的体积是 L; 面正好与刻度线相切。
2(4)下列情况会导致所配制“84 消毒液”的物质的量浓度偏高的是 (填字母)。
(2)
a.容量瓶用蒸馏水洗涤后未干燥 b.定容时俯视刻度线
(3) 溶液
c.配制过程中未洗涤烧杯和玻璃棒 d.定容摇匀后,液面低于刻度线
【分析】有A、B、C、D四种易溶于水的固体,它们分别由 、 、 、 、 、
Ⅱ.实验室可以用高锰酸钾和浓盐酸反应制取氯气,反应方程式如下:
、 、 中的一种阳离子和一种阴离子构成(同一种离子只存在一种物质中);
2KMnO 4 ﹢16HCl(浓) =2KCl+2MnCl 2 +5Cl 2 ↑ +8H₂O ①将四种盐各取少量,分别溶于盛有一定量蒸馏水的4支试管中,只有B盐溶液呈蓝色:则B溶液
(5)该反应中氧化剂是 (填写化学式)。 的阳离子为 ,阴离子不可能是 ;
②分别向4支试管中加入足量稀盐酸,发现A盐溶液中产生白色沉淀:则A溶液的阳离子为 ,
(6)在化学方程式上用双线桥标出电子转移方向及数目 。
由于 与 、 、 都不能共存,则A溶液的阴离子只有 满足,所以A溶液为
(7)当有0.2mol电子发生转移时,理论上生成氯气的体积(标准状况)为 ,发生反应的高锰酸
溶液;
钾的质量为 。
C盐溶液中有较多气泡产生:说明 C溶液的阴离子为 ,因 与 、 、 都不能
(8)把氯气溶于水得到氯水,氯水的成分复杂。将氯水滴入紫色石蕊试液中,观察到石蕊试液先变红
共存,则C溶液的阳离子只有 满足,所以C溶液为 溶液;
后褪色,产生上述现象的原因是因为溶液中含有的主要微粒是 (填化学符号)。
D盐溶液无明显现象:结合前面判断,D溶液的阳离子为 ,与剩余的 、 中的 不能
共存,则D溶液的阴离子为 ,得到D溶液为 溶液;最后剩余的B溶液为 溶液,据
此分析解答。
【详解】(1)根据分析,A的化学式为: ;D的化学式为: 。
高一化学参考答案
(2)写出下列反应的离子方程式:
① : ;
1-14: BCDDA BBACD CDCA
15. ③⑥⑦⑧⑩ ①②⑤ ④⑨ 44.8L 0.1N 1:2
A ② 气体: 。
16.(1) (2) (3) 3.5 8.4 (3)如果溶液中同时存在 和 , 会对 的检验产生干扰;为了确定该溶液中是否存
【详解】(1)根据摩尔质量知,1mol该原子的质量是Mg,1mol原子有阿伏加德罗常数N 个 在 ,需要先排除 产生的干扰,可以先用过量硝酸消耗 : ;
A
(N =6.02×1023),即N 个原子的质量是Mg,则一个该原子的真实质量约为 ; 然后再加入少量 溶液;如有白色沉淀产生,则原溶液中存在 。
A A
18.(1)1 (2)74.5 (3) 1~2cm 胶头滴管 (4)b (5)KMnO
4
(2) ,故0.5mol臭氧(O )中含有O 的分子数
3 3
目是 ;1个臭氧分子中含有三个氧原子,故0.5mol臭氧(O )中含有O的原子数目是
3 (6) (7) 22.4L 6.32g (8)H+、HClO
;
(3)CO燃烧发生反应: ,CO的体积与生成CO 的体积相等,燃烧后CO 的总 【分析】配制一定物质的量浓度的溶液,所需的步骤有计算、称量、溶解(冷却)、转移、洗涤、
2 2
定容、摇匀、装瓶贴签。
体积为11.2L,故20gCO和CO 的混合气体的总体积为11.2L,在标准状况下,20gCO和CO 的混
2 2 【详解】(1)由 可知密度为1 g/mL,质量分数为25%的NaClO的物质的量浓度为
合气体的物质的量为0.5mol,设CO的物质的量为x mol,CO 的物质的量为y mol,则
2
, ,解得 , 。则混合气体中CO的质量 ;
(2)由于容量瓶没有900mL的规格,故选用1000mL的容量瓶进行配制,需用托盘天平称量
;原混合气体中,CO 在标准状况下的体积是 ;原混合气体在标准状况下
2
NaClO 固体的质量为 ;
(3)定容时向容量瓶中加蒸馏水至液面距离刻度线1~2cm时,改用胶头滴管滴加蒸馏水至溶液的
的密度是
凹液面正好与刻度线相切;
17.(1) AgNO BaCl (4)a.容量瓶用蒸馏水洗涤后未干燥,不会影响浓度,a错误;
3 2
b.定容时俯视刻度线,导致体积偏小,浓度偏高,b正确;c.配制过程中未洗涤烧杯和玻璃棒,导致溶质损失,溶质物质的量减小,浓度偏小,c错误;
d.由于分子间有间隙,定容摇匀后,液面低于刻度线,不影响溶液浓度,d错误;
故选b;
(5)2KMnO ﹢16HCl(浓) =2KCl+2MnCl +5Cl↑ +8H₂O中Mn元素化合价由+7降低到+2,化合价
4 2 2
降低,故KMnO 为氧化剂;
4
(6)
在2KMnO ﹢16HCl(浓) =2KCl+2MnCl +5Cl↑ +8H₂O上用双线桥标出电子转移方向及数目为
4 2 2
;
(7)由2KMnO ﹢16HCl(浓) =2KCl+2MnCl +5Cl↑ +8H₂O中转移10个电子可知,当有0.2mol电子
4 2 2
发生转移时,理论上生成氯气的物质的量为0.1mol,体积(标准状况)为2.24L,发生反应的高锰酸钾
的物质的量为0.04mol,质量为6.32g;
(8)将氯水滴入紫色石蕊试液中,观察到石蕊试液先变红,说明溶液呈酸性,含有大量H+,后褪
色,说明溶液有漂白性,含有大量的HClO。
4