文档内容
第六章 化学反应与能量
章末检测
一、选择题(本题包括18小题,每小题3分,共54分。每小题只有一个选项符合题意)
1.研究物质变化时,人们可以从不同的角度、不同的层面来认识物质变化时所引起的化学键及能
量变化。据此判断以下叙述中错误的是( )
A.金属钠与氯气反应生成氯化钠后,其结构的稳定性增强,体系的能量降低
B.物质燃烧可看作是储存在物质内部的能量(化学能)转化为热能释放出来
C.氮气分子内部存在着很强的化学键,故通常情况下氮气的化学性质很活泼
D.需要加热才能发生的反应不一定是吸收能量的反应
2.化学反应条件的控制具有重要的现实意义。如下反应条件的控制中,不恰当的是( )
A.为防止铁生锈,在其表面涂一层防锈油漆
B.为防止火灾,在面粉厂、加油站等场所要严禁烟火
C.为加快KClO 的分解速率而加入MnO
3 2
D.降温加快HO 的分解速率
2 2
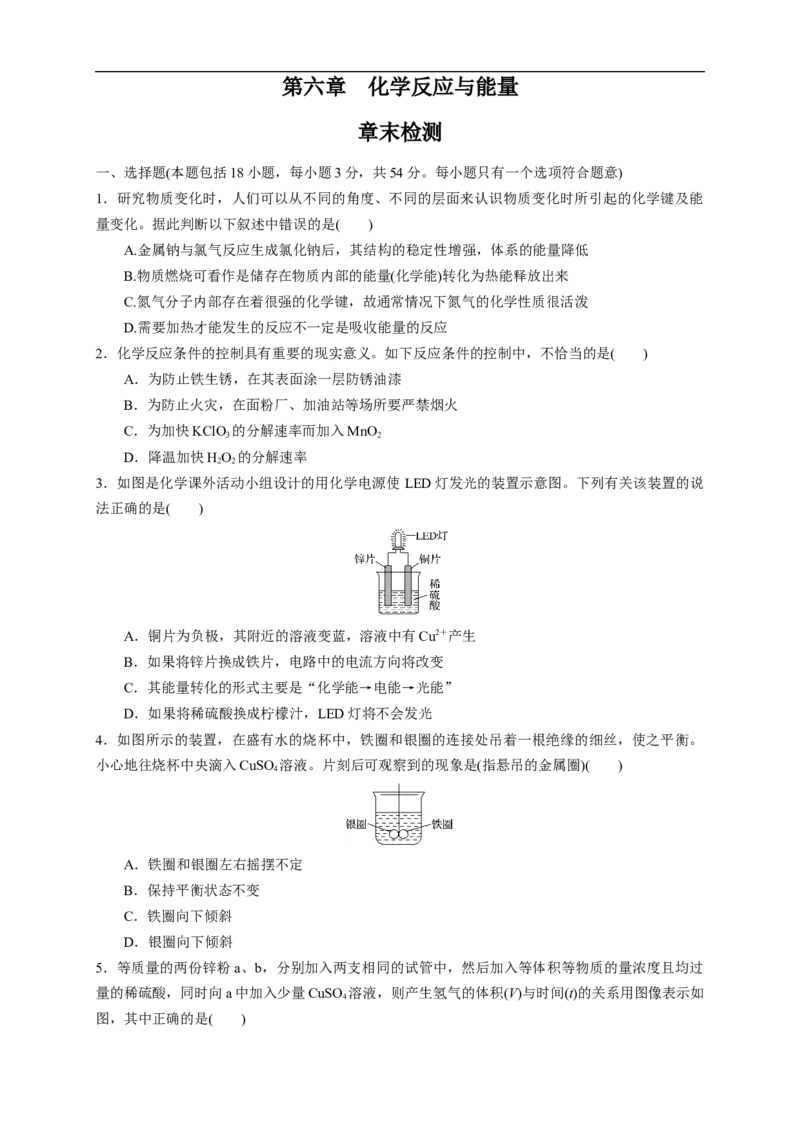
3.如图是化学课外活动小组设计的用化学电源使 LED灯发光的装置示意图。下列有关该装置的说
法正确的是( )
A.铜片为负极,其附近的溶液变蓝,溶液中有Cu2+产生
B.如果将锌片换成铁片,电路中的电流方向将改变
C.其能量转化的形式主要是“化学能→电能→光能”
D.如果将稀硫酸换成柠檬汁,LED灯将不会发光
4.如图所示的装置,在盛有水的烧杯中,铁圈和银圈的连接处吊着一根绝缘的细丝,使之平衡。
小心地往烧杯中央滴入CuSO 溶液。片刻后可观察到的现象是(指悬吊的金属圈)( )
4
A.铁圈和银圈左右摇摆不定
B.保持平衡状态不变
C.铁圈向下倾斜
D.银圈向下倾斜
5.等质量的两份锌粉a、b,分别加入两支相同的试管中,然后加入等体积等物质的量浓度且均过
量的稀硫酸,同时向a中加入少量CuSO 溶液,则产生氢气的体积(V)与时间(t)的关系用图像表示如
4
图,其中正确的是( )6.已知汽车尾气无害化处理反应为2NO(g)+2CO(g)N(g)+2CO(g)。下列说法不正确的是(
2 2
)
A.升高温度可使该反应的逆反应速率降低
B.使用高效催化剂可有效提高正反应速率
C.反应达到平衡后,NO的反应速率保持恒定
D.单位时间内消耗CO和CO 的物质的量相等时,反应达到平衡
2
7.下列有关化学反应速率和限度的说法中,不正确的是( )
A.实验室用HO 分解制O,加入MnO 后,反应速率明显加快
2 2 2 2
B.在金属钠与足量水反应中,增加水的量能加快反应速率
C.2SO +O2SO 反应中,SO 不能全部转化为SO
2 2 3 2 3
D.实验室用碳酸钙和盐酸反应制取CO,用碳酸钙粉末比用块状碳酸钙反应要快
2
8.根据下面的信息,下列叙述正确的是( )
HO(g)
2
A.2 mol H (g)与1 mol O (g)反应生成2 mol H O(g)吸收能量为490 kJ
2 2 2
B.化学反应中能量变化的大小与反应物的质量多少无关
C.1 mol H (g)与0.5 mol O(g)反应生成1 mol H O(l)释放能量为245 kJ
2 2 2
D.2 mol H O(g)的能量比2 mol H (g)与1 mol O (g)的能量之和低
2 2 2
9.纽扣电池可作计算器、电子表等的电源。有一种纽扣电池,其电极分别为Zn和Ag O,用KOH
2
溶液作电解质溶液,电池的总反应为Zn+Ag O===2Ag+ZnO。关于该电池下列叙述不正确的是(
2
)
A.正极的电极反应为Ag O+2e-+HO===2Ag+2OH-
2 2
B.Zn极发生氧化反应,Ag O极发生还原反应
2
C.使用时电子由Zn极经外电路流向Ag O极,Zn是负极
2
D.使用时溶液中电流的方向是由Ag O极流向Zn极
2
10.为了探究温度对化学反应速率的影响,下列实验方案可行的是( )11.甲:在试管中加入1 g粉末状大理石,加入4 mol·L-1盐酸20 mL(过量);乙:在试管中加入2 g
颗粒状大理石,加入4 mol·L-1盐酸20 mL(过量);下列CO 生成体积(折算成标准状况)V(CO)同反
2 2
应时间t的关系曲线图合理的是( )
12.下列可以证明2HI(g) H(g)+I(g)已达平衡状态的是( )
2 2
①单位时间内生成n mol H 的同时生成n mol HI
2
②一个H—H键断裂的同时有两个H—I键断裂
③温度和体积一定时,混合气体密度不再变化
④v(H )=v(I)=0.5v(HI)
2 2
⑤c(HI)∶c(H )∶c(I)=2∶1∶1
2 2
⑥温度和体积一定时,某一生成物浓度不再变化
⑦温度和体积一定时,容器内压强不再变化
⑧温度和压强一定时,混合气体的平均相对分子质量不再变化
⑨温度和体积一定时,混合气体的颜色不再变化
A.②③④⑤⑥ B.②⑥⑦⑧⑨
C.①②⑥⑧ D.②⑥⑨
13.向容积为2 L的密闭容器中充入2 mol A气体和1 mol B气体,在一定条件下发生如下反应:
2A(g)+B(g)3C(g);经2 s后达到平衡,测得C气体的浓度为0.6 mol·L-1。下列说法中正确的是(
)
①用物质A表示该反应的平均反应速率为0.2 mol·L-1·s-1
②用物质B表示该反应的平均反应速率为0.2 mol·L-1·s-1
③平衡时物质A与B的转化率相等
④平衡时物质B的浓度为0.2 mol·L-1
A.①②③ B.①③
C.②④ D.①④
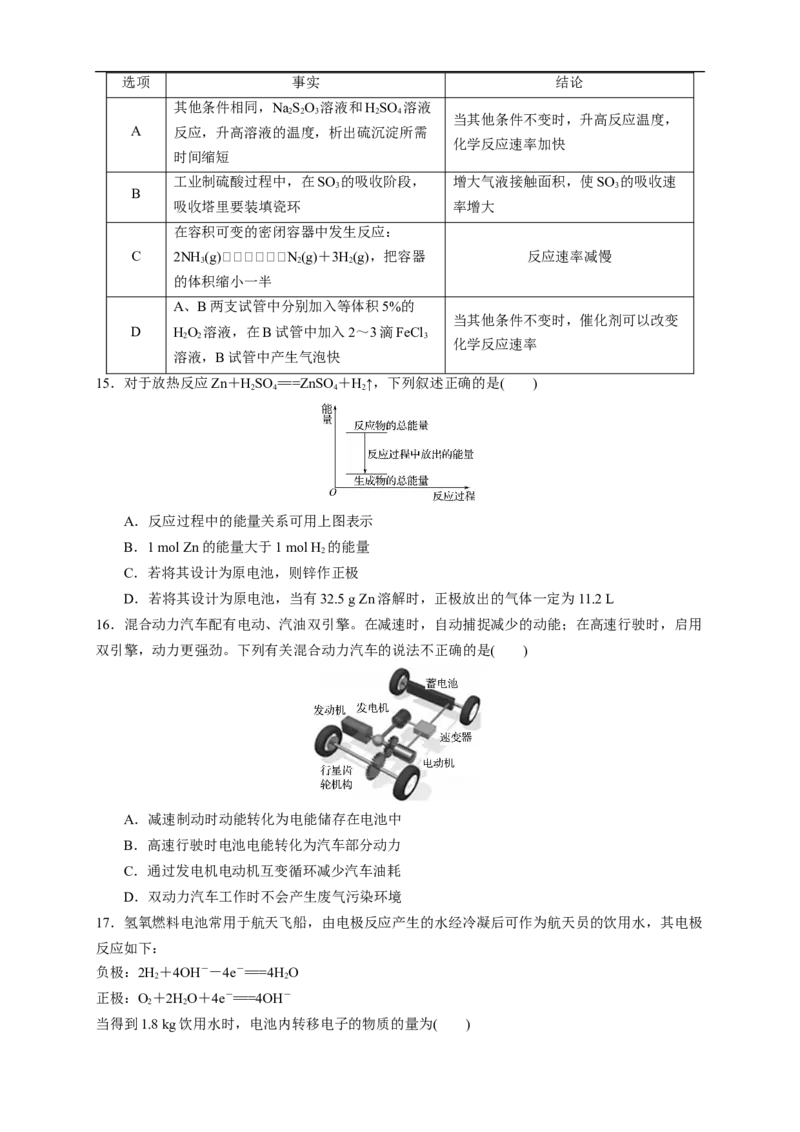
14.下列生产或实验事实引出的结论不正确的是( )选项 事实 结论
其他条件相同,NaSO 溶液和HSO 溶液
2 2 3 2 4
当其他条件不变时,升高反应温度,
A 反应,升高溶液的温度,析出硫沉淀所需
化学反应速率加快
时间缩短
工业制硫酸过程中,在SO 的吸收阶段, 增大气液接触面积,使SO 的吸收速
3 3
B
吸收塔里要装填瓷环 率增大
在容积可变的密闭容器中发生反应:
C 2NH (g)N(g)+3H(g),把容器 反应速率减慢
3 2 2
的体积缩小一半
A、B两支试管中分别加入等体积5%的
当其他条件不变时,催化剂可以改变
D HO 溶液,在B试管中加入2~3滴FeCl
2 2 3
化学反应速率
溶液,B试管中产生气泡快
15.对于放热反应Zn+HSO ===ZnSO +H↑,下列叙述正确的是( )
2 4 4 2
A.反应过程中的能量关系可用上图表示
B.1 mol Zn的能量大于1 mol H 的能量
2
C.若将其设计为原电池,则锌作正极
D.若将其设计为原电池,当有32.5 g Zn溶解时,正极放出的气体一定为11.2 L
16.混合动力汽车配有电动、汽油双引擎。在减速时,自动捕捉减少的动能;在高速行驶时,启用
双引擎,动力更强劲。下列有关混合动力汽车的说法不正确的是( )
A.减速制动时动能转化为电能储存在电池中
B.高速行驶时电池电能转化为汽车部分动力
C.通过发电机电动机互变循环减少汽车油耗
D.双动力汽车工作时不会产生废气污染环境
17.氢氧燃料电池常用于航天飞船,由电极反应产生的水经冷凝后可作为航天员的饮用水,其电极
反应如下:
负极:2H+4OH--4e-===4H O
2 2
正极:O+2HO+4e-===4OH-
2 2
当得到1.8 kg饮用水时,电池内转移电子的物质的量为( )A.1.8 mol B.3.6 mol C.100 mol D.200 mol
18.一定条件下,将3 mol A气体和1 mol B气体混合于固定容积为2 L的密闭容器中,发生反应:
3A(g)+B(g) C(g)+2D(s)。2 min末该反应达到平衡,生成D的物质的量随时间的变化情况如图
所示。下列判断正确的是( )
A.若混合气体的密度不再改变时,该反应不一定达到平衡状态
B.2 min后,加压会使正反应速率加快,逆反应速率变慢
C.反应过程中A和B的转化率之比为3∶1
D.开始到平衡,用A表示的化学反应速率为0.3 mol·L-1·min-1
二、非选择题(本题包括4小题,共46分)
19.(12分)反应Fe+HSO ===FeSO+H↑的能量变化趋势如图所示:
2 4 4 2
(1)该反应为________(填“吸热”或“放热”)反应。
(2)若要使该反应的反应速率加快,下列措施可行的是________(填字母)。
A.改铁片为铁粉
B.改稀硫酸为98%的浓硫酸
C.升高温度
D.减小压强
(3)若将上述反应设计成原电池,铜为原电池某一极材料,则铜为________(填“正”或“负”)
极 。 铜 片 上 产 生 的 现 象 为 ________________ , 该 极 上 发 生 的 电 极 反 应 为
__________________________,外电路中电子由________(填“正”或“负”,下同)极向________
极移动。
20.(10分) 将Fe片和石墨用导线相连,一组插入稀HSO 中,一组插入FeCl 溶液中,分别形成了
2 4 3
原电池。
(1)这两个原电池中,正极分别是________(填字母)。
A.石墨、石墨 B.石墨、Fe片 C.Fe片、Fe片 D.Fe片、石墨
(2)写出插入稀HSO 中形成原电池的正极反应式:___________________________________(用离子
2 4
方程式表示,下同)。
(3)写出插入FeCl 溶液中形成原电池的总反应式:____________________________________。
3
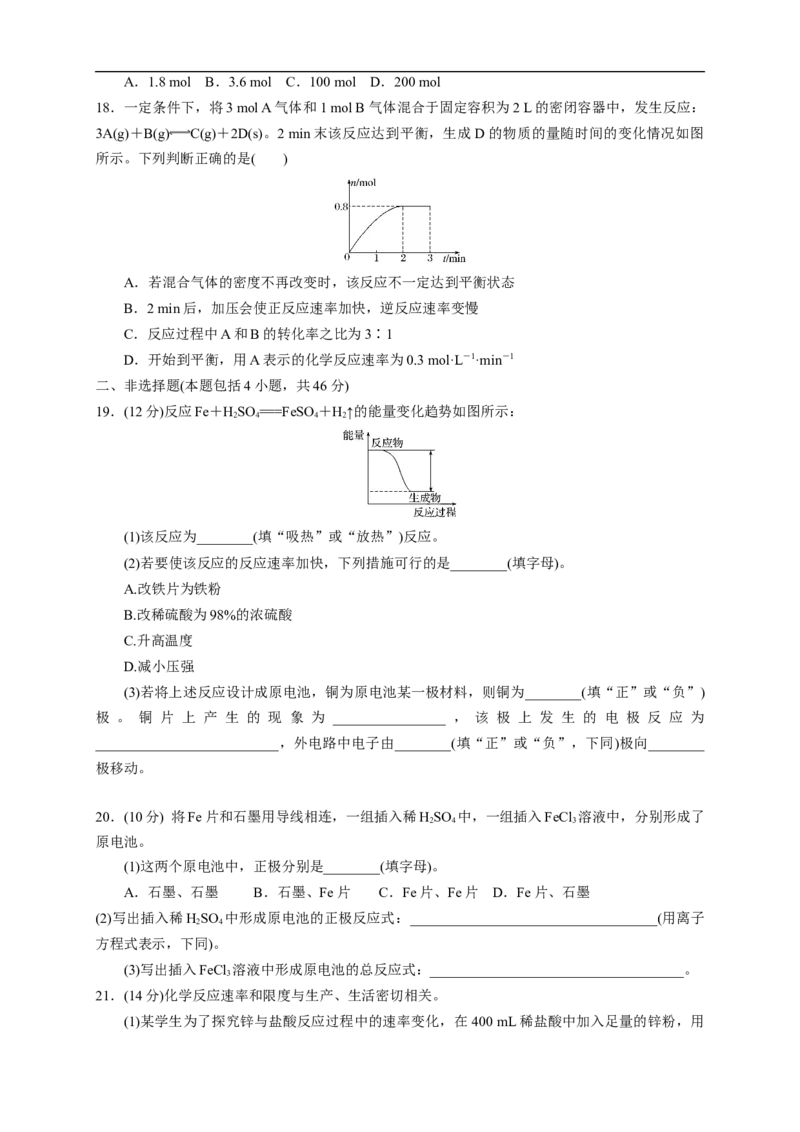
21.(14分)化学反应速率和限度与生产、生活密切相关。
(1)某学生为了探究锌与盐酸反应过程中的速率变化,在 400 mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):
时间/min 1 2 3 4 5
氢气体积/mL (标准状况) 100 240 464 576 620
①哪一时间段反应速率最大______min(填“0~1”“1~2”“2~3”“3~4”或“4~5”),原因是
________________________________________。
②求3~4 min时间段以盐酸的浓度变化来表示的该反应速率_____________(设溶液体积不变)。
(2)另一学生为控制反应速率防止反应过快难以测量氢气体积,他事先在盐酸中加入等体积的下
列溶液以减慢反应速率,你认为不可行的是________(填字母)。
A.蒸馏水 B.KCl溶液 C.KNO 溶液 D.CuSO 溶液
3 4
(3)某温度下在4 L密闭容器中,X、Y、Z三种气态物质的物质的量随时间变化曲线如图。
①该反应的化学方程式是_________________________________________。
②该反应达到平衡状态的标志是________(填字母)。
A.Y的体积分数在混合气体中保持不变
B.X、Y的反应速率比为3∶1
C.容器内气体压强保持不变
D.容器内气体的总质量保持不变
E.生成1 mol Y的同时消耗2 mol Z
③2 min内Y的转化率为________。
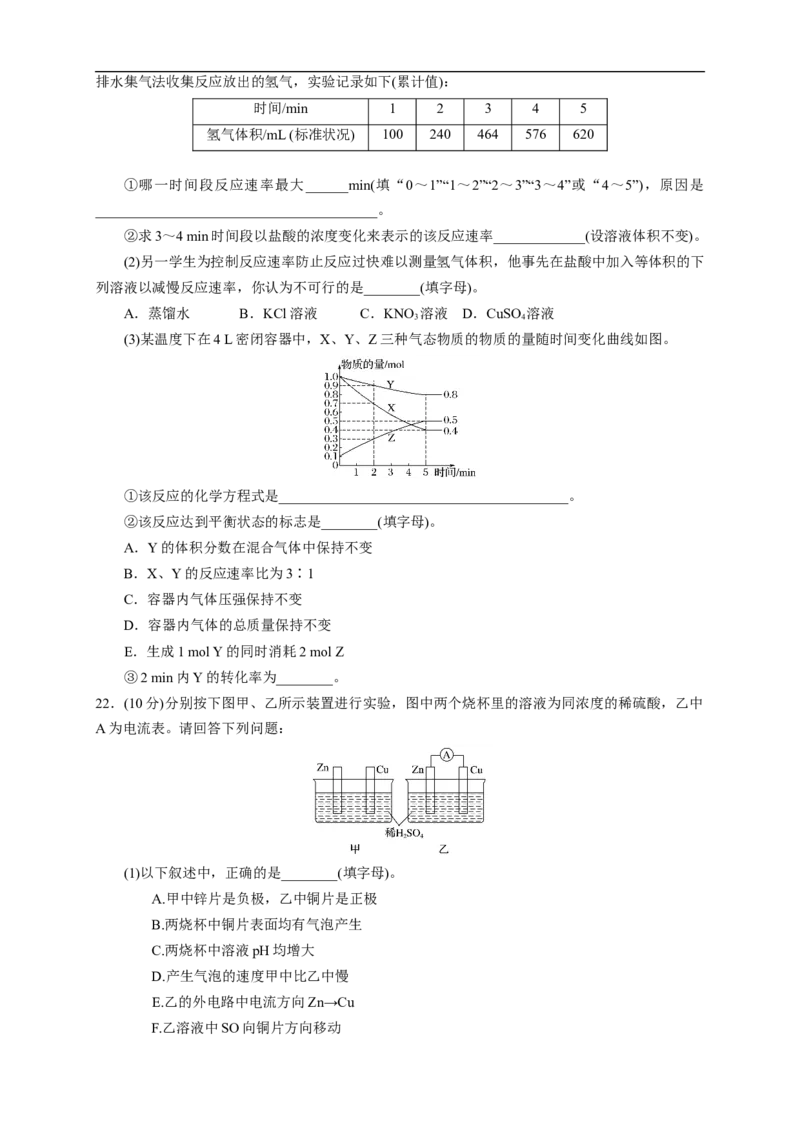
22.(10分)分别按下图甲、乙所示装置进行实验,图中两个烧杯里的溶液为同浓度的稀硫酸,乙中
A为电流表。请回答下列问题:
(1)以下叙述中,正确的是________(填字母)。
A.甲中锌片是负极,乙中铜片是正极
B.两烧杯中铜片表面均有气泡产生
C.两烧杯中溶液pH均增大
D.产生气泡的速度甲中比乙中慢
E.乙的外电路中电流方向Zn→Cu
F.乙溶液中SO向铜片方向移动(2)变化过程中能量转化的主要形式:甲为________;乙为____________。
(3)在乙实验中,某同学发现不仅在铜片上有气泡产生,而且在锌片上也产生了气体,分析原因
可能是_____________________________________________________________________。
(4)在乙实验中,如果把硫酸换成硫酸铜溶液,请写出铜电极的电极反应方程式及总反应离子方
程式:铜电极:__________________,总反应:__________________。
当电路中转移0.25 mol电子时,消耗负极材料的质量为___________ g(Zn的相对原子质量65)。