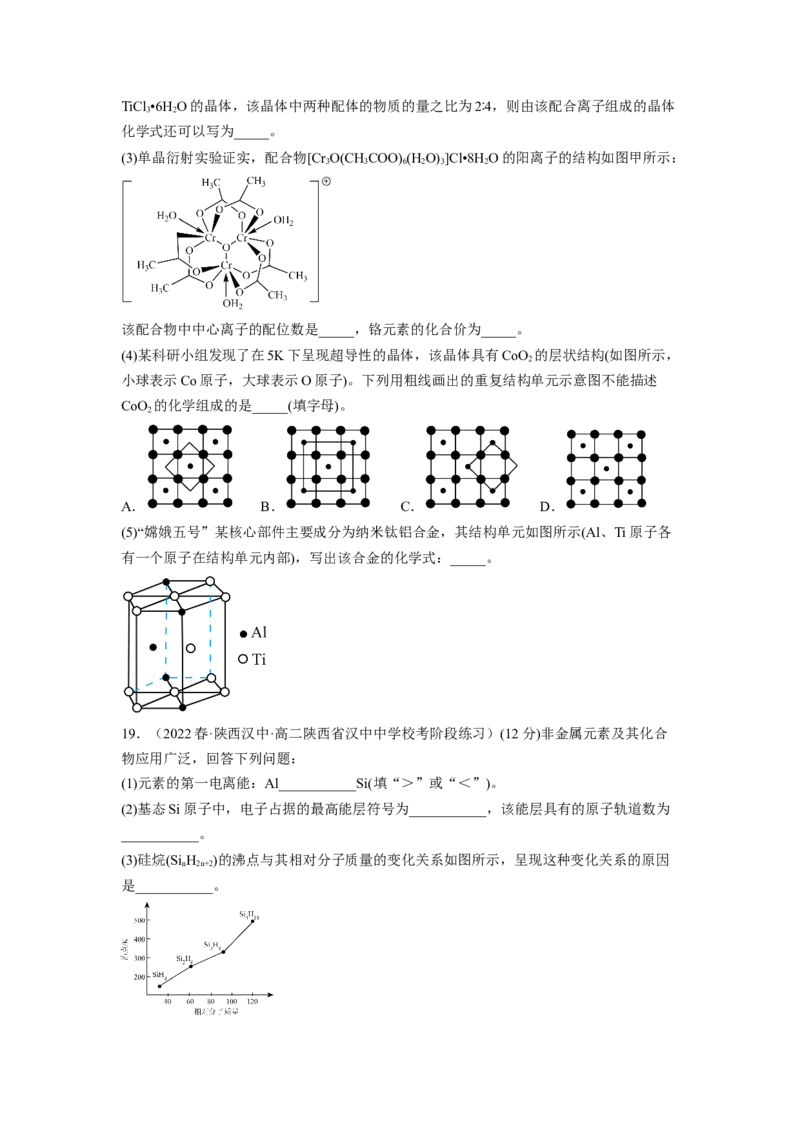文档内容
期末模拟测试(提高卷)
(时间:75分钟 满分:100分)
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Cl 35.5 Br 80 I 127
一、选择题(本题包括10个小题,每小题只有一个选项符合题意。每小题2分,共20分)
1.(2022春·浙江丽水·高二校考阶段练习)下列说法不正确的是
A. 的分子式为CuC HNO
4 4 2 4
B.某元素气态基态原子的逐级电离能(kJ·mol-1)分别为738、1451、7733、10540、13630、
17995、21703,当它与氯气反应时可能生成的阳离子是X2+
C.Na、P、Cl的电负性依次增大
D.CHCH(OH)COOH分子中有手性碳原子
3
2.(2023秋·四川内江·高二统考期末)A、B、C、D是原子序数依次增大的前四周期的主
族元素,A是宇宙中含量最多的元素;基态B原子核外 能级上的电子总数与 能级上的电
子总数相等,但第一电离能低于同周期相邻元素;基态C原子核外 能级上的电子总数与
能级上的电子总数相等,但第一电离能高于同周期相邻元素;基态D原子的最外层只有
一个电子,其次外层内的所有轨道的电子均成对。下列说法错误的是
A.A元素的单质常温下为气体
B.离子半径:C>B>A
C.C元素的最高价氧化物的水化物碱性强于氢氧化铝
D.D元素原子核外共有19种不同运动状态的电子
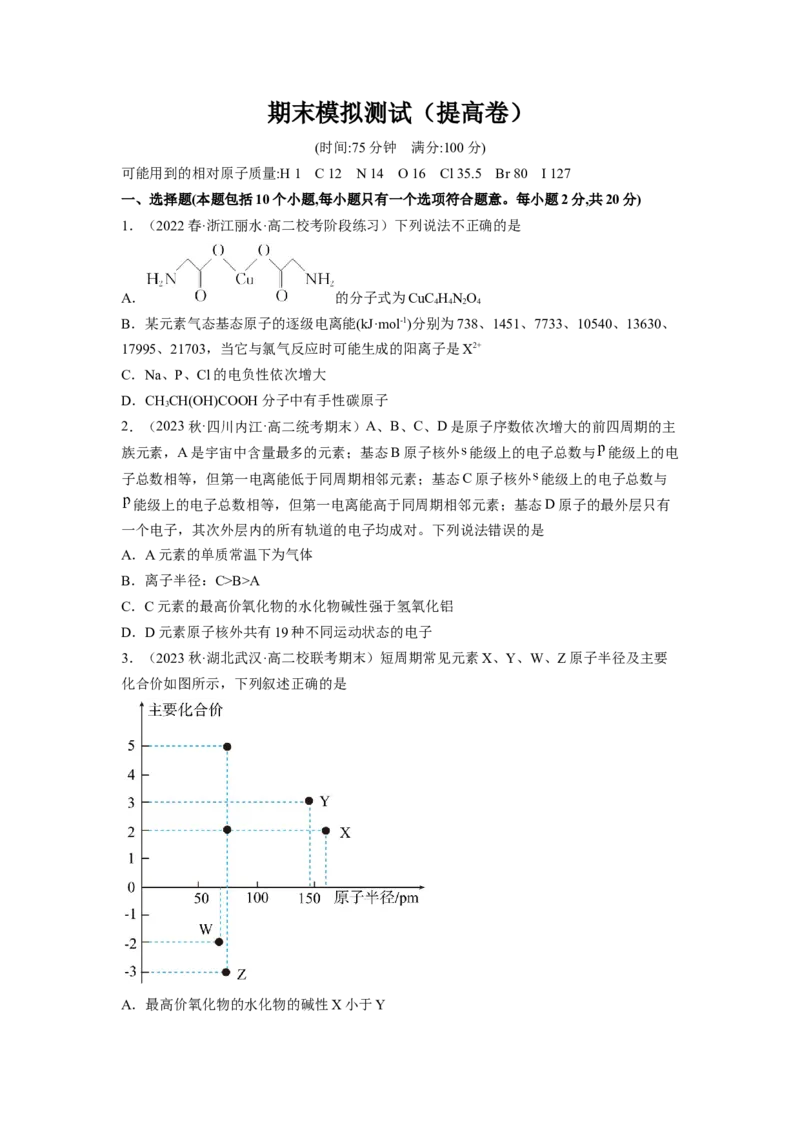
3.(2023秋·湖北武汉·高二校联考期末)短周期常见元素X、Y、W、Z原子半径及主要
化合价如图所示,下列叙述正确的是
A.最高价氧化物的水化物的碱性X小于YB.简单氢化物的热稳定性以及沸点均为W大于Z
C.常温下,Y的单质能溶于Z最高价氧化物的水化物的浓溶液
D.与Y同周期且第一电离能小于Y的元素有两种
4.(2023秋·内蒙古通辽·高二开鲁县第一中学校考期末)向含 的废水中加入铁粉和
可制备 ,发生反应:
,下列说法错误的是
A.依据反应可知: ;还原性:
B.基态碳原子和基态氮原子的未成对电子之比为2∶3
C. 位于周期表中第VIII族;反应中 失去 电子
D.离子半径大小:
5.(2023秋·重庆北碚·高二西南大学附中校考阶段练习)近期重庆新冠肺炎疫情蔓延,防
疫人员使用了多种消毒剂进行环境消毒。 为阿伏加德罗常数的值,下列关于常见消毒剂
的说法中不正确的是
A.1mol 中 键的数目为
B.84消毒液不能与洁厕灵混合使用
C.过氧乙酸( )分子中C的杂化类型均相同
D.饱和氯水既有酸性又有漂白性,向其中加入 固体后漂白性增强
6.(2023秋·河北秦皇岛·高二秦皇岛一中校考期末)南京理工大学化工学院胡炳成教授团
队成功合成世界首个全氮阴离子盐,其局部结构如图所示。下列说法错误的是
A.经 射线衍射可以测得全氮阴离子盐晶体结构
B.全氮阴离子盐两种阳离子中心原子的杂化轨道类型相同
C. 中所有的氮原子在同一平面内
D. 的键角比全氮阴离子盐的两种阳离子键角都大
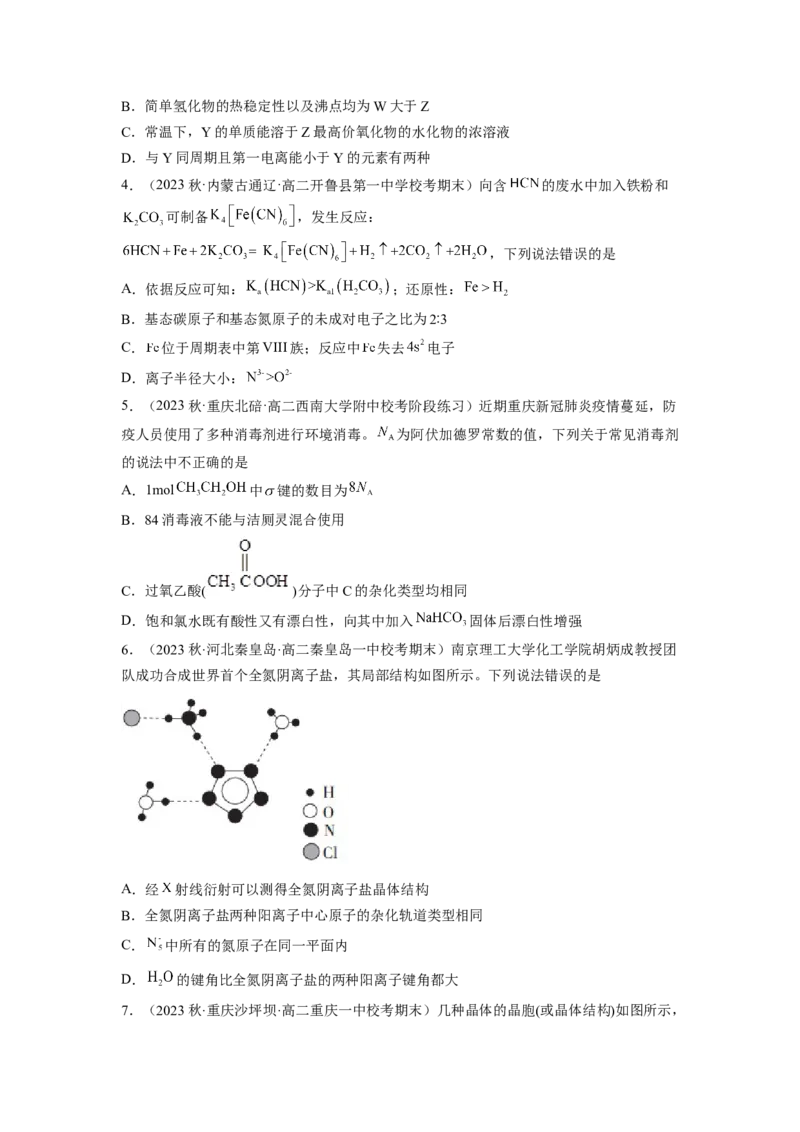
7.(2023秋·重庆沙坪坝·高二重庆一中校考期末)几种晶体的晶胞(或晶体结构)如图所示,下列说法正确的是
石墨晶体结构
NaCl晶胞 CO 晶胞 金刚石晶胞
2
A.NaCl中Na+的配位数小于干冰中CO 分子的配位数
2
B.干冰晶胞中CO 分子之间和金刚石晶胞中碳原子间的静电作用均是共价键
2
C.若金刚石的晶胞边长为acm,其中两个最近的碳原子之间的距离为
D.石墨晶体层内是共价键,层间是范德华力,所以石墨是一种过渡晶体
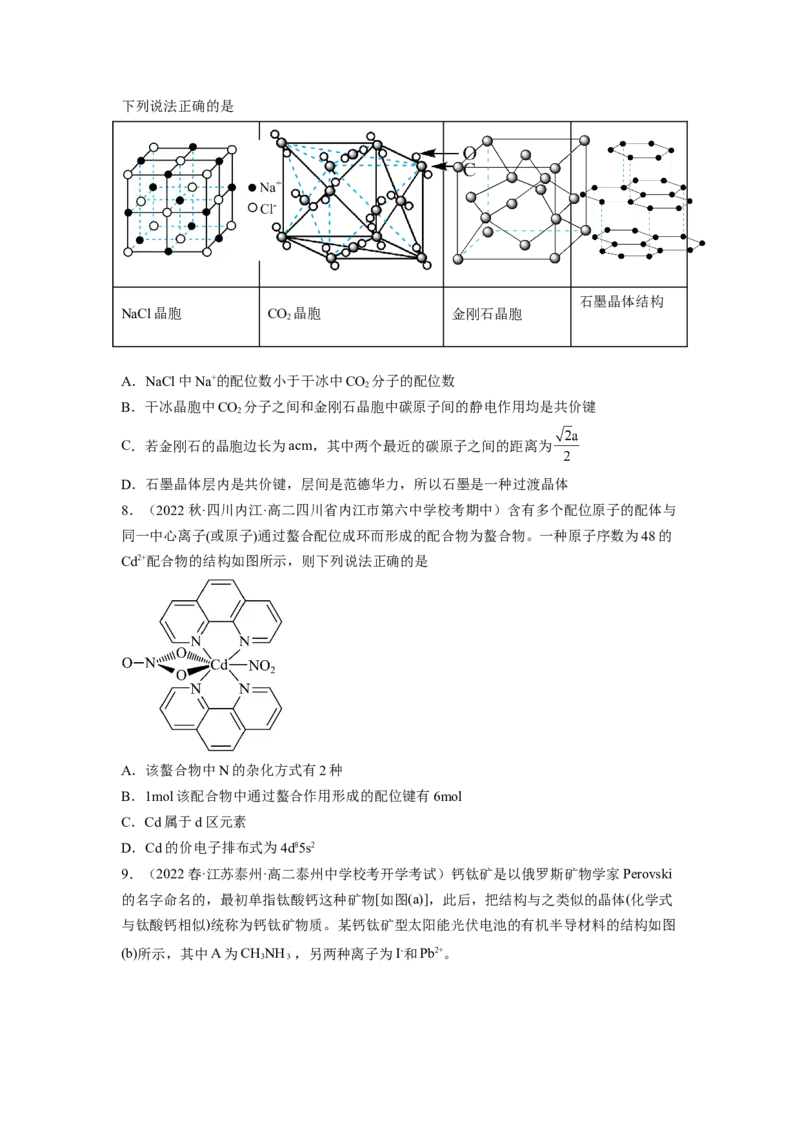
8.(2022秋·四川内江·高二四川省内江市第六中学校考期中)含有多个配位原子的配体与
同一中心离子(或原子)通过螯合配位成环而形成的配合物为螯合物。一种原子序数为48的
Cd2+配合物的结构如图所示,则下列说法正确的是
A.该螯合物中N的杂化方式有2种
B.1mol该配合物中通过螯合作用形成的配位键有6mol
C.Cd属于d区元素
D.Cd的价电子排布式为4d85s2
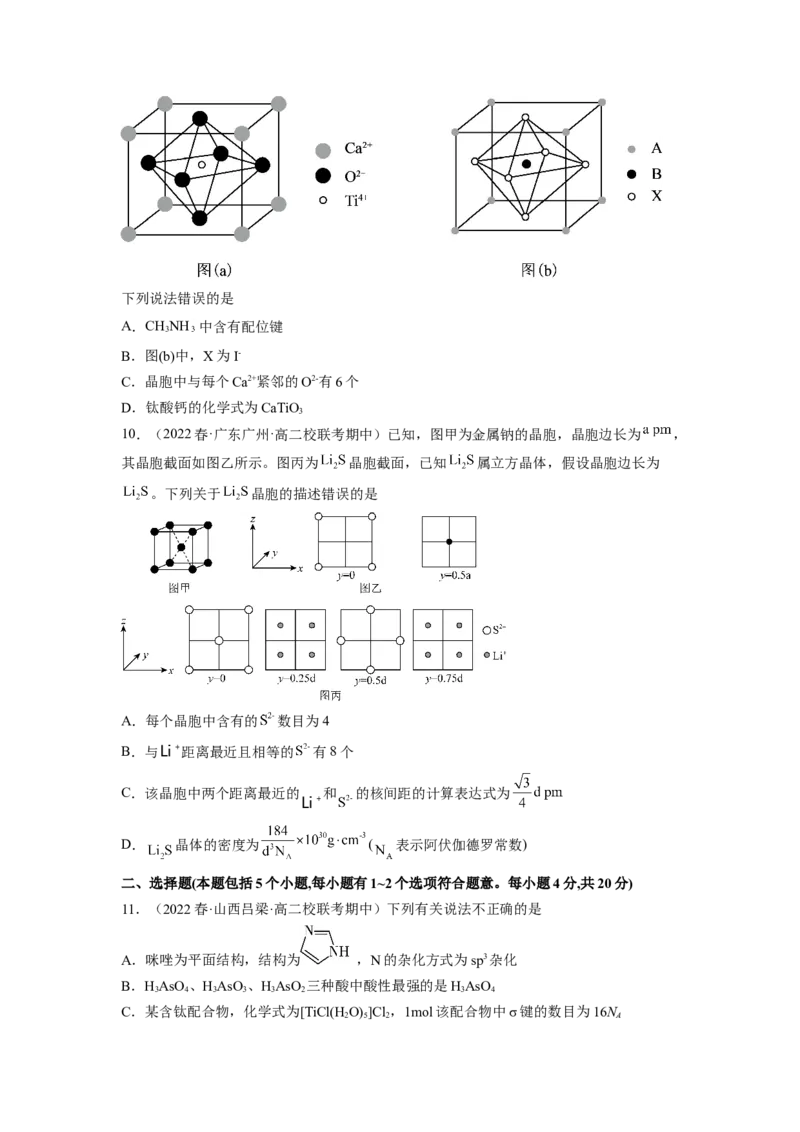
9.(2022春·江苏泰州·高二泰州中学校考开学考试)钙钛矿是以俄罗斯矿物学家Perovski
的名字命名的,最初单指钛酸钙这种矿物[如图(a)],此后,把结构与之类似的晶体(化学式
与钛酸钙相似)统称为钙钛矿物质。某钙钛矿型太阳能光伏电池的有机半导材料的结构如图
(b)所示,其中A为CHNH ,另两种离子为I-和Pb2+。
3下列说法错误的是
A.CHNH 中含有配位键
3
B.图(b)中,X为I-
C.晶胞中与每个Ca2+紧邻的O2-有6个
D.钛酸钙的化学式为CaTiO
3
10.(2022春·广东广州·高二校联考期中)已知,图甲为金属钠的晶胞,晶胞边长为 ,
其晶胞截面如图乙所示。图丙为 晶胞截面,已知 属立方晶体,假设晶胞边长为
。下列关于 晶胞的描述错误的是
A.每个晶胞中含有的 数目为4
B.与 距离最近且相等的 有8个
C.该晶胞中两个距离最近的 和 的核间距的计算表达式为
D. 晶体的密度为 ( 表示阿伏伽德罗常数)
二、选择题(本题包括5个小题,每小题有1~2个选项符合题意。每小题4分,共20分)
11.(2022春·山西吕梁·高二校联考期中)下列有关说法不正确的是
A.咪唑为平面结构,结构为 ,N的杂化方式为sp3杂化
B.HAsO 、HAsO 、HAsO 三种酸中酸性最强的是HAsO
3 4 3 3 3 2 3 4
C.某含钛配合物,化学式为[TiCl(H O) ]Cl ,1mol该配合物中σ键的数目为16N
2 5 2 AD.SrCO 和CaCO 受热均可分解,且分解温度:SrCO < CaCO
3 3 3 3
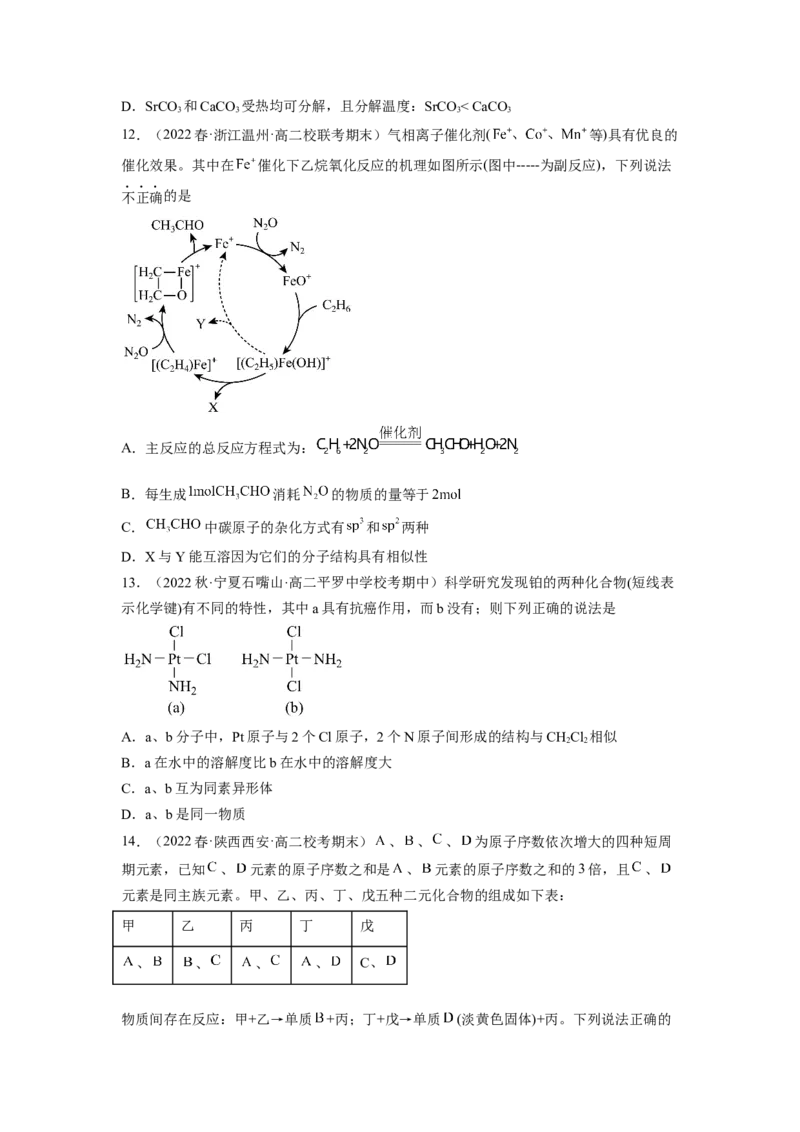
12.(2022春·浙江温州·高二校联考期末)气相离子催化剂( 等)具有优良的
催化效果。其中在 催化下乙烷氧化反应的机理如图所示(图中-----为副反应),下列说法
不正确的是
A.主反应的总反应方程式为:
B.每生成 消耗 的物质的量等于
C. 中碳原子的杂化方式有 和 两种
D.X与Y能互溶因为它们的分子结构具有相似性
13.(2022秋·宁夏石嘴山·高二平罗中学校考期中)科学研究发现铂的两种化合物(短线表
示化学键)有不同的特性,其中a具有抗癌作用,而b没有;则下列正确的说法是
A.a、b分子中,Pt原子与2个Cl原子,2个N原子间形成的结构与CHCl 相似
2 2
B.a在水中的溶解度比b在水中的溶解度大
C.a、b互为同素异形体
D.a、b是同一物质
14.(2022春·陕西西安·高二校考期末) 、 、 、 为原子序数依次增大的四种短周
期元素,已知 、 元素的原子序数之和是 、 元素的原子序数之和的3倍,且 、
元素是同主族元素。甲、乙、丙、丁、戊五种二元化合物的组成如下表:
甲 乙 丙 丁 戊
、 、 、 、 C、
物质间存在反应:甲+乙→单质 +丙;丁+戊→单质 (淡黄色固体)+丙。下列说法正确的是A.甲、乙、丙、丁、戊均为只含极性键的极性分子
B.原子半径: ;电负性:
C.可用酒精洗涤粘在容器内壁上的单质
D.若 甲与 乙恰好反应生成 单质 ,则乙为双原子分子
15.(2022·高二课时练习)由短周期前10号元素组成的物质 和 有如图所示的转化。
不稳定,易分解。下列有关说法正确的是( )
A.为使该转化成功进行, 可以是酸性 溶液
B.等物质的量的 、 分子中含有 键的数目均为
C. 分子中含有的 键个数是 分子中含有的 键个数的2倍
D.T、X分子均只含有极性键,无非极性键
三、非选择题(本题包括5个小题,共60分)
16.(2022秋·四川绵阳·高二四川省绵阳江油中学校考阶段练习)(12分)按要求回答下列
问题:
(1)研究发现,在 低压合成甲醇反应( )中,Co氧化物负载的Mn
氧化物纳米粒子催化剂具有高活性,显示出良好的应用前景。Co是第_______号元素。元
素Mn与O中,基态原子核外未成对电子数较多的是_______。
(2)我国科学家成功合成了世界上首个五氮阴离子盐 。
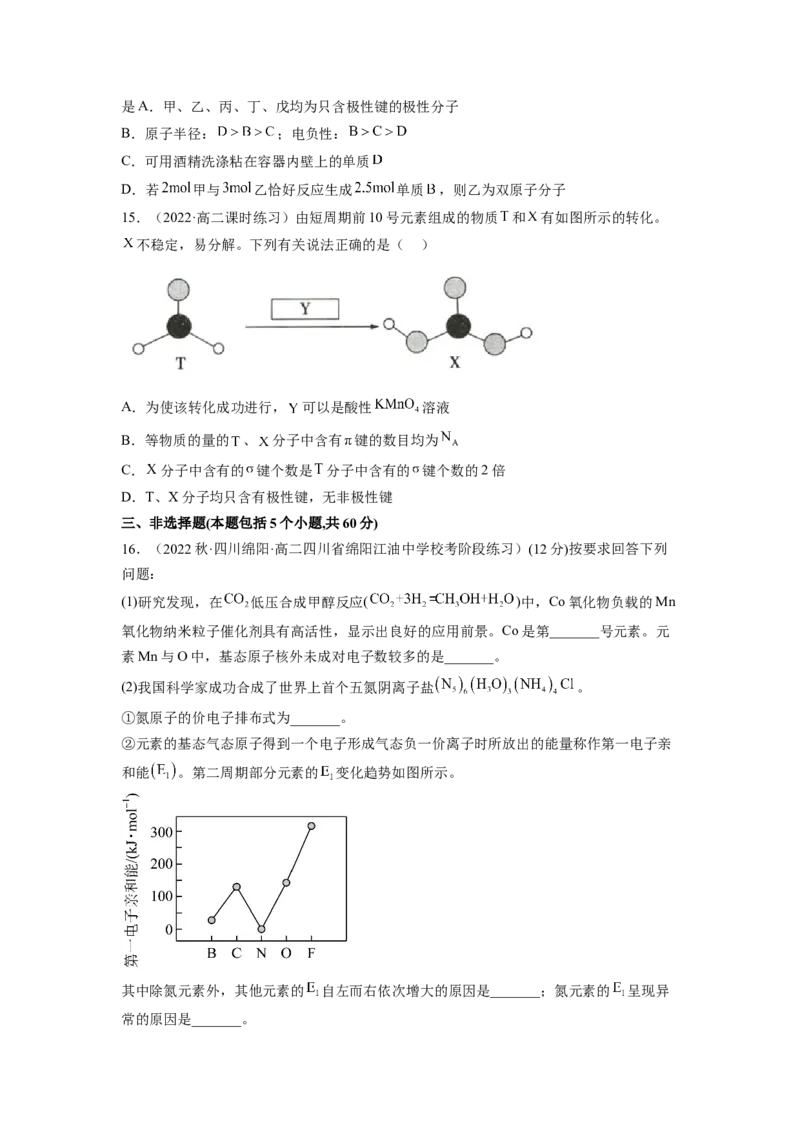
①氮原子的价电子排布式为_______。
②元素的基态气态原子得到一个电子形成气态负一价离子时所放出的能量称作第一电子亲
和能 。第二周期部分元素的 变化趋势如图所示。
其中除氮元素外,其他元素的 自左而右依次增大的原因是_______;氮元素的 呈现异
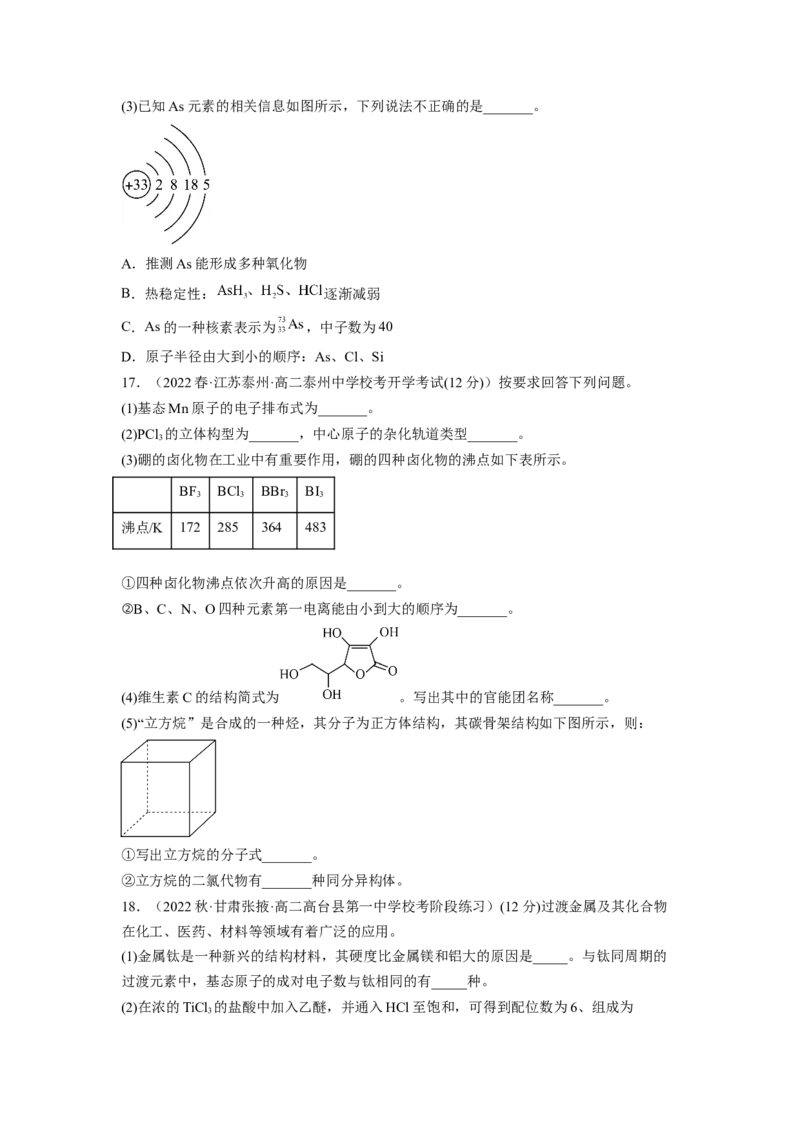
常的原因是_______。(3)已知As元素的相关信息如图所示,下列说法不正确的是_______。
A.推测As能形成多种氧化物
B.热稳定性: 逐渐减弱
C.As的一种核素表示为 ,中子数为40
D.原子半径由大到小的顺序:As、Cl、Si
17.(2022春·江苏泰州·高二泰州中学校考开学考试(12分))按要求回答下列问题。
(1)基态Mn原子的电子排布式为_______。
(2)PCl 的立体构型为_______,中心原子的杂化轨道类型_______。
3
(3)硼的卤化物在工业中有重要作用,硼的四种卤化物的沸点如下表所示。
BF BCl BBr BI
3 3 3 3
沸点/K 172 285 364 483
①四种卤化物沸点依次升高的原因是_______。
②B、C、N、O四种元素第一电离能由小到大的顺序为_______。
(4)维生素C的结构简式为 。写出其中的官能团名称_______。
(5)“立方烷”是合成的一种烃,其分子为正方体结构,其碳骨架结构如下图所示,则:
①写出立方烷的分子式_______。
②立方烷的二氯代物有_______种同分异构体。
18.(2022秋·甘肃张掖·高二高台县第一中学校考阶段练习)(12分)过渡金属及其化合物
在化工、医药、材料等领域有着广泛的应用。
(1)金属钛是一种新兴的结构材料,其硬度比金属镁和铝大的原因是_____。与钛同周期的
过渡元素中,基态原子的成对电子数与钛相同的有_____种。
(2)在浓的TiCl 的盐酸中加入乙醚,并通入HCl至饱和,可得到配位数为6、组成为
3TiCl •6H O的晶体,该晶体中两种配体的物质的量之比为2∶4,则由该配合离子组成的晶体
3 2
化学式还可以写为_____。
(3)单晶衍射实验证实,配合物[CrO(CH COO) (H O) ]Cl•8H O的阳离子的结构如图甲所示:
3 3 6 2 3 2
该配合物中中心离子的配位数是_____,铬元素的化合价为_____。
(4)某科研小组发现了在5K下呈现超导性的晶体,该晶体具有CoO 的层状结构(如图所示,
2
小球表示Co原子,大球表示O原子)。下列用粗线画出的重复结构单元示意图不能描述
CoO 的化学组成的是_____(填字母)。
2
A. B. C. D.
(5)“嫦娥五号”某核心部件主要成分为纳米钛铝合金,其结构单元如图所示(Al、Ti原子各
有一个原子在结构单元内部),写出该合金的化学式:_____。
19.(2022春·陕西汉中·高二陕西省汉中中学校考阶段练习)(12分)非金属元素及其化合
物应用广泛,回答下列问题:
(1)元素的第一电离能:Al___________Si(填“>”或“<”)。
(2)基态Si原子中,电子占据的最高能层符号为___________,该能层具有的原子轨道数为
___________。
(3)硅烷(Si H )的沸点与其相对分子质量的变化关系如图所示,呈现这种变化关系的原因
n 2n+2
是___________。(4)石墨烯可转化为富勒烯(C ),某金属M与C 可制备一种低温超导材料,晶胞如图丙所
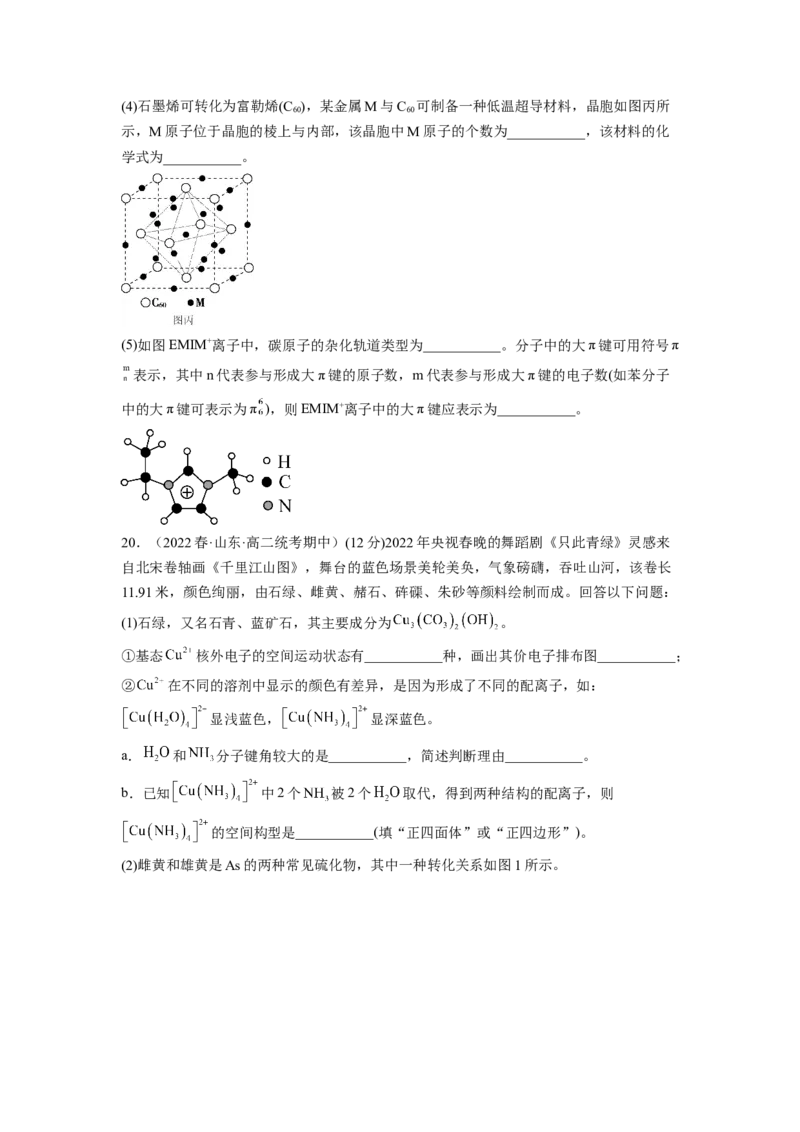
60 60
示,M原子位于晶胞的棱上与内部,该晶胞中M原子的个数为___________,该材料的化
学式为___________。
(5)如图EMIM+离子中,碳原子的杂化轨道类型为___________。分子中的大π键可用符号π
表示,其中n代表参与形成大π键的原子数,m代表参与形成大π键的电子数(如苯分子
中的大π键可表示为π ),则EMIM+离子中的大π键应表示为___________。
20.(2022春·山东·高二统考期中)(12分)2022年央视春晚的舞蹈剧《只此青绿》灵感来
自北宋卷轴画《千里江山图》,舞台的蓝色场景美轮美奂,气象磅礴,吞吐山河,该卷长
11.91米,颜色绚丽,由石绿、雌黄、赭石、砗磲、朱砂等颜料绘制而成。回答以下问题:
(1)石绿,又名石青、蓝矿石,其主要成分为 。
①基态 核外电子的空间运动状态有___________种,画出其价电子排布图___________;
② 在不同的溶剂中显示的颜色有差异,是因为形成了不同的配离子,如:
显浅蓝色, 显深蓝色。
a. 和 分子键角较大的是___________,简述判断理由___________。
b.已知 中2个 被2个 取代,得到两种结构的配离子,则
的空间构型是___________(填“正四面体”或“正四边形”)。
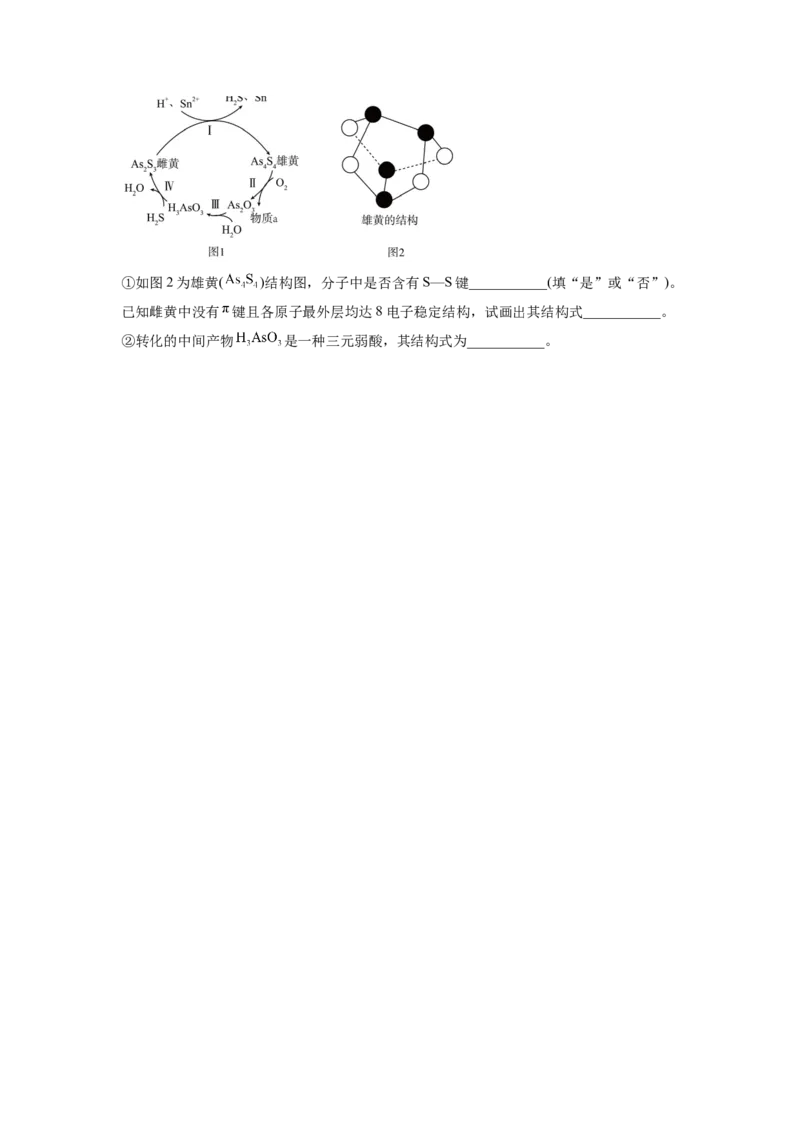
(2)雌黄和雄黄是As的两种常见硫化物,其中一种转化关系如图1所示。①如图2为雄黄( )结构图,分子中是否含有S—S键___________(填“是”或“否”)。
已知雌黄中没有 键且各原子最外层均达8电子稳定结构,试画出其结构式___________。
②转化的中间产物 是一种三元弱酸,其结构式为___________。