文档内容
第四章单元检测试卷(原卷版)
可能用到的原子量:H 1 C 12 N 14 O 16 Na 23 Cl 35.5 S 32 Fe 56 Mg 24 Al 27
第Ⅰ卷
一、选择题:本题共20个小题,每小题2分,共40分。在每小题给出的四个选项中,只有一项是符合题
目要求的。
一、选择题:本题共20个小题,每小题2分,共40分。在每小题给出的四个选项中,只有一项是符合题
目要求的。
1.元素周期表是一座开放的“元素大厦”,“元素大厦”尚未客满。若发现119号元素,请在“元素
大厦”中安排好它的“房间”( )
A.第七周期0族 B.第六周期第ⅡA族
C.第八周期第ⅠA族 D.第七周期第ⅦA族
2.放射性元素Cn的一个原子经过6次衰变(每次衰变都放出一个相同的粒子)后,得到比较稳定的第
100号元素镄(Fm)的含153个中子的原子。下列说法中正确的是( )
A.每次衰变都放出He
B.每次衰变都放出T
C.Fm只是元素镄的一个原子,153不代表镄元素的相对原子质量
D.Cn经过3次这样的衰变是得不到镄原子的,产生的是Cn的同位素原子
3.下图中,a、b、c、d、e为元素周期表中前四周期的一部分元素,下列有关叙述正确的是( )
A.元素b位于ⅥA族,有+6价、-2价两种常见化合价
B.五种元素中,元素e的性质最稳定
C.元素c和d的最高价氧化物对应水化物的酸性:c>d
D.元素c和e的气态氢化物的稳定性:c>e
4.食盐(NaCl)是生活中常用的调味品,HCl是胃酸的主要成分。下列关于两种物质的说法正确的是(
)
A.炒菜时放入食盐并不破坏NaCl中的化学键
B.HCl的电子式是H+
C.NaCl熔化时破坏共价键D.HCl的结构式是H—Cl
5.下列各组元素性质递变情况错误的是( )
A.H、Be、B原子最外层电子数依次增多
B.P、S、Cl元素最高正化合价依次升高
C.B、C、N、O、F原子半径依次增大
D.Li、Na、K、Rb的金属性依次增强
6.根据元素周期律,由下列事实进行归纳推测,推测不合理的是( )
选项 事实 推测
A Mg与水反应缓慢, Ca与水反应较快 Ba(第ⅡA族)与水反应会更快
12 20 56
Si是半导体材料,同族的Ge也是半导体 第ⅣA族的元素的单质都可作半导体材
B
材料 料
HCl在1 500 ℃时分解,HI在230 ℃时
C HBr的分解温度介于二者之间
分解
D Si与H 高温时反应,S与H 加热能反应 P与H 在高温时能反应
2 2 2
7.下列物质中只含有共价键的是( )
A.NaCl、HCl、HO、NaOH B.Cl、NaS、HCl、SO
2 2 2 2
C.HBr、CO、HO、CS D.NaO、HO、HO、O
2 2 2 2 2 2 2 2 3
8.几种短周期元素的原子半径和主要化合价见下表,下列说法中正确的是( )
元素代号 原子半径/nm 主要化合价
X 0.160 +2
Y 0.143 +3
Z 0.102 +6、-2
L 0.099 +7、-1
M 0.077 +4、-4
Q 0.074 -2
A.等物质的量的X、Y的单质与足量的盐酸反应,生成的H 一样多
2
B.Y与Q形成的化合物不能跟氢氧化钠溶液反应
C.Z的氢化物的稳定性强于L的氢化物的稳定性
D.在化学反应中,M原子与其他原子易形成共价键而不易形成离子键
9.短周期元素W、X、Y和Z的原子序数依次增大。元素W是制备一种高效电池的重要材料,X原
子的最外层电子数是内层电子数的2倍,元素Y是地壳中含量最丰富的金属元素,Z原子的最外层电子数
是其电子层数的2倍。下列说法错误的是( )
A.元素W、X的氯化物中,各原子均满足8电子的稳定结构
B.元素X与氢形成的原子比为1∶1的化合物有很多种C.元素Y的单质与氢氧化钠溶液或盐酸反应均有氢气生成
D.元素Z可与元素X形成的化合物XZ 属于共价化合物
2
10.A、B、C、D、E五种短周期主族元素,它们的原子序数依次增大。已知:A和C、B和D分别位
于同主族,且B、D质子数之和是A、C质子数之和的2倍。下列说法正确的是( )
A.原子半径的大小顺序:r(B)>r(C)>r(D)
B.C的最高价氧化物对应水化物的碱性在同周期中最强
C.E分别与A、C形成的化合物中化学键类型相同
D.B的简单气态氢化物的热稳定性比D的弱
11.元素X、Y、Z的原子序数之和为36,X、Y在同一周期,X+与Z2-具有相同的核外电子排布。下
列推测不正确的是( )
A.同周期元素中X的金属性最强
B.原子半径:X>Y,离子半径:X+>Z2-
C.同族元素中Z的氢化物稳定性最高
D.同周期元素中Y的最高价含氧酸的酸性最强
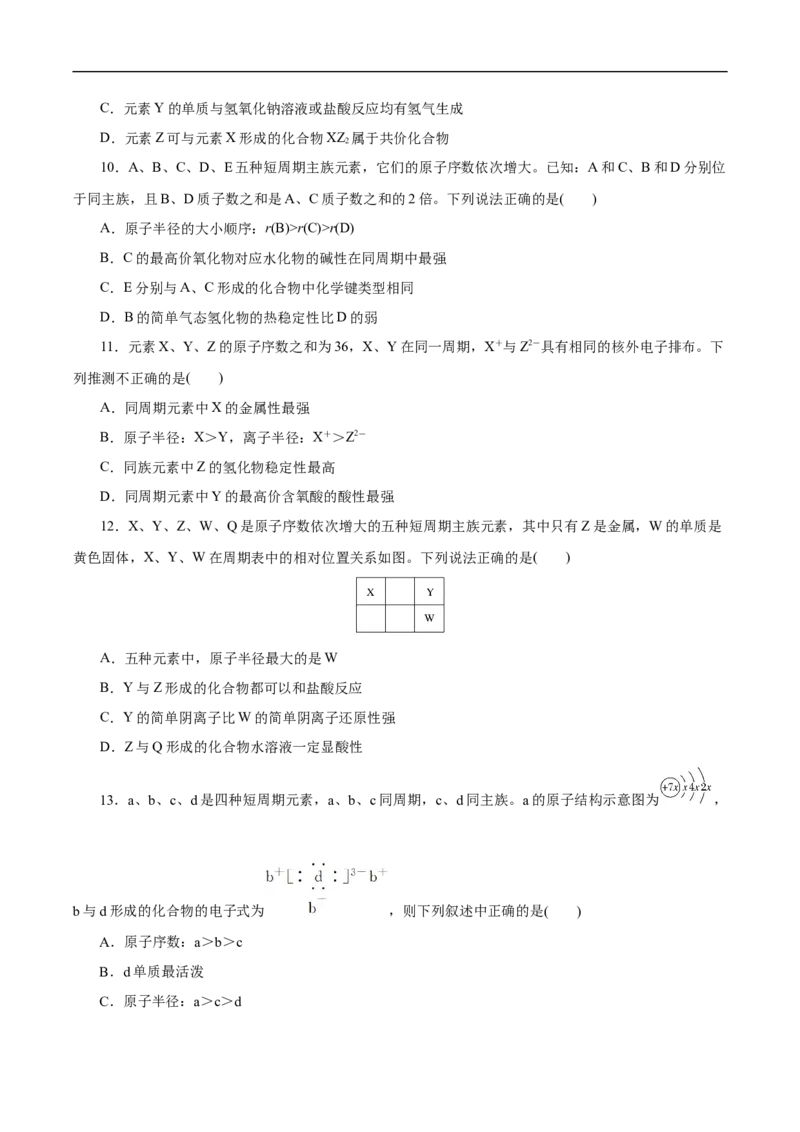
12.X、Y、Z、W、Q是原子序数依次增大的五种短周期主族元素,其中只有Z是金属,W的单质是
黄色固体,X、Y、W在周期表中的相对位置关系如图。下列说法正确的是( )
A.五种元素中,原子半径最大的是W
B.Y与Z形成的化合物都可以和盐酸反应
C.Y的简单阴离子比W的简单阴离子还原性强
D.Z与Q形成的化合物水溶液一定显酸性
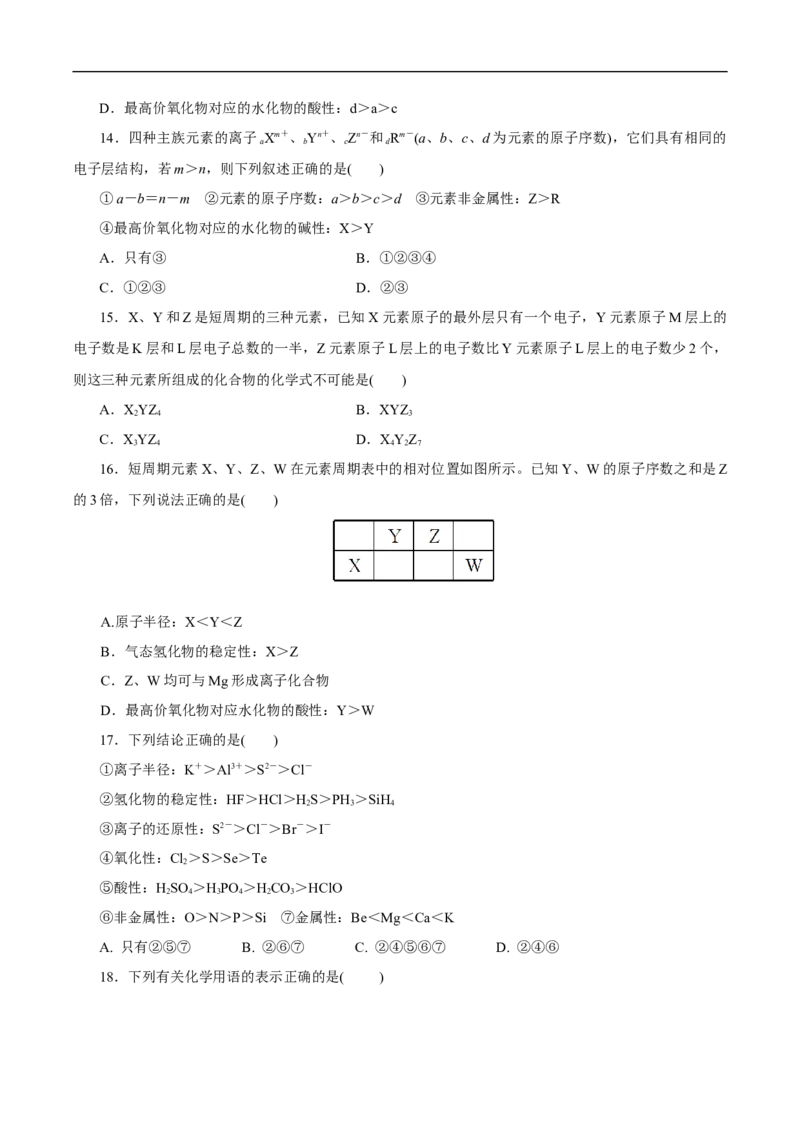
13.a、b、c、d是四种短周期元素,a、b、c同周期,c、d同主族。a的原子结构示意图为 ,
b与d形成的化合物的电子式为 ,则下列叙述中正确的是( )
A.原子序数:a>b>c
B.d单质最活泼
C.原子半径:a>c>dD.最高价氧化物对应的水化物的酸性:d>a>c
14.四种主族元素的离子 Xm+、 Yn+、Zn-和 Rm-(a、b、c、d为元素的原子序数),它们具有相同的
a b c d
电子层结构,若m>n,则下列叙述正确的是( )
①a-b=n-m ②元素的原子序数:a>b>c>d ③元素非金属性:Z>R
④最高价氧化物对应的水化物的碱性:X>Y
A.只有③ B.①②③④
C.①②③ D.②③
15.X、Y和Z是短周期的三种元素,已知X元素原子的最外层只有一个电子,Y元素原子M层上的
电子数是K层和L层电子总数的一半,Z元素原子L层上的电子数比Y元素原子L层上的电子数少2个,
则这三种元素所组成的化合物的化学式不可能是( )
A.XYZ B.XYZ
2 4 3
C.XYZ D.XYZ
3 4 4 2 7
16.短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示。已知Y、W的原子序数之和是Z
的3倍,下列说法正确的是( )
A.原子半径:X<Y<Z
B.气态氢化物的稳定性:X>Z
C.Z、W均可与Mg形成离子化合物
D.最高价氧化物对应水化物的酸性:Y>W
17.下列结论正确的是( )
①离子半径:K+>Al3+>S2->Cl-
②氢化物的稳定性:HF>HCl>HS>PH >SiH
2 3 4
③离子的还原性:S2->Cl->Br->I-
④氧化性:Cl>S>Se>Te
2
⑤酸性:HSO >HPO >HCO>HClO
2 4 3 4 2 3
⑥非金属性:O>N>P>Si ⑦金属性:Be<Mg<Ca<K
A. 只有②⑤⑦ B. ②⑥⑦ C. ②④⑤⑥⑦ D. ②④⑥
18.下列有关化学用语的表示正确的是( )A. NHCl的电子式: B. S2-的结构示意图:
4
C. 氨的电子式: D. 碳元素位于第2周期,VIA族
19.有人建议将氢元素排在元素周期表的ⅦA族。下列事实能支持这一观点的是( )
①H原子得到一个电子实现最外电子层稳定结构;
②氢分子的结构式为H—H;
③与碱金属元素形成离子化合物: ;
④分子中原子间的化学键都属于非极性键。
A.①②③ B.①③④
C.②③④ D.①②③④
20.元素的原子结构决定其性质和在周期表中的位置。下列说法正确的是( )
A.元素原子的最外层电子数等于元素的最高化合价
B.多电子原子中,在离核较近的区域内运动的电子能量较高
C.P、S、Cl得电子能力和最高价氧化物对应水化物的酸性均依次增强
D.元素周期表中位于金属元素和非金属元素分界线附近的元素属于过渡元素
第Ⅱ卷
21.(12分)A、B、C、D都是短周期元素,原子半径D>C>A>B,其中A、B处在同一周期,A、C
处在同一主族。C原子核内质子数等于A、B原子核内质子数之和,C原子最外层上的电子数是D原子最
外层电子数的4倍。试回答:
(1)这四种元素分别是A___________,B____________,C________,D________。
(2) 这 四 种 元 素 中 在 常 温 常 压 下 的 液 态 或 气 态 氢 化 物 的 稳 定 性 由 大 而 小 的 顺 序 是
________________________________________________________________________。
(3)A与B形成的三原子分子的电子式是________,B与D形成的原子个数比为1∶1的化合物的电子式是
________。
(4)A元素某氧化物与D元素某氧化物反应生成单质的化学方程式是____________________。当有0.1mol单
质生成的时,反应转移电子的物质的量为
22.(12分)下图是元素周期表的一部分,针对表中的①~⑩中元素,填写下列空格:① ⑩ ② ③
④ ⑤ ⑦ ⑧ ⑨
⑥
(1)在这10种元素中,原子半径较小的是_____(填元素符号,稀有气体除外),化学性质最不活泼的元
素是__(填“元素名称”)。
(2)元素⑧的离子结构示意图为________,请用电子式表示化合物④和⑧的形成过程________。
(3)元素⑤的单质与氢氧化钠溶液反应的化学方程式为:_______________________。
(4)元素⑧单质的水溶液中通入元素⑦的某种氧化物,该氧化物被氧化为元素⑦的最高价氧化物的水化
物,反应的化学方程式为_______________________________________。
23.(12分)A、B、C、D、E、F、G的原子序数依次增大的元素,A、D元素的原子最外层电子数
相同,A元素的一种原子没有中子;B的一种同位素可用于考古断代;C是地壳中含量最多的一种元素;D
元素的阳离子电子层结构与氖原子相同;E的最外层电子数是电子层数的2倍;F的单质具有强氧化性.G
是用途最广泛的金属元素,它的单质能被磁铁所吸引;试回答以下问题:
(1)E的原子结构示意图:____________。
(2)D单质与C单质在加热条件下反应产物的电子式 _______,该物质与AC反应的离子方程式
2
________________________________________________。
(3)化合物甲、乙由A、B、C、D中的三种或四种组成的常见物质,且甲、乙的水溶液均呈碱性.
则甲、乙反应的化学方程式为____________。
的
(4)E 最高价氧化物对应水合物的浓溶液加入G单质,下列说法正确的是____________。
A.常温下两者不发生反应 B. 常温下无现象 ,G单质不溶解
C.受热能发生反应,开始放出氢气 D. 受热能发生反应,开始放出是SO
2
的
(5)用电子式写出AC 形成过程________________________________________。
2
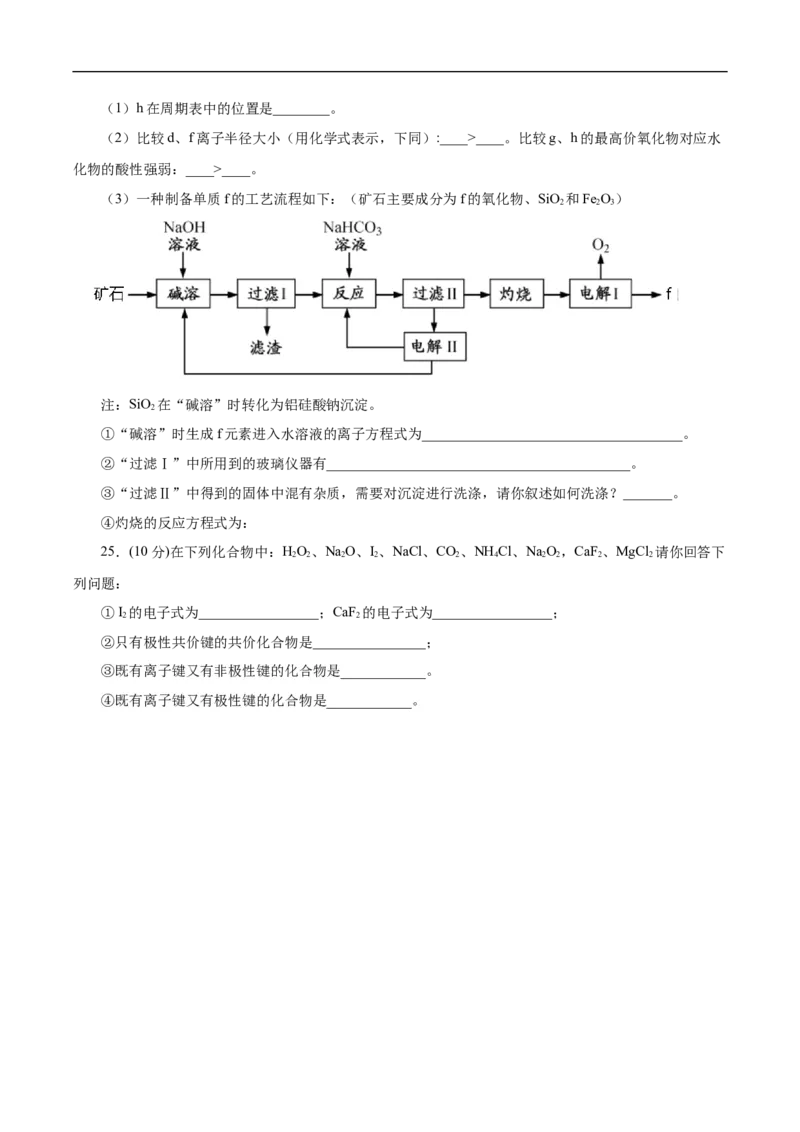
24.(14分)随原子序数递增,八种短周期元素(用字母x等表示)原子半径的相对大小、最高正价或最
低负价的变化如下图所示。
根据判断出的元素回答问题:(1)h在周期表中的位置是________。
(2)比较d、f离子半径大小(用化学式表示,下同):____>____。比较g、h的最高价氧化物对应水
化物的酸性强弱:____>____。
(3)一种制备单质f的工艺流程如下:(矿石主要成分为f的氧化物、SiO 和Fe O)
2 2 3
注:SiO 在“碱溶”时转化为铝硅酸钠沉淀。
2
①“碱溶”时生成f元素进入水溶液的离子方程式为_____________________________________。
②“过滤Ⅰ”中所用到的玻璃仪器有___________________________________________。
③“过滤Ⅱ”中得到的固体中混有杂质,需要对沉淀进行洗涤,请你叙述如何洗涤?_______。
④灼烧的反应方程式为:
25.(10分)在下列化合物中:HO、NaO、I、NaCl、CO、NH Cl、NaO,CaF 、MgCl 请你回答下
2 2 2 2 2 4 2 2 2 2
列问题:
①I 的电子式为_________________;CaF 的电子式为_________________;
2 2
②只有极性共价键的共价化合物是________________;
③既有离子键又有非极性键的化合物是____________。
④既有离子键又有极性键的化合物是____________。