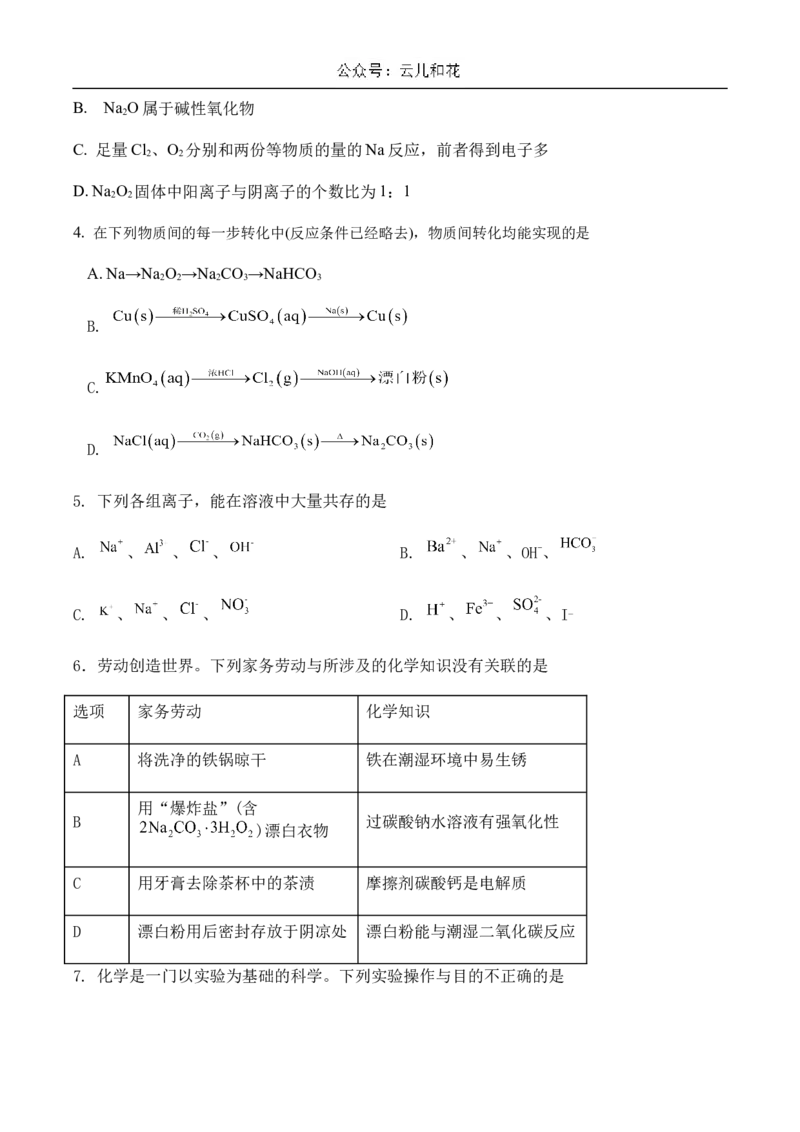文档内容
2024-2025 学年第一学期第二次段考
高一化学试卷
注意事项:
1. 答卷前,考生务必将自己的姓名、准考证号填写在试卷和答题卡上。
2. 回答选择题时,选出每小题答案后,用 2B铅笔把答题卡上对应题目的答案标号涂黑。如需
改动,用橡皮擦干净后,再选涂其他答案标号。回答非选择题时,将答案写在答题卡上。写在本卷上
无效。
3. 常见相对原子量H 1 C 12 N 14 O 16 Na 23 S 32 Cl 35.5
一、选择题:本题共包括 16小题,共 44分。第 1~10小题,每小题 2分;第 11~16 小题,每小题 4
分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1. “中国名片”、“中国制造”发展在众多领域受到世界瞩目,它们与化学有着密切联系。
下列不正确的是
A. 新型核潜艇“长征18”可以在海底潜伏数月之久,运用 作供氧剂
B. 港珠澳大桥桥梁采用先进的抗腐蚀方法,钢铁桥梁被腐蚀是氧化还原反应
C. C919大型客机使用了大量先进碳纤维复合材料、铝锂合金等,铝锂合金可减轻机身自重
D. 壮观的丹霞地貌中红色岩层是因含有
2. 下列关于钠及其化合物的叙述正确的是
A. 钠在空气中的缓慢氧化与其在空气中点燃的产物都一样
B. 钠比铜活泼,能与CuSO 溶液发生置换反应生成Cu
4
C. 钠易与空气和水发生反应,实验室中钠通常保存在煤油中
D. Na O 与H O的反应中有O 生成,H O是还原剂
2 2 2 2 2
3. 下列关于钠的单质及其氧化物的叙述正确的是
A. Na O与Na O 溶于水滴加酚酞试液后,现象相同
2 2 2B. Na O属于碱性氧化物
2
C. 足量Cl 、O 分别和两份等物质的量的Na反应,前者得到电子多
2 2
D. Na O 固体中阳离子与阴离子的个数比为1:1
2 2
4. 在下列物质间的每一步转化中(反应条件已经略去),物质间转化均能实现的是
A. Na→Na O →Na CO →NaHCO
2 2 2 3 3
B.
C.
D.
5. 下列各组离子,能在溶液中大量共存的是
A. 、 、 、 B. 、 、OH-、
C. 、 、 、 D. 、 、 、I_
6.劳动创造世界。下列家务劳动与所涉及的化学知识没有关联的是
选项 家务劳动 化学知识
A 将洗净的铁锅晾干 铁在潮湿环境中易生锈
用“爆炸盐”(含
B 过碳酸钠水溶液有强氧化性
)漂白衣物
C 用牙膏去除茶杯中的茶渍 摩擦剂碳酸钙是电解质
D 漂白粉用后密封存放于阴凉处 漂白粉能与潮湿二氧化碳反应
7. 化学是一门以实验为基础的科学。下列实验操作与目的不正确的是选项 实验操作 目的
铁粉与水蒸气反应中将生成的气体通入肥皂水中,
A 检验反应产生氢气
并点燃肥皂泡
B 配制 溶液时加入适量铁粉 防止 被氧化
蒸馏水加热至沸腾后滴加几滴饱和 溶液,继
C 制备 胶体
续煮沸至液体呈红褐色
D 实验结束,将剩余 固体放回原试剂瓶 节约试剂
8. 下列叙述中正确的是
A. 1 mol 的质量为44 g/mol B. 硝酸的摩尔质量63 g
C. 2 g 所含原子数目为2 mol D. 个 的质量为24 g
9. 下列离子方程式或化学方程式能用来解释相应实验现象的是
A. 将CO 气体通入CaCl 溶液中:CO +H O+Ca2+=CaCO ↓+2H+
2 2 2 2 3
B. 新制的氯水光照下产生气泡:2HClO O ↑+2HCl
2
C. 氧化亚铁溶于稀盐酸:FeO+2H+=Fe3++H O
2
D. 铜片溶于氯化铁溶液:Fe3++Cu=Cu2++Fe2+
10. 下列转化中,一定要加入还原剂才能实现的是
A. B. C. D.
11. 下列实验装置或操作正确且能达到预期目的的是A.实验室制取氯气 B.先从b管通入 ,再从a管通入
C.收集干燥纯净的 D.验证氯气是否具有漂白性
12、二氧化氯(ClO )是国际上公认的安全、无毒、绿色消毒剂和去污剂,可用于饮用水和环
2
境的消毒杀菌处理,可以除去水体或环境中的氰化物污染等,除去氰化物污染的反应原理
2ClO +2CN-=2CO +N +2Cl-。下列关于该反应的说法错误的是:
2 2 2
A. 氧化剂只有ClO
2
B. 氧化剂与还原剂的物质的量之比为1:1
C. 氧化产物只有CO
2
D. 转移1 mol电子时,理论上生成6.72L(标准状况)气体
13.下列“推理或结论”与“实验操作及现象”相符的一组是
选项 实验操作及现象 推理或结论
向氯水中加入盐酸酸化,再加入硝酸银溶液产生
A 氯水中有Cl-存在
白色沉淀
B 向碳酸钠溶液中逐滴滴加盐酸 马上产生大量气泡
C 向镁粉中加入新制氯水,有无色无味的气体产生 氯水中含有H+与Mg反应,产生H
2
用洁净的铂丝蘸取某溶液样品,在酒精灯外焰上 溶液中含有K+,不
D
灼烧,透过蓝色钴玻璃观察到火焰为紫色 含Na+
14、已知:KClO +6HCl(浓) KCl+3Cl ↑+3H O,如图所示,将少量试剂分别放入培养皿中的相
3 2 2
应位置,实验时将浓盐酸滴在KClO 晶体上,并用表面皿盖好。表中由实验现象得出的结论完全
3
正确的是 ( )
选项 实验现象 结论
A FeCl 溶液由浅绿色变为棕黄色 Cl 具有还原性
2 2
B 滴有酚酞的NaOH溶液褪色 Cl 具有酸性
2
C 紫色石蕊溶液先变红后褪色 Cl 具有漂白性
2
D 淀粉 ⁃KI溶液变为蓝色 Cl
2
具有氧化性
15.下列说法正确的是
A. 若某NaOH溶液的浓度是0.5mol⋅L ,则该溶液中含有0.5mol的
B. 若1L某 溶液中溶有98g ,则该溶液的物质的量浓度为98g/L
C. 将0.5molNaCl溶于装有0.5L溶液的烧杯中,溶液的物质的量浓度约为1mol/L
D. 从1L1mol·L 的 溶液中取出800mL,剩余溶液中 的浓度为0.4mol/L
16、设N 为阿伏加德罗常数的值,下列说法正确的是
A
A. 气体所含的分子数目为
B. 在标准状况下 的 含有电子的数目为
C. 在标准状况下, 含有分子数为D. 的 溶液中所含的 数目为
二、非选择题:本题共包括4小题,共56分。
17. 化学创造美好生活,某化学学习小组从日常生活中取来了下列常见物质,并展开研究。
①食用小苏打 ②洁厕灵(主要成分为浓盐酸) ③ 补铁剂 ④ 0.01%高锰酸钾洗液
⑤84消毒液(主要成分为 ) ⑥稀硫酸
的
(1)小苏打可用于面团 发酵,能使制成的面点更加松软可口。其作为发酵粉的原理是____
_________________________(用化学方程式表示)。
(2)上述物质在使用的过程中体现氧化性的是_______(填序号)。
(3)向少量④和⑥的混合溶液中,逐滴加入由③配制的 溶液,观察到混合溶液由紫色
变为棕黄色,在此反应中,每消耗 ,转移电子的物质的量为_______ 。
(4)乙同学想将洁厕灵与84消毒液混合后使用,以增强清洁效果,该方法_______(填“可
行”或“不可行”),理由是___________________(若可行,请以文字说明,若不可行,请用
离子方程式说明)。
(5)某同学在实验室配制80mL1.8mol/L稀硫酸溶液用于上述实验:
①该同学应选择 mL的容量瓶,该同学需取用浓度为18mol/L浓硫酸的体积是
mL。
②若实验中出现以下情况,对所配溶液的物质的量浓度有何影响?(填“偏高”“偏低”或
“无影响”)。
容量瓶中原有少量蒸馏水 ;
定容时俯视容量瓶瓶颈上的刻度线 ;
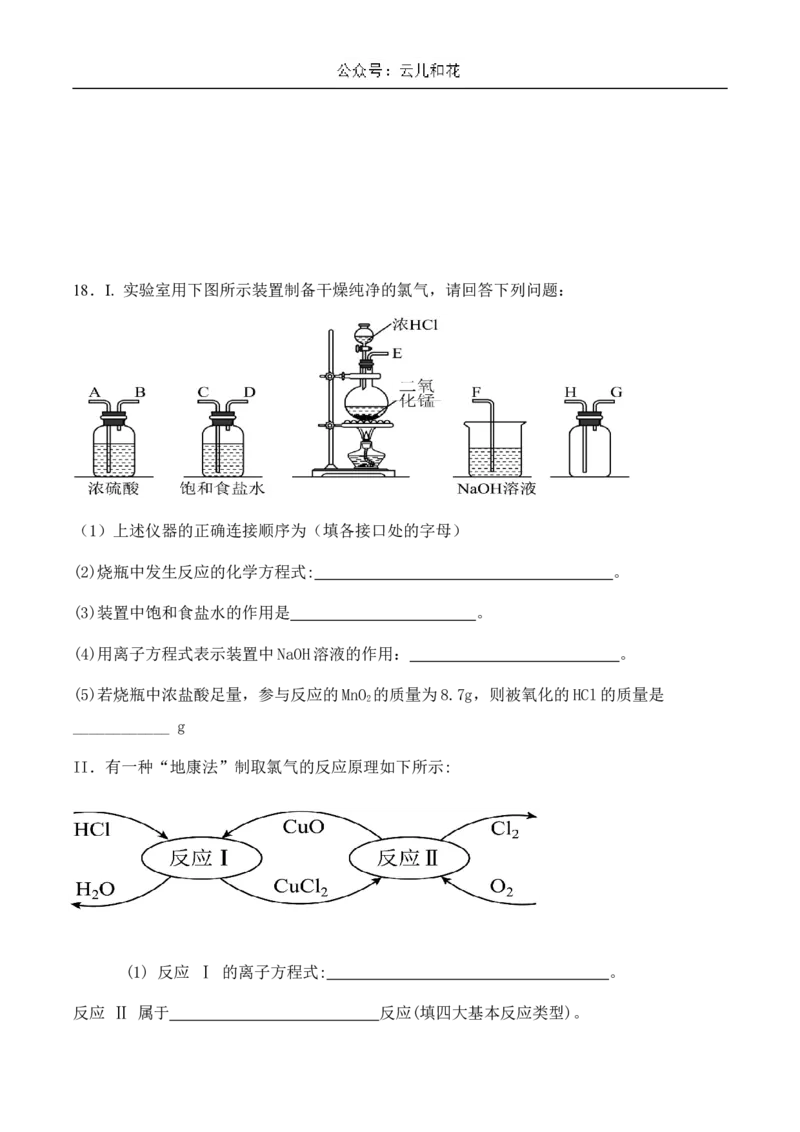
向容量瓶中转移溶液时不慎将少量溶液溅出洒在容量瓶外面 。18.I. 实验室用下图所示装置制备干燥纯净的氯气,请回答下列问题:
(1)上述仪器的正确连接顺序为(填各接口处的字母)
(2)烧瓶中发生反应的化学方程式: 。
(3)装置中饱和食盐水的作用是 。
(4)用离子方程式表示装置中NaOH溶液的作用: 。
(5)若烧瓶中浓盐酸足量,参与反应的MnO 的质量为8.7g,则被氧化的HCl的质量是
2
____________ g
II.有一种“地康法”制取氯气的反应原理如下所示:
(1) 反应 Ⅰ 的离子方程式: 。
反应 Ⅱ 属于 反应(填四大基本反应类型)。(2)用廉价的石灰乳吸收氯气可制得漂粉精,写出工业制漂粉精反应的化学方程式:
。
19. 研究铁及其化合物的性质与转化关系是中学化学重要的学习内容。回答下列问题:
(1)人体血液中如果缺乏亚铁离子,就会造成缺铁性贫血。市场出售的某种麦片中含有微量、
颗粒细小的还原铁粉,这些铁粉在人体胃酸(主要成分是 )作用下转化成亚铁盐。写出该
反应的离子方程式:_____________________。
(2)高铁酸钠 是一种新型绿色消毒剂,主要用于饮用水处理,工业上常用向
和 混合溶液中滴加 溶液的方法制备 ,同时生成NaCl,则反
应中氧化剂与还原剂物质的量之比为_________________,制备 转移的电子数目
为______________。
(3)某兴趣小组通过下列实验探究 、 的性质。
已知: 可与 溶液反应生成蓝色沉淀。
实验
实验操作 得出结论
现象
甲 溶液 可将 氧
向 溶液中加入几滴氯水,再加入1滴 溶液
组 变红 化
乙 取一定量 溶液于试管中,加入维生素C片,振荡 紫色 维生素C可将
组 褪去 还原为
溶解得到溶液a.取a溶液少许,滴加酸性 溶液
①甲组同学得出结论“ 可将 氧化”,其反应的离子方程式为____________;同学们认为甲组实验不够严谨,改进了实验:用煮沸冷却后的水配制溶液,向 溶液中先加入
0.5mL煤油,再于液面下依次加入几滴氯水和1滴 溶液,溶液变红,证明了结论正确,
煮沸的作用是______________________。
的
②其他组同学认为乙组 实验同样不够严谨,可能是_______使溶液紫色褪去。请设计补充实
验:取a溶液少许,滴加_______,若出现_______,则结论正确。
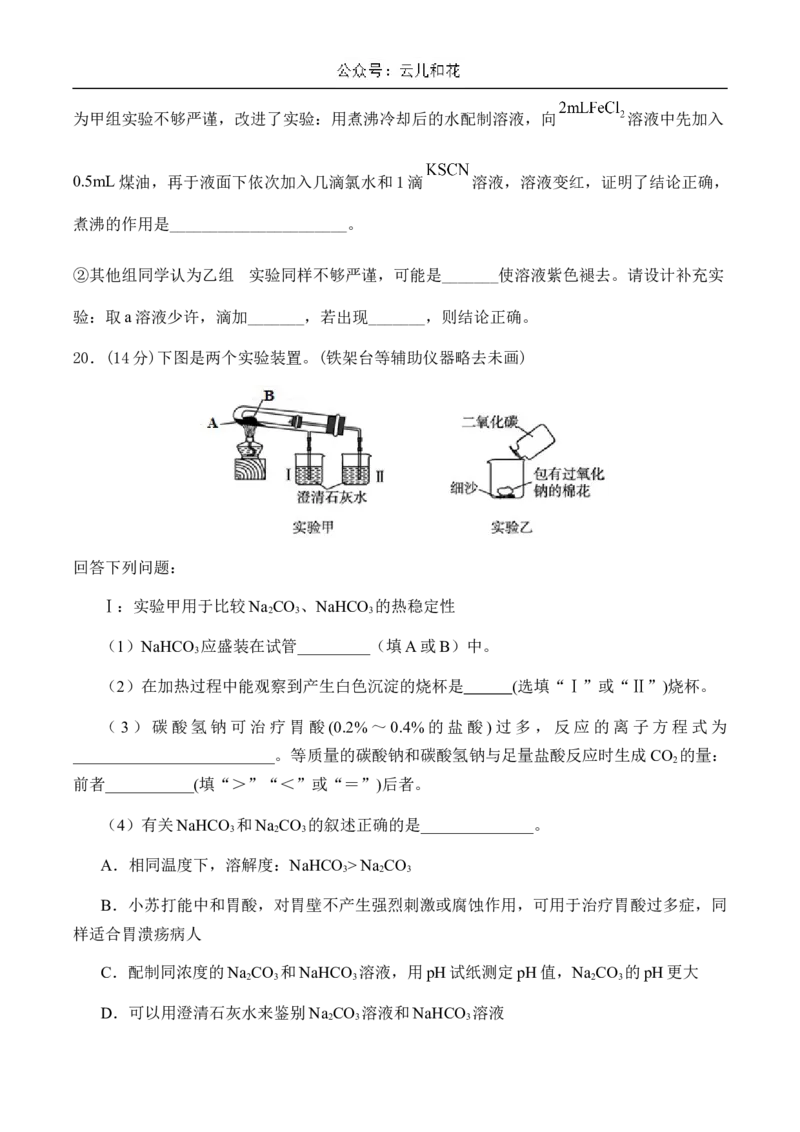
20.(14分)下图是两个实验装置。(铁架台等辅助仪器略去未画)
回答下列问题:
Ⅰ:实验甲用于比较Na CO 、NaHCO 的热稳定性
2 3 3
(1)NaHCO 应盛装在试管_________(填A或B)中。
3
(2)在加热过程中能观察到产生白色沉淀的烧杯是 (选填“Ⅰ”或“Ⅱ”)烧杯。
(3)碳酸氢钠可治疗胃酸(0.2%~0.4%的盐酸)过多,反应的离子方程式为
_________________________。等质量的碳酸钠和碳酸氢钠与足量盐酸反应时生成CO 的量:
2
前者___________(填“>”“<”或“=”)后者。
(4)有关NaHCO 和Na CO 的叙述正确的是______________。
3 2 3
A.相同温度下,溶解度:NaHCO > Na CO
3 2 3
B.小苏打能中和胃酸,对胃壁不产生强烈刺激或腐蚀作用,可用于治疗胃酸过多症,同
样适合胃溃疡病人
C.配制同浓度的Na CO 和NaHCO 溶液,用pH试纸测定pH值,Na CO 的pH更大
2 3 3 2 3
D.可以用澄清石灰水来鉴别Na CO 溶液和NaHCO 溶液
2 3 3E.往Na CO 饱和溶液中通入CO 气体,可获得NaHCO 沉淀
2 3 2 3
Ⅱ:实验乙用来验证Na O 与CO 的反应
2 2 2
(1)把CO 倒入烧杯中后,观察到的实验现象是包有Na O 的棉花着火燃烧。反应的化
2 2 2
学方程式为:____________________________,棉花能着火燃烧说明该反应的特点是
。
(2)将一定量的Na O 固体投入到含有下列离子的溶液中: 、 、 、 ,完
2 2
全反应后,上述溶液中离子数目几乎不变的是________(填离子符号)。2024-2025学年第一学期第二次段考
高一化学试卷答案
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16
D C B A C C D D B A D C C D C B
17(共14分) (1)2NaHCO ===Na CO +CO +H O(2分)
3 2 3 2 2
(2)④⑤(2分) (3) 2 (2分)
(4)不可行(1分),Cl- + ClO- + 2H+ ==== Cl + H O (2分)
2 2
(5) 100 (1分) 10.0或10(1分)
无影响 (1分) 偏高(1分) 偏低(1分)
18、(共14分)
I.(1)E C D A B H G F (2分)
(2)MnO +4HCl(浓) == MnCl +Cl ↑+2H O(2分)
2 2 2 2
(3)除去氯气中的氯化氢(1分)
(4)Cl +2OH- = Cl-+ClO-+H O(2分)
2 2
(5)7.3(2分)
II.(1)CuO+2H+=Cu2++H O (2分) 置换(1分)
2
(2)2Cl +2Ca(OH) =CaCl +Ca(ClO) +2H O(2分)
2 2 2 2 2
19【共14分】(1) (2分)
(2) 3:2 (2分) (或 或 ) (2分)
(3) ①. (2分) 排除水中的溶解氧 (1分)②. 维生素C过量,与高锰酸钾反应(1分) 铁氰化钾溶液(或氢氧化钠溶液)(2分) ⑤.
蓝色沉淀(或白色沉淀变为灰绿色最终变为红褐色)(2分)
20(14分)Ⅰ:B(1分) (2)Ⅱ(1分)
(3)H+ + HCO - == H O + CO (2分) < (2分) (4)CE(2分)
3 2 2
Ⅱ:(1) 2Na O +2CO =2Na CO +O (2分) 反应放热且生成氧气(2分)
2 2 2 2 3 2
(2)Cl-(2分)