文档内容
高二选择性必修二(人教版2019)期末复习培优与提升
(八)
一、单选题
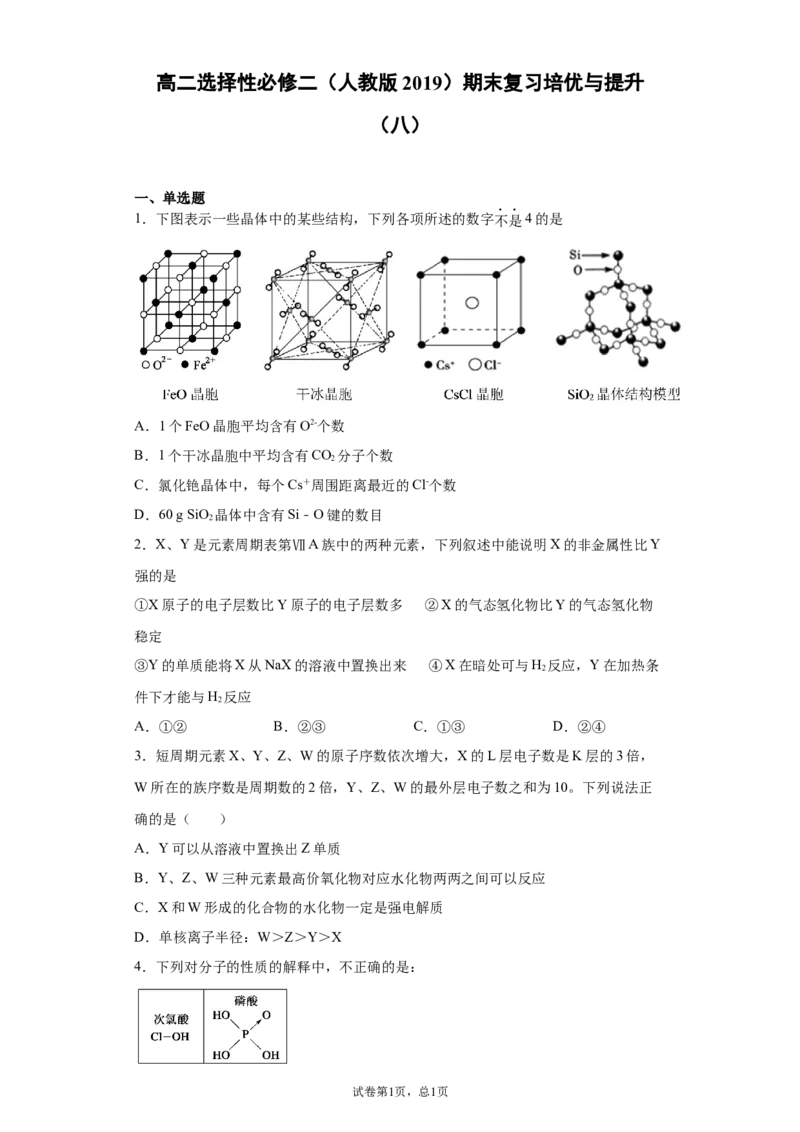
1.下图表示一些晶体中的某些结构,下列各项所述的数字不是4的是
A.1个FeO晶胞平均含有O2-个数
B.1个干冰晶胞中平均含有CO 分子个数
2
C.氯化铯晶体中,每个Cs+周围距离最近的Cl-个数
D.60 g SiO 晶体中含有Si﹣O键的数目
2
2.X、Y是元素周期表第ⅦA族中的两种元素,下列叙述中能说明X的非金属性比Y
强的是
①X原子的电子层数比Y原子的电子层数多 ②X的气态氢化物比Y的气态氢化物
稳定
③Y的单质能将X从NaX的溶液中置换出来 ④X在暗处可与H 反应,Y在加热条
2
件下才能与H 反应
2
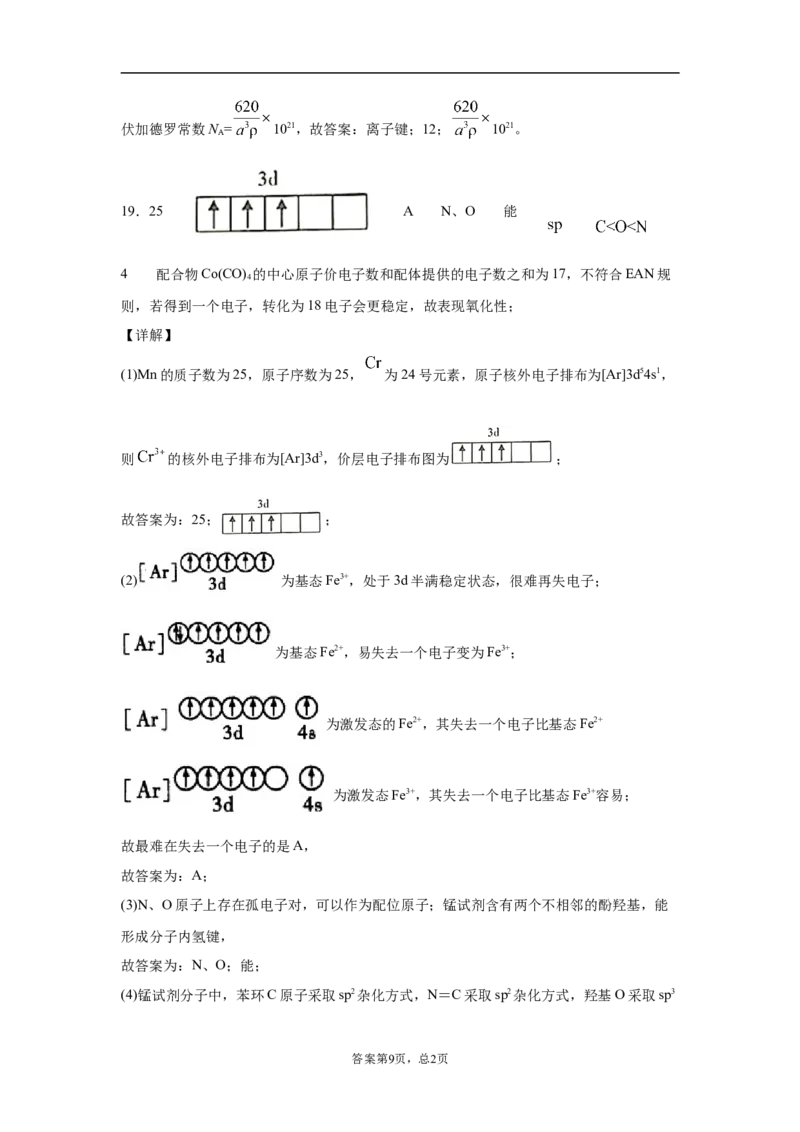
A.①② B.②③ C.①③ D.②④
3.短周期元素X、Y、Z、W的原子序数依次增大,X的L层电子数是K层的3倍,
W所在的族序数是周期数的2倍,Y、Z、W的最外层电子数之和为10。下列说法正
确的是( )
A.Y可以从溶液中置换出Z单质
B.Y、Z、W三种元素最高价氧化物对应水化物两两之间可以反应
C.X和W形成的化合物的水化物一定是强电解质
D.单核离子半径:W>Z>Y>X
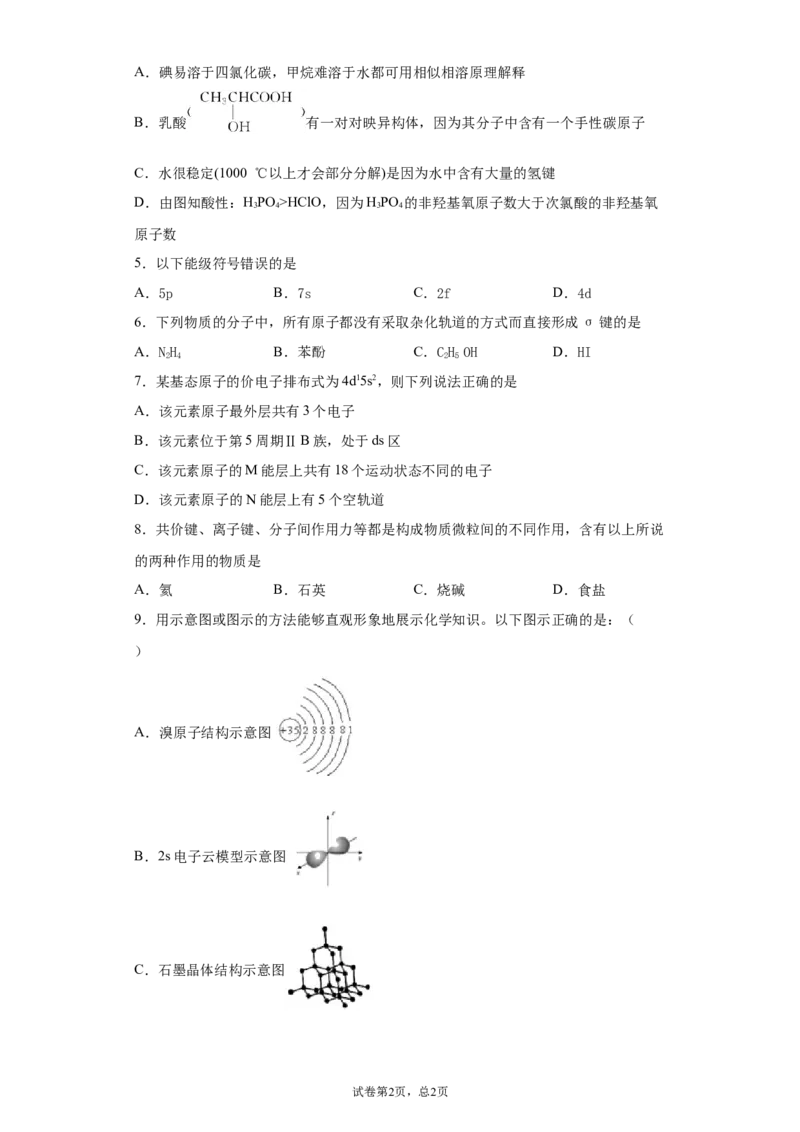
4.下列对分子的性质的解释中,不正确的是:
试卷第1页,总1页A.碘易溶于四氯化碳,甲烷难溶于水都可用相似相溶原理解释
B.乳酸 有一对对映异构体,因为其分子中含有一个手性碳原子
C.水很稳定(1000 ℃以上才会部分分解)是因为水中含有大量的氢键
D.由图知酸性:HPO >HClO,因为HPO 的非羟基氧原子数大于次氯酸的非羟基氧
3 4 3 4
原子数
5.以下能级符号错误的是
A.5p B.7s C.2f D.4d
6.下列物质的分子中,所有原子都没有采取杂化轨道的方式而直接形成σ键的是
A.NH B.苯酚 C.CH OH D.HI
2 4 2 5
7.某基态原子的价电子排布式为4d15s2,则下列说法正确的是
A.该元素原子最外层共有3个电子
B.该元素位于第5周期ⅡB族,处于ds区
C.该元素原子的M能层上共有18个运动状态不同的电子
D.该元素原子的N能层上有5个空轨道
8.共价键、离子键、分子间作用力等都是构成物质微粒间的不同作用,含有以上所说
的两种作用的物质是
A.氦 B.石英 C.烧碱 D.食盐
9.用示意图或图示的方法能够直观形象地展示化学知识。以下图示正确的是:(
)
A.溴原子结构示意图
B.2s电子云模型示意图
C.石墨晶体结构示意图
试卷第2页,总2页D.放热反应过程中能量变化示意图
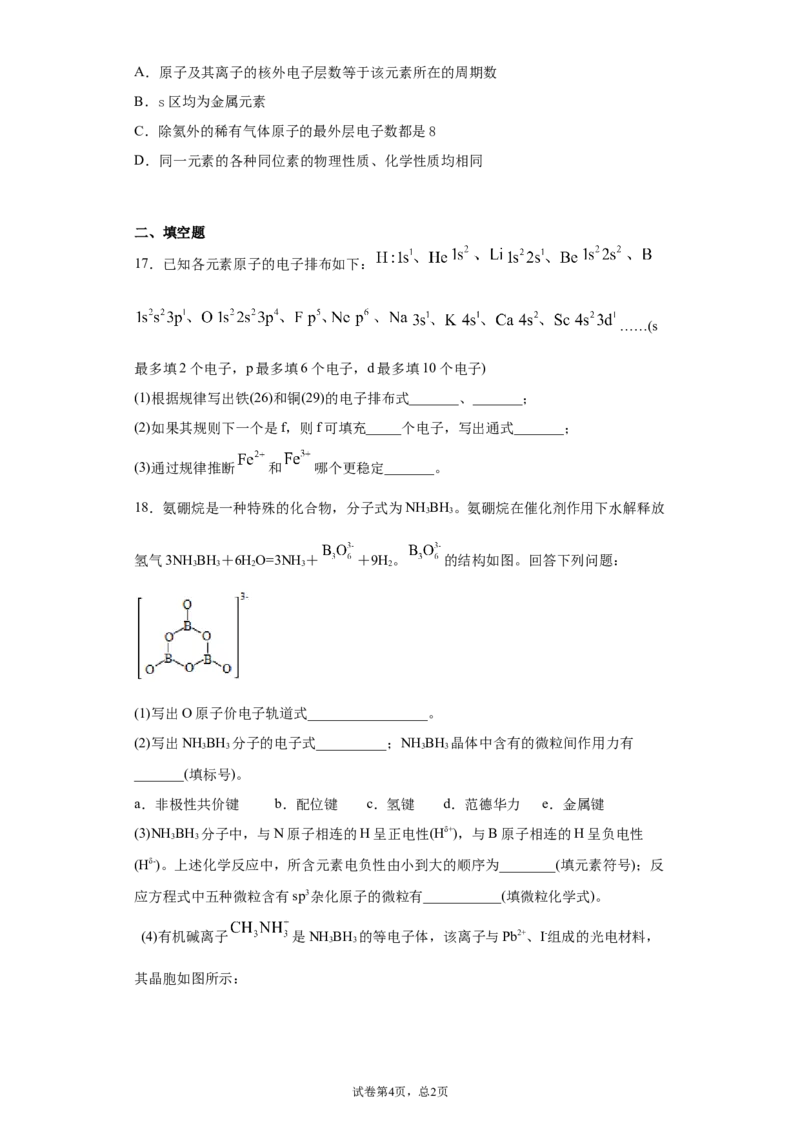
10.关于钾型晶胞结构(如图)的叙述中正确的是 ( )
A.是密置层的一种堆积方式 B.晶胞是六棱柱
C.每个晶胞内含2个原子 D.每个晶胞内含6个原子
11.对σ键的认识不正确的是
A.σ键属于共价键
B.s-s σ键与s-p σ键的对称性相同
C.分子中含有共价键,则至少含有一个σ键
D.含有π键的化合物与只含σ键的化合物的化学性质不同
12.下列化学用语正确的是
A.Zn的电子排布式:1s22s22p63s23p64s2 B.Fe2+的原子结构示意图:
C.C的价电子轨道表示式: D.HClO的电子式:
13.元素周期表中,第二周期第一电离能比较,介于硼和氮之间的元素有几种(
)
A.1 B.2 C.3 D.4
14.下列说法正确的是
A.石墨晶体呈层状结构,每个碳原子只有3个价电子形成共价键
B.白磷是正四面体分子,键角是109°28′,1摩尔白磷含共价键6N 个
A
C.臭氧是直线型分子,等质量的臭氧和氧气所含的氧原子数相同
D.S 是分子晶体,8个硫原子形成环状结构,摩尔质量为256g
8
15.下列分子或离子中键角由大到小排列的是( )
①BCl ②NH ③HO ④PCl + ⑤HgCl
3 3 2 4 2
A.⑤④①②③ B.⑤①④②③ C.④①②⑤③ D.③②④①⑤
16.下列说法中正确的是( )
试卷第3页,总1页A.原子及其离子的核外电子层数等于该元素所在的周期数
B.s区均为金属元素
C.除氦外的稀有气体原子的最外层电子数都是8
D.同一元素的各种同位素的物理性质、化学性质均相同
二、填空题
17.已知各元素原子的电子排布如下:
……(s
最多填2个电子,p最多填6个电子,d最多填10个电子)
(1)根据规律写出铁(26)和铜(29)的电子排布式_______、_______;
(2)如果其规则下一个是f,则f可填充_____个电子,写出通式_______;
(3)通过规律推断 和 哪个更稳定_______。
18.氨硼烷是一种特殊的化合物,分子式为NH BH。氨硼烷在催化剂作用下水解释放
3 3
氢气3NH BH+6HO=3NH + +9H。 的结构如图。回答下列问题:
3 3 2 3 2
(1)写出O原子价电子轨道式_________________。
(2)写出NH BH 分子的电子式__________;NH BH 晶体中含有的微粒间作用力有
3 3 3 3
_______(填标号)。
a.非极性共价键 b.配位键 c.氢键 d.范德华力 e.金属键
(3)NH BH 分子中,与N原子相连的H呈正电性(Hδ+),与B原子相连的H呈负电性
3 3
(Hδ-)。上述化学反应中,所含元素电负性由小到大的顺序为________(填元素符号);反
应方程式中五种微粒含有sp3杂化原子的微粒有___________(填微粒化学式)。
(4)有机碱离子 是NH BH 的等电子体,该离子与Pb2+、I-组成的光电材料,
3 3
其晶胞如图所示:
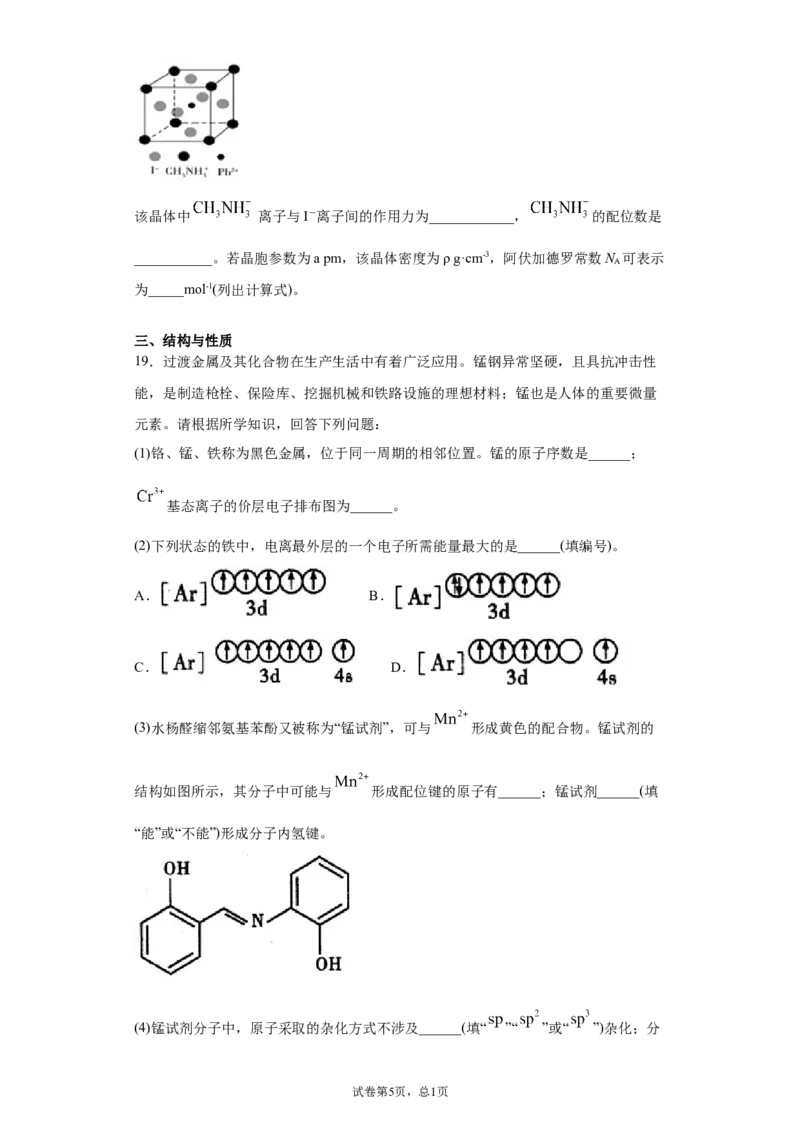
试卷第4页,总2页该晶体中 离子与I-离子间的作用力为____________, 的配位数是
___________。若晶胞参数为a pm,该晶体密度为ρ g·cm-3,阿伏加德罗常数N 可表示
A
为_____mol-1(列出计算式)。
三、结构与性质
19.过渡金属及其化合物在生产生活中有着广泛应用。锰钢异常坚硬,且具抗冲击性
能,是制造枪栓、保险库、挖掘机械和铁路设施的理想材料;锰也是人体的重要微量
元素。请根据所学知识,回答下列问题:
(1)铬、锰、铁称为黑色金属,位于同一周期的相邻位置。锰的原子序数是______;
基态离子的价层电子排布图为______。
(2)下列状态的铁中,电离最外层的一个电子所需能量最大的是______(填编号)。
A. B.
C. D.
(3)水杨醛缩邻氨基苯酚又被称为“锰试剂”,可与 形成黄色的配合物。锰试剂的
结构如图所示,其分子中可能与 形成配位键的原子有______;锰试剂______(填
“能”或“不能”)形成分子内氢键。
(4)锰试剂分子中,原子采取的杂化方式不涉及______(填“ ”“ ”或“ ”)杂化;分
试卷第5页,总1页子中除氢以外的元素,第一电离能从小到大的顺序为______(用元素符号表示)。
(5) 规则指的是配合物中心原子价电子数和配体提供的电子数之和为18.符合
规则的配合物分子结构和化学性质都较稳定。已知 和 均符
合 规则,性质稳定,而 则容易在化学反应中表现氧化性。
①x=______。
②从结构角度解释 则容易在化学反应中表现氧化性的原因______。
20.过渡金属及其化合物在生产生活中有着广泛应用。回答下列问题:
(1)锰、锝、铼位于同一副族相邻位置。类比锰,写出基态锝原子的价层电子排布式
___________。
(2)下列状态的铁中,电离最外层的一个电子所需能量最大的是___________(填编号)。
A.[Ar] B.[Ar] C.[Ar] D.[Ar]
(3)铁制容器在储存NO 液体时,会腐蚀生成离子化合物NO[Fe(NO )],NO 的离
2 4 4 6 3 4 2 4
子为平面结构,其结构图如图1,中心N原子的杂化类型为___________。
(4)EAN规则指的是配合物中心原子价电子数和配体提供的电子数之和为18.符合EAN
规则的配合物分子结构和化学性质都较稳定。已知Fe(CO) 和Ni(CO) 均符合EAN规
5 x
则,性质稳定,而Co(CO) 则容易在化学反应中表现氧化性。
4
①x=___________。
②从结构角度解释Co(CO) 则容易在化学反应中表现氧化性的原因___________。
4
(5) Ni和As形成某种晶体的晶胞图如图2所示。其中,大球为Ni,小球为As,距离
As最近的Ni构成正三棱柱,其中晶胞下方As原子坐标为(1/3,2/3,1/4)。
试卷第6页,总2页①Ni的配位数为___________。
②已知晶胞底面边长为apm,高为cpm,N 为阿伏加德罗常数。则晶胞密度为
A
___________g/cm3
四、原理综合题
21.二氧化氯(ClO )是国际公认高效、安全的杀菌、保鲜剂,是氯制剂的理想替代
2
品。工业上制备ClO 的方法很多,NaClO 和NaClO 是制取ClO 的常见原料。
2 3 2 2
完成下列填空:
(1)以下反应是制备ClO 的一种方法:HC O+ 2 NaClO + H SO = Na SO + 2 CO ↑ +
2 2 2 4 3 2 4 2 4 2
2 ClO ↑ + 2 H O,上述反应物中属于第三周期的元素的原子半径大小顺序是
2 2
__________;其中原子半径最大元素的原子,其核外有___________种不同能量的电子。
(2)ClO 的分子构型为“V”形,则ClO 是______________(选填“极性”、“非极性”)
2 2
分子,其在水中的溶解度比氯气__________(选填“大”、“小”、“一样”)。
(3)ClO 具有强氧化性,若ClO 和Cl 在消毒时自身均被还原为Cl-,ClO 的消毒能
2 2 2 2
力是等质量Cl 的___________倍(保留2位小数)。
2
(4)若以NaClO 为原料制取ClO ,需要加入具有________(填“氧化”、“还原”)性
2 2
的物质。
(5)工业上将氯碱工业和制取NaClO 联合进行。研究发现,电解时,不同反应环境
3
下的总反应分别为:
4 NaCl + 18 H O =4 NaClO + 3 O ↑+ 18 H ↑(中性环境)
2 3 2 2
NaCl + 3 HO = NaClO + 3 H ↑(微酸性环境)
2 3 2
①电解时,氢气在__________极产生。
②更有利于工业生产NaClO 的反应环境是___________,理由__________________。
3
试卷第7页,总1页参考答案
1.C
【详解】
A.氧化亚铁晶胞中Fe2+数目 , O2-数目 ,A不符合题意;
B.1个干冰晶胞中平均含有CO 分子个数 ,B不符合题意;
2
C.氯化铯晶体中,每个Cs+周围距离最近的Cl-个数是8,C符合题意;
D.在二氧化硅晶体结构中,一个硅原子与四个氧原子形成Si-O键,60 g SiO 晶体中含有
2
Si﹣O键的数目4N, D不符合题意;
A
故选C。
2.D
【详解】
①X原子比Y原子的电子层数多,X在Y的下方,则非金属性X比Y弱,①错误;
②卤族元素氢化物越稳定,其非金属性越强,②正确;
③Y能置换NaX中的X,则非金属性X比Y弱,③不正确;
④单质与H 化合越容易,其非金属性越强,④正确;
2
综上所述,②④正确,故选D。
3.B
【解析】
【分析】
X的L层电子数是K层的3倍,X是O元素;W所在的族序数是周期数的2倍,W是S元素;
X、Y、Z、W的原子序数依次增大,Y、Z、W的最外层电子数之和为10,则Y是Na元素、Z
是Al元素。
【详解】
A. Na与水发生剧烈反应,钠不能从溶液中置换出Al单质,故A错误;
B. 氢氧化铝具有两性,氢氧化钠、氢氧化铝、硫酸两两之间可以反应,故B正确;
C. 二氧化硫与水反应生成亚硫酸,HSO 是弱电解质,故C错误 ;
2 3
D. 电子层数越多半径越大,电子层数相同,质子数越多半径越小,单核离子半径:S2->
O2->Na+>Al3+,故D错误。
4.C
答案第1页,总2页【详解】
A.碘是非极性分子易溶于非极性溶剂四氯化碳,甲烷属于非极性分子难溶于极性溶剂水,
所以都可用相似相溶原理解释,故A正确;
B.碳原子连接四个不同的原子或原子团时,该碳原子为手性碳原子,所以乳酸
中第二个C连有四个不一样的基团:氢原子、甲基、羧基和羟基,是手性
碳原子,导致该物质存在互为镜像的两个手性异构体;生产中可利用“手性合成”法主要得
到其中一种手性分子,故B正确;
C.水很稳定(1000℃以上才会部分分解)是因为水中含有的H-O键非常稳定,与存在氢
键无关,故C错误;
D.由题中图示可知,HPO 的非羟基氧原子数为1,HClO的非羟基氧原子数为0,HPO
3 4 3 4
的非羟基氧原子数大于次氯酸的非羟基氧原子数,含氧酸中非羟基氧原子数越多,酸性越
强,所以磷酸的酸性大于次氯酸,故D正确;
答案为C。
5.C
【分析】
根据第一层(K层)上只有1s亚层,第二电子层(L层)只有2s和2p亚层,第三电子层(M层)
只有3s、3p和3d亚层,第四电子层(N层)只有4s、4p、4d和4f亚层。
【详解】
s亚层在每一能层上都有,p亚层至少在第二能层及以上,d亚层至少在第三能层及以上,f
亚层至少在第四能层及以上,因此能级符号错误的是2f ,故合理选项是C。
【点睛】
本题主要考查了能层上的具有的能级,抓住能层与能级的规律即可,难度不大。
6.D
【详解】
有杂化轨道的是分子中含有多个原子,即至少有三个原子组成,故选项D正确。
7.C
【详解】
由价电子排布式为 可知,该元素应为Y元素,位于第5周期ⅢB族,处于d区,该
答案第2页,总2页元素原子中共有39个电子,分5个电子层,该元素基态原子的电子排布式为
,其中M能层上有18个电子,最外层上有2个电子,
故A、B错误,C正确;该元素原子的N能层的电子排布式为 , 轨道有4个
空轨道,故D错误,综上所述,故选C。
答案C
8.C
【分析】
①共价键是原子间通过共用电子对形成的强的相互作用;②离子键是通过阴阳离子间的静
电作用形成的;③分子间作用力是分子之间的相互作用,不是化学键,作用力弱;④一种物
质中可以同时存在离子键、共价键,分子间作用力只存在于分子间,据以上分析解答。
【详解】
A、氦是稀有气体,是由原子构成的单原子分子,分子中无化学键,分子间存在分子间作用力,
故A错误;
B、石英的主要成分是SiO,它是由原子构成的物质,原子间通过共价键形成空间网状结构,
2
只存在共价键,故B错误;
C、烧碱是离子化合物,由钠离子和氢氧根离子构成,阴阳离子间形成的是离子键,氢原子和
氧原子以共价键形成氢氧根离子,所以C选项是正确的;
D、食盐是离子化合物,由钠离子和氯离子构成,只存在离子键,故D错误;
综上所述,本题正确选项C。
9.D
【详解】
A.Br是35号元素,原子核外电子排布是2、8、18、7,核外电子排布式是 ,
A错误;
B.2s电子云是球形对称的,不是纺锤形的,B错误;
C.石墨是层状结构,在层内C原子与相邻的3个C原子形成共价键,在层间以分子间作用
答案第3页,总2页力结合,C错误;
D.反应是放热反应,说明反应物的能量比生成物的能量高,D正确;
故合理选项是D。
10.C
【详解】
根据金属钾晶体的结构图可知,在晶胞中钾原子分布在晶胞的体心和八个顶点,是体心立
方堆积,是一种非密置层堆积,选项A错误;
晶胞的形状是立方体,选项B错误;
利用均摊可计算出每个晶胞中所含有的原子数为8× +1=2,选项C正确,选项D错误;
答案选C。
11.B
【详解】
σ键是共价键中的一种,故A项正确;s-s σ键上下、左右对称,而s-p σ键是上下对称,左右不对
称,故B项错误;C、D项明显正确。
12.B
【详解】
A.Zn原子核外电子数为30,根据能量最低原理,核外电子排布式为
1s22s22p63s23p63d104s2,故A错误;
B.Fe是26号元素,Fe2+的核外有24个电子,所以Fe2+原子结构示意图是 ,故B
正确;
C.C的价电子排布式为2s22p2,价电子轨道表示式为 ,故C错误;
D.Cl原子最外层有7个电子,形成1对共用电子对,而氧原子最外层有6个电子,形成2
对共用电子对,HClO的电子式为 ,故D错误。
答案选:B。
13.C
【详解】
第一电离能一般变化规律:周期表往右往上第一电离能逐渐增大,出现反常的有:IIA、
答案第4页,总2页VA价电子属于全满、半满稳定结构,第一电离能比相邻原子大,故B < Be (IIA) < C < O <
N(VA),所以介于B、N之间的有三种元素,故答案选C。
14.A
【详解】
A.石墨的层状结构图为 ,每个碳原子与其它3个碳原子形成3个共
价键,所以每个碳原子只有3个价电子形成共价键,A选项正确;
B.白磷的分子的结构为 ,白磷分子呈正四面体,键角60°,1mol白磷含共
价键6mol,个数为6N ,B选项错误
A
C.臭氧分子含3个O原子,为V型结构,而等质量的臭氧和氧气,均由氧原子构成,则
氧原子物质的量相同,所含的氧原子数相同,C选项错误;
D.S 是分子晶体,8个硫原子不在同一个平面上,摩尔质量为256g/mol,D选项错误;
8
答案选A。
【点睛】
C选项为易错选项,解答时要注意O 和O 是同素异形体,等质量的臭氧和氧气,均由氧原
2 3
子构成,氧原子物质的量相同,所含的氧原子数相同,但分子的空间构型不同。
15.B
【分析】
根据题中分子或离子中键角由大到小可知,本题考查键角判断,运用VSEPR理论分析。
【详解】
,根据VSEPR理论价电子对数为 ,根据杂化轨道理论,中心B
原子为 杂化,键角为 ;
答案第5页,总2页,根据VSEPR理论价电子对数为 ,根据杂化轨道理论,中心N
原子为 杂化,理论上正四面体构型键角为 ,由于 分子中孤电子对存在,
孤电子对斥力大于键合电子对斥力,使键角 ;
,根据VSEPR理论价电子对数为 ,根据杂化轨道理论,中心O
原子为 杂化,理论上正四面体构型键角为 ,由于 分子中存在两对孤电子
对,且孤电子对斥力大于键合电子对斥力,且存在两对孤电子对,使得键角比 分子的
键角还小;
,根据VSEPR理论价电子对数为 ,根据杂化轨道理论,中心
P原子为 杂化,键角为 ;
,根据VSEPR理论价电子对数为 ,根据杂化轨道理论,中心
Hg原子为sp杂化,键角为 ;
综上,键角由大到小的顺序为 ,
答案选B。
16.C
【解析】
A、钾离子的核外电子层数为3,该元素所在的周期数为4,钠离子的核外电子层数为2,
该元素所在的周期数为3,均不相等,故A错误;B、s区除氢外,全是金属元素,故B错
误;C、稀有气体原子中,只有氦原子的最外层电子数为2,其余的均为8,故C正确;
答案第6页,总2页D、各种同位素的化学性质相同,但同一元素的各种同位素的物理性质不同,如氕和氚物
理性质就不一样,氚可以发生核聚变,产生巨大能量,但氕就很难发生核聚变,故D错误;
故选C。
点睛:阳离子为原子失去最外层电子形成的稳定结构,据此分析;根据s区中含有氢元素
来回答;根据稀有气体原子的核外电子排布特点来回答;互为同位素的中子数不同,所以
互为同位素的原子的质量就不同了,从而导致物理性质有差异,据此分析。
17.1s2 2s2 2p6 3s2 3p6 3d6 4s2 1s2 2s2 2p6 3s2 3p6 3d10 4s1 14 2(2n-1),n=1,
2,3,…
【详解】
(1)根据能量最低原理,铁(26)的核外电子排布式是1s2 2s2 2p6 3s2 3p6 3d6 4s2,根据能量最
低原理、洪特规则,铜(29)的核外电子排布式是1s2 2s2 2p6 3s2 3p6 3d10 4s1;
(2) f能级有7个原子轨道,每个轨道最多容纳2电子,则f可填充14个电子,每个能级容
纳电子数的通式是2(2n-1),n=1,2,3,…;
(3) 的价电子电子排布是3d5, 的价电子排布是3d6 ,轨道全空、全满或半充满的
状态是比较稳定的,所以较稳定的是 ;
18. bcd B S > Cl 4 极性 大 2.63 氧化 阴极 微酸性环境 转移
电子都生成氯酸钠,能量利用率高;水消耗少;不同时生成氢气和氧气,相对更安全
【详解】
(1)反应中属于第三周期的是Na、S、Cl,同一周期自左向右原子半径逐渐减小,所以原
子半径由大到小的顺序为Na > S > Cl;钠原子的核外排布式为1s22s22p63s1,有4种不同能
量的电子。
(2)ClO 的分子构型为“V”形,分子中正负电中心不重合,所以ClO 是极性分子;ClO 、
2 2 2
HO都是极性分子,Cl 是非极性分子,根据“相似相溶”的经验规律,ClO 在水中溶解度
2 2 2
比氯气大。
(3)设质量都是m,ClO 消毒的效率是Cl 的 =2.63倍。
2 2
(4)以NaClO 为原料制取ClO ,氯元素的化合价由+3价升至+4价,NaClO 被氧化,所
2 2 2
以需加入氧化性物质。
(5)①电解时,H元素的化合价由+1价降至0价,氢离子得电子生成氢气,所以H 在阴
2
极产生;
②对比两个反应方程式可知,更有利于工业生产NaClO 的反应环境是微酸性环境,理由是:
3
微酸性环境中,转移电子都生成氯酸钠,能量利用率高;水消耗少;不同时生成氢气和氧
气,相对更安全。
答案第11页,总2页