文档内容
高二选择性必修二(人教版2019)期末复习培优与提升
(六)
一、单选题
1.下列说法正确的是
A.HO的热稳定性比HS强,是因为HO分子间作用力比HS强
2 2 2 2
B.离子化合物中一定含有离子键、一定不含共价键
C.NaClO是含有两种类型化学键的离子化合物
D.SiO 属于原子晶体,熔化破坏共价键和分子间作用力
2
2.下列实验中,现象和对应结论均正确的是
选
实 验 现 象 结 论
项
向淀粉溶液中加入稀H 2 SO 4 ,加热 没有砖红色沉淀 淀粉没有水解成葡
A
几分钟,冷却后再加入新制 生成 萄糖
Cu(OH) 浊液,加热。
2
NaCO 溶液变红
分别向等浓度的NaCO 溶液或 2 3
B 2 3 色,NaSO 溶液 非金属性:S>C
NaSO 溶液中滴加酚酞试剂 2 4
2 4 无明显现象
说明原溶液中一定
C 取无色溶液做焰色反应 焰色呈黄色
不含钾元素
向品红溶液中滴加NaClO溶液或 品红溶液均褪为 两者均有漂白性且
D
通入SO 气体 无色 原理相同
2
A.A B.B C.C D.D
3.设N 为阿伏加德罗常数的值,下列说法正确的是
A
A.4gNaOH固体所含电子总数为2N
A
B.22.4LCH 所含化学键总数为7 N
2 6 A
C.常温常压下,14gCO、N 混合气体所含分子总数为NA
2
D.0.1 mol-1LNH C1溶液中,NH +与Cl一数之和小于0.2 N
4 4 A
4.短周期元素W、X、Y和Z的原子序数依次增大。W是宇宙中最丰富的元素,
是维持生命过程的必需物质, 可用于玻璃的刻蚀, 是酸雨的主要形成
原因之一,室温下化合物 是气体。下列说法错误的是
试卷第1页,总1页A.Y的第一电离能在四种元素中最大 B. 和 的中心原子分别为
和 杂化
C. 的沸点高于 的沸点 D. 分子中原子均为8电子结构
5.原子核外L电子层最多能容纳的电子数是
A.2 B.8 C.10 D.18
6.下列有关说法正确的是
A.原子最外层电子数为 2 的元素一定处于周期表ⅡA 族
B.主族元素 X、Y 能形成 XY2 型化合物,则 X 与 Y 的原子序数之差可能为 2
或 5
C.第三周期元素的离子半径,从左到右逐渐减小
D.同主族元素形成的氧化物化学键类型均相同
7.在白磷(P )分子中,4个P原子分别处在正四面体的四个顶点,结合有关P原子的成
4
键特点,下列有关白磷的说法正确的是
A.白磷分子的键角为109.28′ B.分子中共有4个共价键
C.白磷分子的键角为60° D.分子间存在共价键
8.冰晶胞中水分子的空间排列方式与金刚石晶胞类似,如图:
下列有关冰晶胞说法正确的是
A.冰晶胞内水分子间以共价键结合
B.每个冰晶胞平均含有4个水分子
C.水分子间的氢键无方向性和饱和性
D.实验测得冰中氢键的作用力为18.5kJ/mol,而冰的熔化热为5.0kJ/mol,这说明冰熔
化成水,氢键部分被破坏。
9.下列化学用语表达正确的是( )
A.Mn的原子结构示意图: B.HClO的电子式:
试卷第2页,总2页C.Cr的外围电子排布式:3d54s1 D.基态碳原子的电子排布图:
10.下列分子或离子的立体结构,其中不正确的是( )
A.NH+ 为正四面体形 B.CS 为直线形
4 2
C.HCN为角形(V形) D.PCl 为三角锥形
3
11.某品牌食盐包装袋部分说明如下。下列相关叙述正确的是
配料:
精制盐、碘酸钾、
亚铁氰化钾 ,抗结剂
食用方法:待食品熟后加入
A.碘酸钾化学式为 B.该食盐配料受热均易分解
C. 中含有金属键 D.NaCl晶体属于离子晶体
12.已知下列元素原子的价电子排布式,其中能表示该元素不是主族元素的是
A.3s23p3 B.3d14s2 C.4s24p2 D.3s23p5
13.下列各组原子中,彼此的化学性质一定相似的是
A.P原子:1s2Q原子:2s2
B.P原子:M电子层上有2个电子 Q原子:N电子层上有2个电子
C.P原子:2p能级上有1个未成对电子 Q原子:3p能级上有1个未成对电子
D.P原子:最外电子层L层上只有一个空轨道 Q原子:3P能级上只有一个空轨道
14.下列电子排布图正确的是
A.基态镁原子的核外电子排布图:
B.基态氧原子L层电子排布图:
C.基态硫原子的电子排布图:
试卷第3页,总1页D.基态铜原子的价电子排布图:
15.氰气:(CN) ,结构:N≡C-C≡N;化学性质与卤素单质相似,下列叙述中正确的
2
是
A.(CN) 分子中C—C键的键长小于F—F键的键长
2
B.氰化钠和氰化银均不溶于水
C.(CN) 不可以和不饱和烃起加成反应
2
D.(CN) 和NaOH溶液反应可生成NaCN、NaOCN和HO
2 2
16.下列描述中正确的是
A.NO -的空间构型为三角锥形
3
B.SiF 和SO 2-的中心原子均为sp3杂化
4 3
C.在所有的元素中,氟的第一电离能最大
D.C HOH分子中共含有8个极性键,1个π键
2 5
二、填空题
17.冰晶石(Na AlF)是工业上冶炼铝的助熔剂,制取冰晶石(Na AlF)的化学方程式为
3 6 3 6
2Al(OH) +12HF+3A =2Na AlF+3CO +9H O。
3 3 s 2 2
(1)熔融晶体A时痛要破坏的作用力是_______,冰晶石中的配位体是______。
(2)上述反应的生成物中属于非极性分子的中心原子的杂化轨道类型为
________________,该分子的空间构型为___________。
(3)上述反应的反应物中有两种元素在元素周期表中的位置相邻,用化学方程式表示二
者的电负性大小:____________;写出含有其中电负性较小元素的原子,且形成的分
子的空间构型呈“V”形的物质的化学式(单质和化合物各写一种)_______________、
________________。
(4)某种Al—Fe合金的晶胞如图所示,该合金的化学式为_________。若晶胞的边长为
a nm,则合金的密度为______g• cm-3。
试卷第4页,总2页18.明代宋应星所著《天工开物》中己经记载了我国古代用炉甘石(主要成分ZnCO)
3
和煤冶锌工艺,锌的主要用途是制造锌合金和作为其他金属的保护层。回答下列问题:
(1) Zn原子基态核外电子排布式为___________________。
(2)硫酸锌溶于氨水形成[Zn(NH)]SO 溶液。
3 4 4
①SO2-中心原子的轨道杂化类型为_____,与它互为等电子体的阴离子化学式为
4
____(写出一种)。
②在[Zn(NH)]2+中Zn2+与NH 之间形成的化学键为___,提供孤电子对的成键原子是
3 4 3
____。 ③氨的热稳定性强于膦(PH),原因是_______。
3
(3)黄铜是由铜和锌所组成的合金,元素铜与锌的第一电离能分别为:I =746kJ/mol,
Cu
I =906 kJ/mol,I < I 的原因是_____________。
zn Cu zn
(4)《本草纲目》中记载炉甘石(主要成分ZnCO)可止血,消肿毒,生肌,明目……。
3
Zn、C、O电负性由大至小的顺序是________。ZnCO 中阴离子的立体构型是______。
3
(5)ZnS在荧光体、光导体材料、涂料、颜料等行业中应用广泛,立方ZnS晶胞结构如
图所示,每个Zn原子周围最近的Zn原子数目为____________。
晶胞边长为a pm,阿伏加德罗常数为N,则ZnS晶体的密度为_____g/cm3 (列出计算
A
式即可)
三、结构与性质
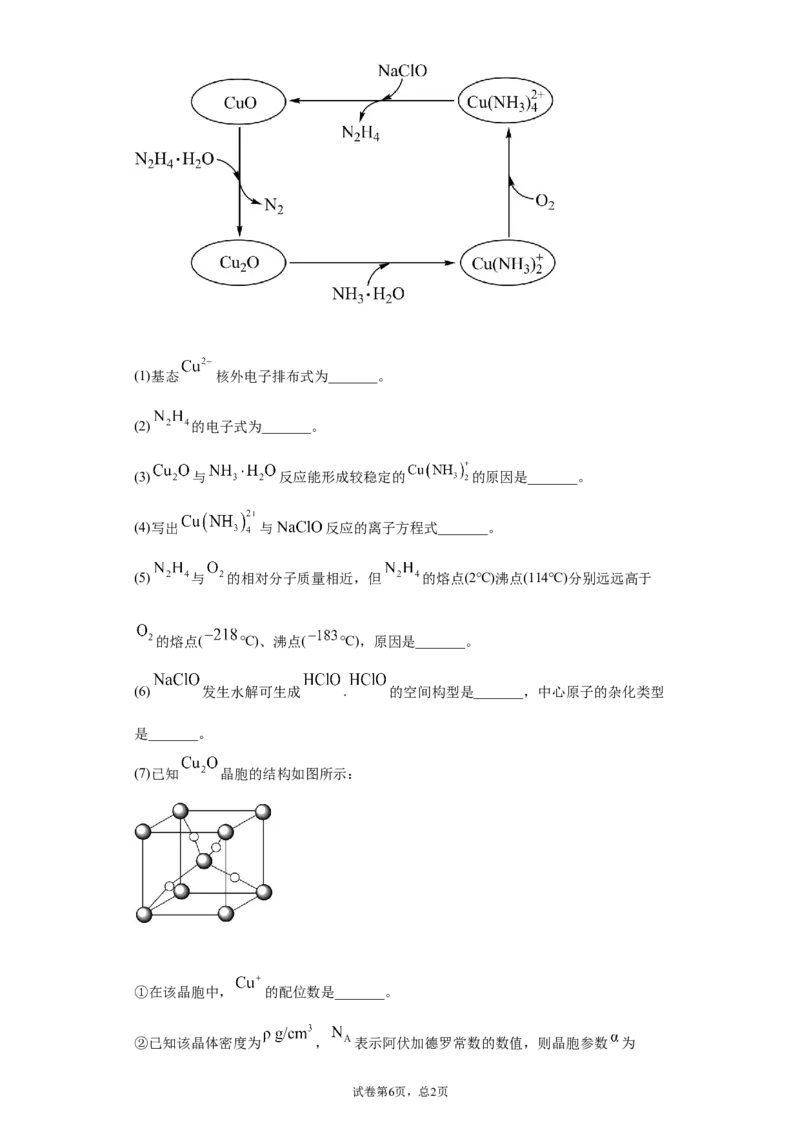
19.联氨 可以用于处理高压锅炉水中的氧,防止锅炉被腐蚀,其中一种可能
的反应机理如图所示.回答下列问题:
试卷第5页,总1页(1)基态 核外电子排布式为_______。
(2) 的电子式为_______。
(3) 与 反应能形成较稳定的 的原因是_______。
(4)写出 与 反应的离子方程式_______。
(5) 与 的相对分子质量相近,但 的熔点(2℃)沸点(114℃)分别远远高于
的熔点( ℃)、沸点( ℃),原因是_______。
(6) 发生水解可生成 . 的空间构型是_______,中心原子的杂化类型
是_______。
(7)已知 晶胞的结构如图所示:
①在该晶胞中, 的配位数是_______。
②已知该晶体密度为 , 表示阿伏加德罗常数的数值,则晶胞参数 为
试卷第6页,总2页_______ (用含 和 的代数式表示)。
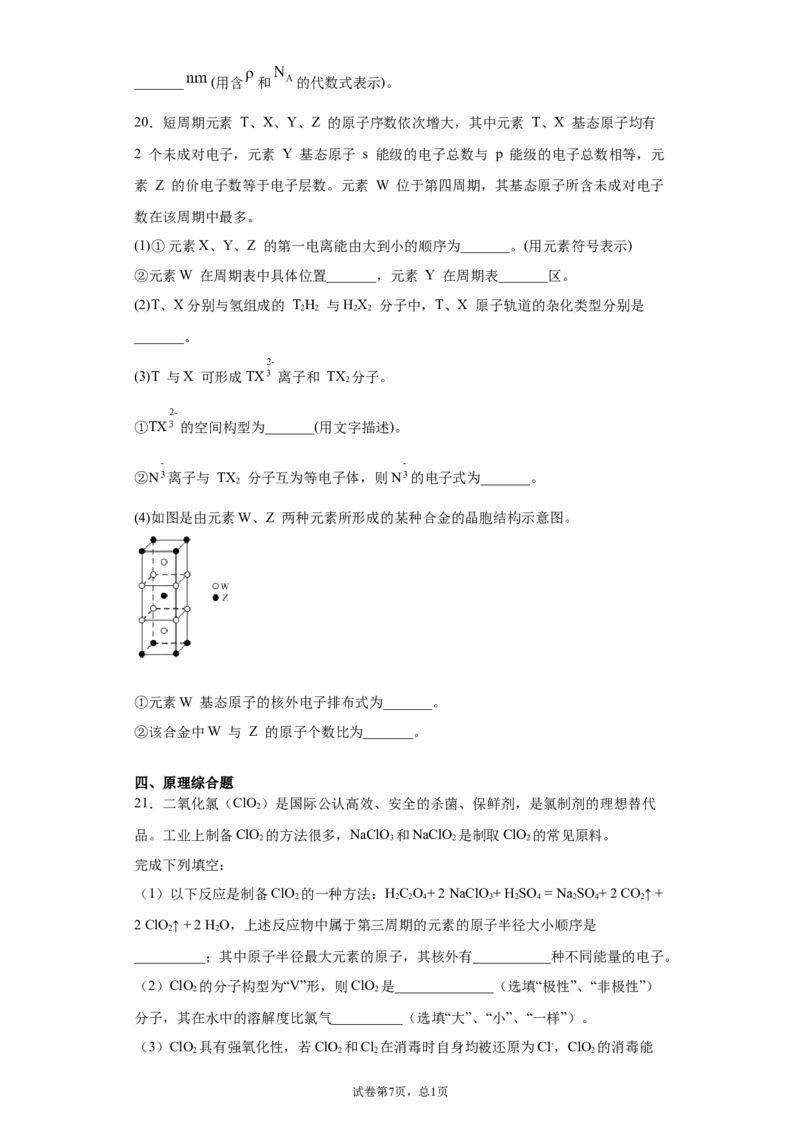
20.短周期元素 T、X、Y、Z 的原子序数依次增大,其中元素 T、X 基态原子均有
2 个未成对电子,元素 Y 基态原子 s 能级的电子总数与 p 能级的电子总数相等,元
素 Z 的价电子数等于电子层数。元素 W 位于第四周期,其基态原子所含未成对电子
数在该周期中最多。
(1)①元素X、Y、Z 的第一电离能由大到小的顺序为_______。(用元素符号表示)
②元素W 在周期表中具体位置_______,元素 Y 在周期表_______区。
(2)T、X分别与氢组成的 TH 与HX 分子中,T、X 原子轨道的杂化类型分别是
2 2 2 2
_______。
(3)T 与X 可形成TX 离子和 TX 分子。
2
①TX 的空间构型为_______(用文字描述)。
②N 离子与 TX 分子互为等电子体,则N 的电子式为_______。
2
(4)如图是由元素W、Z 两种元素所形成的某种合金的晶胞结构示意图。
①元素W 基态原子的核外电子排布式为_______。
②该合金中W 与 Z 的原子个数比为_______。
四、原理综合题
21.二氧化氯(ClO )是国际公认高效、安全的杀菌、保鲜剂,是氯制剂的理想替代
2
品。工业上制备ClO 的方法很多,NaClO 和NaClO 是制取ClO 的常见原料。
2 3 2 2
完成下列填空:
(1)以下反应是制备ClO 的一种方法:HC O+ 2 NaClO + H SO = Na SO + 2 CO ↑ +
2 2 2 4 3 2 4 2 4 2
2 ClO ↑ + 2 H O,上述反应物中属于第三周期的元素的原子半径大小顺序是
2 2
__________;其中原子半径最大元素的原子,其核外有___________种不同能量的电子。
(2)ClO 的分子构型为“V”形,则ClO 是______________(选填“极性”、“非极性”)
2 2
分子,其在水中的溶解度比氯气__________(选填“大”、“小”、“一样”)。
(3)ClO 具有强氧化性,若ClO 和Cl 在消毒时自身均被还原为Cl-,ClO 的消毒能
2 2 2 2
试卷第7页,总1页力是等质量Cl 的___________倍(保留2位小数)。
2
(4)若以NaClO 为原料制取ClO ,需要加入具有________(填“氧化”、“还原”)性
2 2
的物质。
(5)工业上将氯碱工业和制取NaClO 联合进行。研究发现,电解时,不同反应环境
3
下的总反应分别为:
4 NaCl + 18 H O =4 NaClO + 3 O ↑+ 18 H ↑(中性环境)
2 3 2 2
NaCl + 3 HO = NaClO + 3 H ↑(微酸性环境)
2 3 2
①电解时,氢气在__________极产生。
②更有利于工业生产NaClO 的反应环境是___________,理由__________________。
3
试卷第8页,总2页参考答案
1.C
【详解】
A.稳定性是化学性质,与分子间作用力无关,而与共价键的强弱有关,故A错误;
B.离子化合物中一定含有离子键,可能存在共价键,如 NaO,NaOH等,故B错误;
2 2
C.NaClO中含有离子键和共价键,属于离子化合物,故C正确;
D.SiO 属于原子晶体,熔化只破坏共价键,故D错误;
2
故选C。
2.B
【解析】
A、在加入新制Cu(OH) 悬浊液之前,先用氢氧化钠将溶液里的稀硫酸中和,甚
2
至要过量形成碱性环境,这样Cu(OH) 才会与醛基反应有砖红色沉淀生成,才
2
能检测出葡萄糖,故A错误;B、NaCO 溶液遇酚酞变红色,NaSO 溶液无明显现象,说明
2 3 2 4
酸性HSO 强于HCO,非金属性:S>C,故B正确;C、观察钾的焰色反应颜色时,要透过蓝
2 4 2 3
色钴玻璃片,以滤去黄色的光,才能看到紫色,所以焰色呈黄色时,不能说明原溶液中一定
不含钾元素,故C错误;D、次氯酸具有漂白性的原因是强氧化性,永久漂白,SO 的漂白性:
2
SO 能和有机色素化合,暂时漂白,不能永久漂白,故D错误。故选B。
2
3.A
【解析】
试题分析:A、4克氢氧化钠为0.1摩尔,每摩尔氢氧化钠含有的电子数为20摩尔,所以含
有2摩尔电子,正确,选A;B、没有说明是在标准状况下,所以不能计算其物质的量,不
选B;C、一氧化碳和氮气的相对分子质量为28,所以14克混合气体为0.5摩尔,所以含
有0.5摩尔分子,错误,不选C;D、没有说明溶液的体积,不能确定物质的量,错误,不
选D。
考点:阿伏伽德罗常数
4.D
【分析】
W是宇宙中最丰富的元素,则W是H; 是维持生命过程的必需物质,则X为O;
可用于玻璃的刻蚀,则WY为HF,Y为F; 是酸雨的主要形成原因之一,且Z
答案第1页,总2页的原子序数比Y大,则Z为S;综上所述,W、X、Y和Z分别为H、O、F、S,据此解答。
【详解】
A.一般规律:非金属性越强,第一电离能越大,第ⅡA族、第ⅤA族元素的第一电离能
比同周期相邻元素大,因此F的第一电离能在四种元素中最大,A正确;
B.HO中O的价层电子对数为2+ =4,SO 中S的价层电子对数为2+ =3,
2 2
因此HO和SO 的中心原子分别为 和 杂化,B正确;
2 2
C.O和S属于同主族元素,但HO分子间存在氢键,而HS分子间不存在氢键,因此HO
2 2 2
的沸点高于HS的沸点,C正确;
2
D.SF 中,S的最外层电子数为10,D错误;
4
答案选D。
5.B
【详解】
A. 原子核外K层最多容纳电子数为2,但L层不超8个,A不合题意;
B. 原子核外L层最多可容纳8个电子,B符合题意;
C. 原子核外L层最多容纳的电子数不能超过8个,不可能达10个,C不合题意;
D. 原子核外L层最多容纳的电子数不能超过8个,不可能达18个,D不合题意。
答案为B。
6.B
【详解】
A.ⅡA族元素最外层电子数为2,但氦原子只有2个电子,为零族元素,过渡元素中一些
元素原子最外层电子数也为2,故A错误;B. 主族元素 X、Y 能形成 XY 型化合物,则
2
可能是CO、MgCl , X 与 Y 的原子序数之差可能为 2 或 5,故B正确;C.离子结构
2 2
电子层数越多,离子半径越大,离子结构相同,核电荷数越大,离子半径越小,则S2-大于
Cl-,故C错误;D.H与Na同主族,H2O分子内存在共价键,而,Na2O存在离子键,故
D错误;答案为B。
7.C
【详解】
A.在白磷(P )分子中,4个P原子分别处在正四面体的四个顶点,则白磷分子的键角为
4
60°,A错误;
答案第2页,总2页B.在白磷(P )分子中,4个P原子分别处在正四面体的四个顶点,任意一个顶点的P原子
4
与相邻的3个顶点的P原子之间形成P-P键,则分子中共有共价键数目是 =6个,B
错误;
C.在白磷(P )分子中,4个P原子分别处在正四面体的四个顶点,则任意两个顶点连线夹
4
角是60°,即白磷分子的键角为60°,C正确;
D.白磷(P )是由分子构成的物质,在分子之间存在分子间作用力,不存在共价键,D错误;
4
故合理选项是C。
8.D
【详解】
A.冰晶胞内水分子间以氢键结合,A错误;
B.每个冰晶胞平均占有分子个数=4+ ×8+ ×6=8,B错误;
C.水分子间的氢键具有饱和性和方向性,C错误;
D.冰中氢键的作用能为18.5kJ•mol-1,而冰熔化热为5.0kJ•mol-1,说明冰熔化为液态水时
只是破坏了一部分氢键,并且液态水中仍在氢键,D正确;
答案选D。
9.C
【详解】
A.Mn原子核外电子排布为1s22s22p63s23p63d54s2,原子结构示意图为 ,A错
误;
B.HClO分子中O原子和H、Cl分别共用一对电子,电子式为 ,B错误;
C.Cr为24号元素,基态原子的核外电子排布为1s22s22p63s23p63d54s1,外围电子排布式为
3d54s1,C正确;
D.基态C原子的2s轨道全满,电子排布图为 ,D错误;
综上所述答案为C。
10.C
答案第3页,总2页【详解】
A.NH +中N原子的价层电子对数=4+ ×(5-1-4×1)=4,且不含有孤电子对,所以其空间构
4
型为四面体结构,故A正确;
B.CS 分子中价层电子对数=2+ ×(4-2×2)=2,且不含有孤电子对,所以为直线形结构,
2
故B正确;
C.HCN的结构为H-C≡N,C原子的价层电子对数为2,不含有孤电子对,为直线形,故
C错误;
D.PCl 分子中P原子的价层电子对数=3+ ×(5-3×1)=4,且含一个有孤电子对,所以其空
3
间构型为三角锥形,故D正确;
故选C。
【点睛】
正确计算价层电子对数是解题的关键,本题的易错点为孤电子对的计算,要注意理解 (a-
xb)中各字母的含义,并能灵活运用。
11.D
【详解】
A.碘酸钾化学式为 , 是高碘酸钾,A项错误;
B.NaCl受热不分解,B项错误;
C. 是离子化合物,含有离子键和共价键,不含金属键,金属键存在于金属单
质和合金中,C项错误;
D.NaCl是离子化合物,其晶体是离子晶体,D项正确;
答案选D。
12.B
【解析】
【详解】
答案第4页,总2页A.3s23p3表示的是磷元素,属于第三周期第VA族,属于主族元素,A错误;
B.3d14s2表示的是钪元素,属于第四周期第IIIB族,属于副族元素,B正确;
C.4s24p2表示的是锗元素,属于第四周期第IVA族,属于主族元素,C错误;
D.3s23p5表示的是氯元素,属于第三周期第VIIA族,属于主族元素,D错误;
故合理选项是B。
13.D
【详解】
A.P为He,属于稀有气体元素性质稳定,Q为Be属于金属元素,易失电子,二者性质不
同,故A错误;
B.原子核外M层上仅有两个电子的P为Mg元素,原子核外N层上仅有两个电子的Q可
能为Ca、Sc、Ti、V、Fe、Co、Ni、Zn等元素,价电子数不同,性质不相同,故B错误;
C、2p能级上有1个未成对电子,则P为B或F,3p能级上有1个未成对电子,则Q为Al
或Cl,所以P、Q的价电子数不一定相同,性质可能不同,故C错误;
D.最外电子层L层上只有一个空轨道,即2p轨道上只有一个空轨道的P原子是C,3p轨
道上只有一个空轨道的Q原子是Si,最外层电子数都为4,化学性质相似,故D正确;
选D。
14.A
【详解】
A.基态镁原子的核外电子排布式为 ,所以核外电子排布图为
,A正确;
B.基态氧原子的L层 轨道应有4个电子,则L层的电子排布图为 ,
B错误;
C.基态硫原子 能级中的3个电子优先分别占据1个轨道,且自旋状态相同,第4个电
子占据 能级中的一个轨道,且同一轨道内2个电子的自旋状态不同,故 能级电子排
答案第5页,总2页布图应该为 ,C错误;
D. 的原子序数为29,价电子排布式为 ,故基态铜原子的价电子排布图为
,D错误;
故选A。
15.D
【详解】
A、由于碳原子半径大于氟原子半径,(CN) 分子中C—C键的键长大于F—F键的键长,A
2
错误;
B、除氟化银外,卤化银都难溶于水,故AgCN可能难溶于水,但氰化钠为钠盐,能溶于
水,B错误;
C、卤素单质均可和不饱和烃发生加成反应,(CN) 也可以和不饱和烃起加成反应,C错误;
2
D、氰气性质与卤素相似,(CN) 能与NaOH溶液反应,(CN)
2 2
+2NaOH═NaCN+NaCNO+H O,D正确;
2
故答案选D。
16.B
【解析】
A.硝酸根离子的空间构型为平面三角形,A项错误;B.SiF 中硅原子含有4个σ键且不含孤
4
电子对,所以硅原子采用sp3杂化,SO 2-中价层电子对个数=3+1/2(6+2−3×2)=4,所以硫原
3
子为sp3杂化,B项正确;C.第一电离能最大的是零族元素的He,C项错误;D.乙醇分子中
只有单键,没有双键和三键,所以没有π键,D项错误。答案选B。
17.离子键 F- sp 直线型 2F+2H O==4HF+O HO O Fe Al(或
2 2 2 2 3 2
AlFe )
2
【分析】
(1)根据反应前后元素的原子不变,确定A化学式,然后确定断裂的化学键类型;根据络合
答案第6页,总2页物NaAlF 先确定其外界离子、络离子,再确定配位体;
3 6
(2)先确定非极性分子的种类,再确定其中心原子的杂化轨道类型及分子的空间构型;
(3)利用元素周期律比较元素非金属性强弱,再判断元素电负性大小;
(4)用均摊法计算一个晶胞中含有的Al、Fe原子数目,确定物质化学式;并根据 计
算其密度大小,要注意长度和密度的单位。
【详解】
(1)根据原子守恒可知A为NaCO,属于离子化合物,反应中会破坏离子键。NaAlF 中
2 3 3 6
AlF-是配离子,Al是中心原子,F-为配位体;
6
(2)CO 是非极性分子,中心原子C的轨道杂化方式为sp杂化,分子构型是直线型;
2
(3)相邻的两种元素是F和O,F的电负性比O大,元素的非金属性比O强,F 可将水中的
2
氧置换出来。含有O且分子构型是“V”型的分子有HO、SO 、O 等。
2 2 3
(4)晶胞中含有铁原子个数为 个,Al原子在晶胞内,其中含有4
个Al原子,所以该晶体的化学式为Fe Al,也可写为AlFe 。设该晶胞的密度为ρ,则有
2 2
ρ·(a×10-7)3·N =4×(56×2+27),则ρ= g/nm3。
A
【点睛】
本题以制取冰晶石为线索,全面考察了原子结构的有关知识,包括化学键、原子轨道杂化、
配位键、分子极性、电负性、晶胞密度的计算等。掌握物质结构及有关概念的含义是解答
本题的关键。
18.1s22s22p62s23p63d104s2 或[Ar] 3d104s2 sp3 PO3- 或 ClO- 配位键 N
4 4
氮元素的非金属性强于磷元素 锌失去的是全充满的4s2电子,铜失去的是4s1电子
O>C>Zn 平面三角形 12
【解析】
(1) Zn为30号元素,原子基态核外电子排布式为1s22s22p62s23p63d104s2,故答案为
1s22s22p62s23p63d104s2;
答案第7页,总2页(2)①SO 2-中S原子价层电子对=4+ (6+2-4×2)=4,且不含孤电子对,所以其立体构型是正
4
四面体,硫原子采取sp3杂化;与SO 2-互为等电子体的阴离子有PO 3-、SiO4- ClO -等,故
4 4 4 4
答案为 sp3;PO 3-或SiO4-或 ClO -;
4 4 4
②在[Zn(NH)]2+中Zn2+与NH 之间形成的化学键为配位键,配体为NH,N原子含有孤电子
3 4 3 3
对,可以提供给新原子共用,故答案为配位键;N ;
③N、P属于同一主族元素,N的非金属性强于P,非金属性越强,氢化物越稳定,PH 与NH
3 3
的热稳定性:NH 更强,故答案为氮元素的非金属性强于磷元素;
3
(3)锌失去的是全充满的4s2电子,较为稳定,不容易失去,铜失去的是4s1电子,4s2为全充
满结构,较为稳定,不容易失去,使得I < I ,故答案为锌失去的是全充满的4s2电子,
Cu zn
铜失去的是4s1电子;
(4) Zn是活泼的金属元素,电负性最小、O的非金属性大于C,电负性O>C,因此电负性
由大至小的顺序为O>C>Zn;ZnCO 中阴离子中C原子价层电子对=3+ (4+2-3×2)=3,
3
且不含孤电子对,所以其立体构型是平面三角形,故答案为O>C>Zn;平面三角形;
(5)Zn原子位于顶点和面心,每个Zn原子周围最近的Zn原子有12个,分别位于相互垂直
的三个平面上;黑球全部在晶胞内部,该晶胞中含有黑球个数是4,白球个数= ×8+
×6=4,ρ= = = g/(cm)3,故答案为12;
。
点睛:本题考查了较综合,涉及原子杂化方式判断、粒子空间构型判断、晶胞的计算等知
识点,这些知识点都是高考高频点。本题的易错点是Zn原子周围最近的Zn原子数目的判
断。
19.1s22s22p63s23p63d9 氨中的氮原子提供孤对电子与亚铜离子形成配
答案第8页,总2页位键 +2 =CuO+N H+H O+2H++2Cl- 分子之间存在氢键,
2 4 2
氧气分子之间为范德华力,氢键比范德华力更强 V形 sp3 2
【详解】
(1)铜为29号元素,基态原子的核外电子排布为1s22s22p63s23p63d104s1,,4s和3d上各失去
一个电子形成铜离子,所以基态 核外电子排布式为1s22s22p63s23p63d9。
(2) 中存在4个氮氢键,和一个氮氮键,电子式为 。
(3) 与 反应能形成较稳定的 的原因是氨中的氮原子提供孤对电
子与亚铜离子形成配位键。
(4)从图分析, 与 反应生成氧化铜和 ,根据氧化还原反应分析氮
元素化合价升高,氯元素化合价降低,该反应的离子方程式 +2
=CuO+N H+H O+2H++2Cl-。
2 4 2
(5) 与 的相对分子质量相近,但 的熔点(2℃)沸点(114℃)分别远远高于 的
熔点( ℃)、沸点( ℃),原因是 分子之间存在氢键,氧气分子之间为范德华
力,氢键比范德华力更强。
(6) 的中心原子氧原子孤电子对数为 ,价层电子对数为2+2=4,所以空
间构型是V形,中心原子氧原子的杂化类型是sp3。
(7)①晶胞中大白球数为 ,小白球数目为4,结合化学式分析,大白球为氧,小
白球为铜,该晶胞中亚铜离子的配位数为2。
答案第9页,总2页②晶胞的质量为 g,则有 = ,解的晶胞参数
为 。
20.O>Mg>Al 第四周期ⅥB族 s sp、sp3 平面三角形
1s22s22p63s23p63d54s1 2:1
【分析】
短周期元素 T、X、Y、Z 的原子序数依次增大,元素 Y 基态原子 s 能级的电子总数与
p 能级的电子总数相等,Y核外电子排布式是1s22s22p63s2,Y是Mg元素;元素 Z 的价电
子数等于电子层数,Z是Al元素;元素 T、X 基态原子均有 2 个未成对电子,T是C元
素、X是O元素;元素 W 位于第四周期,其基态原子所含未成对电子数在该周期中最多,
W核外电子排布式是1s22s22p63s23p63d53s1,W是Cr元素;
【详解】
(1) ①同一周期元素,元素第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第
VA族元素第一电离能大于其相邻元素,同一主族,元素第一电离能随着原子序数增大而减
弱,所以第一电离能大小顺序是O>Mg>Al;
②W是Cr元素,在周期表中具体位置是第四周期ⅥB族,Y是Mg元素,在周期表第三周
期ⅡA族,属于s区元素;
(2) T是C元素、X是O元素,分别与氢组成的 C H 与HO 分子中, 中碳原
2 2 2 2
子含有叁键,碳原子轨道的杂化类型是sp;HO 的结构是H-O-O-H,O原子的杂化轨道数
2 2
是4,轨道的杂化类型是sp3;
(3) ①CO 中C原子杂化轨道数是3,没有孤电子对,空间构型为平面三角形。
②等电子体具有相似的结构,N 离子与 CO 分子互为等电子体,CO 的结构式是
2 2
O=C=O,则 N 的电子式为 。
(4) ①W 是Cr元素,核外有24个电子,根据构造原理书写元素Cr基态原子的核外电子排
答案第10页,总2页布式为1s22s22p63s23p63d54s1;
②根据均摊原则,该晶胞中Al原子个数=1+8× =2,Cr原子数是2+8× =4,所以Cr、Al
原子个数之比=4:2=2:1。
21.Na > S > Cl 4 极性 大 2.63 氧化 阴极 微酸性环境 转移
电子都生成氯酸钠,能量利用率高;水消耗少;不同时生成氢气和氧气,相对更安全
【详解】
(1)反应中属于第三周期的是Na、S、Cl,同一周期自左向右原子半径逐渐减小,所以原
子半径由大到小的顺序为Na > S > Cl;钠原子的核外排布式为1s22s22p63s1,有4种不同能
量的电子。
(2)ClO 的分子构型为“V”形,分子中正负电中心不重合,所以ClO 是极性分子;ClO 、
2 2 2
HO都是极性分子,Cl 是非极性分子,根据“相似相溶”的经验规律,ClO 在水中溶解度
2 2 2
比氯气大。
(3)设质量都是m,ClO 消毒的效率是Cl 的 =2.63倍。
2 2
(4)以NaClO 为原料制取ClO ,氯元素的化合价由+3价升至+4价,NaClO 被氧化,所
2 2 2
以需加入氧化性物质。
(5)①电解时,H元素的化合价由+1价降至0价,氢离子得电子生成氢气,所以H 在阴
2
极产生;
②对比两个反应方程式可知,更有利于工业生产NaClO 的反应环境是微酸性环境,理由是:
3
微酸性环境中,转移电子都生成氯酸钠,能量利用率高;水消耗少;不同时生成氢气和氧
气,相对更安全。
答案第11页,总2页