文档内容
高二选择性必修二(人教版2019)期末复习培优与提升
(四)
一、单选题
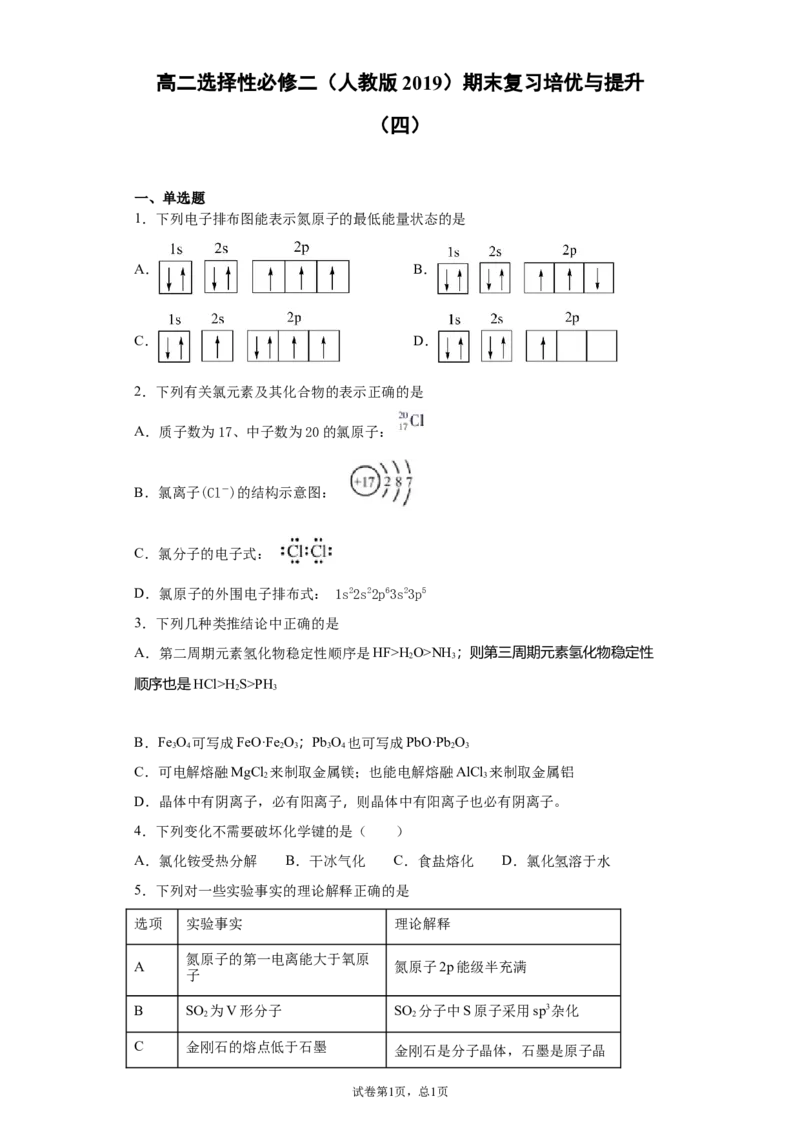
1.下列电子排布图能表示氮原子的最低能量状态的是
A. B.
C. D.
2.下列有关氯元素及其化合物的表示正确的是
A.质子数为17、中子数为20的氯原子:
B.氯离子(Cl-)的结构示意图:
C.氯分子的电子式:
D.氯原子的外围电子排布式: 1s22s22p63s23p5
3.下列几种类推结论中正确的是
A.第二周期元素氢化物稳定性顺序是HF>H O>NH ;则第三周期元素氢化物稳定性
2 3
顺序也是HCl>H S>PH
2 3
B.Fe O 可写成FeO·Fe O;Pb O 也可写成PbO·Pb O
3 4 2 3 3 4 2 3
C.可电解熔融MgCl 来制取金属镁;也能电解熔融AlCl 来制取金属铝
2 3
D.晶体中有阴离子,必有阳离子,则晶体中有阳离子也必有阴离子。
4.下列变化不需要破坏化学键的是( )
A.氯化铵受热分解 B.干冰气化 C.食盐熔化 D.氯化氢溶于水
5.下列对一些实验事实的理论解释正确的是
选项 实验事实 理论解释
氮原子的第一电离能大于氧原
A 氮原子2p能级半充满
子
B SO 为V形分子 SO 分子中S原子采用sp3杂化
2 2
C 金刚石的熔点低于石墨 金刚石是分子晶体,石墨是原子晶
试卷第1页,总1页体
D HF的沸点高于HCl HF的相对分子质量小于HCl
A.A B.B C.C D.D
6.下列关于元素周期表的叙述中不正确的是( )
A.元素种类最多的族是第Ⅷ族
B.第ⅠA族金属元素单质均能与水反应
C.第ⅡA族中无非金属元素
D.金属元素的种类比非金属元素多
7.由下列实验及相应事实推理所得的结论,不能用元素周期律解释的是
实验 事实 结论
将体积相同的Na和K
K与HO反应更剧
A 2 金属性:K>Na
烈
分别投入冷水中
B 将足量硫酸与NaPO 溶液混合 生成HPO 非金属性:S>P
3 4 3 4
C 分别加热HCl气体和HI气体 HI气体更易分解 稳定性:HCl>HI
分别加热NaCO 固体和 NaHCO 固体更易 热稳定性:
D 2 3 3
NaHCO 固体 分解 NaCO>NaHCO
3 2 3 3
A.A B.B C.C D.D
8.下列有关构造原理的说法错误的是
A.原子核外电子填充3p、3d、4s能级的顺序一般为3p→4s→3d
B.某基态原子部分核外电子的排布式为
C.在多电子原子中,电子最后填入的能级不一定是原子最外能层上的能级
D.从第三能层开始出现能级交错现象,即电子填入能级的顺序与能层顺序不同
9.新冠病毒疫情期间,养成良好的卫生习惯,做好个人的消毒防护可以有效地防止病
毒的扩散和感染,三氯生(结构简式如图所示)是一种高效广谱抗菌剂,对人体毒性很小,
在洗手液成分中非常常见。学名“二氯苯氧氯酚”,又名“三氯新”“三氯沙”等,下列有关
说法不正确的是
试卷第2页,总2页A.该有机物的分子式为
B.碳原子的杂化方式为 杂化
C.分子中所有原子可能共平面
D.1mol该物质含有 键和 键
10.下列关于晶体中存在的作用力的说法一定正确的是
A.共价晶体中一定存在极性共价键
B.分子晶体中一定存在范德华力
C.硫黄晶体和冰晶体中存在的作用力完全相同
D.只有共价晶体中存在共价键
11.下列说法正确的是( )
A.非极性键只能存在单质中,不可能存在化合物中
B.阴、阳离子间通过静电引力所形成的化学键是离子键
C.冰中HO分子间存在氢键,HO分子内存在极性共价键
2 2
D.HBr比HCl的热稳定性差,说明HBr的分子间作用力比HCl弱
12.下列物质性质的变化规律描述正确,且与共价键的键能大小有关的是
A.F、Cl、Br 、I 的熔、沸点逐渐升高
2 2 2 2
B.HF、HCl、HBr、HI的热稳定性依次减弱,熔点依次升高
C.金刚石的硬度、熔点、沸点都高于晶体硅
D.NaF、NaCl、NaBr、NaI的熔点依次降低
13.以下化学用语错误的是
A.碳原子的最外层电子的轨道表示式:
B.OH-的电子式:
C.硫离子的电子排布式: 1s22s22p63s23p6
D.碳-12原子: C
14.下列微粒结构示意图中,表示钠离子的是
A. B. C. D.
15.下列说法中正确的是
试卷第3页,总1页A.NO、SO、BF、NCl 分子中没有一个分子中原子的最外层电子都满足了8e-稳定结
2 2 3 3
构;
B.P 和CH 都是正四面体分子且键角都为109o28ˊ;
4 4
C.CO、SO 都是直线形的分子
2 2
D.CH=CH 分子中共有五个σ键和一个π键
2 2
16.下列一组粒子的中心原子杂化类型相同,分子或离子的键角不相等的是
A.CCl、SiCl、SiH B.HS、NF、CH
4 4 4 2 3 4
C.BCl、NH、CO D.SO、BF、HO+
3 3 2 3 3 3
二、填空题
17.环烷酸金属(Cu、Ni、Co、Sn、Zn)盐常作为合成聚氨酯过程中的有效催化剂。回
答下列问题:
(1)基态Cu原子的价电子排布___________。
(2)镍的氨合离子 中存在的化学键有___________。
A.离子键 B.共价键 C.配位键 D.氢键 E. 键 F. 键
(3)Ni、Co的第五电离能: , ,
,其原因是___________。
(4)锡元素可形成白锡、灰锡、脆锡三种单质。其中灰锡晶体与金刚石结构相似,但灰
锡不如金刚石稳定,其原因是___________。
(5)硒化锌晶胞结构如图所示,其晶胞参数为a pm。
①相邻的 与 之间的距离为___________pm。
②已知原子坐标:A点为(0,0,0),B点为(1,1,1),则C点的原子坐标___________。
③若硒化锌晶体的密度为 ,则阿伏加德罗常数 ___________(用含a、
的计算式表示)。
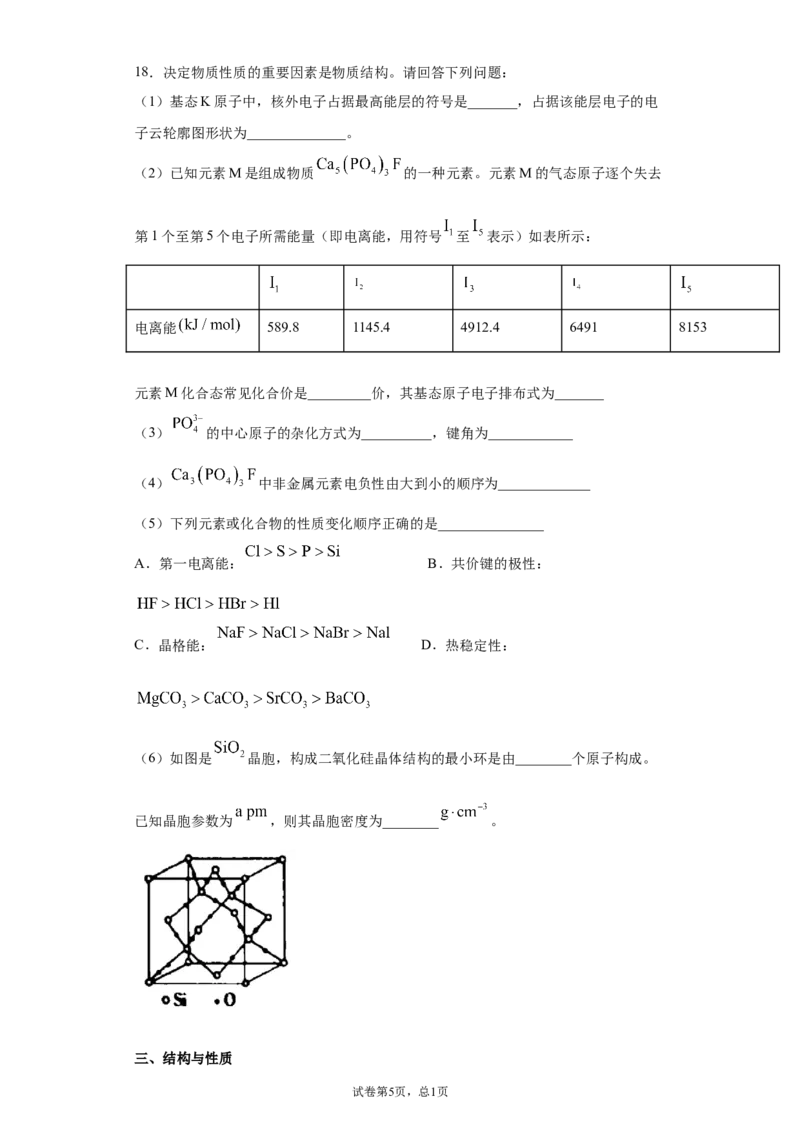
试卷第4页,总2页18.决定物质性质的重要因素是物质结构。请回答下列问题:
(1)基态K原子中,核外电子占据最高能层的符号是_______,占据该能层电子的电
子云轮廓图形状为______________。
(2)已知元素M是组成物质 的一种元素。元素M的气态原子逐个失去
第1个至第5个电子所需能量(即电离能,用符号 至 表示)如表所示:
电离能 589.8 1145.4 4912.4 6491 8153
元素M化合态常见化合价是_________价,其基态原子电子排布式为_______
(3) 的中心原子的杂化方式为__________,键角为____________
(4) 中非金属元素电负性由大到小的顺序为_____________
(5)下列元素或化合物的性质变化顺序正确的是_______________
A.第一电离能: B.共价键的极性:
C.晶格能: D.热稳定性:
(6)如图是 晶胞,构成二氧化硅晶体结构的最小环是由________个原子构成。
已知晶胞参数为 ,则其晶胞密度为________ 。
三、结构与性质
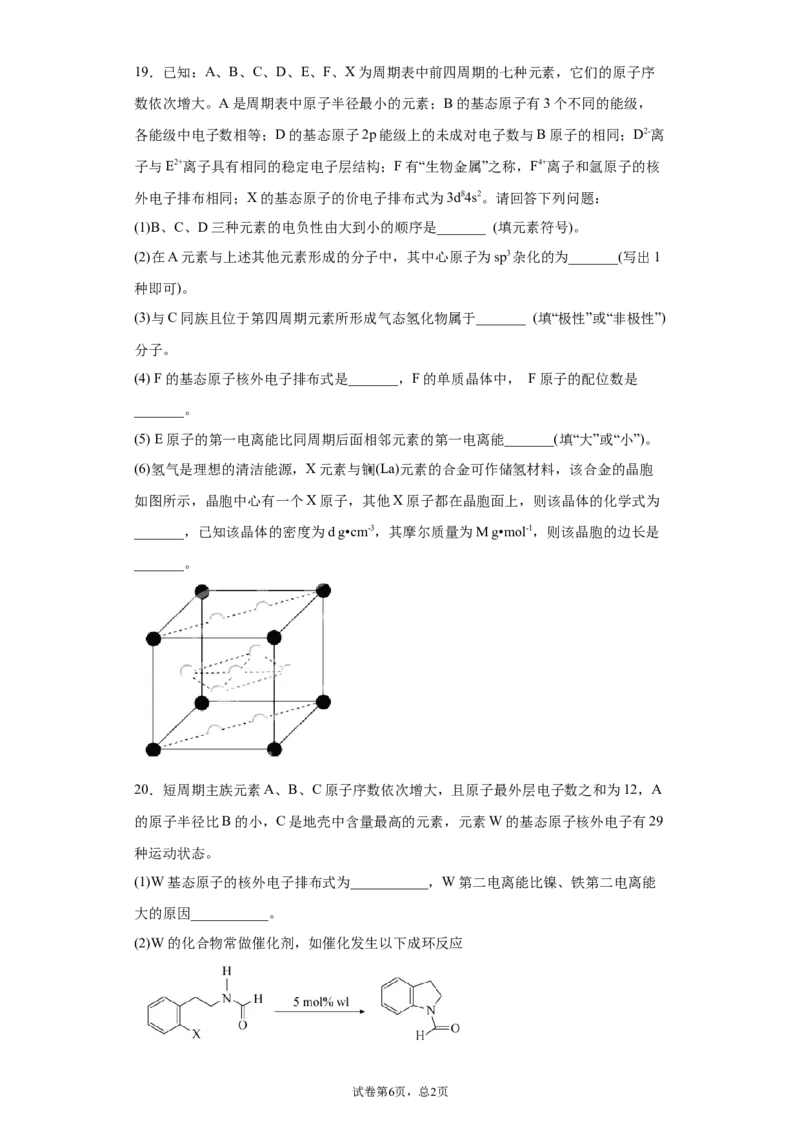
试卷第5页,总1页19.已知:A、B、C、D、E、F、X为周期表中前四周期的七种元素,它们的原子序
数依次增大。A是周期表中原子半径最小的元素;B的基态原子有3个不同的能级,
各能级中电子数相等;D的基态原子2p能级上的未成对电子数与B原子的相同;D2-离
子与E2+离子具有相同的稳定电子层结构;F有“生物金属”之称,F4+离子和氩原子的核
外电子排布相同;X的基态原子的价电子排布式为3d84s2。请回答下列问题:
(1)B、C、D三种元素的电负性由大到小的顺序是_______ (填元素符号)。
(2)在A元素与上述其他元素形成的分子中,其中心原子为sp3杂化的为_______(写出1
种即可)。
(3)与C同族且位于第四周期元素所形成气态氢化物属于_______ (填“极性”或“非极性”)
分子。
(4) F的基态原子核外电子排布式是_______,F的单质晶体中, F原子的配位数是
_______。
(5) E原子的第一电离能比同周期后面相邻元素的第一电离能_______(填“大”或“小”)。
(6)氢气是理想的清洁能源,X元素与镧(La)元素的合金可作储氢材料,该合金的晶胞
如图所示,晶胞中心有一个X原子,其他X原子都在晶胞面上,则该晶体的化学式为
_______,已知该晶体的密度为d g•cm-3,其摩尔质量为M g•mol-1,则该晶胞的边长是
_______。
20.短周期主族元素A、B、C原子序数依次增大,且原子最外层电子数之和为12,A
的原子半径比B的小,C是地壳中含量最高的元素,元素W的基态原子核外电子有29
种运动状态。
(1)W基态原子的核外电子排布式为___________,W第二电离能比镍、铁第二电离能
大的原因___________。
(2)W的化合物常做催化剂,如催化发生以下成环反应
试卷第6页,总2页上述反应,反应物中碳的杂化类型为___________。
(3)A、B、C的电负性由大到小的顺序为___________(请用元素符号表示)
(4)A与B形成的18电子分子为二元弱碱,写出在水中一级电离生成的阳离子的电子式
___________,A与C形成的简单化合物分子形状为___________,这种化合物在自然
界是以通过___________作用形成团簇分子。
四、原理综合题
21.NaCl是一种基础化工原料,通过电解饱和食盐水可以制得NaOH、H、Cl。
2 2
完成下列填空:
(1)写出电解饱和食盐水的化学方程式_____________________。
(2)氯原子的最外层电子排布式为_______,氯离子核外有_____种运动状态不同的电
子。
(3)氯气压缩成为液氯属于________变化(选填“物理”“化学”)。常用浓氨水来
检查输氯管道是否泄漏,泄漏处会观察到大量的白烟(NHCl),还生成一种无色无味
4
的单质气体,写出此反应的化学方程式并标出电子转移的方向和数目
__________________。
(4)氯气可用来标定碘水中碘单质的含量:5Cl+I+6HO→10HCl+2HIO。测定时可用
2 2 2 3
气体流量计准确控制氯气的体积,以淀粉做指示剂来指示反应终点,反应终点时的现
象是___________________。
用氯气标定一定体积碘水中碘单质的浓度,进行三次平行实验,数据记录见下表:
碘水的体积(mL) 标况下氯气的体积(mL)
500 56
500 55
500 57
则上述碘水中碘单质的浓度为____mol/L,假定碘水的实际浓度为1.02×10-3mol/L,则
实验的相对误差为_______(保留两位小数)。
试卷第7页,总1页参考答案
1.A
【详解】
A.总电子数为7,且符合电子排布规律,是最低能量状态,是基态氮原子的电子排布图,
A正确;
B.2p层电子的自旋方向不对,违背洪特规则,B错误;
C.2s层没有排满,违背能量最低原子,C错误;
D.电子只有5个,不是基态氮原子的电子排布图,D错误;
故选A。
2.C
【详解】
A. 不正确,该氯原子的质量数为37,不是20; B. 不正确,氯离子(Cl-)的核外有18个电
子 ,不是17;C. 氯分子的电子式 是正确的;D. 氯原子的外围电子排布式
1s22s22p63s23p5是不正确的,氯原子的外围电子是它的最外层电子,应为3s23p5。综上所述,
本题选C。
3.A
【详解】
A.元素的非金属性越强,稳定性越大,同周期元素从左到右元素的非金属性逐渐增强,则
对应的氢化物的稳定性逐渐增强,故A正确;B. Pb O 中铅元素的化合价为+2价和+4价,
3 4
则应写成2PbO·PbO,故B错误;C.因AlCl 为共价化合物,在熔融状态下不导电,故C错
2 3
误;D.金属晶体组成微粒为金属阳离子和自由电子,不含阴离子,故D错误;答案选A。
【点睛】
本题主要考查元素性质、物质结构等理论的一般规律,在掌握物质变化的一般规律的同时,
也要物质变化的特殊性,平衡好一般与特殊之间的关系。
4.B
【解析】
氯化铵受热分解破坏离子键和共价键,故A错误;干冰气化破坏分子间作用力,故B正确;
食盐熔化破坏离子键,故C错误;氯化氢溶于水破坏共价键,故D错误。
5.A
【详解】
答案第1页,总2页A.原子轨道中电子处于全空、半满、全满时较稳定,氮原子2p能级半充满,则氮原子的
第一电离能大于同一周期相邻的氧原子,故A正确;
B.SO 中S的价层电子对数=2+ =3,为sp2杂化,立体构型为V形,故B错误;
2
C.金刚石为原子晶体,石墨为混合型晶体,但石墨中共价键的键长比金刚石中共价键键
长短,键能更大,所以石墨的熔点比金刚石的高,故C错误;
D.卤族元素氢化物都属于分子晶体,分子晶体的沸点随着其相对分子质量的增大而增大,
但氟化氢分子间含有氢键,氯化氢中不含氢键,导致氟化氢沸点高于HCl,故D错误;
答案选A。
【点睛】
本题的易错点为C,要注意石墨为混合型晶体,层与层之间为分子间作用力,层内存在共
价键,石墨熔化时需要破坏层内的共价键。
6.A
【详解】
A. 元素种类最多的族是第ⅢB族,A错误;
B. 第ⅠA族金属元素均是活泼性很强的元素,单质均能与水反应,B正确;
C. 第ⅡA族是碱土金属元素,其中无非金属元素,C正确;
D. 元素周期表中大部分是金属元素,金属元素的种类比非金属元素多,D正确。
答案选A。
7.D
【详解】
A.将体积相同的Na和K分别投入冷水中,K与HO反应更剧烈,因同主族元素从上到到
2
下金属性逐渐增强,非金属性逐渐减弱,则金属性:K>Na;故A不符合题意;
B.将足量硫酸与NaPO 溶液混合,生成HPO ,说明硫酸可以制取HPO ,则硫酸的酸性
3 4 3 4 3 4
比磷酸的酸性强,根据最高价含氧酸的酸性强弱可以比较非金属性的强弱,则非金属性:
S>P,故B不符合题意;
C.分别加热HCl气体和HI气体,HI气体更易分解,根据同主族非金属元素从上到下非金
属性逐渐减弱,非金属氢化物的稳定性逐渐减弱,则稳定性:HCl>HI,故C不符合题意;
D.分别加热NaCO 固体和NaHCO 固体,NaHCO 固体更易分解,因为NaCO 属于正盐,
2 3 3 3 2 3
而NaHCO 属于酸式盐,二者不属于同一类别,没有可比性,所以不能用元素周期律来解
3
释,故D符合题意;
答案第2页,总2页故选D。
8.B
【详解】
A.根据构造原理判断,A项正确;
B.根据构造原理可知,3s与4s能级之间还有3p能级,B项错误;
C.电子最后填入的能级不一定是原子最外能层上的能级,如某些过渡元素,C项正确;
D.从M能层开始,电子填入的顺序是3s→3p→4s→3d……,与能层的顺序不同,D项正
确;
故选B。
9.D
【详解】
A.由物质的结构简式得出该有机物的分子式为 ,A项正确;
B.可通过键角来推断C原子的杂化方式,苯分子中的键角为120°,为平面结构,推知C
原子的杂化方式为 ,B项正确;
C.苯环结构中的原子共平面,利用单键旋转法,可使两个苯环上的原子共平面,即所有
原子可以共平面,C项正确;
D.该物质分子中含有两个苯环,一个苯环含有1个大π键, 键数目为 ;
则 该物质含有 键和 键,D项错误;
故选D。
10.B
【详解】
A.共价晶体中不一定存在极性共价键,如硅、金刚石等晶体中只存在非极性共价键,A
错误;
B.范德华力存在于所有分子晶体中,B正确;
C.硫黄晶体中分子间存在范德华力,而冰晶体中分子间除存在范德华力外,还存在氢键,
C错误;
D.很多分子晶体(如干冰等)中都存在共价键,D错误;
答案第3页,总2页故选B。
11.C
【详解】
A.同种非金属原子间形成非极性键,化合物中也可能含有非极性键,如过氧化氢中含有
O-O非极性键,A错误;
B.阴、阳离子间通过静电作用所形成的化学键是离子键,静电作用包含吸引力和排斥力,
B错误;
C.在固态水即冰中的的HO分子间存在氢键,非金属原子间通过共价键结合,则水分子
2
中O与H原子之间通过共价键结合,C正确;
D.物质的稳定性是化学性质,是由共价键的强弱决定的,元素的非金属性:Br<Cl,所
以HBr比HCl的热稳定性差,这与分子间作用力大小无关,D错误;
故合理选项是C。
12.C
【详解】
A.F、Cl、Br 、I 均为分子晶体,它们熔、沸点的高低与分子间作用力的大小有关;A
2 2 2 2
项错误;
B.物质的稳定性与化学键键能的大小有关,因为键能H—F>H—Cl>H—Br>H—I,
HF、HCl、HBr、HI分子的热稳定性逐渐减弱,HF分子间会形成氢键,所以熔点高低顺序
为:HF>HI>HBr>HCl,B项错误;
C.金刚石和晶体硅均为原子晶体,原子间共价键的键能越大,该原子晶体的硬度就越大,
熔沸点就越高,金刚石中的C—C键的键能大于晶体硅中Si—Si键的键能,C项正确;
D.NaF、NaCl、NaBr、NaI均为离子化合物,其晶体是离子晶体,离子晶体熔点的高低与
晶格能的大小有关,D项错误;
答案选C。
13.A
【详解】
A. 碳原子的最外层电子的轨道表示式:2s能级排满后再排2p能级,
,故A错误;
答案第4页,总2页B.OH-是阴离子,是原子团,要加括号, OH-的电子式: ,故B正确;
C. 硫离子核外有18个电子,排在三个电子层中,电子排布式:1s22s22p63s23p6,故C正确;
D. 碳-12原子,有6个质子、6个中子: C,故D正确;
故选A。
14.D
【详解】
钠离子核内有11个质子,核外有10个电子,其离子结构示意图为 ,故答案为
D。
15.D
【解析】A,NO 中N元素的化合价为+4价,N元素化合价的绝对值+5=9,NO 中N原子
2 2
的最外层不满足8e-结构,SO 中S元素的化合价为+4价,S元素化合价的绝对值+6=10,
2
SO 中S原子的最外层不满足8e-结构,BF 中B元素的化合价为+3价,B元素化合价的绝
2 3
对值+3=6,BF 中B原子的最外层不满足8e-结构,NCl 的电子式为 ,NCl 分子
3 3 3
中N原子、Cl原子的最外层电子都满足8e-稳定结构,A项错误;B,P 为正四面体结构,
4
4 个 P 原子处于正四面体的 4 个顶点,键角为 60º,CH 为正四面体结构,键角为
4
109º28′,B项错误;C,SO 中S上的孤电子对数为 (6-2 2)=1,S的价层电子对数
2
为1+2=3,SO 的VSEPR模型为平面三角形,由于S上有1对孤对电子,SO 是V形分子,
2 2
CO 是直线形分子,C项错误;D,CH=CH 中有4个C-H键,1个C=C键,单键全为σ
2 2 2
键,双键中有1个σ键和1个π键,CH=CH 分子共有五个σ键和一个π键,D项正确;
2 2
答案选D。
点睛:本题考查8e-稳定结构的判断、分子的空间构型、σ键和π键的判断。含H原子的
分子不可能所有原子都满足8e-,对AB 型分子可用下列方法判断分子中原子是否满足
n
8e-:元素化合价的绝对值与该元素原子最外层电子数之和为8时该原子满足8e-,反之不满
足。注意P 与CH 分子结构的区别。
4 4
答案第5页,总2页16.B
【详解】
A.CCl 、SiCl 、SiH 中所有的原子的价层电子对数都为4,杂化方式为sp3杂化,键角都
4 4 4
是109o28´,A错误;
B.HS中S原子的价层电子对数为2+ (6-2×1)=4,杂化方式为sp3杂化,NF 中N原子的
2 3
价层电子对数为3+ (5-3×1)=4,杂化方式为sp3杂化,CH 中C原子的杂化方式为sp3杂化,
4
由于分子中孤电子对的数目不同,分子间的夹角不同,B正确;
C.BCl 、NH 、CO 分子中的中心原子的杂化方式不同,C错误;
3 3 2
D.SO 、BF 中的S和B都采用sp2杂化,HO+用的是sp3杂化,D错误;
3 3 3
答案选B。
17. BCE (Co)和 (Ni)分别指失去 和 上的一个电子所需能量,
处于半充满稳定状态,需要的能量较高 Sn与C同主族,Sn原子半径大,
键的键长长,键能小,故灰锡不如金刚石稳定
【详解】
(1)铜为29号元素,其基态Cu原子的价电子排布 。
(2)镍的氨合离子 中氨气分子中存在共价单键,单键就是 键,镍离子和氨
气之间存在配位键。
(3) (Co)和 (Ni)分别指失去 和 上的一个电子所需能量, 处于半充满稳定状
答案第6页,总2页态,需要的能量较高;
(4) Sn与C同主族,Sn原子半径大, 键的键长长,键能小,故灰锡不如金刚石
稳定。
(5)①硒化锌晶胞中相邻的 与 之间的距离晶胞体对角线长度的四分之一,而晶胞
体对角线的常数为晶胞棱长的 倍,故之间的距离为为 pm。
②根据硒化锌晶胞中相邻的 与 之间的距离晶胞体对角线长度的四分之一分析,A
点为(0,0,0),B点为(1,1,1),则C点的原子坐标 。
③根据均摊法分析,一个晶胞中锌原子的个数为4,硒原子个数为
,所以晶胞的质量为
,故 ,可得阿伏加德罗常数
。
18.N 球形 +2 1s22s22p63s23p64s2或[Ar] 4s2 sp3 109°28′ F>O>P
BC 12
【分析】
(1) 基态K原子共有4给电子层,最高能层位N;价层电子排布式为4s1;
答案第7页,总2页(2) M的第三电离能远远大于第二电离能,该元素最外层有2个电子;
(3) 根据价层电子互斥理论确定 杂化方式及空间构型;
(4)Ca (PO )F中非金属元素为P、O、F,同周期主族元素自左而右电负性增大,同主族自
3 4 3
上而下电负性减小;
(5) A. 同周期元素的第一电离能有增大的趋势,价层电子处于充满或半充满状态时,第一
电离能大于其后元素的;
B. 键合原子的电子亲合能或电负性的差值越大,极性越大;
C. 离子半径越小,键长越短,晶格能越大;
D. 金属阳离子的半径越小,其碳酸盐的热稳定性越弱;
(6)构成二氧化硅晶体结构的最小环是六元环,根据密度公式 计算晶体密度。
【详解】
(1) 基态K原子共有4给电子层,最高能层位N;价层电子排布式为4s1,该能层电子云轮
廓为球形,故答案为:N;球形;
(2) M的第三电离能远远大于第二电离能,说明该元素失去2个电子时为稳定结构,则该元
素最外层有2个电子,则M为Ca,元素M化合态常见化合价是+2,其基态原子电子排布
式为:1s22s22p63s23p64s2或[Ar] 4s2,故答案为:+2;1s22s22p63s23p64s2或[Ar] 4s2;
(3) 的中心原子P的孤电子对数为:1/2(a-xb)=1/2(5+3-2×4)=0,价层电子对数为:
4+0=4,P原子杂化方式为sp3杂化,空间构型为正四面体,键角为109°28′,故答案为:
sp3;109°28′;
(4)Ca (PO )F中非金属元素为P、O、F,同周期主族元素自左而右电负性增大,同主族自
3 4 3
上而下电负性减小,所以电负性:F>O>P,故答案为:F>O>P;
(5) A. 同周期元素的第一电离能有增大的趋势,价层电子处于全充满或半充满状态时,第
一电离能大于其后元素的第一电离能,则Cl>P>S>Si,A错误;
B. 键合原子的电子亲合能或电负性的差值越大,极性越大,则共价键的极性:HF>HCl>
HBr>HI,B正确;
C. 离子半径越小,键长越短,晶格能越大,则晶格能:NaF>NaCl>NaBr>NaI,C正确;
D. 金属阳离子的半径越小,其碳酸盐的热稳定性越弱,则热稳定性:BaCO >SrCO >
3 3
CaCO >MgCO ,D错误;故答案为:BC。
3 3
答案第8页,总2页(6)构成二氧化硅晶体结构的最小环是六元环,其中有6个Si原子和6个O原子,所以构成
二氧化硅晶体结构的最小环是由12个原子构成;1个晶胞中含有Si原子的数目为:
8×1/8+6×1/2+4=8,含有O原子的数目为:16,则根据公式: ,其晶胞的密度为:
,故答案为:12; 。
【点睛】
中心原子的孤电子对数=1/2(a-xb);中心原子的价层电子对数=孤电子对数+ 键。中心
原子的价层电子对数=2,为sp杂化;中心原子的价层电子对数=3,为sp2杂化;中心原子
的价层电子对数=4,为sp3杂化。
19.O>N>C CH 或HO 极性 1s22s22p63s23p63d24s2 12 大 Ni La
4 2 5
cm
【分析】
由A是周期表中原子半径最小的元素,所以A为:H;根据B的基态原子有3个不同的能
级,各能级中电子数相等得出B是1s2 2s2 2p2,故B为:C;根据D的基态原子2p能级上
的未成对电子数与B原子相同,故D为:O;依据A、B、C、D、E原子序数逐渐增大,
可知C为:N;D2-离子与E2+离子具有相同的稳定电子层结构,则E是Mg.F4+离子和氩原
子的核外电子排布相同,则F为22号元素:Ti;X的基态原子的外围电子排布式为
3d84s2,则X是Ni,据此分析解答。
【详解】
(1)B、C、D为同一周期元素,同周期从左到右电负性依次增强,所以O>N>C,故答案
为:O>N>C;
(2)中心原子通过sp3杂化形成分子,则说明中心原子含有4个价电子对,价层电子对数=σ
键个数+ (a-xb),则CH、HO都含有4个价电子对,故答案为:CH、HO;
4 2 4 2
(3)与氮元素同主族的第四周期元素是As,AsH ,其氢化物为其结构与氨气相似,所以其
3
氢化物是极性分子,故答案为:极性;
答案第9页,总2页(4)F为22号元素:Ti,其核外有22个电子,电子排布式为1s22s22p63s23p63d24s2,Ti晶体的
原子堆积模型属于Mg型为六方最密堆积,配位数为12;故答案为:1s22s22p63s23p63d24s2;
12;
(5)Mg的最外层电子排布为3s2,属于能量最低的全排满结构,不易失去电子,所以第一电
离能大,故答案为:大;
(6)该合金的晶胞如图所示,晶胞中心有一个镍原子,其他8个镍原子都在晶胞面上,镧原
子都在晶胞顶点.所以晶胞实际含有的镍原子为1+8× =5,晶胞实际含有的镧原子为8×
=1,所以晶体的化学式Ni La;晶胞的质量为 ,根据ρ= ,V=a3,则ρ= ,
5
所以a= cm;故答案为:Ni La; cm。
5
20.1s22s22p63s23p63d104s1 当铜失去一个电子后达到3d10为全满稳定结构,失去电子需
要的能量多 sp2 sp3 O>N>H V形 氢键
【分析】
C是地壳中含量最高的元素,则C为O元素,A、B、C均为短周期主族元素,且原子序数
依次增大,A的原子半径比B的小,则A是H元素,又3种原子最外层电子数之和为12,
则B为N元素,元素W的基态原子核外电子有29种运动状态,则W为Cu元素,据此分
析解答。
【详解】
(1)元素W是Cu,Cu的基态原子的核外电子排布式为1s22s22p63s23p63d104s1,Cu的第二电
离能比镍、铁大的原因是当铜失去一个电子后达到3d10为全满稳定结构,失去电子需要的
能量多;
(2) 中苯环上和羰基上的碳都是sp2杂化,其他位置的饱和碳
原子是sp3杂化;
答案第10页,总2页(3)A是H元素,B为N元素,C为O元素,则A、B、C的电负性由大到小的顺序为O>N
>H;
(4)A与B形成的18电子分子为NH,结合水电离出的一个H+,同时产生OH-,溶液显碱
2 4
性,NH 的一级电离方程式为 ,所得的阳离子为 ,其
2 4
电子式为 ;A与C形成的简单化合物为HO,分子形状为V形,水分子通
2
过氢键作用而聚合在一起,形成水分子簇。
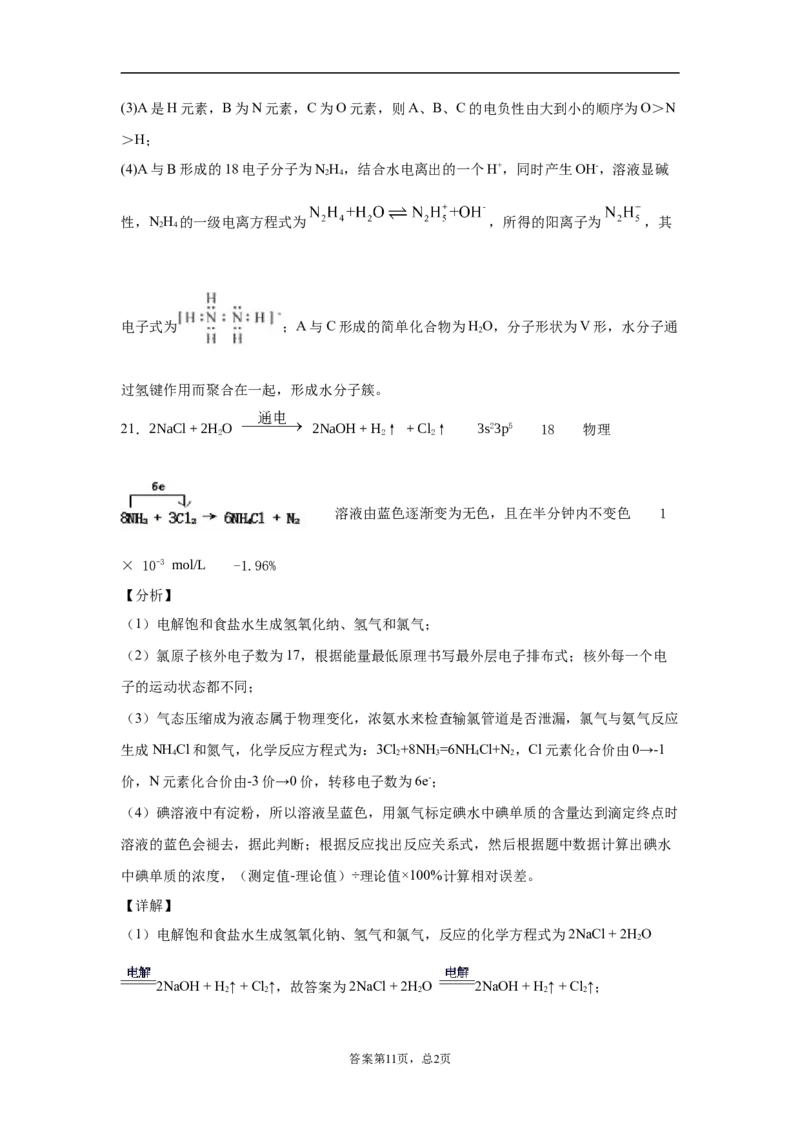
21.2NaCl + 2H O 2NaOH + H ↑ + Cl ↑ 3s23p5 18 物理
2 2 2
溶液由蓝色逐渐变为无色,且在半分钟内不变色 1
× 10-3 mol/L -1.96%
【分析】
(1)电解饱和食盐水生成氢氧化纳、氢气和氯气;
(2)氯原子核外电子数为17,根据能量最低原理书写最外层电子排布式;核外每一个电
子的运动状态都不同;
(3)气态压缩成为液态属于物理变化,浓氨水来检查输氯管道是否泄漏,氯气与氨气反应
生成NH Cl和氮气,化学反应方程式为:3Cl+8NH=6NHCl+N ,Cl元素化合价由0→-1
4 2 3 4 2
价,N元素化合价由-3价→0价,转移电子数为6e-;
(4)碘溶液中有淀粉,所以溶液呈蓝色,用氯气标定碘水中碘单质的含量达到滴定终点时
溶液的蓝色会褪去,据此判断;根据反应找出反应关系式,然后根据题中数据计算出碘水
中碘单质的浓度,(测定值-理论值)÷理论值×100%计算相对误差。
【详解】
(1)电解饱和食盐水生成氢氧化钠、氢气和氯气,反应的化学方程式为2NaCl + 2H O
2
2NaOH + H ↑ + Cl ↑,故答案为2NaCl + 2H O 2NaOH + H ↑ + Cl ↑;
2 2 2 2 2
答案第11页,总2页(2)氯是17号元素,原子的最外层电子排布式为3s23p5,氯离子核外有18种运动状态不
同的电子,故答案为3s23p5;18;
(3)氯气压缩成为液氯是状态的变化,属于物理变化;浓氨水来检查输氯管道是否泄漏,
泄漏处会观察到大量的白烟(NH Cl),还生成一种无色无味的单质气体为氮气,反应的
4
化学方程式和电子转移的方向和数目表示为 ,故答案为物理;
;
(4)根据5Cl + I + 6H O → 10HCl + 2HIO ,以淀粉做指示剂来指示反应终点,反应终
2 2 2 3
点时溶液由蓝色逐渐变为无色,且在半分钟内不变色;三次的平均体积为56 mL,根据
5Cl + I + 6H O → 10HCl + 2HIO ,n(I)= n(Cl )= × =5×10-4mol,c(I )=
2 2 2 3 2 2 2
= 1 × 10-3 mol/L,实验的相对误差= ×100%=
-1.96%,故答案为溶液由蓝色逐渐变为无色,且在半分钟内不变色;1 × 10-3 mol/L;
-1.96%。
答案第12页,总2页