文档内容
期末复习检测卷二
一、单选题
1.(2023秋·湖南长沙·高二长沙市实验中学校考期末)下列各原子或离子的电子排布
式或电子排布图表示正确的是
A. B.
C. D. 最外层电子排布图为
2.(2023春·湖南湘潭·高三湘潭一中校考开学考试)X、Y、W、N是原子序数依次增
大的短周期主族元素,X原子的核外电子只有一种运动状态,Y的最外层电子数为其
轨道电子数的3倍,W与Y位于同一主族。下列叙述正确的是
A.简单离子半径:
B.W、N的最高价氧化物对应水化物的酸性:
C.最简单氢化物的沸点:
D. 分子中只含极性共价键
3.(2023秋·河北唐山·高二统考期末)某元素基态原子价层电子排布式为3d24s2,下
列说法正确的是
A.该元素原子处于能量最低状态时,原子中共有4个未成对电子
B.该元素基态原子核外有4个能层被电子占据
C.该元素原子的M层共有8个电子
D.该元素原子的最外层共有4个电子
4.(2023·江苏南通·统考一模)X、Y、Z、W、Q是原子序数依次增大且不超过20的
主族元素。X是地壳中含量最多的元素,Y基态原子核外s能级和p能级电子数相等,
Z与X同主族,Q的焰色试验呈紫色。列说法正确的是
A.简单离子半径;
B.X的第一电离能比同周期的相邻元素的大
C.Z的简单气态氢化物的热稳定性比W的强
D.Q最高价氧化物对应水化物的碱性比Y的弱
5.(2023·广东茂名·统考一模)我国科学家合成了一种深紫外非线性光学晶体新材料,晶体中阴离子为 。元素M、X、Y、Z均为短周期元素,M、Y与
Z同周期,M的最外层电子数比次外层电子数多1,Z为电负性最强的元素,Y是地壳
中含量最高的元素,X的 轨道有3个电子。下列说法中不正确的是
A.电负性: B.简单离子半径:
C.简单气态氢化物的稳定性: D.M最高价氧化物对应水化物能与盐酸
反应
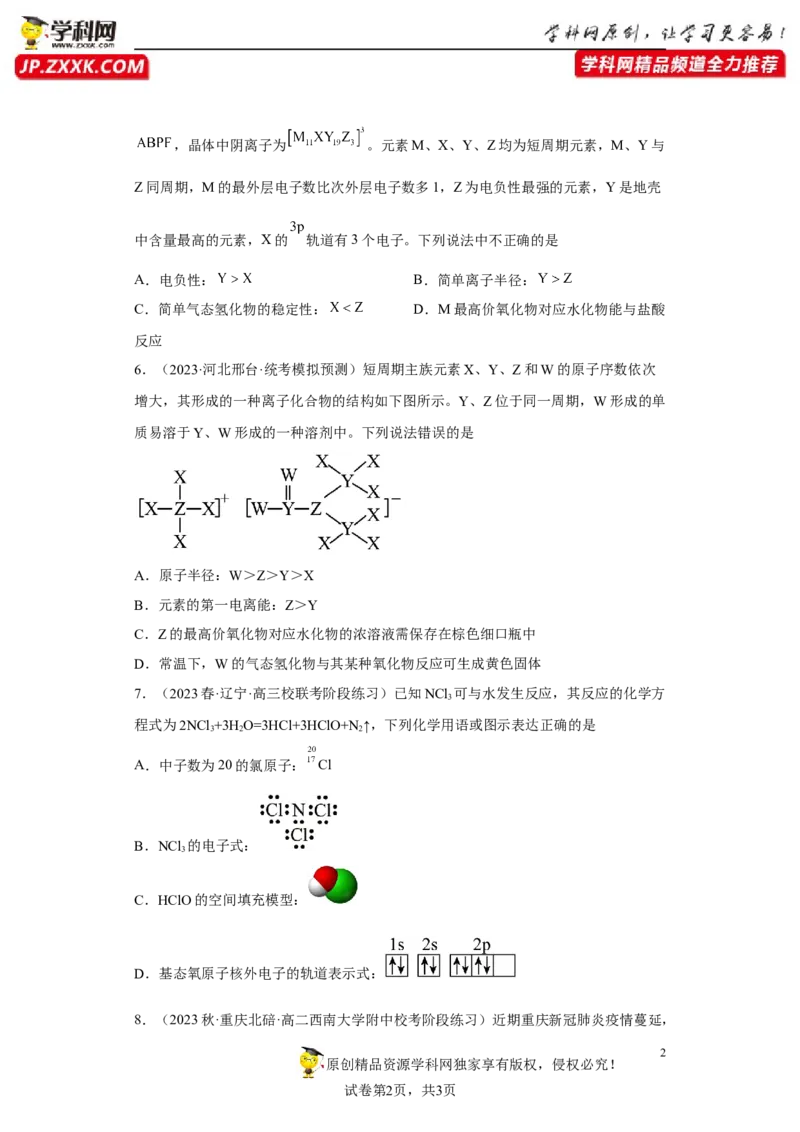
6.(2023·河北邢台·统考模拟预测)短周期主族元素X、Y、Z和W的原子序数依次
增大,其形成的一种离子化合物的结构如下图所示。Y、Z位于同一周期,W形成的单
质易溶于Y、W形成的一种溶剂中。下列说法错误的是
A.原子半径:W>Z>Y>X
B.元素的第一电离能:Z>Y
C.Z的最高价氧化物对应水化物的浓溶液需保存在棕色细口瓶中
D.常温下,W的气态氢化物与其某种氧化物反应可生成黄色固体
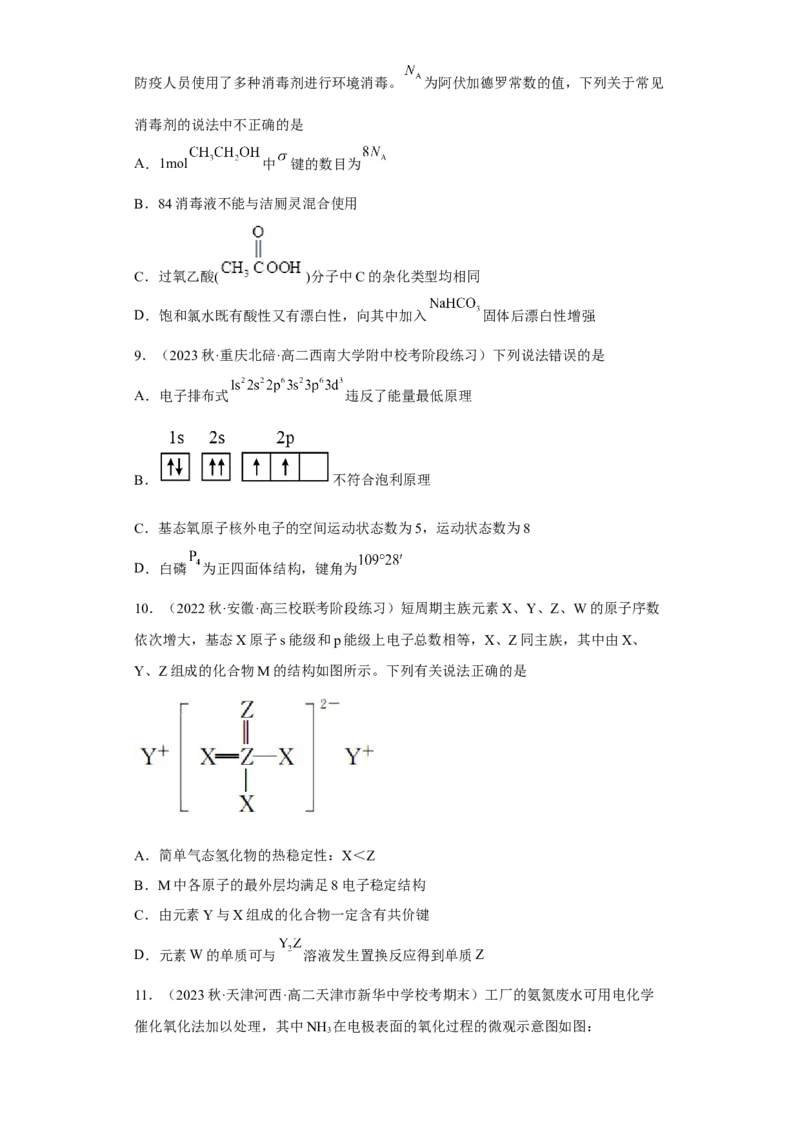
7.(2023春·辽宁·高三校联考阶段练习)已知NCl 可与水发生反应,其反应的化学方
3
程式为2NCl +3H O=3HCl+3HClO+N ↑,下列化学用语或图示表达正确的是
3 2 2
A.中子数为20的氯原子: Cl
B.NCl 的电子式:
3
C.HClO的空间填充模型:
D.基态氧原子核外电子的轨道表示式:
8.(2023秋·重庆北碚·高二西南大学附中校考阶段练习)近期重庆新冠肺炎疫情蔓延,
2
原创精品资源学科网独家享有版权,侵权必究!
试卷第2页,共3页防疫人员使用了多种消毒剂进行环境消毒。 为阿伏加德罗常数的值,下列关于常见
消毒剂的说法中不正确的是
A.1mol 中 键的数目为
B.84消毒液不能与洁厕灵混合使用
C.过氧乙酸( )分子中C的杂化类型均相同
D.饱和氯水既有酸性又有漂白性,向其中加入 固体后漂白性增强
9.(2023秋·重庆北碚·高二西南大学附中校考阶段练习)下列说法错误的是
A.电子排布式 违反了能量最低原理
B. 不符合泡利原理
C.基态氧原子核外电子的空间运动状态数为5,运动状态数为8
D.白磷 为正四面体结构,键角为
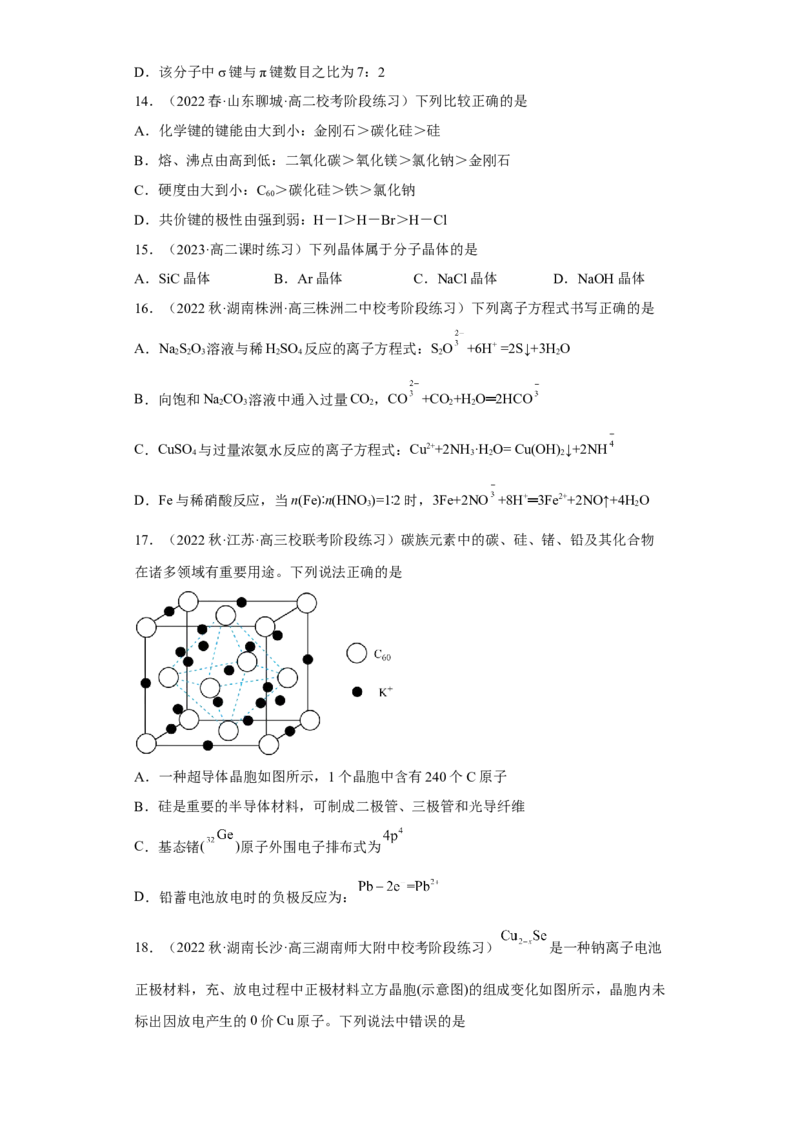
10.(2022秋·安徽·高三校联考阶段练习)短周期主族元素X、Y、Z、W的原子序数
依次增大,基态X原子s能级和p能级上电子总数相等,X、Z同主族,其中由X、
Y、Z组成的化合物M的结构如图所示。下列有关说法正确的是
A.简单气态氢化物的热稳定性:X<Z
B.M中各原子的最外层均满足8电子稳定结构
C.由元素Y与X组成的化合物一定含有共价键
D.元素W的单质可与 溶液发生置换反应得到单质Z
11.(2023秋·天津河西·高二天津市新华中学校考期末)工厂的氨氮废水可用电化学
催化氧化法加以处理,其中NH 在电极表面的氧化过程的微观示意图如图:
3下列说法中,不正确的是
A.过程①②均有N-H键断裂
B.过程③的电极反应式为:
C.过程④中没有非极性键形成
D.催化剂可以降低该反应的活化能
12.(2022秋·湖北武汉·高二华中师大一附中校考期中)下列叙述正确的个数是
①稀有气体原子与同周期ⅠA、ⅡA族元素的简单阳离子具有相同的核外电子排布
②第n主族元素其最高价氧化物分子式为R O,氢化物分子式为RH (n≥4)
2 n n
③若R2﹣和M+的电子层结构相同,则原子序数:R>M
④含有共价键的化合物一定是共价化合物
⑤共价化合物中不可能含有离子键
⑥键角大小SO >SO>SO >SO
3 2
⑦由于非金属性:F>Cl>Br>I,所以酸性:HF>HCl>HBr>HI
⑧HF分子很稳定是由于HF分子之间能形成氢键
⑨分子极性HF>HCl>HBr>HI
⑩熔沸点HF<HCl<HBr<HI
A.1 B.2 C.3 D.4
13.(2022秋·湖北武汉·高二华中师大一附中校考期中)法匹拉韦是治疗新冠肺炎的
一种药物,其结构简式如图所示。下列说法错误的是
A.该分子中所含元素中电负性最小的是H
B.该分子中C﹣F键的键能大于C﹣N键的键能
C.该分子中所有C原子都为sp2杂化
4
原创精品资源学科网独家享有版权,侵权必究!
试卷第4页,共3页D.该分子中σ键与π键数目之比为7:2
14.(2022春·山东聊城·高二校考阶段练习)下列比较正确的是
A.化学键的键能由大到小:金刚石>碳化硅>硅
B.熔、沸点由高到低:二氧化碳>氧化镁>氯化钠>金刚石
C.硬度由大到小:C >碳化硅>铁>氯化钠
60
D.共价键的极性由强到弱:H-I>H-Br>H-Cl
15.(2023·高二课时练习)下列晶体属于分子晶体的是
A.SiC晶体 B.Ar晶体 C.NaCl晶体 D.NaOH晶体
16.(2022秋·湖南株洲·高三株洲二中校考阶段练习)下列离子方程式书写正确的是
A.NaSO 溶液与稀HSO 反应的离子方程式:SO +6H+ =2S↓+3H O
2 2 3 2 4 2 2
B.向饱和NaCO 溶液中通入过量CO,CO +CO +H O═2HCO
2 3 2 2 2
C.CuSO 与过量浓氨水反应的离子方程式:Cu2++2NH·H O= Cu(OH) ↓+2NH
4 3 2 2
D.Fe与稀硝酸反应,当n(Fe)∶n(HNO)=1∶2时,3Fe+2NO +8H+═3Fe2++2NO↑+4HO
3 2
17.(2022秋·江苏·高三校联考阶段练习)碳族元素中的碳、硅、锗、铅及其化合物
在诸多领域有重要用途。下列说法正确的是
A.一种超导体晶胞如图所示,1个晶胞中含有240个C原子
B.硅是重要的半导体材料,可制成二极管、三极管和光导纤维
C.基态锗( )原子外围电子排布式为
D.铅蓄电池放电时的负极反应为:
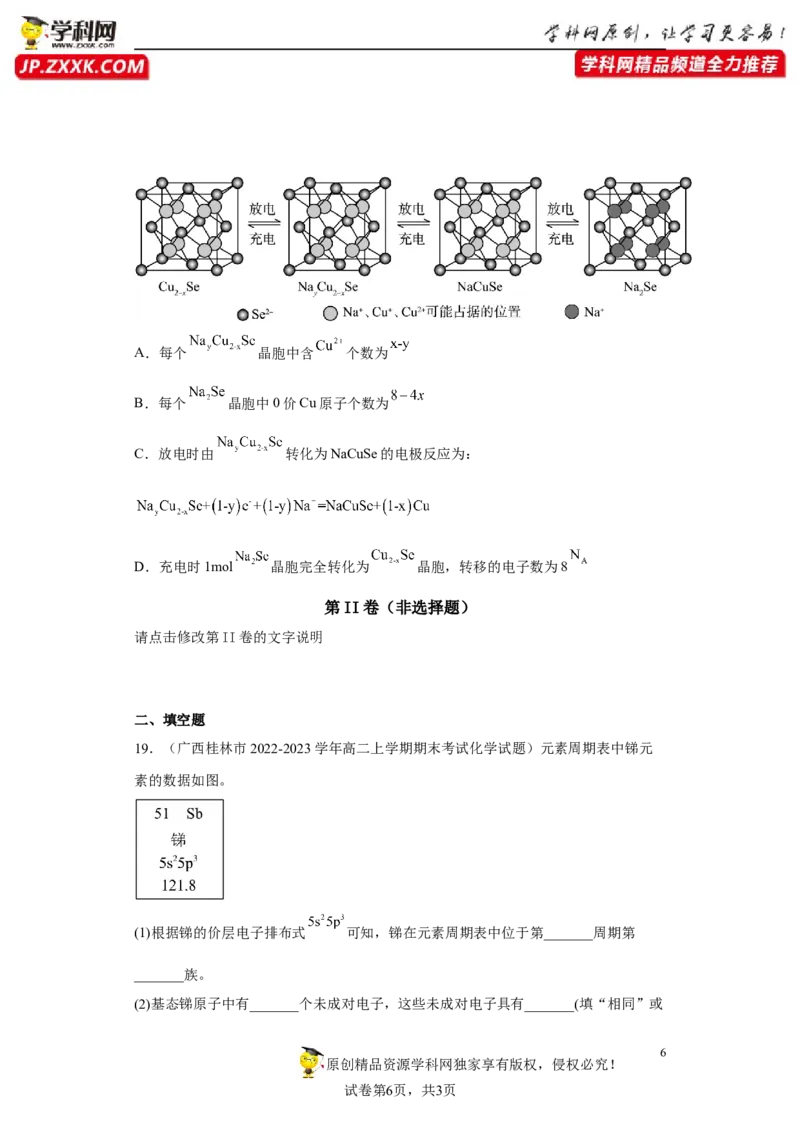
18.(2022秋·湖南长沙·高三湖南师大附中校考阶段练习) 是一种钠离子电池
正极材料,充、放电过程中正极材料立方晶胞(示意图)的组成变化如图所示,晶胞内未
标出因放电产生的0价Cu原子。下列说法中错误的是A.每个 晶胞中含 个数为
B.每个 晶胞中0价Cu原子个数为
C.放电时由 转化为NaCuSe的电极反应为:
D.充电时1mol 晶胞完全转化为 晶胞,转移的电子数为8
第II卷(非选择题)
请点击修改第II卷的文字说明
二、填空题
19.(广西桂林市2022-2023学年高二上学期期末考试化学试题)元素周期表中锑元
素的数据如图。
(1)根据锑的价层电子排布式 可知,锑在元素周期表中位于第_______周期第
_______族。
(2)基态锑原子中有_______个未成对电子,这些未成对电子具有_______(填“相同”或
6
原创精品资源学科网独家享有版权,侵权必究!
试卷第6页,共3页“不同”)的自旋状态。
(3)基态锑原子的5s轨道形状为_______形;该原子最外层电子占有_______个轨道。
(4)Bi在元素周期表中与Sb相邻,位于Sb的正下方。
①下列推断正确的是_______。
a.电负性:Sb>Bi b.原子半径:Sb>Bi c.金属性:Sb>Bi d.氧化性:
②第一电离能 _______(填“大于”或“小于”) ,原因是_______。
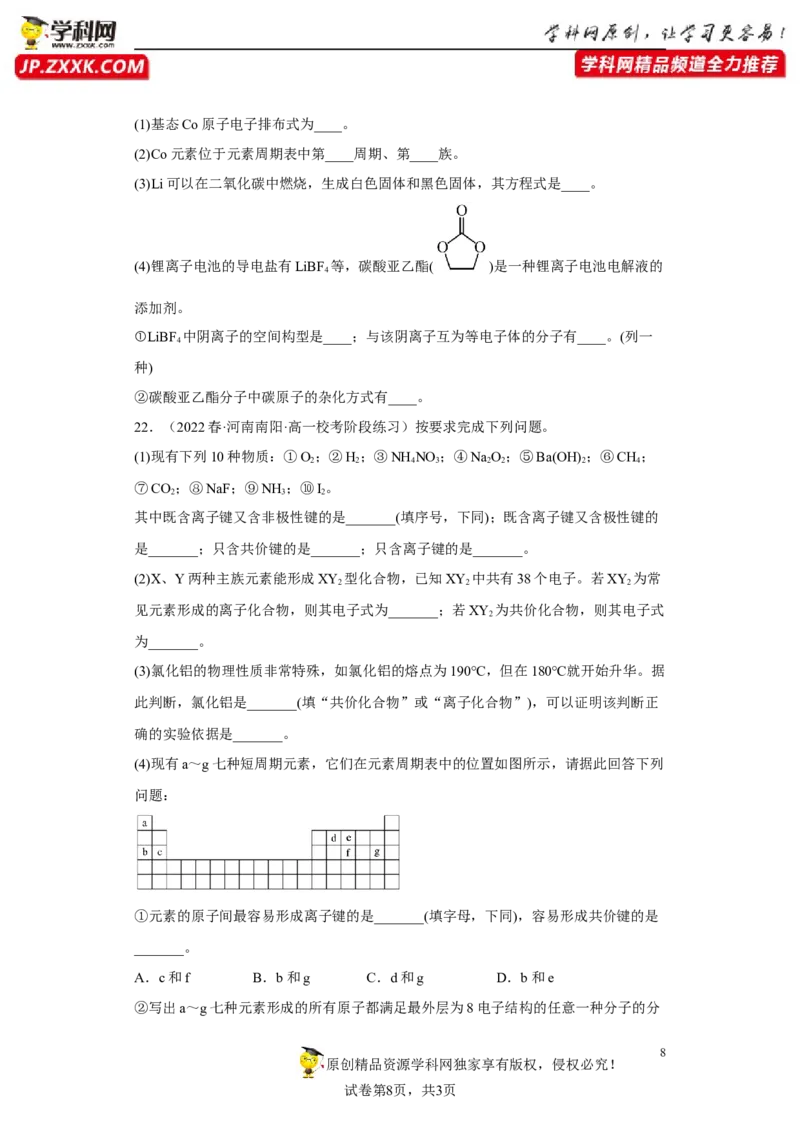
20.(2023秋·广西北海·高一统考期末)根据所学习的元素周期表的相关知识,回答
下列问题:
(1)在上面元素周期表中,全部是金属元素的区域为___________(填字母)。
A.Ⅰ区 B.Ⅱ区 C.Ⅲ区 D.Ⅳ区
(2)写出a~h中,金属性最强的元素的原子结构示意图:___________。
(3)已知某粒子的结构示意图为 ,试回答:
当 , 时,该粒子为___________(填“原子”“阳离子”或“阴离子”),该
元素为周期表中的___________(填上面表格中标注的字母)。
(4)d元素与c元素形成的化合物中可用作呼吸面具内的供氧剂的是___________(填化学
式),它与 反应的化学方程式是___________。
(5)q、h元素对应单质与氢气反应的剧烈程度:___________>___________(写出元素
对应单质的化学式)。
21.(2022春·海南省直辖县级单位·高二校考期末)2019年诺贝尔化学奖由来自美、
英、日的三人分获,以表彰他们在锂离子电池研究方面做出的贡献,他们最早发明用
LiCoO 作离子电池的正极,用聚乙炔作负极。回答下列问题:
2(1)基态Co原子电子排布式为____。
(2)Co元素位于元素周期表中第____周期、第____族。
(3)Li可以在二氧化碳中燃烧,生成白色固体和黑色固体,其方程式是____。
(4)锂离子电池的导电盐有LiBF 等,碳酸亚乙酯( )是一种锂离子电池电解液的
4
添加剂。
①LiBF 中阴离子的空间构型是____;与该阴离子互为等电子体的分子有____。(列一
4
种)
②碳酸亚乙酯分子中碳原子的杂化方式有____。
22.(2022春·河南南阳·高一校考阶段练习)按要求完成下列问题。
(1)现有下列10种物质:①O;②H;③NH NO ;④NaO;⑤Ba(OH) ;⑥CH;
2 2 4 3 2 2 2 4
⑦CO;⑧NaF;⑨NH ;⑩I。
2 3 2
其中既含离子键又含非极性键的是_______(填序号,下同);既含离子键又含极性键的
是_______;只含共价键的是_______;只含离子键的是_______。
(2)X、Y两种主族元素能形成XY 型化合物,已知XY 中共有38个电子。若XY 为常
2 2 2
见元素形成的离子化合物,则其电子式为_______;若XY 为共价化合物,则其电子式
2
为_______。
(3)氯化铝的物理性质非常特殊,如氯化铝的熔点为190℃,但在180℃就开始升华。据
此判断,氯化铝是_______(填“共价化合物”或“离子化合物”),可以证明该判断正
确的实验依据是_______。
(4)现有a~g七种短周期元素,它们在元素周期表中的位置如图所示,请据此回答下列
问题:
①元素的原子间最容易形成离子键的是_______(填字母,下同),容易形成共价键的是
_______。
A.c和f B.b和g C.d和g D.b和e
②写出a~g七种元素形成的所有原子都满足最外层为8电子结构的任意一种分子的分
8
原创精品资源学科网独家享有版权,侵权必究!
试卷第8页,共3页子式:_____。
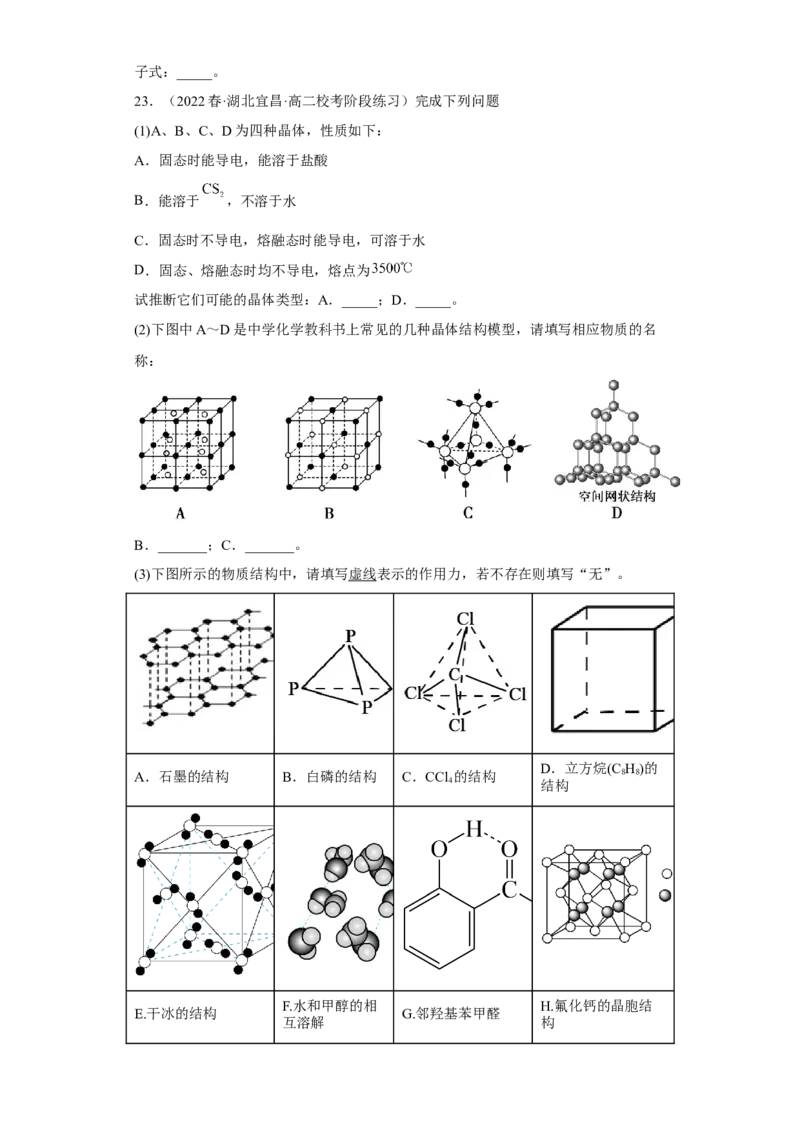
23.(2022春·湖北宜昌·高二校考阶段练习)完成下列问题
(1)A、B、C、D为四种晶体,性质如下:
A.固态时能导电,能溶于盐酸
B.能溶于 ,不溶于水
C.固态时不导电,熔融态时能导电,可溶于水
D.固态、熔融态时均不导电,熔点为
试推断它们可能的晶体类型:A._____;D._____。
(2)下图中A~D是中学化学教科书上常见的几种晶体结构模型,请填写相应物质的名
称:
B._______;C._______。
(3)下图所示的物质结构中,请填写虚线表示的作用力,若不存在则填写“无”。
D.立方烷(C H)的
A.石墨的结构 B.白磷的结构 C.CCl 的结构 8 8
4 结构
F.水和甲醇的相 H.氟化钙的晶胞结
E.干冰的结构 G.邻羟基苯甲醛
互溶解 构A._______;B._______;C._______;F. _______。
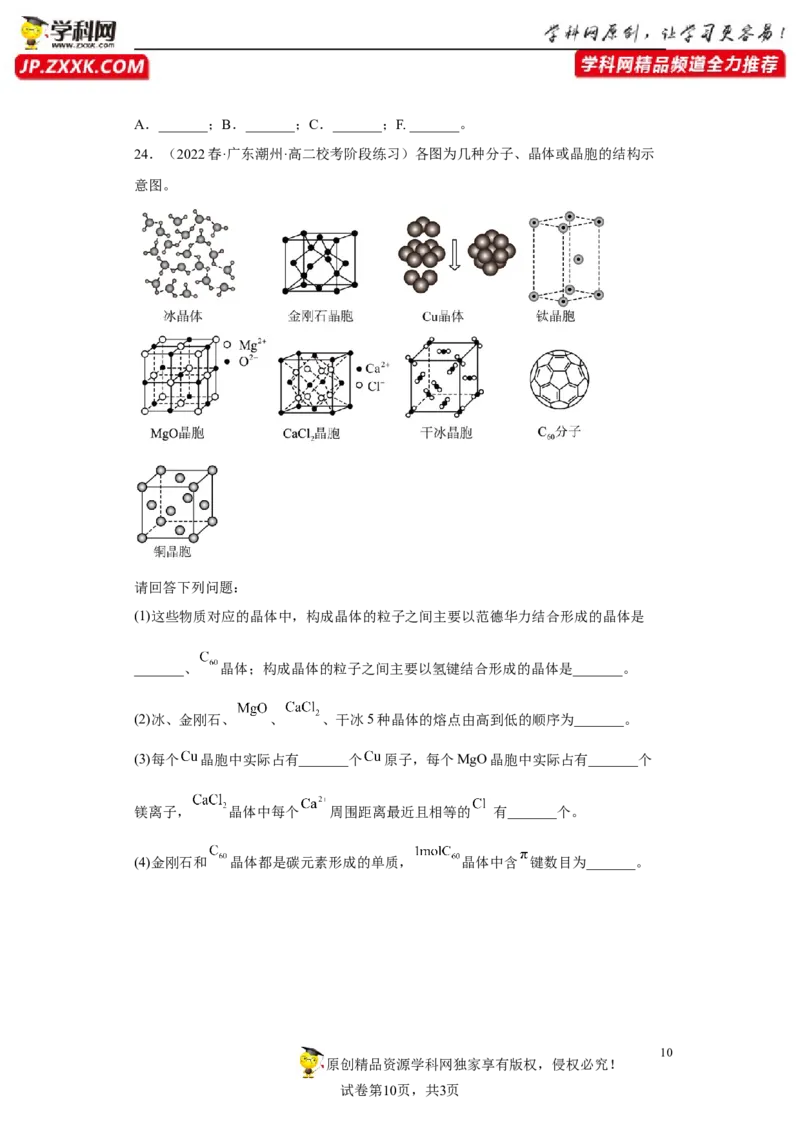
24.(2022春·广东潮州·高二校考阶段练习)各图为几种分子、晶体或晶胞的结构示
意图。
请回答下列问题:
(1)这些物质对应的晶体中,构成晶体的粒子之间主要以范德华力结合形成的晶体是
_______、 晶体;构成晶体的粒子之间主要以氢键结合形成的晶体是_______。
(2)冰、金刚石、 、 、干冰5种晶体的熔点由高到低的顺序为_______。
(3)每个 晶胞中实际占有_______个 原子,每个MgO晶胞中实际占有_______个
镁离子, 晶体中每个 周围距离最近且相等的 有_______个。
(4)金刚石和 晶体都是碳元素形成的单质, 晶体中含 键数目为_______。
10
原创精品资源学科网独家享有版权,侵权必究!
试卷第10页,共3页