文档内容
高三期初考 化学
可能用到的相对原子质量:H 1 B 11 C 12 N 14 O 16 Na 23 S 32 Cl 35.5 Fe 56 Co
59 Ag 108
一、选择题:本题共10小题,每小题2分,共20分.每小题只有一个选项符合题意.
1.化学与生产生活密切相关.下列说法错误的是( )
A.饱和 溶液处理锅炉水垢中的 ,发生了沉淀的转化
B.夏天雷雨过后空气清新,是因为放电时 和 合成了
C.神舟系列飞船返回舱使用氮化硅耐高温结构材料, 属于共价晶体
D. 可用于污水脱氯 ,是由于其具有还原性
2.下列有关物质性质的说法正确的是( )
A.苯酚和乙醇都能与 溶液反应
B. 的酸性弱于
C.邻羟基苯甲醛的沸点高于对羟基苯甲醛
D.酰胺在酸或碱存在并加热的条件下可发生水解反应
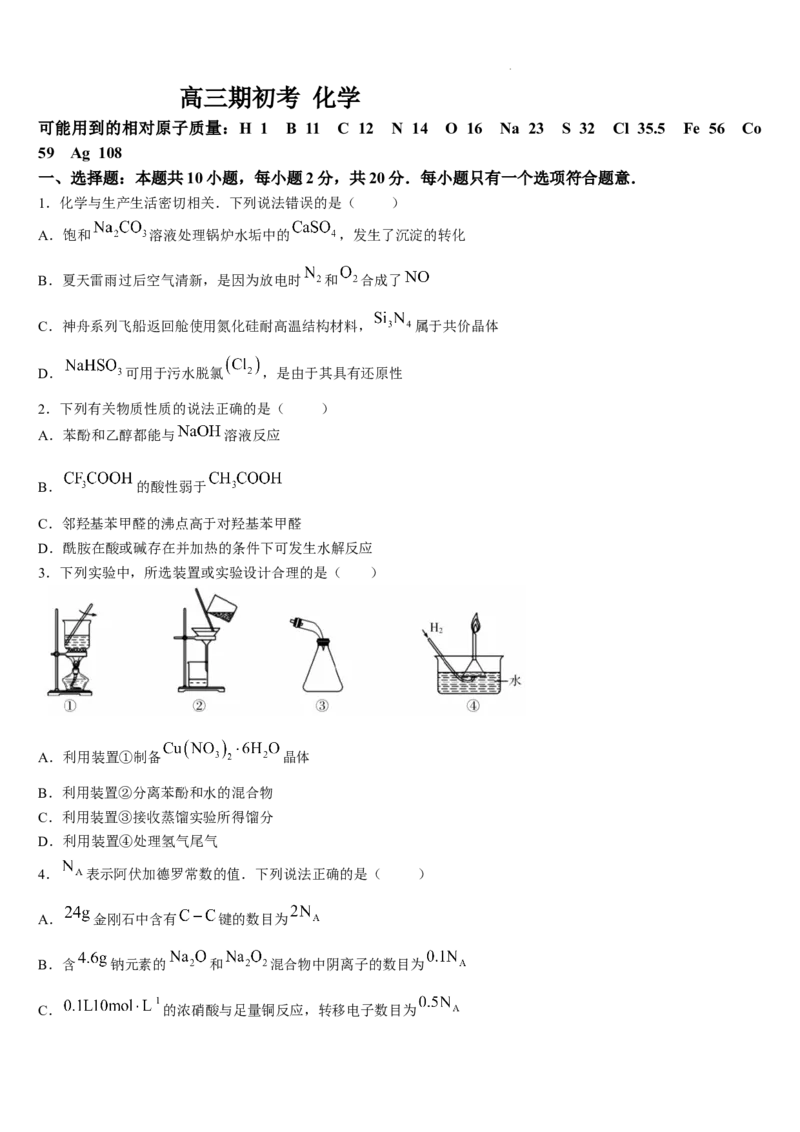
3.下列实验中,所选装置或实验设计合理的是( )
A.利用装置①制备 晶体
B.利用装置②分离苯酚和水的混合物
C.利用装置③接收蒸馏实验所得馏分
D.利用装置④处理氢气尾气
4. 表示阿伏加德罗常数的值.下列说法正确的是( )
A. 金刚石中含有 键的数目为
B.含 钠元素的 和 混合物中阴离子的数目为
C. 的浓硝酸与足量铜反应,转移电子数目为
学科网(北京)股份有限公司D. 时, 的 溶液中水电离出的 的数目为
5.有机物W可发生如图所示的反应,下列说法正确的是( )
A. 最多可与 反应
B.除氢原子外, 中其他原子可能共平面
C.W、X、Y都存在顺反异构体
D. 都能与 溶液反应
6. 化合物 中X、Y、Z、W、Q、R的原子序数依次增大。X与Y、Z、W均能形成 、
微粒,基态Q原子的3d轨道上有3个未成对电子,R被称为“海洋元素”,其原子序数等于W与Q的原子序数之和。
下列说法错误的是
A. 化合物中Q的化合价为
B. Y、Z、W中,第一电离能最大的是Z,电负性最大的是W
C. X、Z、W三种元素组成的化合物可能显酸性,也可能显碱性
D. Y、Z、W、R分别与X形成的化合物中,沸点最高的是W对应的化合物
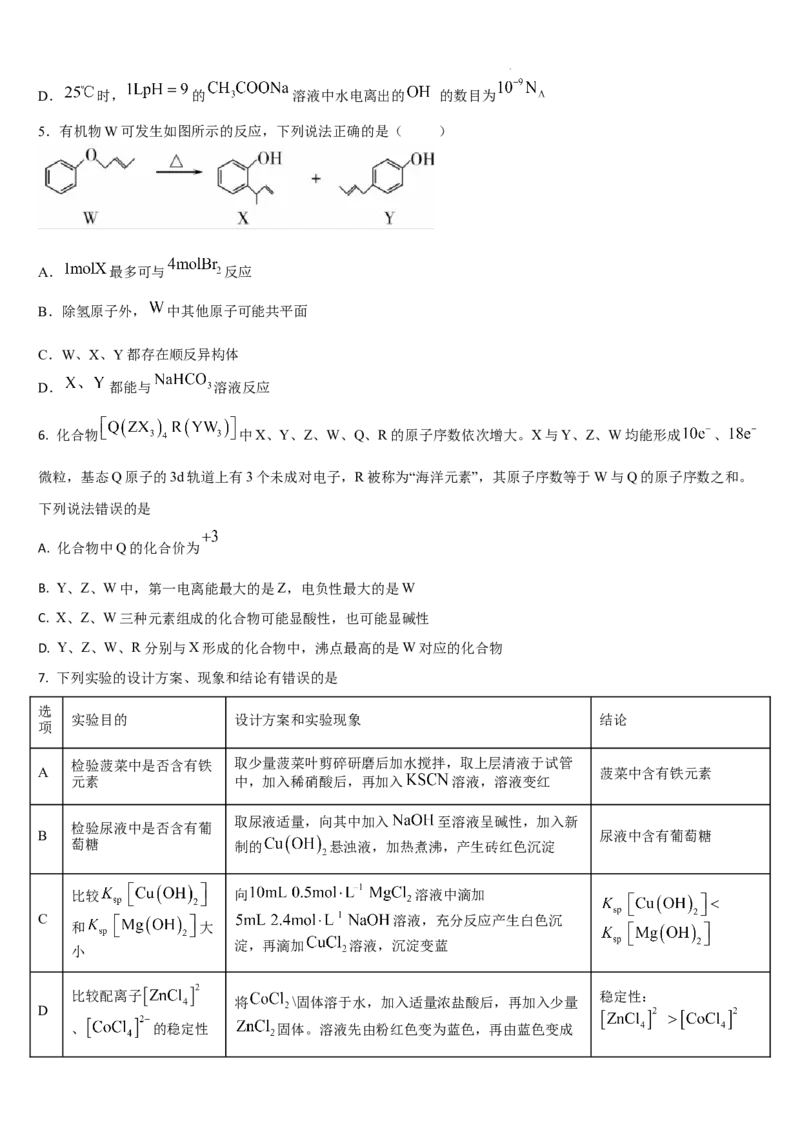
7. 下列实验的设计方案、现象和结论有错误的是
选
实验目的 设计方案和实验现象 结论
项
检验菠菜中是否含有铁 取少量菠菜叶剪碎研磨后加水搅拌,取上层清液于试管
A 菠菜中含有铁元素
元素 中,加入稀硝酸后,再加入 溶液,溶液变红
取尿液适量,向其中加入 至溶液呈碱性,加入新
检验尿液中是否含有葡
B 尿液中含有葡萄糖
萄糖 制的 悬浊液,加热煮沸,产生砖红色沉淀
比较 向 溶液中滴加
C 溶液,充分反应产生白色沉
和 大
淀,再滴加 溶液,沉淀变蓝
小
比较配离子 稳定性:
将 \固体溶于水,加入适量浓盐酸后,再加入少量
D
、 的稳定性 固体。溶液先由粉红色变为蓝色,再由蓝色变成
学科网(北京)股份有限公司粉红色(已知: 呈粉红色, 呈
蓝色, 呈无色)
A. A B. B C. C D. D
8. 某有机物中间体结构如图所示,下列说法错误的是
在
A. 存 顺反异构和对映异构
B. 含有4种官能团
C. 所有碳原子有可能共面
D. 检验其中碘元素所用试剂为 溶液、稀硝酸、硝酸银溶液
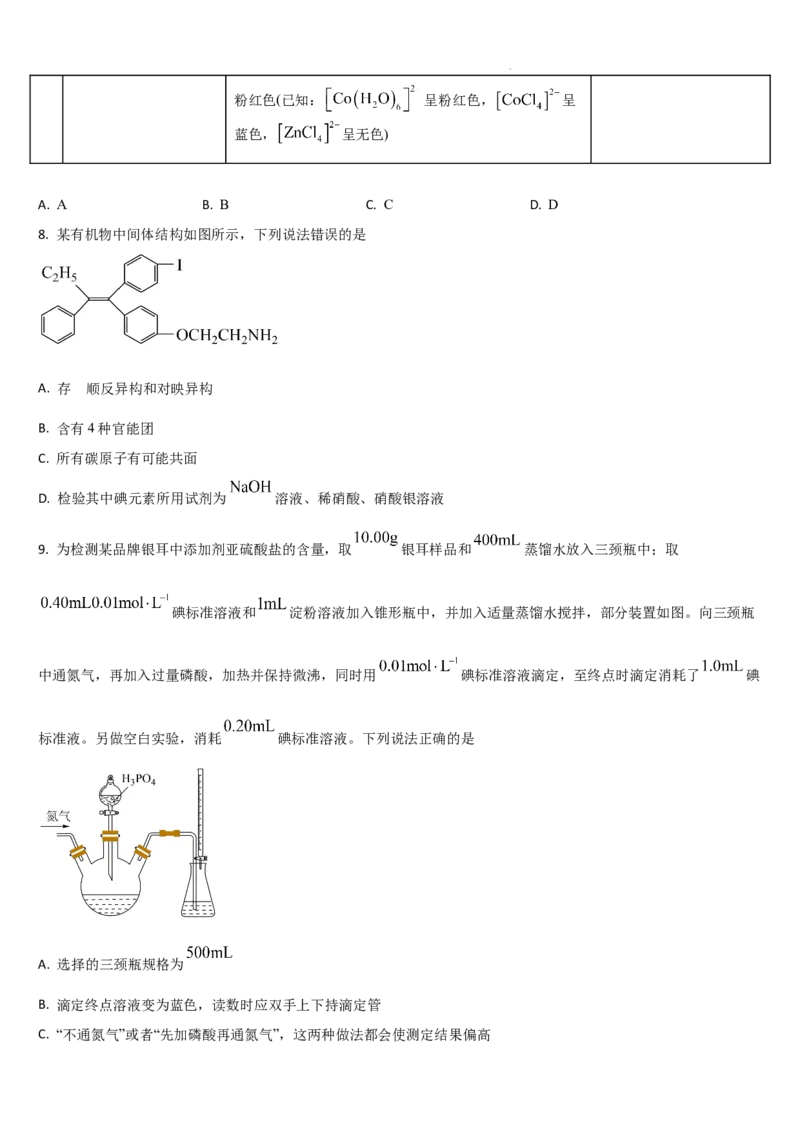
9. 为检测某品牌银耳中添加剂亚硫酸盐的含量,取 银耳样品和 蒸馏水放入三颈瓶中;取
碘标准溶液和 淀粉溶液加入锥形瓶中,并加入适量蒸馏水搅拌,部分装置如图。向三颈瓶
中通氮气,再加入过量磷酸,加热并保持微沸,同时用 碘标准溶液滴定,至终点时滴定消耗了 碘
标准液。另做空白实验,消耗 碘标准溶液。下列说法正确的是
A. 选择的三颈瓶规格为
B. 滴定终点溶液变为蓝色,读数时应双手上下持滴定管
C. “不通氮气”或者“先加磷酸再通氮气”,这两种做法都会使测定结果偏高
学科网(北京)股份有限公司D. 银耳样品中亚硫酸盐的百分含量(以 质量计)为
10. 黄连素具有清热解毒等功效。实验室从黄连中提取黄连素的操作流程如图所示:
已知:黄连素为黄色针状结晶,属于生物碱,微溶于水和乙醇,易溶于热水及热醇;黄连素的含氧酸盐在水中溶解度
较大,不含氧酸盐难溶于水。下列说法错误的是
A. 加热回流时,将黄连切成碎片的目的是增大接触面积,加快提取速率
B. 加热溶解时,加入乙酸的作用是将黄连素转变成含氧酸盐,增大在水中的溶解度
C. 试剂a和b可分别选用冰水和热水
D. 抽滤③和抽滤④均需要冷却后进行
二、选择题:本题共5小题,每小题4分,共20分。每小题只有一个或两个选项符合题意,全部选对
得4分,选对但不全的得2分,有选错的得0分。
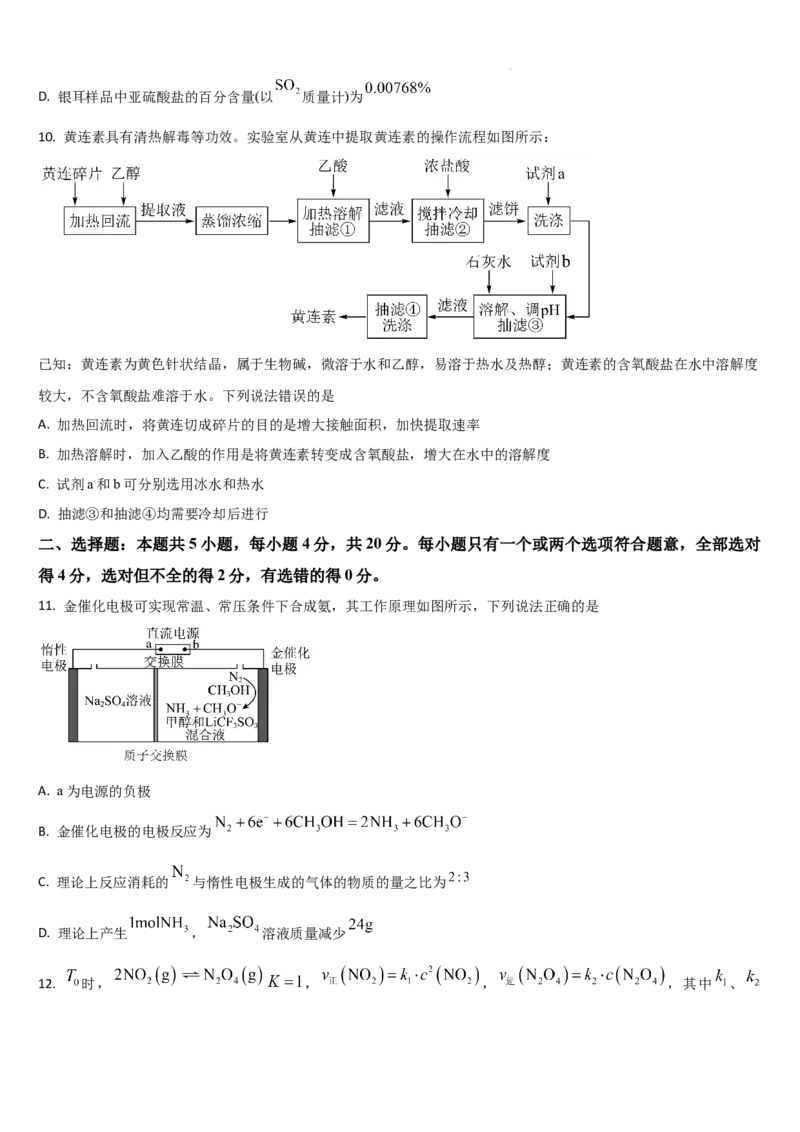
11. 金催化电极可实现常温、常压条件下合成氨,其工作原理如图所示,下列说法正确的是
A. a为电源的负极
B. 金催化电极的电极反应为
C. 理论上反应消耗的 与惰性电极生成的气体的物质的量之比为
D. 理论上产生 , 溶液质量减少
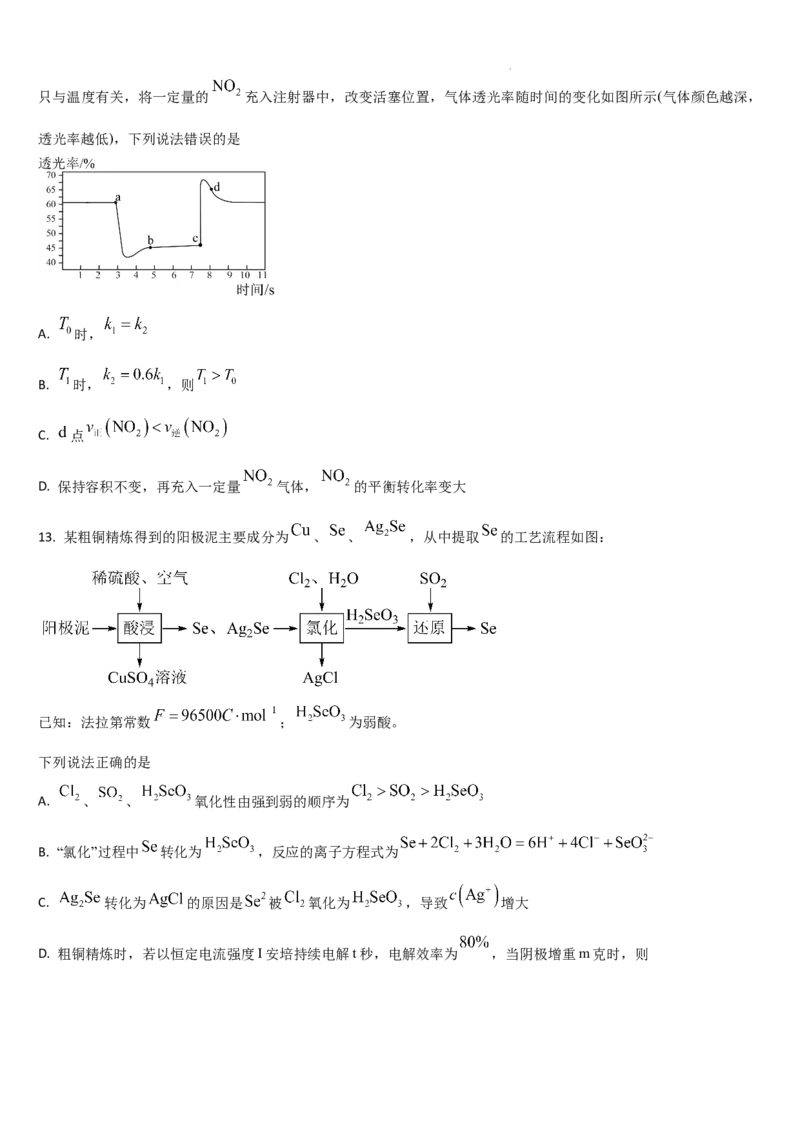
12. 时, , , ,其中 、
学科网(北京)股份有限公司只与温度有关,将一定量的 充入注射器中,改变活塞位置,气体透光率随时间的变化如图所示(气体颜色越深,
透光率越低),下列说法错误的是
A. 时,
B. 时, ,则
C. 点
D. 保持容积不变,再充入一定量 气体, 的平衡转化率变大
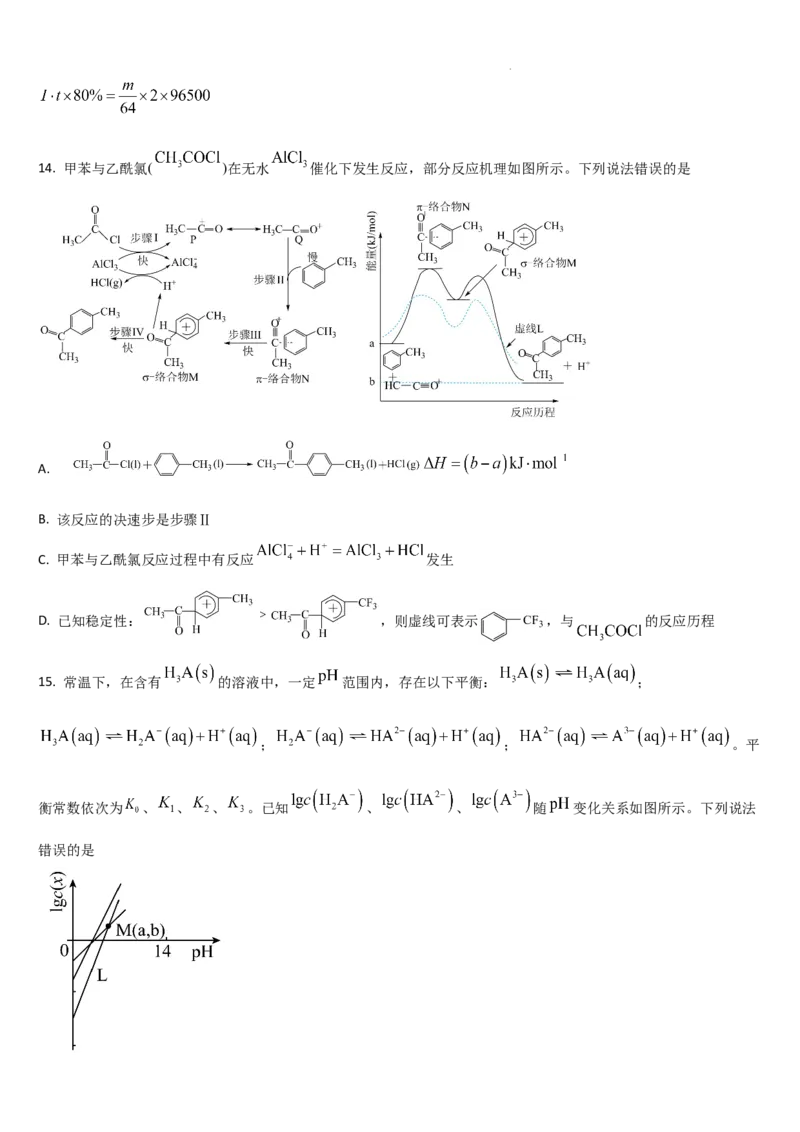
13. 某粗铜精炼得到的阳极泥主要成分为 、 、 ,从中提取 的工艺流程如图:
已知:法拉第常数 ; 为弱酸。
下列说法正确的是
A. 、 、 氧化性由强到弱的顺序为
B. “氯化”过程中 转化为 ,反应的离子方程式为
C. 转化为 的原因是 被 氧化为 ,导致 增大
D. 粗铜精炼时,若以恒定电流强度I安培持续电解t秒,电解效率为 ,当阴极增重m克时,则
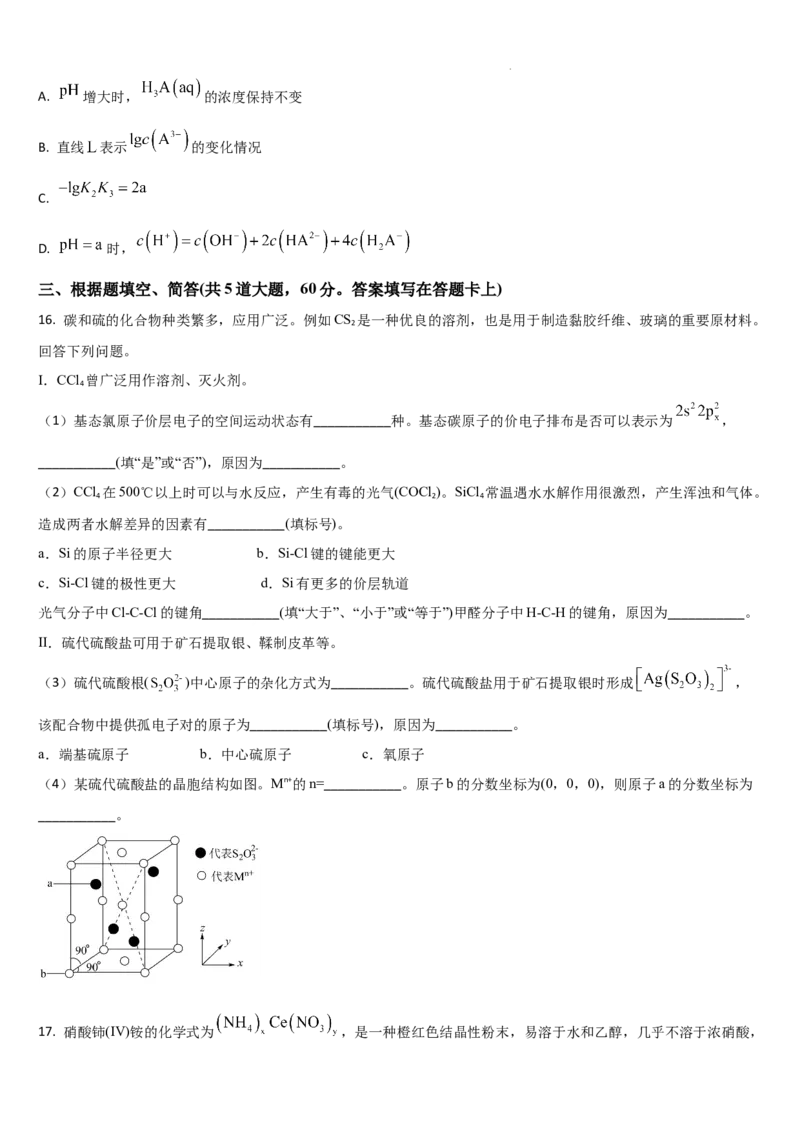
学科网(北京)股份有限公司14. 甲苯与乙酰氯( )在无水 催化下发生反应,部分反应机理如图所示。下列说法错误的是
A.
B. 该反应的决速步是步骤Ⅱ
C. 甲苯与乙酰氯反应过程中有反应 发生
D. 已知稳定性: ,则虚线可表示 ,与 的反应历程
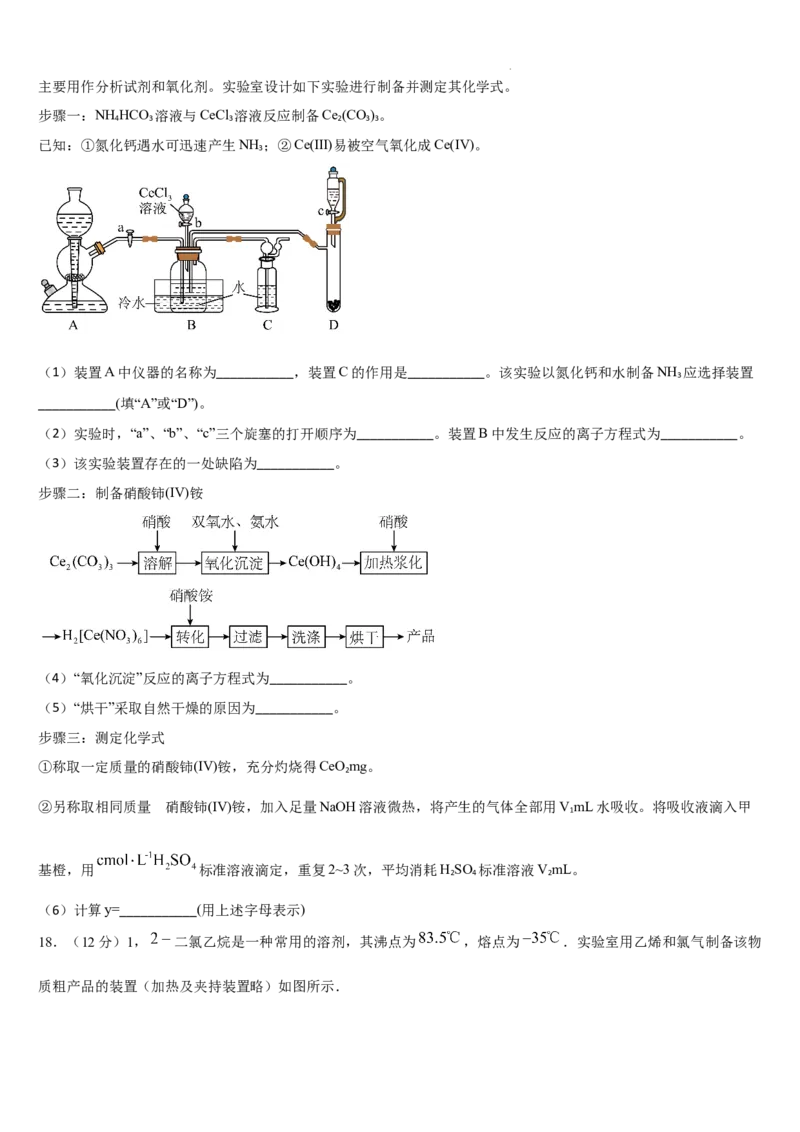
15. 常温下,在含有 的溶液中,一定 范围内,存在以下平衡: ;
; ; 。平
衡常数依次为 、 、 、 。已知 、 、 随 变化关系如图所示。下列说法
错误的是
学科网(北京)股份有限公司A. 增大时, 的浓度保持不变
B. 直线 表示 的变化情况
C.
D. 时,
三、根据题填空、简答(共5道大题,60分。答案填写在答题卡上)
16. 碳和硫的化合物种类繁多,应用广泛。例如CS 是一种优良的溶剂,也是用于制造黏胶纤维、玻璃的重要原材料。
2
回答下列问题。
I.CCl 曾广泛用作溶剂、灭火剂。
4
(1)基态氯原子价层电子的空间运动状态有___________种。基态碳原子的价电子排布是否可以表示为 ,
___________(填“是”或“否”),原因为___________。
(2)CCl 在500℃以上时可以与水反应,产生有毒的光气(COCl )。SiCl 常温遇水水解作用很激烈,产生浑浊和气体。
4 2 4
造成两者水解差异的因素有___________(填标号)。
a.Si的原子半径更大 b.Si-Cl键的键能更大
c.Si-Cl键的极性更大 d.Si有更多的价层轨道
光气分子中Cl-C-Cl的键角___________(填“大于”、“小于”或“等于”)甲醛分子中H-C-H的键角,原因为___________。
Ⅱ.硫代硫酸盐可用于矿石提取银、鞣制皮革等。
(3)硫代硫酸根( )中心原子的杂化方式为___________。硫代硫酸盐用于矿石提取银时形成 ,
该配合物中提供孤电子对的原子为___________(填标号),原因为___________。
a.端基硫原子 b.中心硫原子 c.氧原子
(4)某硫代硫酸盐的晶胞结构如图。Mn+的n=___________。原子b的分数坐标为(0,0,0),则原子a的分数坐标为
___________。
17. 硝酸铈(Ⅳ)铵的化学式为 ,是一种橙红色结晶性粉末,易溶于水和乙醇,几乎不溶于浓硝酸,
学科网(北京)股份有限公司主要用作分析试剂和氧化剂。实验室设计如下实验进行制备并测定其化学式。
步骤一:NH HCO 溶液与CeCl 溶液反应制备Ce (CO ) 。
4 3 3 2 3 3
已知:①氮化钙遇水可迅速产生NH ;②Ce(Ⅲ)易被空气氧化成Ce(Ⅳ)。
3
(1)装置A中仪器的名称为___________,装置C的作用是___________。该实验以氮化钙和水制备NH 应选择装置
3
___________(填“A”或“D”)。
(2)实验时,“a”、“b”、“c”三个旋塞的打开顺序为___________。装置B中发生反应的离子方程式为___________。
(3)该实验装置存在的一处缺陷为___________。
步骤二:制备硝酸铈(Ⅳ)铵
(4)“氧化沉淀”反应的离子方程式为___________。
(5)“烘干”采取自然干燥的原因为___________。
步骤三:测定化学式
①称取一定质量的硝酸铈(Ⅳ)铵,充分灼烧得CeO mg。
2
的
②另称取相同质量 硝酸铈(Ⅳ)铵,加入足量NaOH溶液微热,将产生的气体全部用V mL水吸收。将吸收液滴入甲
1
基橙,用 标准溶液滴定,重复2~3次,平均消耗H SO 标准溶液V mL。
2 4 2
(6)计算y=___________(用上述字母表示) 。
18.(12分)1, 二氯乙烷是一种常用的溶剂,其沸点为 ,熔点为 .实验室用乙烯和氯气制备该物
质粗产品的装置(加热及夹持装置略)如图所示.
学科网(北京)股份有限公司回答下列问题:
(1)装置A中发生主要反应的化学方程式为______________.A中还缺少的一种必需实验仪器是______________.
(2)装置B中的试剂是______________,其长导管的作用是______________.
(3)判断反应结束的现象是______________.
(4)酱油中 测定时需用到1, 二氯乙烷.测定步骤如下:
取 酱油,配成 溶液,取出 ,加入适量稀硝酸,再加入过量 的硝酸银
溶液,摇匀充分反应后加入 -二氯乙烷,再充分振荡摇匀,使1, 二氯乙烷完全包裏氯化银.最后加入
几滴铁铵矾 指示剂,用 的 溶液滴定至溶液为浅红色.
做三次平行试验,平均消耗 溶液 .[已知 , ].
① 该酱油样品含 的质量是______________g.
②若1, 二氯乙烷未完全包裹 ,则 的测定值______________(填“偏高”“偏低”或“无影响”).
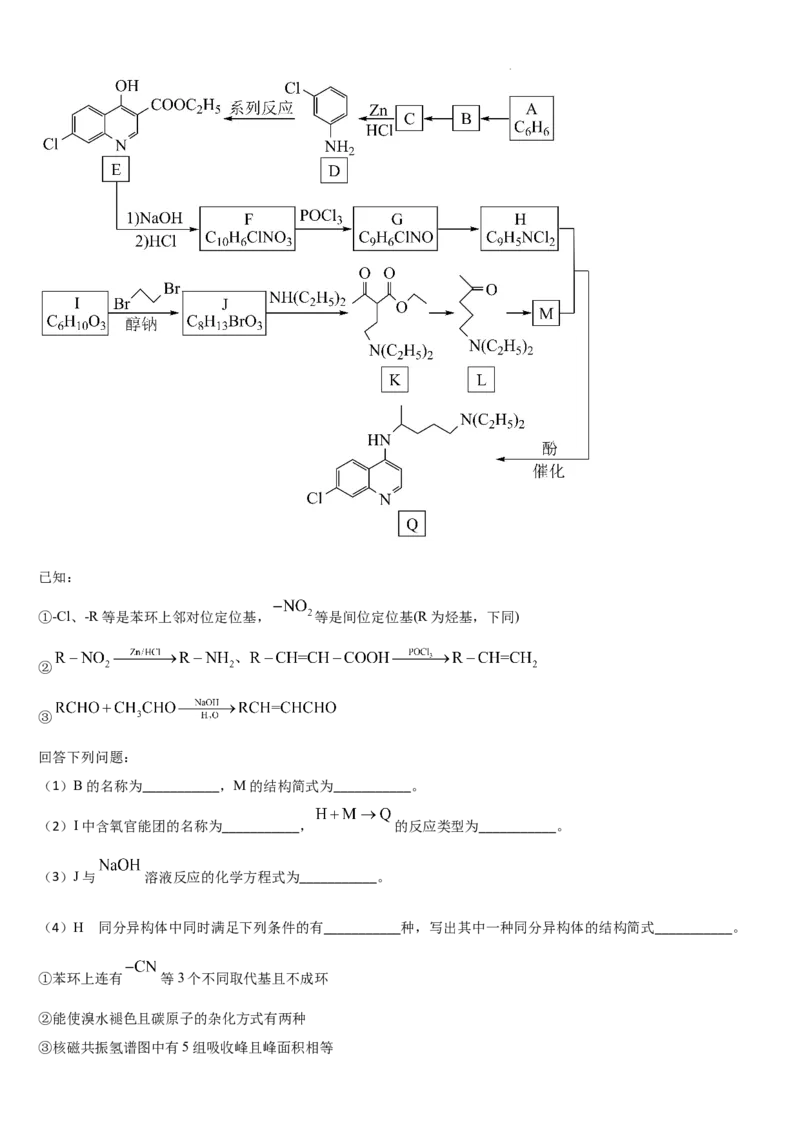
19. 一种抗疟疾药物Q具有广泛的应用价值,其可通过以下路径进行合成:
学科网(北京)股份有限公司已知:
①-Cl、-R等是苯环上邻对位定位基, 等是间位定位基(R为烃基,下同)
②
③
回答下列问题:
(1)B的名称为___________,M的结构简式为___________。
(2)I中含氧官能团的名称为___________, 的反应类型为___________。
(3)J与 溶液反应的化学方程式为___________。
的
(4)H 同分异构体中同时满足下列条件的有___________种,写出其中一种同分异构体的结构简式___________。
①苯环上连有 等3个不同取代基且不成环
②能使溴水褪色且碳原子的杂化方式有两种
③核磁共振氢谱图中有5组吸收峰且峰面积相等
学科网(北京)股份有限公司(5)参照以上合成路线,请以 、 和 为原料设计 的合
成路线_______。
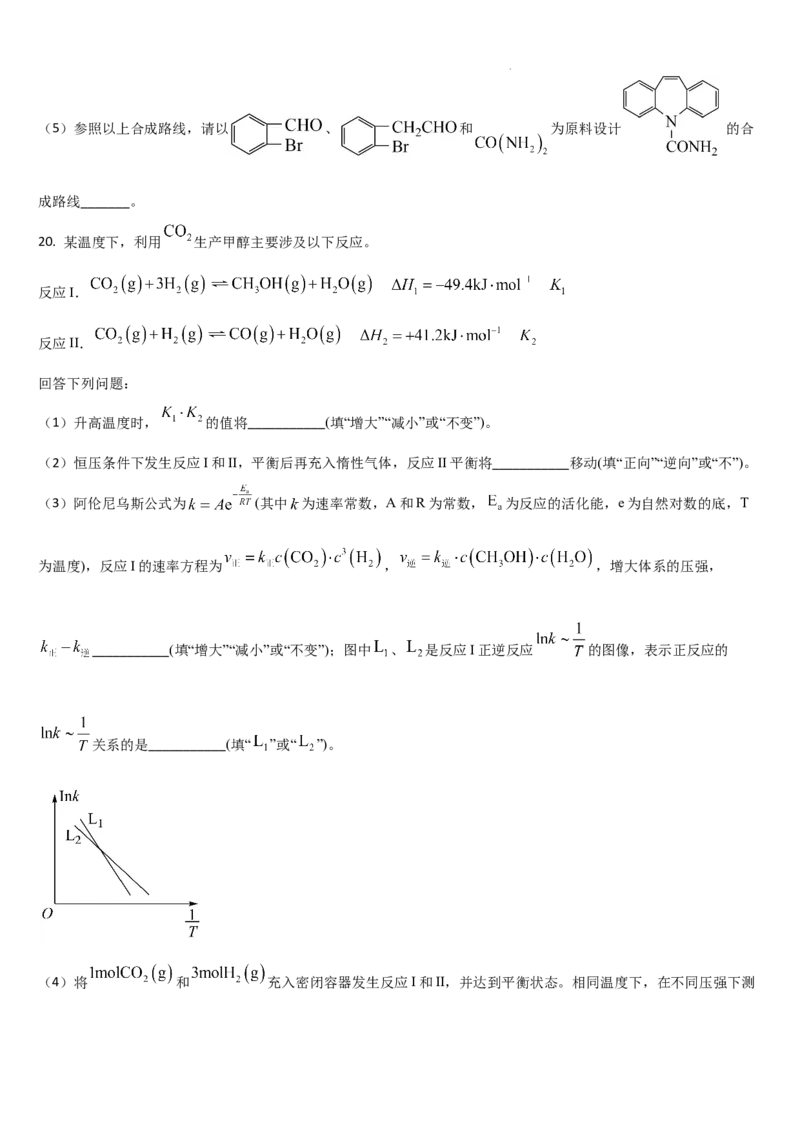
20. 某温度下,利用 生产甲醇主要涉及以下反应。
反应I.
反应II.
回答下列问题:
(1)升高温度时, 的值将___________(填“增大”“减小”或“不变”)。
(2)恒压条件下发生反应I和II,平衡后再充入惰性气体,反应II平衡将___________移动(填“正向”“逆向”或“不”)。
(3)阿伦尼乌斯公式为 (其中 为速率常数,A和R为常数, 为反应的活化能,e为自然对数的底,T
为温度),反应I的速率方程为 , ,增大体系的压强,
___________(填“增大”“减小”或“不变”);图中 、 是反应I正逆反应 的图像,表示正反应的
关系的是___________(填“ ”或“ ”)。
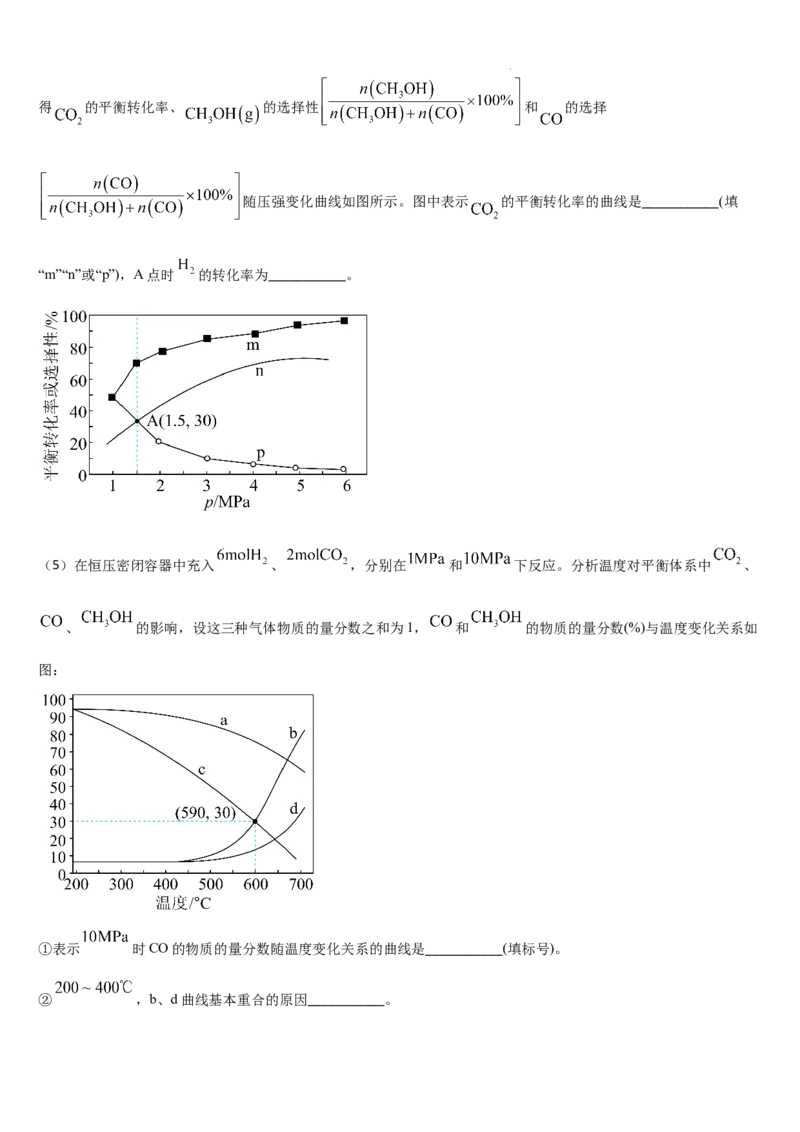
(4)将 和 充入密闭容器发生反应I和II,并达到平衡状态。相同温度下,在不同压强下测
学科网(北京)股份有限公司得 的平衡转化率、 的选择性 和 的选择
随压强变化曲线如图所示。图中表示 的平衡转化率的曲线是___________(填
“m”“n”或“p”),A点时 的转化率为___________。
(5)在恒压密闭容器中充入 、 ,分别在 和 下反应。分析温度对平衡体系中 、
、 的影响,设这三种气体物质的量分数之和为1, 和 的物质的量分数(%)与温度变化关系如
图:
①表示 时CO的物质的量分数随温度变化关系的曲线是___________(填标号)。
② ,b、d曲线基本重合的原因___________。
学科网(北京)股份有限公司③590℃时,反应I的 为___________ (保留2位有效数字)
BDDBB DCADD 11BC 12A 13CD 14AD 15D
16 (1) ①. 4 ②. 否 ③. 违背洪特规则
(2) ①. acd ②. 小于 ③. 氯原子的电负性强于氢原子,对电子吸引力更强,所以甲醛分子中的H-C-H的
键角更大
(3) ①. sp3 ②. a ③. 端基硫原子与氧原子都有孤电子对,但是氧的电负性大于硫,对孤电子的吸引力
强,不易形成配位键
.
(4) ① 2 ②.
17 (1) ①. 启普发生器 ②. 防止Ce3+被氧化 ③. D
(2) ①. c→a→b ②.
(3)氨气极易溶于水,通入B装置需要防倒吸,导管不能伸入液面一下
(4)
(5)防止硝酸铈(Ⅳ)铵受热分解
(6)2cV ×10-3+
2
18
18.(1) (2分) 温度计(1分)
(2)氢氧化钠溶液(1分) 平衡气压,防倒吸(2分)
(3)A中冷凝管下端无液体滴下(2分)
(4)(1)17.55(2分) (2)偏低(2分)
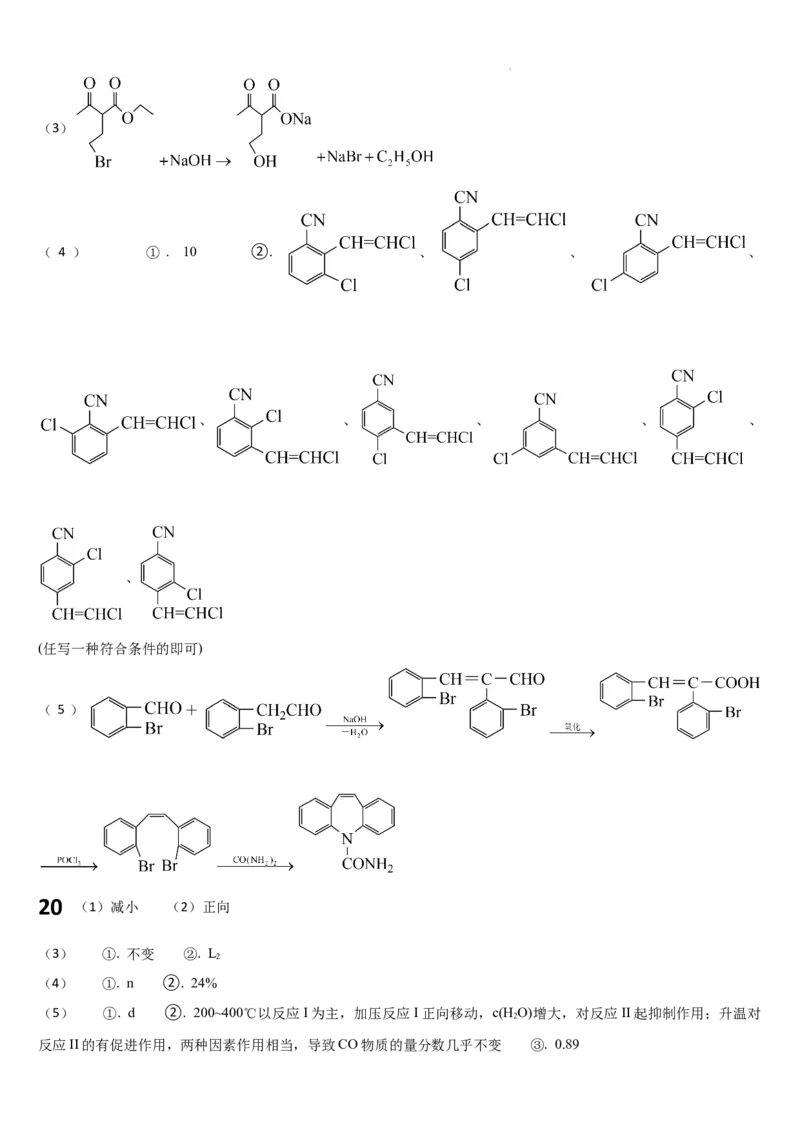
19 (1) ①. 硝基苯 ②.
(2) ①. 羰基、酯基 ②. 取代反应
学科网(北京)股份有限公司(3)
( 4 ) ① . 10 ②. 、 、 、
、 、 、 、 、
、
(任写一种符合条件的即可)
( 5 ) +
20 (1)减小 (2)正向
(3) ①. 不变 ②. L
2
(4) ①. n ②. 24%
(5) ①. d ②. 200~400℃以反应I为主,加压反应I正向移动,c(HO)增大,对反应II起抑制作用;升温对
2
反应II的有促进作用,两种因素作用相当,导致CO物质的量分数几乎不变 ③. 0.89
学科网(北京)股份有限公司学科网(北京)股份有限公司