文档内容
第二节 化学反应的速率与限度--课时训练 2022-2023学年
高一下学期化学人教版(2019)必修第二册
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.下列关于反应速率的说法中,错误的是
A.反应速率用于衡量化学反应的快慢
B.增大反应物浓度,提高反应物温度都可增大反应速率
C.决定反应速率的主要因素是反应物的性质
D.可逆反应达到化学平衡时,正、逆反应速率都为0
2.反应 ,在不同情况下测得反应速率,反应最
快的是
A. B.
C. D.
3.将4mol A气体和2mol B气体在2L密闭容器中混合,在一定条件下发生如下反应:
2A(g)+B(g) 2C(g)。经2s后测得C的浓度为0.6mol·L-1。下列说法正确的是
( )
A.用物质A表示的反应速率为0.3mol·L-1·s-1
B.用物质B表示的反应速率为0.6mol·L-1·s-1
C.2s时物质A的浓度为0.7mol·L-1
D.2s时物质B的浓度为0.9mol·L-1
4.下列措施可加快反应速率的是
A.用黄铁矿制硫酸的过程中将矿石粉碎
B.实验室用大理石制备 时,用等物质的量浓度的稀硫酸代替稀盐酸
C.将食物放入冰箱中防止变坏
D.实验室制氢气时,用表面积相同的铁片代替锌片
5.在一定温度下的密闭容器中,不能说明可逆反应H(g)+I(g) 2HI(g)已经达到
2 2
平衡的标志是( )
A.HI的生成速率与HI的分解速率相等
B.HI的生成速率与H 的生成速率之比是2∶1
2C.单位时间内一个H-H键断裂的同时有两个H-I键断裂
D.单位时间里断裂2nmolHI的同时生成nmolI
2
6.对于可逆反应 ,在不同条件下测得的化学反应速率如
下,下列速率关系正确的是
① ②
③ ④
A.①>④>③>② B.②>③=①>④ C.③>②=④>① D.④>③>①>②
7.下列实验不能达到预期目的的是
选
实验操作 预期目的
项
A 充满NO 的密闭玻璃球分别浸泡在冷、热水中 研究温度对化学平衡移动的影响
2
向盛有 1 mL 硝酸银溶液的试管中滴加 NaCl 溶液 说明一种沉淀能转化为另一种更
B
至不再有沉淀产生,再向其中滴加NaS溶液 难溶的沉淀
2
C 苯酚和水的浊液中,加稍过量浓碳酸钠溶液 比较苯酚与碳酸的酸性
向2支试管中加入同体积同浓度HC O 溶液, 再 依据褪色时间来研究浓度对反应
D 2 2 4
分别加入同体积不同浓度的酸性KMnO 溶液 速率的影响
4
A.A B.B C.C D.D
8.在温度不变的条件下,密闭容器中发生如下反应:N
2
+3H 2⇌2NH
3
,下列叙述能够
说明反应已经达到平衡状态的是
A.容器中N、H、NH 共存
2 2 3
B.N 与NH 的浓度相等
2 3
C.容器中N、H、NH 的物质的量之比为1∶3∶2
2 2 3
D.反应容器中压强不随时间变化
9.一定条件下,将3molA和1molB两种气体混合于固定容积为2L的密闭容器中,发
生如下反应:3A(g)+B(g) xC(g)+2D(s)。2min末该反应达到平衡,生成
0.8molD,并测得C的浓度为0.4mol/L。下列判断正确的是
A.x =1
B.A的平均反应速率为0.3mol/(L·s)
C.B的转化率为60%
D.若混合气体的密度不再改变时,该反应一定达到平衡状态
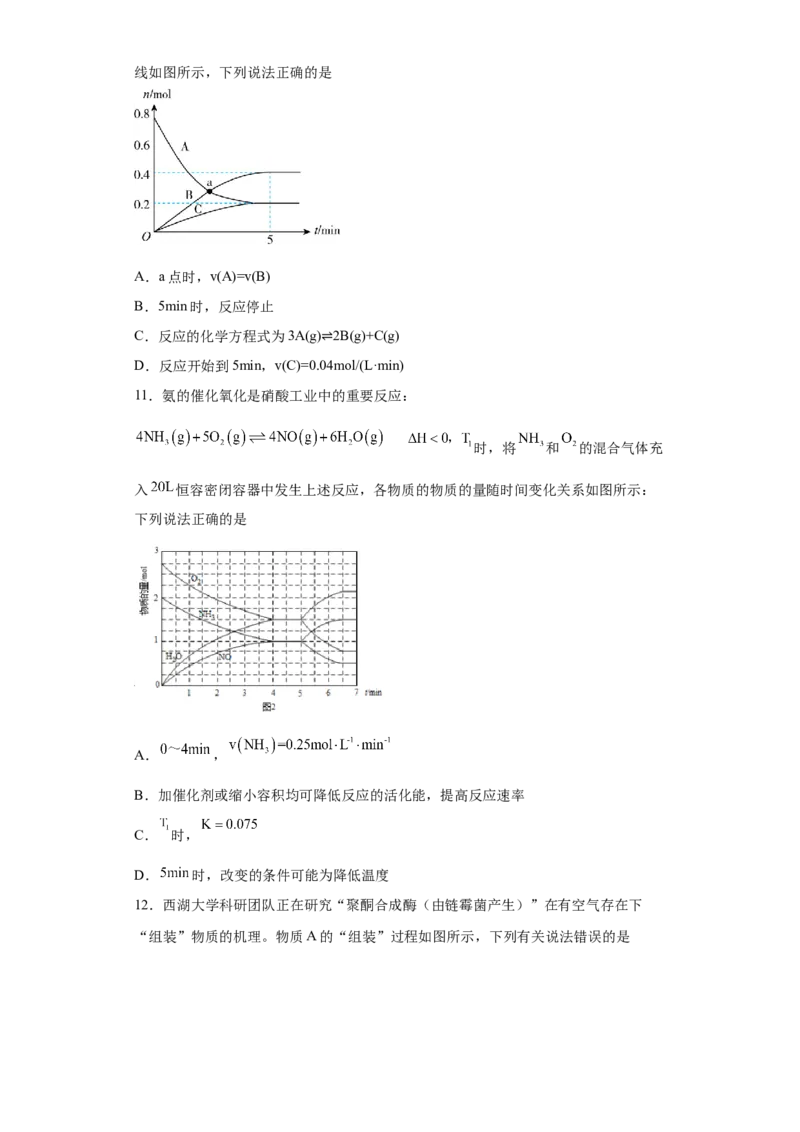
10.一定温度下,在2L密闭容器中,A、B、C三种气体的物质的量随时间变化的曲
试卷第2页,共3页线如图所示,下列说法正确的是
A.a点时,v(A)=v(B)
B.5min时,反应停止
C.反应的化学方程式为3A(g) 2B(g)+C(g)
D.反应开始到5min,v(C)=0.0⇌4mol/(L·min)
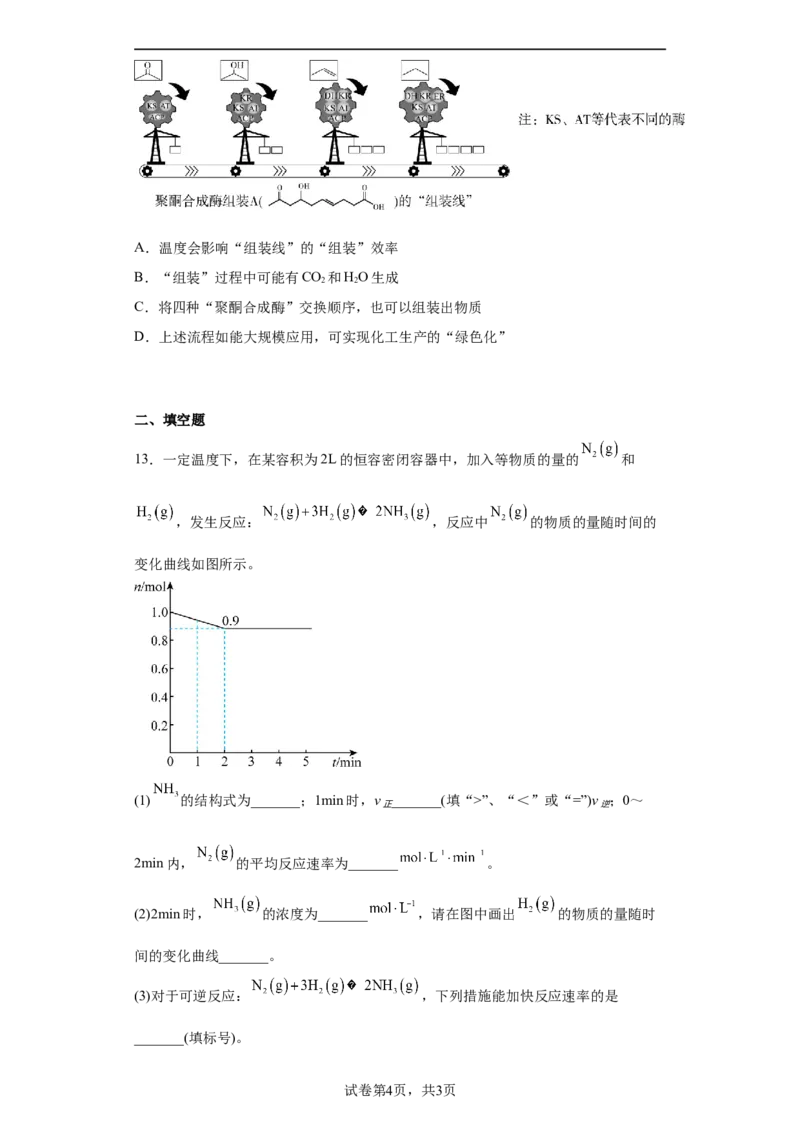
11.氨的催化氧化是硝酸工业中的重要反应:
时,将 和 的混合气体充
入 恒容密闭容器中发生上述反应,各物质的物质的量随时间变化关系如图所示:
下列说法正确的是
A. ,
B.加催化剂或缩小容积均可降低反应的活化能,提高反应速率
C. 时,
D. 时,改变的条件可能为降低温度
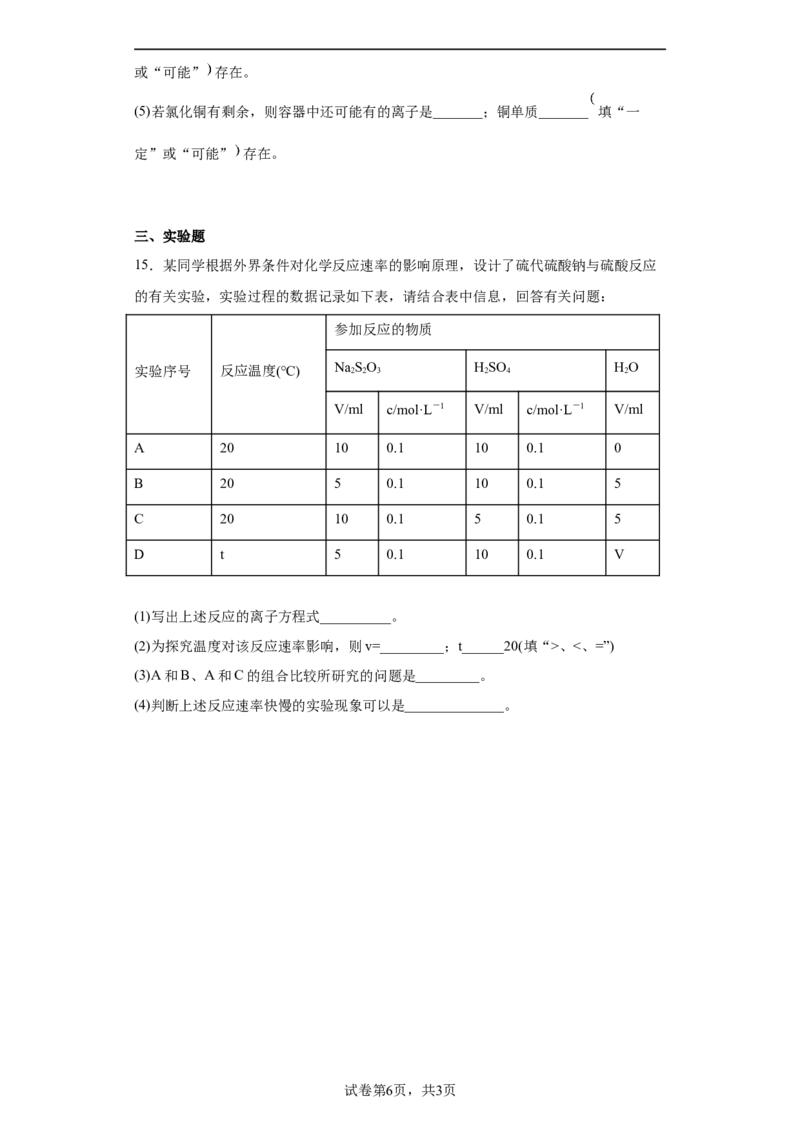
12.西湖大学科研团队正在研究“聚酮合成酶(由链霉菌产生)”在有空气存在下
“组装”物质的机理。物质A的“组装”过程如图所示,下列有关说法错误的是A.温度会影响“组装线”的“组装”效率
B.“组装”过程中可能有CO 和HO生成
2 2
C.将四种“聚酮合成酶”交换顺序,也可以组装出物质
D.上述流程如能大规模应用,可实现化工生产的“绿色化”
二、填空题
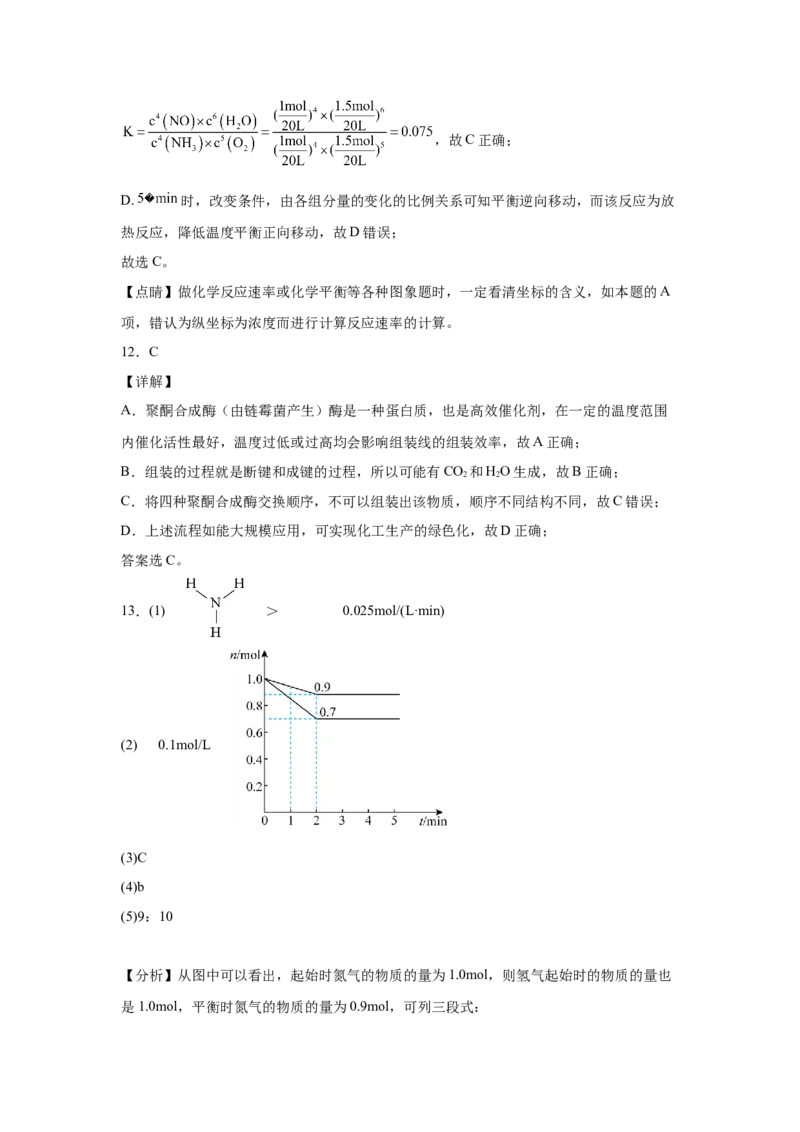
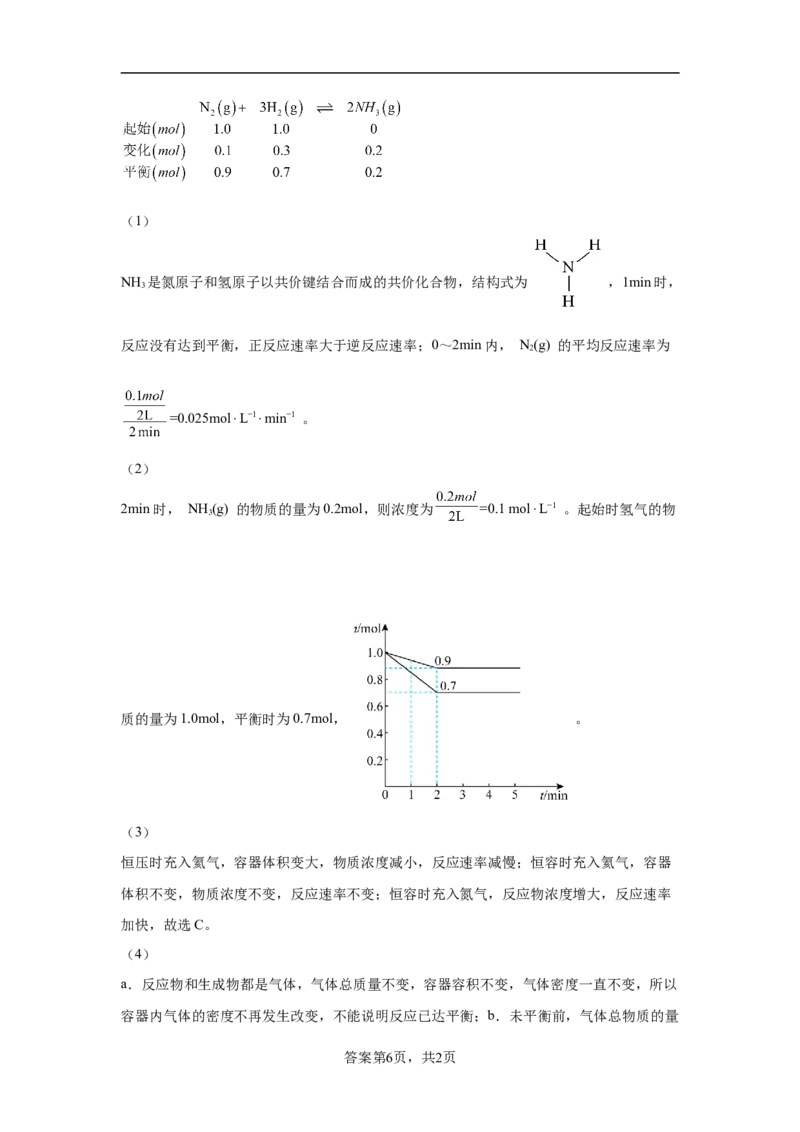
13.一定温度下,在某容积为2L的恒容密闭容器中,加入等物质的量的 和
,发生反应: ,反应中 的物质的量随时间的
变化曲线如图所示。
(1) 的结构式为_______;1min时,v _______(填“>”、“<”或“=”)v ;0~
正 逆
2min内, 的平均反应速率为_______ 。
(2)2min时, 的浓度为_______ ,请在图中画出 的物质的量随时
间的变化曲线_______。
(3)对于可逆反应: ,下列措施能加快反应速率的是
_______(填标号)。
试卷第4页,共3页A.恒压时充入He B.恒容时充入He C.恒容时充入
(4)下列有关说法正确的是_______(填标号)。
a.容器内气体的密度不再发生改变,说明反应已达平衡
b.气体混合物的平均摩尔质量不再改变,说明反应已达平衡
c.当反应达到平衡时,反应停止
d.反应速率 时,说明反应已达平衡
e.单位时间内 键断裂的同时有6molN—H键断裂
(5)设反应达到平衡时气体总物质的量为n(平衡),起始时气体总物质的量为n(起始),
则n(平衡)∶n(起始)=_______。
14.Ⅰ.反应 的能量变化趋势如图所示:
(1)该反应为_______反应 填“吸热”或“放热” 。
(2)若要使该反应的反应速率加快,下列措施可行的是_______ 填序号 。
A.改铁片为铁粉 B.改稀硫酸为 的浓硫酸 C.升高温度
(3)若将上述反应设计成原电池,铜为原电池某一极材料,则铜为_______ 填“正”或
“负” 极。铜片上的现象为_______,该极上发生的电极反应为_______,外电路中电
子由_______极 填“正”或“负”,下同 向_______极移动。
Ⅱ.将铁粉、铜粉、 溶液和 溶液混合于某容器中充分反应 假定容器不参与
反应 。试判断下列情况下,溶液中存在的金属离子和金属单质。
(4)若铁粉有剩余,则容器中不可能有的离子是_______;铜单质_______ 填“一定”或“可能” 存在。
(5)若氯化铜有剩余,则容器中还可能有的离子是_______;铜单质_______ 填“一
定”或“可能” 存在。
三、实验题
15.某同学根据外界条件对化学反应速率的影响原理,设计了硫代硫酸钠与硫酸反应
的有关实验,实验过程的数据记录如下表,请结合表中信息,回答有关问题:
参加反应的物质
实验序号 反应温度(℃) Na 2 S 2 O 3 H 2 SO 4 H 2 O
V/ml c/mol·L-1 V/ml c/mol·L-1 V/ml
A 20 10 0.1 10 0.1 0
B 20 5 0.1 10 0.1 5
C 20 10 0.1 5 0.1 5
D t 5 0.1 10 0.1 V
(1)写出上述反应的离子方程式__________。
(2)为探究温度对该反应速率影响,则v=_________;t______20(填“>、<、=”)
(3)A和B、A和C的组合比较所研究的问题是_________。
(4)判断上述反应速率快慢的实验现象可以是______________。
试卷第6页,共3页参考答案:
1.D
【详解】A.化学反应有的快,有的慢,则使用反应速率用于衡量化学反应的快慢,故A
不选;
B.增大反应物浓度,活化分子数目增多,反应速率加快,提高反应物温度,活化分子百
分数增多,反应速率加快,故B不选;
C.反应物本身的性质是决定反应速率的主要因素,如食物腐败等,故C不选;
D.可逆反应达到化学平衡时,正、逆反应速率相等,但不为0 ,故D选;
故选:D。
2.C
【详解】根据化学反应过程中,各物质的反应速率之比=物质对应计量数之比可将速率转化
为NH 的反应速率,然后进行比较。
3
A. 即为 = × =0.16
;
B. 即为 = × =0.16
;
C. ;
D. 即为 = =0.1 ;
综上所述,反应最快的是 ,故答案为C。
3.A
【详解】A、v(C)= = =0.3mol·L-1·s-1,则v(A)= v(C)=0.3mol·L-1·s-1,A正确;
B、v(B)= v(C)=0.15mol·L-1·s-1,B错误;
C、2s时,c(A)= -2s×0.3mol·L-1·s-1=1.4mol·L-1,C错误;
D、2s时,c(B)= -2s×0.15mol·L-1·s-1=0.7mol·L-1,D错误;
故选A。4.A
【详解】A.用黄铁矿制硫酸的过程中将矿石粉碎,增大接触面积,反应速率加快,A符
合题意;
B.实验室用大理石制备 时,用等物质的量浓度的稀硫酸代替稀盐酸,虽然H+浓度增
大,但由于将生成微溶物CaSO 覆盖在碳酸钙表面,阻止反应继续进行,则减慢反应速率,
4
B不合题意;
C.将食物放入冰箱中防止变坏。降低温度减慢反应速率,C不合题意;
D.由于Zn比Fe活泼,故实验室制氢气时,用表面积相同的铁片代替锌片,将使反应速
率减慢,D不合题意;
故答案为:A。
5.D
【详解】A. HI的生成速率与HI的分解速率相等,说明正反应速率与逆反应速率相等,即
达到平衡状态,A项正确;
B. HI的生成速率与H 的生成速率之比是2∶1,根据各物质的化学反应速率之比等于化学计
2
量数之比可知,当转换成同一物质H 后能反映出正反应速率与逆反应速率相等,即可说明
2
达到平衡状态,B项正确;
C. 单位时间内一个H-H键断裂的同时有两个H-I键断裂,说明正反应速率与逆反应速
率相等,即达到平衡状态,C项正确;
D. 单位时间里断裂2n mol HI的同时生成n mol I ,只代表逆反应方向的速率,不能说明正
2
反应速率是否等于逆反应速率,因此不能说明反应是否达到平衡状态,D项错误;
答案选D。
【点睛】当反应达到平衡状态时,正逆反应速率相等,各物质的浓度不变,由此衍生的一
些物理量不变,注意该反应是一个反应前后气体体积不变的化学反应,所以不能用压强判
断平衡。
6.C
【分析】将各个反应速率先统一成同一个单位,在换算成同种物质的速率进行比较。
【详解】将①②③④均转化为用物质M表示的速率,换算后①②③④依次为
、 、 、
答案第2页,共2页,③>②=④>①,故选C。
7.C
【分析】A.NO(g) 2NO (g) H>0,升高温度平衡向吸热反应方向移动;
2 4 2
B.溶度积常数大的物质能转化为溶△度积常数小的物质;
C.苯酚与碳酸钠反应生成苯酚钠与碳酸氢钠;
D.应用同浓度同体积的酸性KMnO 溶液与同体积不同浓度过量HC O 溶液反应
4 2 2 4
【详解】A.NO(g) 2NO (g) H>0,升高温度平衡向吸热反应方向即向正反应方向
2 4 2
移动,导致容器中气体颜色加深,△所以可以研究温度对化学平衡移动的影响,A正确;
B.向盛有1mL硝酸银溶液的试管中滴加NaCl溶液,至不再有沉淀生成,再向其中滴加
NaS溶液,先生成白色沉淀,后白色沉淀转化为黑色沉淀,所以能说明一种沉淀能转化为
2
另一种溶解度更小的沉淀,B正确;
C.因苯酚与碳酸钠反应生成苯酚钠与碳酸氢钠,所以浑浊的苯酚溶液中加入少量碳酸钠晶
体,振荡后溶液变澄清,强酸反应制取弱酸,反映了酸性:苯酚>NaHCO,不能比较苯酚
3
与碳酸的酸性,C错误;
D.应用同浓度、同体积的酸性KMnO 溶液与同体积不同浓度过量HC O 溶液反应,通过
4 2 2 4
测量褪色的时间长短来研究浓度对反应速率的影响,D正确;
故合理选项是D。
【点睛】本题考查化学实验方案评价,涉及物质检验、性质比较、难溶物的溶解平衡、化
学平衡影响因素等知识点,明确实验原理是解本题关键,会根据实验现象、物质性质分析
解答。
8.D
【详解】A. 可逆反应始终是反应物和生成物共存的体系,不能说明反应已经达到平衡状
态,故A错误;
B. 平衡时,N 与NH 的浓度保持不变,而不一定相等,故B错误;
2 3
C. 当体系达平衡状态时,N、H、NH 的物质的量之比可能为1∶3∶2,也可能不是,与各
2 2 3
物质的初始量及转化率有关,故C错误;
D. 随着反应的进行,气体总物质的量减小,因此压强也会减小,故当反应容器中压强不
随时间变化时,说明反应达平衡状态,故D正确;
故选D。
9.D【分析】。
【详解】A.容积为2L的密闭容器中,测得C的浓度为0.4mol/L,n(C)=0.8mol,根据化
学方程式,x:2=0.8:0.8,推出x=2,故A错误;
B.生成0.8molD,消耗n(A)=1.5×0.8mol=1.2mol,v(A)=1.2/(2×2)mol/(L·min)=0.3
mol/(L·min),故B错误;
C.消耗B的物质的量为n(B)=0.8/2mol=0.4mol,则B的转化率为0.4/1×100%=40%,故C错
误;
D、根据密度的定义式,气体质量减少,气体的物质的量改变,因此密度不再改变,说明
反应达到平衡,故D正确。
故选D。
10.C
【详解】A. 由图可知,a点时,A、B两物质反应的时间相同,但物质的量的变化量不同,
反应速率不相等,选项A错误;
B. 5min时,反应达平衡,是动态平衡,不是反应停止,选项B错误;
C. 反应达到平衡时,A的物质的量由0.8 mol减少为0.2 mol,变化量为0.6 mol,A为反应
物,B的物质的量由0增加到0.4 mol,变化量为0.4 mol,C的物质的量由0增加到0.2
mol,变化量为0.2 mol,B、C为生成物,化学反应计量系数之比等于反应体系中物质变化
量之比,∆n(A):∆n(B) :∆n(C) =0.6 mol:0.4 mol:0.2 mol=3:2:1,则反应的化学方程
式为:3A(g) 2B(g)+C(g),选项C正确;
⇌
D. 反应开始到5min,∆n(C)= 0.2 mol,υ(C) = =0.02 mol/(L·min),
选项D错误;
答案选C。
11.C
【详解】A. , ,故A错误;
B. 加催化剂可降低反应的活化能,提高反应速率;缩小容积不能改变反应的活化能,故B
错误;
C. 由图象可知,反应至4min时反应达到平衡,此时反应的平衡常数
答案第4页,共2页,故C正确;
D. 时,改变条件,由各组分量的变化的比例关系可知平衡逆向移动,而该反应为放
热反应,降低温度平衡正向移动,故D错误;
故选C。
【点睛】做化学反应速率或化学平衡等各种图象题时,一定看清坐标的含义,如本题的A
项,错认为纵坐标为浓度而进行计算反应速率的计算。
12.C
【详解】
A.聚酮合成酶(由链霉菌产生)酶是一种蛋白质,也是高效催化剂,在一定的温度范围
内催化活性最好,温度过低或过高均会影响组装线的组装效率,故A正确;
B.组装的过程就是断键和成键的过程,所以可能有CO 和HO生成,故B正确;
2 2
C.将四种聚酮合成酶交换顺序,不可以组装出该物质,顺序不同结构不同,故C错误;
D.上述流程如能大规模应用,可实现化工生产的绿色化,故D正确;
答案选C。
13.(1) > 0.025mol/(L·min)
(2) 0.1mol/L
(3)C
(4)b
(5)9:10
【分析】从图中可以看出,起始时氮气的物质的量为1.0mol,则氢气起始时的物质的量也
是1.0mol,平衡时氮气的物质的量为0.9mol,可列三段式:(1)
NH 是氮原子和氢原子以共价键结合而成的共价化合物,结构式为 ,1min时,
3
反应没有达到平衡,正反应速率大于逆反应速率;0~2min内, N(g) 的平均反应速率为
2
=0.025mol⋅L−1⋅min−1 。
(2)
2min时, NH (g) 的物质的量为0.2mol,则浓度为 =0.1 mol⋅L−1 。起始时氢气的物
3
质的量为1.0mol,平衡时为0.7mol, 。
(3)
恒压时充入氦气,容器体积变大,物质浓度减小,反应速率减慢;恒容时充入氦气,容器
体积不变,物质浓度不变,反应速率不变;恒容时充入氮气,反应物浓度增大,反应速率
加快,故选C。
(4)
a.反应物和生成物都是气体,气体总质量不变,容器容积不变,气体密度一直不变,所以
容器内气体的密度不再发生改变,不能说明反应已达平衡;b.未平衡前,气体总物质的量
答案第6页,共2页是变化的,所以气体混合物的平均摩尔质量是变化的,当气体混合物的平均摩尔质量不再
改变,说明反应已达平衡;c.当反应达到平衡时,正逆反应仍在进行,故c错误;d.正
逆反应速率相等时,反应达到平衡,反应速率 v(N ):v(H )=1:3 时,正逆反应速率不一定相
2 2
等,不能说明反应已达平衡;e.当反应达到平衡时,单位时间内 1mol N≡N 键断裂的同
时有6molN—H键断裂,即正逆反应速率相等,但没有指明是否平衡状态,故此说法不正
确;故选b。
(5)
起始时,氮气和氢气均为1.0mol,气体总物质的量为2.0mol,平衡时气体的总物质的量为
0.9mol+0.7mol+0.2mol=1.8mol,所以平衡和起始时气体总物质的量之比为1.8:2.0=9:
10。
14.(1)放热
(2)AC
(3) 正 产生无色气泡 负 正
(4) 、 一定
(5) 可能
【解析】(1)
由图示可知,反应物的总能量高于生成物的总能量,该反应为放热反应;
(2)
A.改铁片为铁粉,反应物之间接触面积增大,化学反应速率加快,A正确;
B.改稀硫酸为98%的浓硫酸,铁遇浓硫酸发生钝化,B错误;
C.升高温度,化学反应速率加快,C正确;
答案选AC;
(3)
原电池中负极失电子,元素化合价升高,则若将上述反应设计成原电池,铁作负极,稀硫
酸作电解质溶液,铜作正极,正极上,氢离子得电子生成氢气,现象为:产生无色气泡,
电极反应式为: ,外电路中电子由负极向正极移动;
(4)铁能与铁离子反应生成亚铁离子,铁能与铜离子反应生成亚铁离子和铜,若铁粉有剩余,
则容器中不可能有铁离子和铜离子,而铜单质则一定存在;
(5)
金属的活动性: ,离子的氧化性: ,铁能与铁离子反应生成亚铁
离子,铁能与铜离子反应生成亚铁离子和铜,铜能跟铁离子反应生成亚铁离子和铜离子,
若氯化铜有剩余,则一定没有金属铁,铁离子和铜单质都是有可能存在。
15. SO2-+2H+═S↓+SO ↑+H O 5 >或< 浓度对反应速率的影响
2 3 2 2
出现黄色沉淀的快慢或者产生气泡的快慢
【分析】探究外界条件对化学反应速率的影响,需要有明显的现象,NaSO 中S的化合价
2 2 3
为+2价,不稳定,酸性条件下易发生歧化反应,生成淡黄色固体S和SO 气体,通过观察
2
不同条件下产生淡黄色固体和气泡的速率,可探究外界条件对反应速率的影响,据此分析
解答。
【详解】(1)由分析可知,生成物有S和SO ,结合电荷守恒、原子守恒可得离子方程式为:
2
SO2-+2H+═S↓+SO ↑+H O,故答案为:SO2-+2H+═S↓+SO ↑+H O;
2 3 2 2 2 3 2 2
(2)探究温度对该反应速率影响,需保证其他条件不变,只能选择实验B和D,所以V=5,
温度大于或者小于20℃均可以,故答案为:5;>或<;
(3)A和B溶液体积都是20mL,但是NaSO 的物质的量不同,所以,NaSO 的起始浓度
2 2 3 2 2 3
不同,A和B是探究NaSO 浓度对反应速率的影响。A和C溶液体积都是20mL,但是
2 2 3
HSO 的物质的量不同,所以,HSO 的起始浓度不同,A和B是探究HSO 浓度对反应速
2 4 2 4 2 4
率的影响,综上所述,A和B、A和C的组合比较可探究浓度对反应速率的影响,故答案
为:浓度对反应速率的影响;
(4)由分析可知,判断上述反应速率快慢的实验现象可以是出现黄色沉淀的快慢或者产生气
泡的快慢,故答案为:出现黄色沉淀的快慢或者产生气泡的快慢。
答案第8页,共2页