文档内容
绝密★考试结束前
浙江省 A9 协作体 2024 学年第二学期期中联
考 高一化学试题
考生须知:
1. 本卷满分100分,考试时间90分钟;
2. 答题前,在答题卷指定区域填写班级、姓名、考场号、座位号及准考证号并填涂相应数字。
3. 所有答案必须写在答题卷上,写在试卷上无效;
4. 考试结束后,只需上交答题卷。
5. 可能用到的相对原子质量:H1 C12 N14 O16 Na23 Si28 S32 Cl35.5 Cu64 Ag108
选择题部分
一 、选择题 (本大题共15小题,每小题2分,共30分。每小题列出的四个备选项中只有一个
是符 合题目要求的,不选、多选、错选均不得分)
1. 按物质的组成进行分类,Na[Al(OH)4]属于
A. 盐 B. 碱 C. 酸 D. 氧化物
2. 小明进入实验室想做金属钠与水反应的实验,整个实验操作过程中没有涉及到的图标
A. B. C. D.
3. 下列有关化学用语使用正确的是
A. 氯原子的结构示意图: +17288
B. 中子数为10的氧原子:180
C. 用电子式表示HCl 的形成过程:
D.NaCl 溶液中的水合离子:
4. 用球棍模型表示的某有机反应示意图如图,其反应类型是
A. 取代反应 B. 加成反应 C. 聚合反应 D. 置换反应
5. 下列物质对应的化学式不正确的是
A. 金刚砂:SiC B. 漂白液的主要成分:Ca(ClO)₂
C. 小苏打:NaHCO₃ D. 石膏:CaSO ₄·2H₂O
A9 协作体 高一化学试题 第1 页 共 8 页纯铁
2.
Fe(OH
)₃
6. 雷雨天闪电时空气中有O₃ 生成。下列说法中正确的是
A.O₂ 和O₃ 互为同分异构体
B.O₂ 和O₃ 的相互转化是物理变化
C. 相同质量的O₂ 和 O₃ 含有相同的质子数
D. 在相同的温度和压强下,相同质量的O₂ 和 O3的体积相同
7. 下列属于可再生能源的是
A. 氢能 B. 石油 C. 煤 D. 天然气
8. 化学与生产、生活、社会密切相关,下列叙述不正确的是
A. 聚乙烯耐化学腐蚀、耐寒、无毒,可用于食品保鲜袋
B. 单晶硅具有特殊的光学和电学性能,可用于作光导纤维
C.Na₂CO₃ 和 NaHCO₃ 的溶液均显碱性,可用作食用碱或工业用碱
D.SO₂ 是一种抗氧化剂,能防止葡萄酒中成分被氧化,起到保质作用
9. 近年来我国科技发展取得了巨大成就。下列相关叙述正确的是
A. “华龙一号”核电站反应堆:所用铀棒中含有的232U 与232U互为同素异形体
B. “雪龙2”号破冰船极地科考:破冰过程中水发生了化学变化
C. 大型液化天然气运输船“大鹏昊”成功建造:天然气液化过程中形成了新的化学键
D. “神舟十八号”飞船航天员穿的航天服:使用的多种合成纤维都属于有机高分子材料
10. 根据乙烯的性质推测1-丁烯(H₂C=CH-CH₂-CH₃) 的性质,下列说法中,不正确的是
A.1- 丁烯与乙烯互为同系物
B.1- 丁烯与HCl 加成的产物可能有2种
C. 聚1-丁烯的结构简式为
D. 相同质量的乙烯和1-丁烯在足量的氧气中完全燃烧,耗氧量相同
11. 下列实验装置中,无法达到实验目的的是
气体
酸性高锰
酸钾溶液 红色激光笔
A . 用 pH计精
B . 观察 NaCl D.可用于观察胶体
确 测量氯 C.除去甲烷中乙烯
的 焰色试验 的丁达尔现象
水的
p H 值
A. 该装置的能量转化形式主要为化学能→ 电能
B. 外电路中电流的流向:Al→导线 →Mg
C. 溶液中的SO₄²-向Mg 电极移动
D. 若将稀硫酸替换成NaOH 溶液,电流表指针偏向不变
第12
A9 协作体 高 一 化 学 试 题 第 2 页 共 8 页13. 工业上制备高纯硅,一般需要先制得纯度为98%左右的粗硅,再以其为原料制备高纯硅。其
中 涉及的主要化学反应为:
;(反应未配平)
下列说法正确的是
A. 反应①中另一种生成物为CO₂
B. 反应②和③互为可逆反应
C.SiHCl₃ 的空间构型为正四面体形
D. 在提纯高纯硅的过程中,HCI 和 H₂ 可以循环使用
14. 下列离子方程式不正确的是
A. 氯化铝溶液中滴加过量的氨水:Al³++3NH₃H₂O=Al(OH)₃J+3NH4
B. 氯气通入Ca(OH)₂悬浊液中:Cl₂+Ca(OH)₂===Ca²++C-+ClO-+H₂O
C. 向二元弱酸H₃PO₃溶液中滴入足量烧碱溶液:H₃PO₃+3OH-===PO₃³-+2H₂O
D. 用 FeCl₃溶液刻蚀覆铜板制作印刷电路板:2Fe³++Cu==2Fe²++Cu²+
15. 以空气和钢铁酸洗废液(主要含有FeCl₂和 HC1)为原料合成Fe₂ (OH)₀Cl₆-n,原理如下图所
示。
下列说法中,不正确的是
A. 反应I 、Ⅱ 、Ⅲ 都为氧化还原反应
B. 反应Ⅱ后体系pH 升高
C. 生成FeCl₃的总反应可表示为4FeCl₂+O₂+4HCl
第15题图
催化剂 4FeCl₃+2H₂O
D.NO 可作为生成FeCl₃ 的总反应的催化剂
二、选择题(本大题共10小题,每小题3分,共30分。每小题列出的四个备选项中只有一个
是符
合题目要求的,不选、多选、错选均不得分)
16. 在实验室中,几位同学围绕浓硫酸的化学性质进行了如下
实验探究:将适量的蔗糖(C₁₂H₂₂Oi₁)放入烧杯中,加入几滴
水,搅拌均匀;然后再加入适量浓硫酸,迅速搅拌,观察
① ②
到蔗糖逐渐变黑,体积膨胀,并产生有刺激性气味的气体。
下列说法不正确的是 浓硫酸 蔗
糖 第16题图
A. 生成的黑色物质主要为单质碳
B. 将有刺激性气味的气体通入紫色石蕊溶液中,溶液先变红后褪色
C. 上述实验现象体现了浓硫酸的吸水性、脱水性和强氧化性
D. 该实验的缺点是可能带来环境污染
17. 在恒温条件下,将2mol A 和 2mol B 两种气体混合于2L 恒容密闭容器中,发生如下反
应: A(g)+2B(g)=C(g)。2min 末该反应达平衡,测得C 的物质的量为0.8mol。下列判断正
确的是
A. 若升高温度,正反应速率增大,逆反应速率减小
B. 若再加入1mol 氦气,该反应速率增大
C. 平衡时B 的物质的量浓度为0.4 mol-L-1
D. 气体A 的平衡转化率α(A)=40%
A9 协作体 高 一 化学试题 第 3 页共 8 页18.元素周期表的建立是化学发展史上的重要里程碑。如表列出8种元素在周期表中的位置:
周期 0
IA IA IIIA IVA VA VIA VIIA
1 X
2 Y Z U
3 V W Q E
下列说法不正确的是
A. 离子半径:U2->V+
B.Z、Q 分别与X 形成的化合物的沸点:QX₃>ZX3
C. 最高价氧化物对应的水化物的酸性:H₂YO₃>H₂WO₃
D. 元 素U 和E 形成的某种化合物可作为水处理中的消毒剂
19.NA 为阿伏加德罗常数的值。下列说法正确的是
A.1mol/L 的碳酸钠溶液中钠离子数为2NA
B.6.4gCu 与足量硫粉反应,转移电子数为0.1NA
C. 标准状况下,2.24 L CHCl₃分子中所含氯原子的总数为0.3NA
D.0.2mol SO₂和0.1mol O₂在一定条件下充分反应后的分子总数为0.2NA
20. 提纯 NaCl 粗品(含少量的 Ca²+ 、Mg²+和 SO}-)得到精盐的方案如下,所用试剂为 BaCl₂ 溶
液、 Na₂CO₃ 溶 白 液 色 、 沉淀 盐酸和NaOH 溶液(过程中所加试剂均过量)。
操作 试剂1 试剂2 试剂3 操作
粗盐 粗盐水
I Ⅱ
试剂4 操作Ⅲ 滤液一 精盐水
精盐
下列说法不正确的是
A. 操作I 、Ⅱ 、Ⅲ都要用到玻璃棒
B. 若试剂2是NaOH 溶液,则试剂3一定是Na₂CO₃ 溶液,试剂4为盐酸
C. 滤液中只含有Na+ 、CI-和OH
D. 操作Ⅲ的操作:精盐水蒸发至大量固体析出,停止加热,利用余热使滤液蒸干即得精盐
21. 在元素周期表中,某些主族元素与右下方的主族元素(如右下图)的有些性质是相似的,这种
相似性被称为对角线规则。下表中“方法导引”与“示例”对应关系不正确的是
选项 方法导引 示例
A 比较 Mg的金属性强于Be
Li Be B
单质Si的熔点较高,则单质硼的熔点也
B 预测
很 高
Mg Al Si
向BeCl₂溶液中逐滴加入2mol/L的NaOH
第21
C 实验 溶液至过量,能看到先产生白色絮状沉淀,
然后溶解
Na元素与右上角的Be元素也有类似的
D 模型
对 角线规则,性质上也具有一定的相似
性
A9 协作体 高 一 化 学 试 题 第 4 页 共 8 页铁
粉
含铁
烧渣
酸浸 滤液A 滤液B
滤渣
A
下列说法正确的是
A. 柠檬酸的化学式:C₆H₈O₇
B. 滤渣A 的主要成分是SiO₂, 滤渣B 为 Cu
C. 滤液B 与过量的NH₄HCO₃ 溶液反应的离子方程式为:Fe²+
+CO₃²⁻=FeCO₃J D.FeCO₃ 制备柠檬酸亚铁的反应类型为置换反应
23. 按下图装置进行实验。搅拌一段时间后,滴加浓盐酸。不同反应阶段的预期现象及其相应推
理 不合理的是
滴管
气球
浓盐酸
湿润的红
色 石蕊
试纸
适量NH₄Cl
与
Ba(OH)₂8H₂O
电磁搅拌器
第23题图
A. 搅拌一段时间后烧瓶壁会变冷,说明NH₄Cl 与 Ba(OH)₂·8H₂O 的反应为吸热反应
B. 搅拌一段时间后试纸会变蓝,说明有NH₃ 生成
C. 滴加浓盐酸后,有白烟产生
D. 整个实验过程中,气球会一直变大
24. 铁元素部分价态的价类二维图如图所示,下列说法不正确的是
A.c→f 和 f→c 的反应都有可能是化合反应
B. 在 g→f→e→d 转化过程中,每步反应都存在物质颜色的变
化 C.a 和酸反应都能生成f
D.b 常用作油漆、涂料、油墨和橡胶的红色颜料
A9 协作体 高 一 化 学 试 题 第 5 页 共 8 页25. 下列实验方案设计、现象和结论都正确的是
目 的 方案设计 现象和结论
分别向两支试管中各放入少量碳
鉴别碳酸钠和碳酸 温度升高的是碳酸钠,温度
A 酸钠和碳酸氢钠固体,分别滴入
氢钠固体 几滴水,用温度计测定温度变化 降低的是碳酸氢钠
若滴加 KSCN 溶液无现
检验Fe³+、Fe²+混 向溶液中先滴加KSCN溶液,
B 象, 滴加氯水后溶液变
合 溶液中的Fe²+ 再 滴加氯水
红,则说 明有 Fe²+
向煮沸的氢氧化钠水溶液中滴入 当液体变为红褐色,则得到
C 制备氢氧化铁胶体
5~6滴饱和氯化铁溶液 氢氧化铁胶体
若出现红棕色气体,则说明
探究木炭与浓硝酸 在烧瓶中加入木炭颗粒与浓硝
D 木炭具有还原性,能还原
的反应 酸,然后加热
HNO₃
非选择题部分
三、非选择题(本大题共4小题,共40分)
26. (10分)请回答:
(1)胆矾的化学式_ ; 水的电子式 是 ▲
(2)写出丙烷与氯气发生取代反应生成的一氯取代物(含两个甲基)的结构简式 △ 0
;
(3)元素 Se 的原子结构示意图为+328186,写出元素 Se 在元素周期表中的位置▲
SeO₂ 在一定条件下可与足量的NaOH 溶液反应,书写该反应的化学方程式_ ▲ o
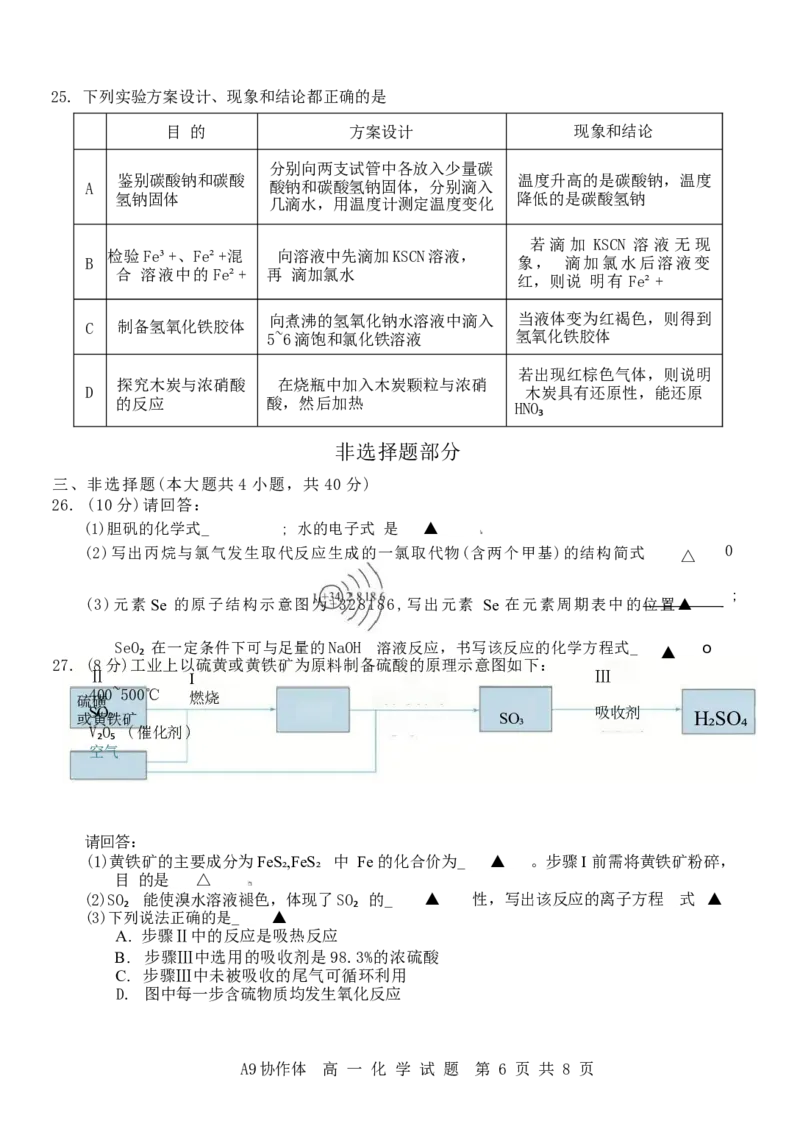
27. (8分)工业上以硫黄或黄铁矿为原料制备硫酸的原理示意图如下:
Ⅱ I Ⅲ
硫 4 磺 00~500℃ 燃烧
或 S 黄 O 铁 ₂ 矿 SO₃ 吸收剂 H₂SO₄
V₂O₅ (催化剂)
空气
请回答:
(1)黄铁矿的主要成分为FeS₂,FeS₂ 中 Fe 的化合价为_ ▲ 。步骤I 前需将黄铁矿粉碎,
目 的是 △
(2)SO₂ 能使溴水溶液褪色,体现了SO₂ 的_ ▲ 性,写出该反应的离子方程 式 ▲
(3)下列说法正确的是_ ▲
A. 步骤Ⅱ中的反应是吸热反应
B. 步骤Ⅲ中选用的吸收剂是98.3%的浓硫酸
C. 步骤Ⅲ中未被吸收的尾气可循环利用
D. 图中每一步含硫物质均发生氧化反应
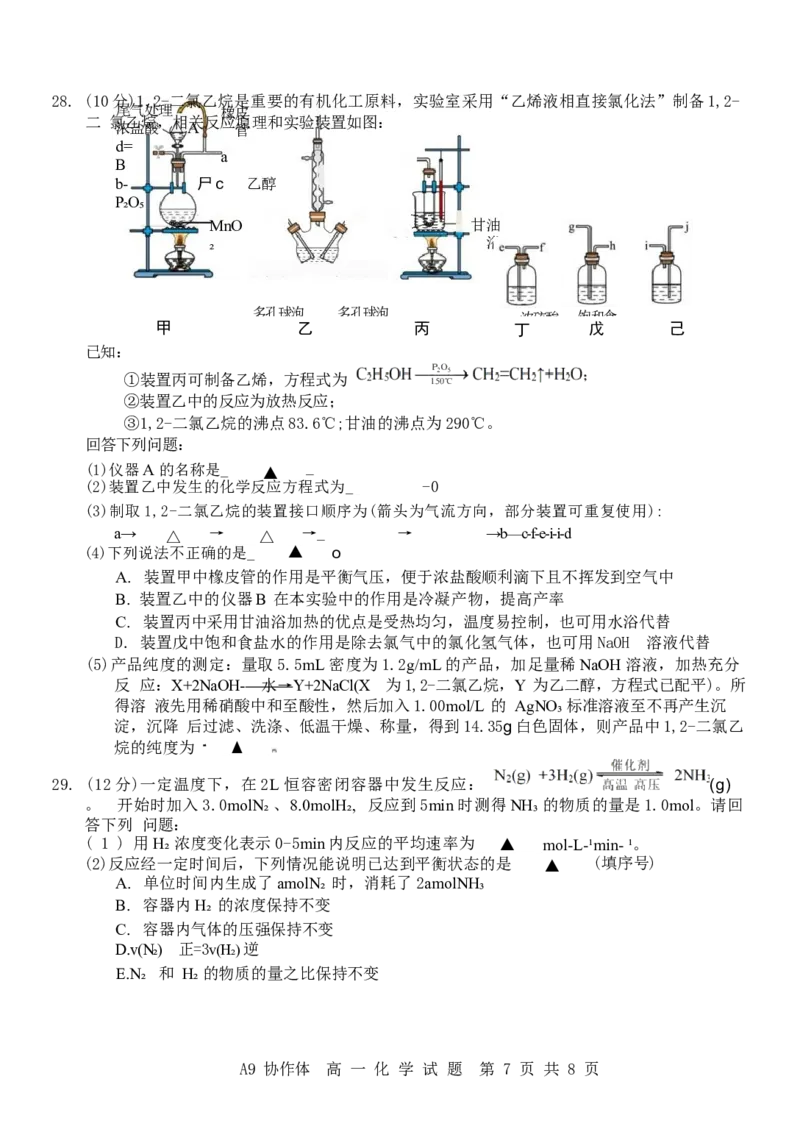
A9协作体 高 一 化 学 试 题 第 6 页 共 8 页28. (10分)1,2-二氯乙烷是重要的有机化工原料,实验室采用“乙烯液相直接氯化法”制备1,2-
尾气处理 橡皮
二 氯乙烷,相关反应原理和实验装置如图:
浓盐酸 △A 管
d=
a
B
b- 尸c 乙醇
P₂O₅
MnO 甘油
₂ 浴
多孔球泡 多孔球泡 浓硫酸 饱和食
甲 乙 丙 丁 戊 己
已知:
①装置丙可制备乙烯,方程式为
②装置乙中的反应为放热反应;
③1,2-二氯乙烷的沸点83.6℃;甘油的沸点为290℃。
回答下列问题:
(1)仪器A 的名称是_ ▲ _
(2)装置乙中发生的化学反应方程式为_ -0
(3)制取1,2-二氯乙烷的装置接口顺序为(箭头为气流方向,部分装置可重复使用):
a→ △ → △ →_ → →b—c-f-e-i-i-d
(4)下列说法不正确的是_ ▲ o
A. 装置甲中橡皮管的作用是平衡气压,便于浓盐酸顺利滴下且不挥发到空气中
B. 装置乙中的仪器B 在本实验中的作用是冷凝产物,提高产率
C. 装置丙中采用甘油浴加热的优点是受热均匀,温度易控制,也可用水浴代替
D. 装置戊中饱和食盐水的作用是除去氯气中的氯化氢气体,也可用NaOH 溶液代替
(5)产品纯度的测定:量取5.5mL 密度为1.2g/mL的产品,加足量稀NaOH 溶液,加热充分
反 应:X+2NaOH- 水→Y+2NaCl(X 为1,2-二氯乙烷,Y 为乙二醇,方程式已配平)。所
得溶 液先用稀硝酸中和至酸性,然后加入1.00mol/L 的 AgNO₃ 标准溶液至不再产生沉
淀,沉降 后过滤、洗涤、低温干燥、称量,得到14.35g白色固体,则产品中1,2-二氯乙
烷的纯度为 一 ▲
29. (12分)一定温度下,在2L 恒容密闭容器中发生反应: (g)
。 开始时加入3.0molN₂ 、8.0molH₂, 反应到5min 时测得NH₃ 的物质的量是1.0mol。请回
答下列 问题:
( 1 ) 用H₂ 浓度变化表示0-5min内反应的平均速率为 ▲ mol-L-¹min- ¹。
(2)反应经一定时间后,下列情况能说明已达到平衡状态的是 ▲ (填序号)
A. 单位时间内生成了amolN₂ 时,消耗了2amolNH₃
B. 容器内H₂ 的浓度保持不变
C. 容器内气体的压强保持不变
D.v(N₂) 正=3v(H₂) 逆
E.N₂ 和 H₂ 的物质的量之比保持不变
A9 协作体 高 一 化 学 试 题 第 7 页 共 8 页(3)已知某条件下断裂1mol 下列化学键需要吸收的能量如下表所示:
化学键 H-H N-H N-N N=N
能量/KJ 436 391 193 946
①若在该条件下N₂ 和H₂ 发生反应,生成2molNH₃ 能放 出 ▲ kJ能量。
②NH₃ 比 NH₂-NH₂ 更稳定的原因是_ o
(4)充满NH₃ 的试管倒插在滴有酚酞的水中的实验现象_ -0
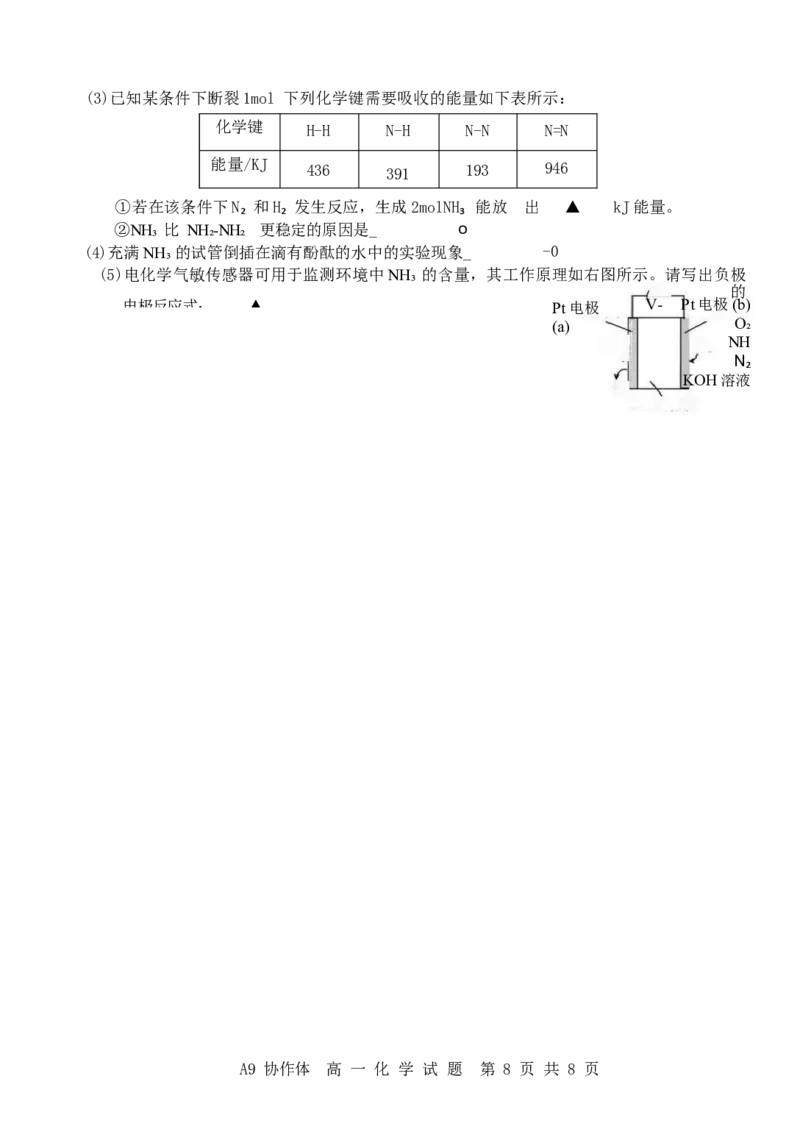
(5)电化学气敏传感器可用于监测环境中NH₃ 的含量,其工作原理如右图所示。请写出负极
的
电极反应式: ▲ Pt电极 V- Pt电极(b)
(a) O₂
NH
N₂
KOH溶液
A9 协作体 高 一 化 学 试 题 第 8 页 共 8 页协作体 2024 学年第二学期期中联
浙 江 省 A9
考 高一化学参考答案
一 、选择题(本大题共15小题,每小题2分,共30分。每小题列出的四个备选项中只有一个
是符 合题目要求的,不选、多选、错选均不得分)
题号 1 2 3 4 5 6 7 8 9 10
答案 A C B A B C A B D C
题号 11 12 13 14 15
答案 C D D C A
二、选择题(本大题共10小题,每小题3分,共30分。每小题列出的四个备选项中只有一个
是符 合题目要求的,不选、多选、错选均不得分)
题号 16 17 18 19 20 21 22 23 24 25
答案 B D B B C D A D C A
三、非选择题(本大题共4小题,共40分)
26 . (10 分)
(1)CuSO₄·5H₂O(2 分 ) ; H:0:H(2 分 ) 。
(2)CH₃CHCICH₃(2 分 ) 。
(3)第四周期第VIA 族 ( 2 分 ) ;SeO₂+2NaOH=Na₂SeO₃+H₂O(2 分 ) 。
2 7 . ( 8 分 )
(1)+2(1 分);增大接触面积,加快反应速率(或使反应更充分)(2 分)。
(2)还原性(1分); SO₂+Br₂+2H₂O=SO₄²-+2Br⁻+4H+(2 分 ) 。
(3)BC(2 分,多选错选不得分,选对1个给1分)。
28 . (10 分)
(1)分液漏斗(2 分)。
(2)Cl₂+CH₂=CH₂→CH₂CICH₂Cl(2 分 ) 。
(3)ghef(2 分,选错或次序错误均不得分)。
(4)CD(2 分,多选错选不得分,选对1个给1分)。
(5)75%(2 分)
29 . (12 分)
(1)0 . 15(2分)。
(2)BCE(2 分,多选错选不得分,选对2个给1分)。
(3)①92(2分);②打断1mol的 N-N 共价键所需要的能量要比N-H 共价键的能量低,N
-N 键比N-H 不牢固,所以氨气要比肼稳定(2分)。
(4)水充满整个试管,试管内溶液呈红色(2分)。
(5)2NH₃-6e⁻+60H⁻=N₂+6H₂O(2 分 ) 。
浙江省A9协作体 化学答案 第 1 页 共 1 页