文档内容
1999 年湖南高考化学真题及答案
本试卷分第I卷(选择题〕和第II卷(非选择题)两部分,第I卷1至4页,第II卷5至
10页。共150分。考试时间[120]分钟。
第I卷(选择题共:83分)
注意事项:
1. 答第I卷前,考生务必将自己的姓名、准考证号、考试科目用铅笔涂写在答题卡上。
2. 每小题选出答案后,用铅笔把答题卡上对应题目的答案标号涂黑如需改动佣橡皮擦干净
后。再选涂其它答案,不能答在试题卷上。
3. 考试结束,监考人将本试卷和答题卡一并收回。
4. 可能用到的原子量:H-l C-12 N-14 O- l6 Na-23 Mg-24
一.选择题(本题包括5小题,每小题3分,并15分,每小题只有一个选项符合题意。)
1.近年来,我国许多城市禁止汽车使用含铅汽油,其主要原因是------[C]
(A)提高汽油燃烧效率 (B)降低汽油成本
(C)避免铅污染大气 (D)铅资源短缺
2.Murad等三位教授最早提出NO分子在人体内有独特功能,近年来此领域研究有很大进展,
因此这三位教授荣获了1998年诺贝尔医学及生理学奖,关于NO的下列叙述不正确的
是----[D]
(A)NO可以是某些含低价N物质氧化的产物 (B)NO不是亚硝酸酐
(C)NO可以是某些含高价N物质还原的产物 (D)NO是红棕色气体
3.原计划实现全球卫星通讯需发射77颗卫星,这与铱(Ir〕元素的原子核外电子数恰好相
等,因此称为“铱星计划”。已知铱的一种同位素是 ,则其核内的中子数是--[B]
(A)77 (B)114 (C)191 (D)268
第1页 | 共11页4.已知自然界中铱有两种质量数分别为191和193的同位素,而铱的平均原子量为
192.22,这两种同位素的原子个数比应为------[A]
(A)39∶61 (B)61∶39 (C)1∶1 (D)39∶11
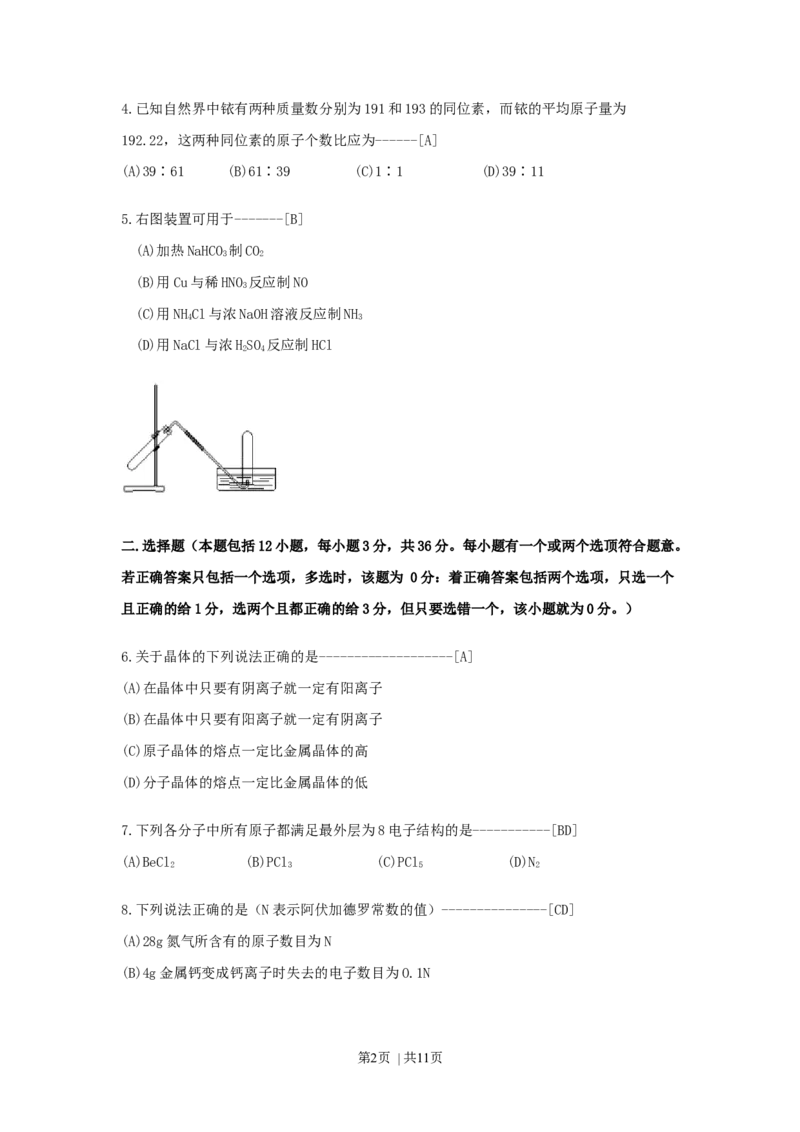
5.右图装置可用于-------[B]
(A)加热NaHCO 制CO
3 2
(B)用Cu与稀HNO 反应制NO
3
(C)用NHCl与浓NaOH溶液反应制NH
4 3
(D)用NaCl与浓HSO 反应制HCl
2 4
二.选择题(本题包括12小题,每小题3分,共36分。每小题有一个或两个选顶符合题意。
若正确答案只包括一个选项,多选时,该题为 0分:着正确答案包括两个选项,只选一个
且正确的给1分,选两个且都正确的给3分,但只要选错一个,该小题就为0分。)
6.关于晶体的下列说法正确的是-------------------[A]
(A)在晶体中只要有阴离子就一定有阳离子
(B)在晶体中只要有阳离子就一定有阴离子
(C)原子晶体的熔点一定比金属晶体的高
(D)分子晶体的熔点一定比金属晶体的低
7.下列各分子中所有原子都满足最外层为8电子结构的是-----------[BD]
(A)BeCl (B)PCl (C)PCl (D)N
2 3 5 2
8.下列说法正确的是(N表示阿伏加德罗常数的值)---------------[CD]
(A)28g氮气所含有的原子数目为N
(B)4g金属钙变成钙离子时失去的电子数目为O.1N
第2页 | 共11页(C)lmol甲烷的质量与N个甲烷分子的质量之和相等
(D) 标准状况下,22.4L甲烷和乙炔混合物所含的分子数为N
9.下列反应的离子方程式正确的是-------------------------[AD]
(A)碳酸氢钙溶液跟稀硝酸反应
(B)饱和石灰水跟稀硝酸反应
(C)向稀氨水中加入稀盐酸
(D)碳酸钙溶于醋酸中
10.反应 在10L密闭容器中进行,
半分钟后,水蒸气的物质的量增加了0.45mol,则此反应的平均速率 (X)(反应物的消耗
速率或产物的生成速率)可表示为---------[C]
11.关于IA族和IIA族元素的下列说法中正确的是------------[B]
(A)在同一周期中,IA族单质的熔点比IIA族的高
(B)浓度都是0.01mol.L-1时,氢氧化钾溶液的pH比氢氧化钡的小
(C)氧化钠的熔点比氧化镁的高
(D)加热时,碳酸钠比碳酸镁易分解
12.化合物的 中的OH被卤原子取代所得的化合物称为酰卤,下列化合物中可以
看作酰卤的是---[AC]
(A)HCOF (B)CCl (C)COCl (D)CHClCOOH
4 2 2
第3页 | 共11页13.x、y、z为短周期元素,这些元素原子的最外层电子数分别是1、4、6.则由这三种元
素组成的化合物的化学式不可能是----------[A]
(A)XYZ (B)XYZ (C)XYZ (D)XYZ
2 2 2 2 3
14.氢镍电池是近年开发出来的可充电电池,它可以取代会产生污染的铜镍电池。氢镍电池
的总反应式是
根据此反应式判断,下列叙述中正确的是--------[CD]
(A)电池放电时,电池负极周围溶液的PH不断增大
(B)电池放电时,镍元素被氧化
(C)电池充电时,氢元素被还原
(D)电池放电时,H 是负极
2
15.下列各组离于在溶液中既可以大量共存,且加入氨水后也不产牛沉淀的是[B]
16.下列各组稀溶液,不用其它试剂或试纸,仅利用溶液间的相互反应。就可以将它们区别
开的是-------[BD]
(A)硝酸钾 硫酸钠 氯化钙 氯化钡
(B) 硫酸 硫酸铝 氯化钠 氢氧化钠
(C)盐酸 硫酸钠 碳酸钠 氢氧化钠
(D)硫酸氢钠 硫酸镁 碳酸钠 氢氧化钠
第4页 | 共11页17.下列有机分子中,所有的原子不可能处于同一平面的是-----------------[D]
三.选择题(本题包括8小题,每小题4分,共32分。每小题只有一个选项符合题意。)
18.用0.1mol.L-1 NaOH溶液滴定0.lmol.L-1盐酸,如达到滴定的终点时不慎多加了1滴
NaOH溶液(1滴溶液的体积约为0.05mL〕.继续加水至50mL,所得溶液的pH是------[C]
(A)4 (B)7.2 (C)10 (D)11.3
19.X、Y、Z为三种气体。把 a molX和 b molY充入一密闭容器中。发生反应X+2Y 2Z
达到平衡时,若它们的物质的量满足:n(X)+n(Y)=n(Z),则Y的转化率为---------
[B]
(A) (B)
(C) (D)
20.已知25%氨水的密度为0.91 ,5%氨水的密度为0.98 ,若将上述两溶液
等体积混合,所得氨水溶液的质量分数是------------------[C]
(A) 等于15% (B)大于15% (C)小于15% (D)无法估算
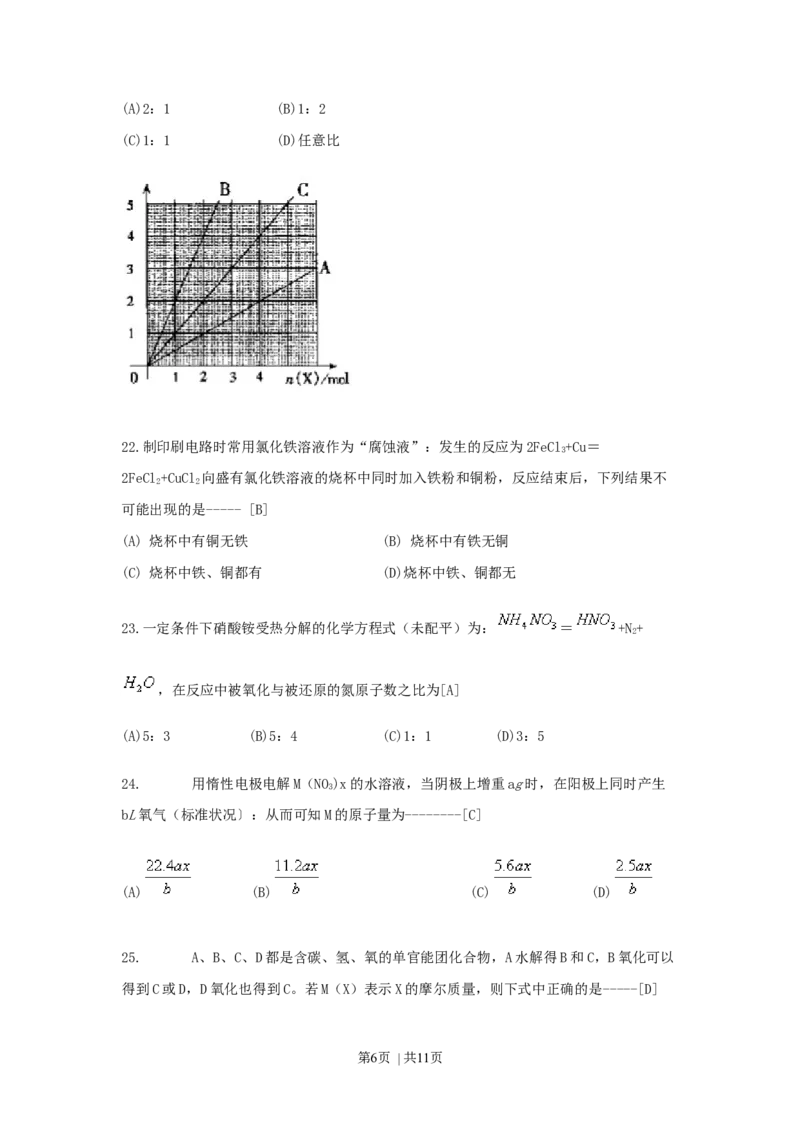
21.右图中横坐标表示完全燃烧时耗用可燃气体X(X=A、B、C)的物质的量n(X).纵坐标
表示消耗O 的物质的量n(O),A、B是两种可燃气体,C是A和B的混合气化则C中n(A):
2 2
n(B)为---------[A]
第5页 | 共11页(A)2:1 (B)1:2
(C)1:1 (D)任意比
22.制印刷电路时常用氯化铁溶液作为“腐蚀液”:发生的反应为2FeCl+Cu=
3
2FeCl+CuCl 向盛有氯化铁溶液的烧杯中同时加入铁粉和铜粉,反应结束后,下列结果不
2 2
可能出现的是----- [B]
(A) 烧杯中有铜无铁 (B) 烧杯中有铁无铜
(C) 烧杯中铁、铜都有 (D)烧杯中铁、铜都无
23.一定条件下硝酸铵受热分解的化学方程式(未配平)为: = +N+
2
,在反应中被氧化与被还原的氮原子数之比为[A]
(A)5:3 (B)5:4 (C)1:1 (D)3:5
24. 用惰性电极电解M(NO)x的水溶液,当阴极上增重ag时,在阳极上同时产生
3
bL氧气(标准状况〕:从而可知M的原子量为--------[C]
(A) (B) (C) (D)
25. A、B、C、D都是含碳、氢、氧的单官能团化合物,A水解得B和C,B氧化可以
得到C或D,D氧化也得到C。若M(X)表示X的摩尔质量,则下式中正确的是-----[D]
第6页 | 共11页(A)M(A)=M(B)+M(C) (B)2M(D)= M(B)+M(C)
(C)M(B)< M(D)
第II卷(非选择题共67分〕
注意事项:1.第II卷共6页,用钢笔或圆珠笔直接答在试题卷上。
2.答卷前将密封线内的项目填写清楚。
四.(本题包括2小题,共18分)
26.(4分)填空
(1)图1表示10mL量筒中液面的位置,A与B,B与C刻度间相差1mL, 如果刻度A为
4,量简中液体的体积是【答:3.2】mL。
(2)图II表示50mL滴定管中液画的位置,如果液面处的读数是a ,则滴定管中液体的体
积(填代号)【答:D】。
(A) 是amL (B)是(50-a)mL
(C) 一定大于amL (D)一定大于(50-a)mL
27.(14分)为了测定人体新陈代谢呼出气体中CO 的体积分数,某学生课外小组设计了如
2
下图的实验装置。实验中用过量NaOH溶液吸收气体中的CO,准确测量瓶I中溶液吸收CO
2 2
后的增重及剩余气体的体积(实验时只用嘴吸气和呼气),请填空。
(1)图中瓶II的作用【答:除去吸人空气中的CO】。
2
(2) 对实验装置尚有如下A、B、C、D四种建议,你认为合理的是【答:D】。(填代号〕
(A) 在E处增加CaCl 干燥管 (B)在下处增加CaCl 燥管
2 2
(C)在E和F两处增加CaCl 干燥管 (D)不必增加干燥管
2
(3)将插入溶液的管子项端改成具有多孔的球泡(图中的III),有利于提高实验的准确度,
其理由是【答:可增大气体与溶液的接触面积,使气体中的CO 被充分吸收】。
2
(4)实验时先缓缓吸气,再缓缓呼气,反复若干次,得如下数据:瓶I溶液增重ag,收集
到的气体体积(标准状况)为bL,该呼出气体中CO 的体积分数是(列出算式)
2
第7页 | 共11页【答: 】。
(5)实验中若猛吸猛呼,会造成不安全后果,猛吸时会【答:把瓶1中的NaOH溶液吸人口
中】。猛呼时会【答:把瓶II中的NaOH溶液吹出瓶外】。
五.(本题包括2小题,共17分)
28.(8分〕提示:某些金属氧化物跟熔融烧碱反应可生成盐。根据以下化学反应框图填空:
(1)单质F是【答:H】。
2
(2)写出由E生成G的离子反应方程式(或化学方程式)。
【答:4Fe2++8NH·HO+O+2HO=4Fe(OH)↓+8NH+
3 2 2 2 3 4
或:Fe2++2NH·HO=Fe(OH)↓+2NH+ 4Fe(OH)+O+2HO=4Fe(OH)】
3 2 2 4 2 2 2 3
(3)溶液I中所含金属离子是【答:Al3+和Na+】。
(4)由C→E+F若改用浓酸,则不能选用的浓酸是(写分子式)【答:HSO(或HNO)】。
2 4 3
29.(9分)某二元弱酸(简写为HA)溶液,按下式发生一级和二级电离:
2
HA H++HA- HA- H++A2-
2
已知相同浓度时的电离度α(HA)> α(HA-),设有下列四种溶液:
2
(A)0.01mol.L-1的HA溶液
2
(B)0.01mol.L-1的NaHA溶液
第8页 | 共11页(C)0.01mol.L-1的HCl与0.04mol.L-1的NaHA溶液等体积混合液
(D)0.02mol.L-1的NaOH与0.02 mol.L-1的NaHA溶液等体积混合液
据此,填写下列空白(填代号)
(1) [H+]最大的是【答:A】,最小的是【答:D】。
(2)[HA]最大的是【答:C】,最小的是【答:D】。
2
(3)[A2-]最大的是【答:D】, 最小的是【答:A】。
六.(本题包括2小题,共17分)
30.(7分)紫杉醇是一种新型抗癌药,其分子式为C H NO ,它是由如下的A酸和B醇生成
47 51 14
的一种酯。
(1)A可在无机酸催化下水解,其反应方程式是:
【答】:
(2)A水解所得的氨基酸不是天然蛋白质水解产物,因为氨基不在(填希腊字母)【答:
α】位。
(3)写出ROH的分子式【答:C H O 】
31 38 11
31.(10分)提示:通常,溴代烃既可以水解生成醇,也可以消去溴化氢生成不饱和烃。
如:
请观察下列化合物A→H的转换反应的关系图(图中副产物均未写出),并填写空白:
第9页 | 共11页(1)写出图中化合物C、G、H的结构简式:C_______G________H_______。
【答】:
(2)属于取代反应的有【答:①③⑥⑧】。(填数字代号,错答要倒扣分〕
七.(本题包括2小题,共15分)
32.(6分)取一根镁条置于坩埚内点燃,得到氧化镁和氮化镁混合物的总质量为0.470g冷
却后加入足量水,将反应产物加热蒸于并的烧,得到的氧化镁质量为0.486 g。
(1)写出氮化镁与水反应生成氢氧化镁和氨的化学方程式。
【答:MgN+6HO=2NH↑+3Mg(OH)】
3 2 2 3 2
(2)计算燃烧所得混合物中氮化镁的质量分数。
【答:17%】
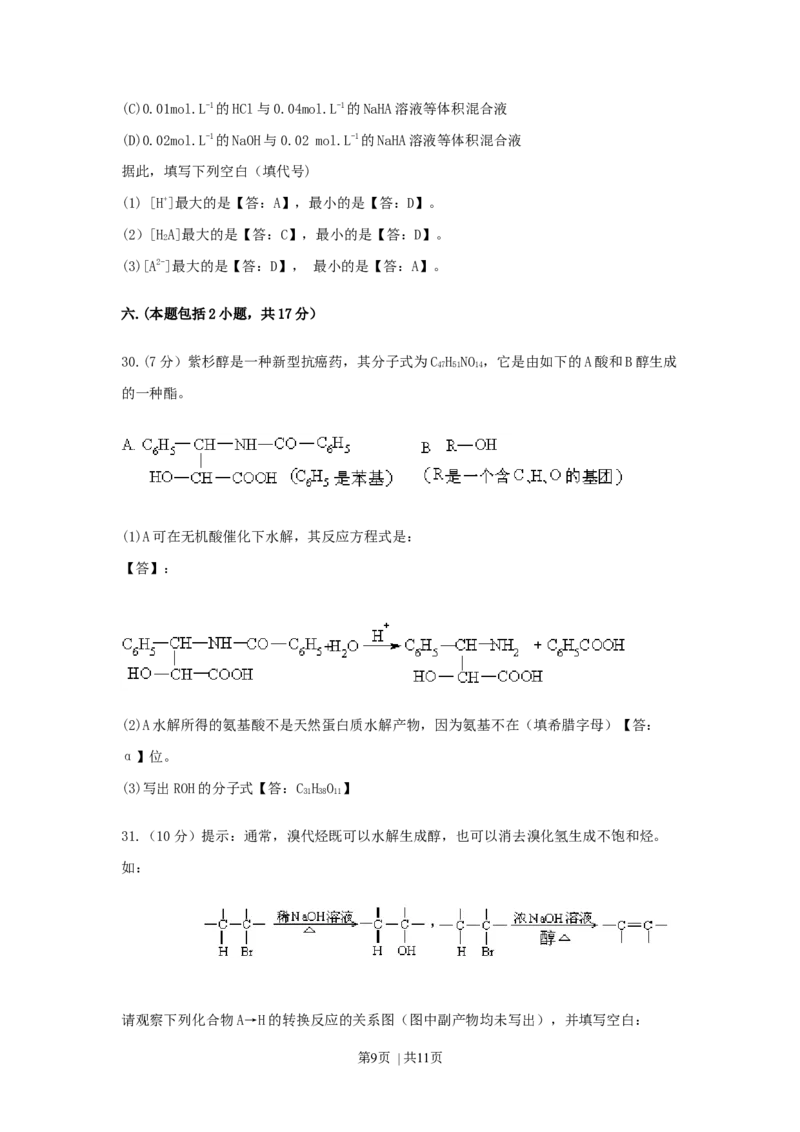
33.(9分)(1)中学教材上图示了NaCl晶体结构,它向三维空间延伸得到完美晶体。 NiO
(氧化镍〕晶体的结构与NaCl相同,Ni2+与最邻近O2-的核间距离为a×10-8cm,计算NiO晶
体的密度(已知NiO的摩尔质量为74.7 )。
(2)天然的和绝大部分人工制备的晶体都存在各种缺陷,例如在某种 NiO晶体中就存在如
右图所示的缺陷:一个Ni2+空缺,另有两个Ni2+被两个Ni3+所取代。其结果晶体仍呈电中性,
但化合物中Ni和O的比值却发生了变化。某氧化镍样品组成为Ni O,试计算该晶体中
0.97
Ni3+与Ni2+的离子数之比。
第10页 | 共11页【解】:(1)1cm3中阴、阳离子总数=
1cm3中 Ni2+-O2-离子对数= ×
密度= =
(2)设1mol Ni O中含Ni3+x mol, Ni2+(0.97-x)mol
0.97
根据电中性:3x mol + 2(0.97-x)mol=2×1mol
x=0.06
Ni2+为(0.97-x)mol=0.91
离子数之比 Ni3+ : Ni2+=0.06 : 0.91=6:91
第11页 | 共11页