文档内容
第二章《 海水中的重要元素——钠和氯》单元检测题
一、单选题
1.下列变化属于化学变化的是
A.车胎爆炸 B.工业制氯气 C.碘的升华 D.海水晒盐
2.设N 表示阿伏伽德罗常数,下列叙述中正确的是
A
A.常温常压下,11.2 L HO所含原子数为1.5N
2 A
B.常温常压下,92gNO 和NO 混合气体中含有原子总数为6N
2 2 4 A
C.标准状况下,22.4 L氦气中所含原子数为2N
A
D.常温常压下,18gHO中含有电子数为3N
2 A
3.下列说法中不正确的是
A. 在与金属反应时表现强氧化性
B.任何物质的燃烧必须有 参与
C. 与 反应的离子方程式为
D.漂白粉的主要成分 和
4.将钠投入滴有紫色石蕊的水中,下列有关现象的叙述中错误的是
A.钠浮在液面上 B.有沉淀产生
C.溶液变为蓝色 D.钠熔成小球并在水面四处游动
5.用 表示阿伏加德罗常数的值,下列说法正确的是
A.11.2 L 含有的分子数为
B.相同质量的 与 所含氧原子个数比为4:6
C.标准状况下,22.4 L 中含有氢原子的个数为
D.1 mol 和 的混合物中含的氧原子数为
6.下列各组中两种物质作用时,反应条件或反应物用量改变,对生成物没有影响的是
A.NaOH溶液与CO B.NaHCO 和盐酸
2 3
C.Na与O D.NaHSO 溶液与Ba(OH) 溶液
2 4 2
7.钙元素在人体血液中以钙离子的形式存在,正常指标参考值为2.13×10-3~2.70 ×10-3 mol·L-1。表示该指标的物理
量是
A.溶解度 B.体积分数 C.物质的量浓度 D.质量分数
8.用N 表示阿伏加德罗常数,下列说法正确的是
A
A.摩尔是一个基本物理量
B.含有2N 个氢原子的水,其物质的量为1 mol
A
C.0.5 mol氧气所含氧元素为N
A
D.2 mol NaCl中含离子数2N
A
9.实验室利用NaOH固体配制480mL0.1mol·L-1的NaOH溶液时,以下操作会使溶液的浓度偏高的是
A.用滤纸称量NaOH固体
B.溶解后没有冷却便进行定容
C.定容时仰视刻度线
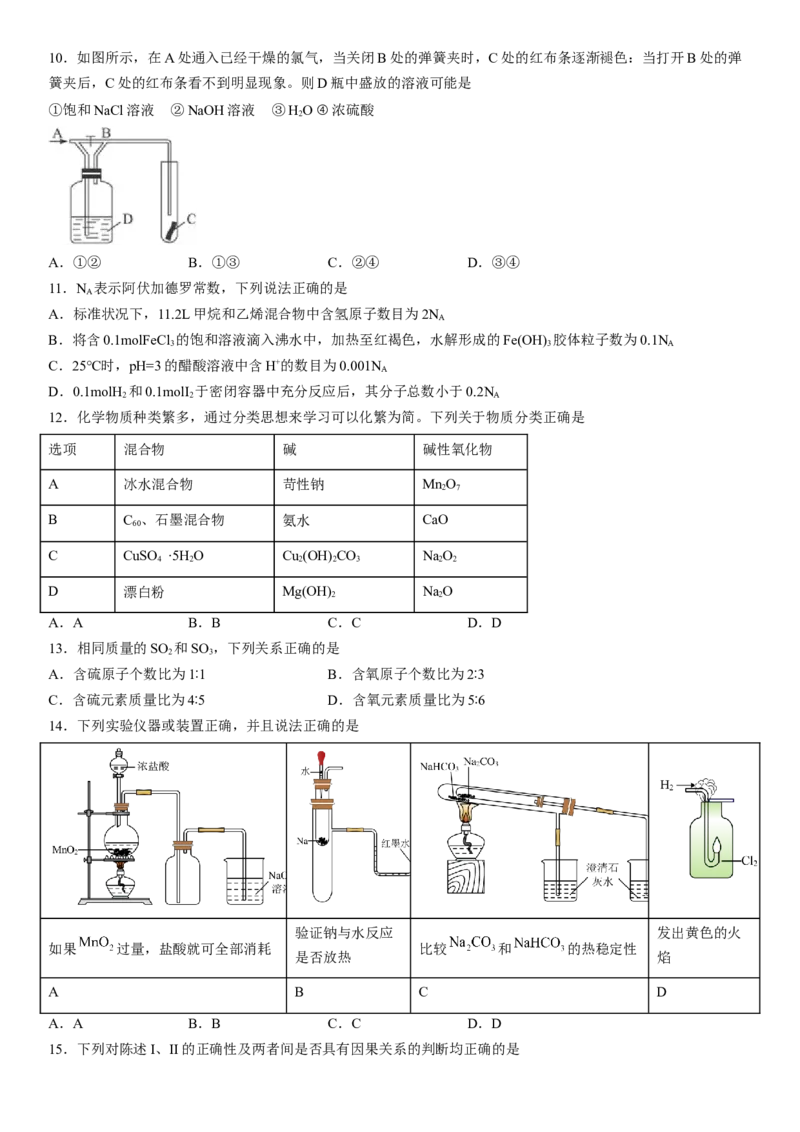
D.将容量瓶中的溶液转移到试剂瓶的过程中,不慎有少量溶液溅出10.如图所示,在A处通入已经干燥的氯气,当关闭B处的弹簧夹时,C处的红布条逐渐褪色:当打开B处的弹
簧夹后,C处的红布条看不到明显现象。则D瓶中盛放的溶液可能是
①饱和NaCl溶液 ②NaOH溶液 ③HO ④浓硫酸
2
A.①② B.①③ C.②④ D.③④
11.N 表示阿伏加德罗常数,下列说法正确的是
A
A.标准状况下,11.2L甲烷和乙烯混合物中含氢原子数目为2N
A
B.将含0.1molFeCl 的饱和溶液滴入沸水中,加热至红褐色,水解形成的Fe(OH) 胶体粒子数为0.1N
3 3 A
C.25℃时,pH=3的醋酸溶液中含H+的数目为0.001N
A
D.0.1molH 和0.1molI 于密闭容器中充分反应后,其分子总数小于0.2N
2 2 A
12.化学物质种类繁多,通过分类思想来学习可以化繁为简。下列关于物质分类正确是
选项 混合物 碱 碱性氧化物
A 冰水混合物 苛性钠 MnO
2 7
B C 、石墨混合物 氨水 CaO
60
C CuSO ∙5H O Cu (OH) CO NaO
4 2 2 2 3 2 2
D 漂白粉 Mg(OH) NaO
2 2
A.A B.B C.C D.D
13.相同质量的SO 和SO ,下列关系正确的是
2 3
A.含硫原子个数比为1∶1 B.含氧原子个数比为2∶3
C.含硫元素质量比为4∶5 D.含氧元素质量比为5∶6
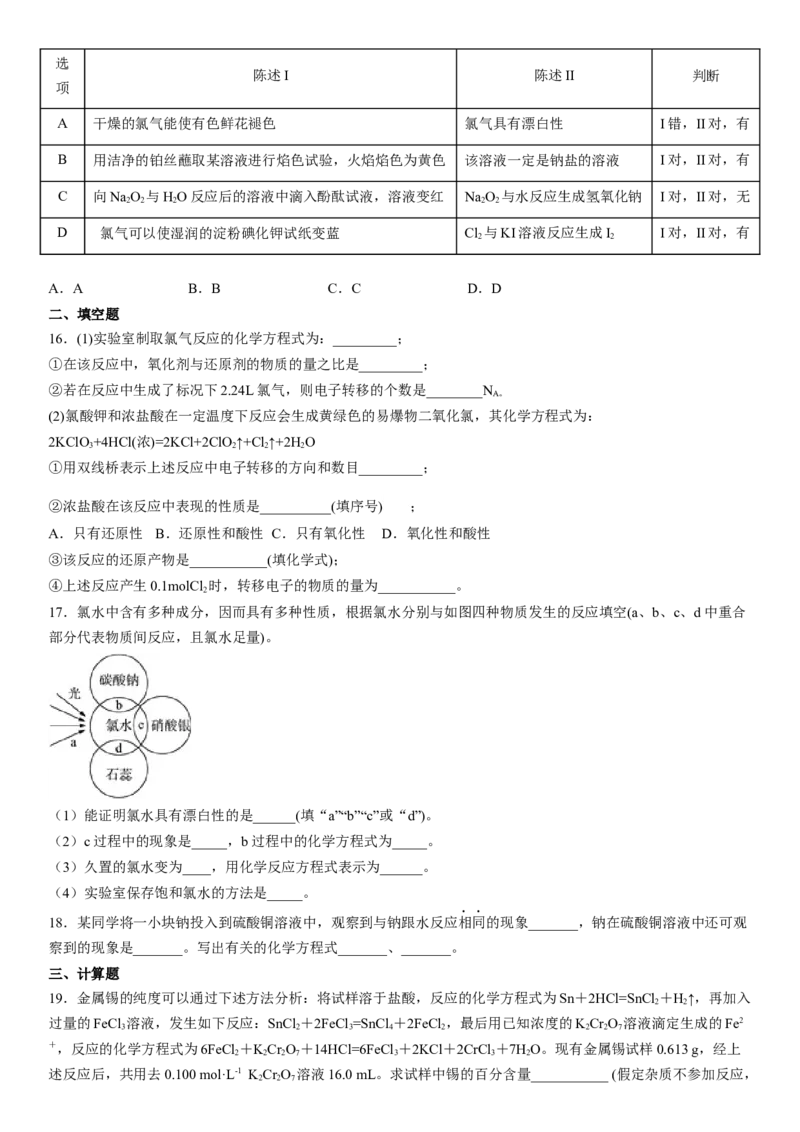
14.下列实验仪器或装置正确,并且说法正确的是
验证钠与水反应 发出黄色的火
如果 过量,盐酸就可全部消耗 比较 和 的热稳定性
是否放热 焰
A B C D
A.A B.B C.C D.D
15.下列对陈述I、II的正确性及两者间是否具有因果关系的判断均正确的是选
陈述I 陈述II 判断
项
A 干燥的氯气能使有色鲜花褪色 氯气具有漂白性 I错,II对,有
B 用洁净的铂丝蘸取某溶液进行焰色试验,火焰焰色为黄色 该溶液一定是钠盐的溶液 I对,II对,有
C 向NaO 与HO反应后的溶液中滴入酚酞试液,溶液变红 NaO 与水反应生成氢氧化钠 I对,II对,无
2 2 2 2 2
D 氯气可以使湿润的淀粉碘化钾试纸变蓝 Cl 与KI溶液反应生成I I对,II对,有
2 2
A.A B.B C.C D.D
二、填空题
16.(1)实验室制取氯气反应的化学方程式为:_________;
①在该反应中,氧化剂与还原剂的物质的量之比是_________;
②若在反应中生成了标况下2.24L氯气,则电子转移的个数是________N
A。
(2)氯酸钾和浓盐酸在一定温度下反应会生成黄绿色的易爆物二氧化氯,其化学方程式为:
2KClO+4HCl(浓)=2KCl+2ClO ↑+Cl↑+2H O
3 2 2 2
①用双线桥表示上述反应中电子转移的方向和数目_________;
②浓盐酸在该反应中表现的性质是__________(填序号) ;
A.只有还原性 B.还原性和酸性 C.只有氧化性 D.氧化性和酸性
③该反应的还原产物是___________(填化学式);
④上述反应产生0.1molCl 时,转移电子的物质的量为___________。
2
17.氯水中含有多种成分,因而具有多种性质,根据氯水分别与如图四种物质发生的反应填空(a、b、c、d中重合
部分代表物质间反应,且氯水足量)。
(1)能证明氯水具有漂白性的是______(填“a”“b”“c”或“d”)。
(2)c过程中的现象是_____,b过程中的化学方程式为_____。
(3)久置的氯水变为____,用化学反应方程式表示为______。
(4)实验室保存饱和氯水的方法是_____。
18.某同学将一小块钠投入到硫酸铜溶液中,观察到与钠跟水反应相同的现象_______,钠在硫酸铜溶液中还可观
察到的现象是_______。写出有关的化学方程式_______、_______。
三、计算题
19.金属锡的纯度可以通过下述方法分析:将试样溶于盐酸,反应的化学方程式为Sn+2HCl=SnCl +H↑,再加入
2 2
过量的FeCl 溶液,发生如下反应:SnCl +2FeCl =SnCl +2FeCl ,最后用已知浓度的KCr O 溶液滴定生成的Fe2
3 2 3 4 2 2 2 7
+,反应的化学方程式为6FeCl +KCr O+14HCl=6FeCl +2KCl+2CrCl +7HO。现有金属锡试样0.613 g,经上
2 2 2 7 3 3 2
述反应后,共用去0.100 mol·L-1 KCr O 溶液16.0 mL。求试样中锡的百分含量___________ (假定杂质不参加反应,
2 2 7锡的相对原子质量为119)。
20.一定量的液态化合物XY ,在一定量的O 中恰好完全燃烧,反应方程式为XY (液)+3O(气) XO (气)+
2 2 2 2 2
2YO (气)。冷却后,在标准状况下测得生成物的体积是672mL,密度是2.56g·L-1。
2
(1)反应前O 的体积是_______mL(标准状况下)。
2
(2)化合物XY 的摩尔质量是_______。
2
(3)若XY 分子中X、Y两元素质量比是3:16,则X、Y两元素分别为_______和_______(填元素符号)。
2
四、实验题
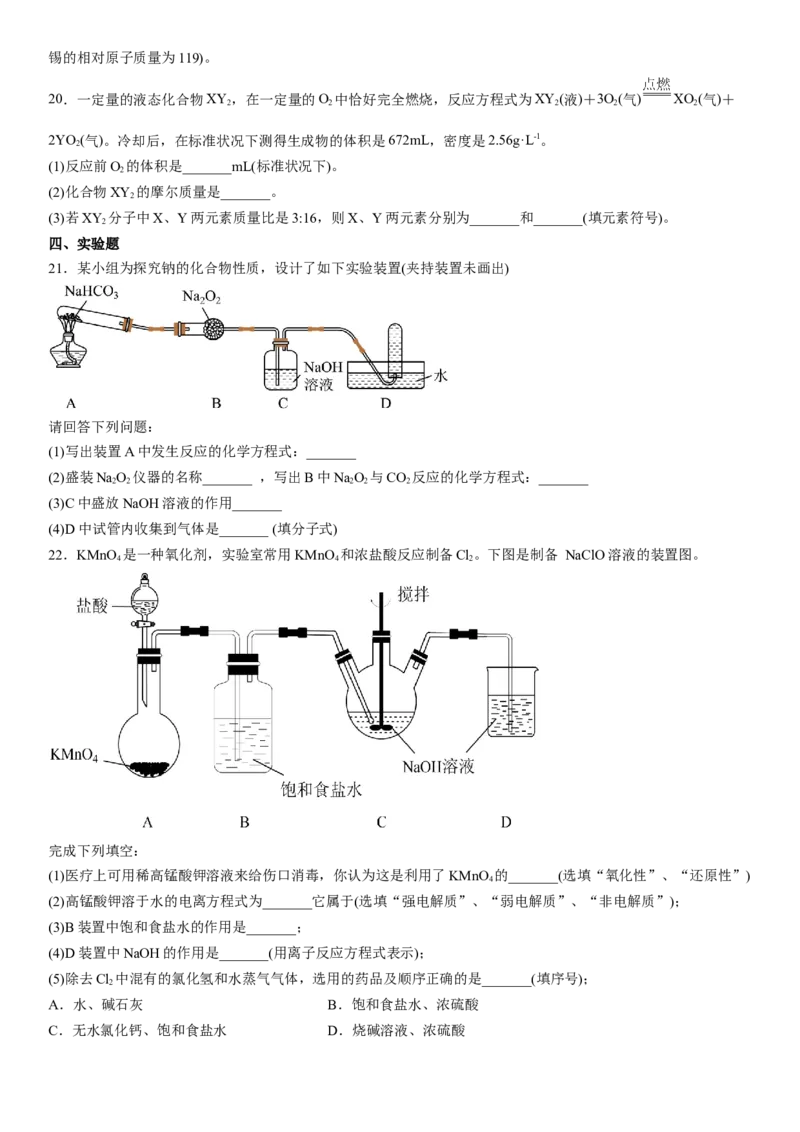
21.某小组为探究钠的化合物性质,设计了如下实验装置(夹持装置未画出)
请回答下列问题:
(1)写出装置A中发生反应的化学方程式:_______
(2)盛装NaO 仪器的名称_______ ,写出B中NaO 与CO 反应的化学方程式:_______
2 2 2 2 2
(3)C中盛放NaOH溶液的作用_______
(4)D中试管内收集到气体是_______ (填分子式)
22.KMnO 是一种氧化剂,实验室常用KMnO 和浓盐酸反应制备Cl。下图是制备 NaClO溶液的装置图。
4 4 2
完成下列填空:
(1)医疗上可用稀高锰酸钾溶液来给伤口消毒,你认为这是利用了KMnO 的_______(选填“氧化性”、“还原性”)
4
(2)高锰酸钾溶于水的电离方程式为_______它属于(选填“强电解质”、“弱电解质”、“非电解质”);
(3)B装置中饱和食盐水的作用是_______;
(4)D装置中NaOH的作用是_______(用离子反应方程式表示);
(5)除去Cl 中混有的氯化氢和水蒸气气体,选用的药品及顺序正确的是_______(填序号);
2
A.水、碱石灰 B.饱和食盐水、浓硫酸
C.无水氯化钙、饱和食盐水 D.烧碱溶液、浓硫酸参考答案
1.B
【分析】化学变化必须有新物质生成。
【详解】A.轮胎爆炸是气压大引起的,没有生成新物质不属于化学反应,故A错误;
B.工业制氯气是利用MnO2与浓盐酸反应生成氯气,有新物质生成属于化学变化,故B正确;
C.碘的升华是物质状态的改变,碘固体受热转化成气体,没有生成新物质不属于化学反应,故C错误;
D.海水晒盐,是蒸发结晶,没有生成新物质不属于化学反应,故D错误;
故答案为B
2.B
【详解】A.常温常压下,HO为液态,不能用气体的摩尔体积计算物质的量,选项A错误;
2B.二氧化氮和四氧化二氮的最简式相同,都为NO ,则92g NO 中含有的原子个数为 ×3×N mol—
2 2 A
1=6N ,选项B正确;
A
C.标准状况下,22.4L氦气的物质的量为1mol,氦气为单原子分子,1mol22.4L氦气含有所含的原子数为N ,选
A
项C错误;
D.18 g HO的物质的量为 =1mol,每个水分子中含有10个电子,所以18 g HO含有10mol电子,个数为
2 2
10N ,选项D错误;
A
答案选B。
3.B
【详解】A. 能与大多数金属化合,生成金属氯化物,表现强氧化性,A正确;
B. 燃烧不一定有氧气参加,如氢气在氯气中燃烧,B错误;
C. 与 反应生成 与 ,离子方程式为 ,C正确;
D.漂白粉的主要成分为 和 ,有效成分是 ,D正确;
答案选B。
4.B
【详解】A.钠的密度小于水,所以钠会浮在液面上,A正确;
B.钠和水反应2Na+2HO=2NaOH+H ↑,生成氢氧化钠和氢气,所以有无色无味的气体产生,没有沉淀产生,B
2 2
错误;
C.钠和水反应生成氢氧化钠和氢气,氢氧化钠溶液呈碱性,紫色石蕊试液遇碱变蓝色, C正确;
D .钠和水反应生成氢氧化钠和氢气,反应放热,且钠熔点低,所以反应过程中钠融成小球在水面四处游动, D
正确;
故选B。
5.D
【详解】A.缺标准状况,无法计算11.2 L二氧化碳的物质的量和含有的分子数,A错误;
B.相同质量的SO 和SO ,含氧原子的物质的量之比为 ,即个数比为5:6,B错误;
2 3
C.标准状况下,水不是气态,不能用气体摩尔体积进行计算,C错误;
D.二氧化碳和二氧化氮中含有的氧原子个数都为2,则1 mol 二氧化碳和二氧化氮的混合物中含的氧原子数为1
mol×2×NAmol-1=2NA,D正确;
故选D。
6.B
【详解】A.NaOH溶液与CO 反应,二氧化碳的用量不同,产物不同,少量的二氧化碳生成碳酸钠,过量的二氧
2
化碳生成碳酸氢钠,A不符合题意;
B.NaHCO 和盐酸无论二者的量多少,无论条件如何,反应均生成氯化钠、水和二氧化碳,B符合题意;
3
C.Na与O 不加热生成NaO,加热生成NaO,条件不同,产物不同,C不符合题意;
2 2 2 2
D.NaHSO 溶液与Ba(OH) 溶液反应,NaHSO 少量,产物为硫酸钡、水、NaOH,NaHSO 过量,产物为硫酸钡、
4 2 4 4
硫酸钠、水,产物与量有关,D不符合题意;
答案选B。7.C
【详解】mol·L-1是物质的量浓度的单位,故表示钙离子在血液正常指标数值的单位,其表示的物理量是物质的量
浓度,故合理选项是C。
8.B
【详解】A.摩尔是物质的量的单位,不是基本物理量,故A错误;
B.1个水分子中含有2个H原子,含有2N 个氢原子的水分子数是N , ,故B正确;
A A
C.0.5mol氧气所含1mol氧原子,氧原子数是N ,故C错误;
A
D.根据NaCl= Na++Cl-,2mol NaCl中含离子数4N ,故D错误;
A
答案选B。
9.B
【详解】A.氢氧化钠易潮解变质,用滤纸称量NaOH固体时,会导致配制的溶液中氢氧化钠的物质的量偏小,配
制的溶液浓度偏低,故A错误;
B.NaOH固体溶解时放热,导致溶液温度高,受热膨胀,没有冷却便进行定容会导致溶液体积偏小,浓度偏高,
故B正确;
C.定容时仰视刻度线会导致溶液体积偏大,浓度偏低,故C错误;
D.将容量瓶中的溶液转移到试剂瓶的过程中,有少量溶液溅出,会导致所配溶液中溶质的物质的量偏少,浓度偏
低,故D错误;
故答案选B。
10.B
【分析】干燥的Cl 没有漂白性,湿润的Cl 具有漂白性;当关闭B处的弹簧夹时,C处的红布条逐渐褪色,说明
2 2
干燥的Cl 变为湿润的Cl;当关闭B处的弹簧夹后,C处的红布条看不到明显现象,说明干燥的Cl 无变化。
2 2 2
【详解】①关闭B处的弹簧夹时,干燥的Cl 通入到饱和NaCl溶液中,干燥的Cl 变为湿润的Cl,C处的红布条
2 2 2
逐渐褪色;
②关闭B处的弹簧夹时,干燥的Cl 通入到NaOH溶液中,干燥的Cl 被吸收,C处的红布条看不到明显现象;
2 2
③关闭B处的弹簧夹时,干燥的Cl 通入到HO中,干燥的Cl 变为湿润的Cl,C处的红布条逐渐褪色;
2 2 2 2
④关闭B处的弹簧夹时,干燥的Cl 通入到浓硫酸中,干燥的Cl 无变化,C处的红布条看不到明显现象;
2 2
综上所述,D瓶中盛放的溶液可能是①③,故选B。
11.A
【详解】A.标准状况下,11.2L甲烷和乙烯混合物中含氢原子数目为: ,A正确;
B.FeCl 水解形成的Fe(OH) 胶体粒子是多个Fe( OH) 的聚集体,所以0.1mol FeCl 水解形成的Fe( OH) 胶体粒子
3 3 3 3 3
数小于0.1 N ,B不正确;
A
C.醋酸的体积未知,不能计算出H+的物质的量,C不正确;
D.根据反应H+I 2HI可知,反应前后分子数目不变,分子总数仍为0.2N ,D不正确;
2 2 A
故选A。
⇌
12.D
【详解】A.冰和水都由水分子构成,冰水混合物属于纯净物,MnO 属于酸性氧化物,A不正确;
2 7
B.氨水是氨气溶于水形成的混合物,一水合氨才是碱,B不正确;
C.Cu (OH) CO 属于碱式盐,NaO 与酸反应,除生成盐和水外,还有氧气生成,不属于碱性氧化物,C不正确;
2 2 3 2 2D.漂白粉是由氯化钙和次氯酸钙构成的混合物,Mg(OH) 属于难溶性碱,NaO是氢氧化钠对应的碱性氧化物,D
2 2
正确;
故选D。
13.D
【详解】SO 和SO 的摩尔质量分别是64g/mol、80g/mol,根据n=m÷M知,相同质量时n与M成反比,所以二者
2 3
的物质的量之比=80g/mol:64g/mol=5:4,则
A.根据N=nN 知,其分子数与n成正比,所以分子个数之比=5:4,每个分子中都含有一个S原子,所以S原子
A
总数=5:4,故A错误;
B.根据N=nN 知,其分子数与n成正比,所以分子个数之比=5:4,二氧化硫分子中含有两个O原子、三氧化硫
A
分子中含有3个O原子,所以O原子总数=(5×2):(4×3)=5:6,故B错误;
C.二氧化硫和三氧化硫的物质的量之比为5:4,每个分子中都含有一个S原子,所以S元素的物质的量之比为
5:4,则根据m=nM知,S元素的质量与n成正比,所以S元素的质量之比=5:4,故C错误;
D.二氧化硫分子中含有两个O原子、三氧化硫分子中含有3个O原子,所以二氧化硫、三氧化硫中O原子的物
质的量之比=(5×2):(4×3)=5:6,根据m=nM知,O元素的质量之比等于物质的量之比,所以O元素质量之
比=5:6,故D正确;
故选D。
14.B
【详解】A.二氧化锰与稀盐酸不反应,如果 过量,盐酸也不可能全部消耗,故A错误;
B.若钠与水反应是放热反应,试管内温度升高,气体膨胀,则“U”形管的右侧液面升高,故B正确;
C.比较 和 的热稳定性,应把 放在温度较低的小试管中,故C错误;
D.氢气在氯气中燃烧,发出苍白色火焰,故D错误;
选B。
15.D
【详解】A.氯气没有漂白性,判断错误,A错误;
B.该溶液可能是氢氧化钠溶液,B错误;
C.因为过氧化钠和水反应生成氢氧化钠,故滴入酚酞试液,溶液变红,两者有因果关系,C错误;
D.Cl 与KI溶液反应生成I,因此氯气可以使湿润的淀粉碘化钾试纸变蓝,D正确;
2 2
故选D。
16. 1:2 0.2N
A
B ClO 0.2mol
2
【详解】(1)实验室用浓盐酸和二氧化锰在加热条件反应制取氯气,化学方程式为:
;①在该反应中,锰元素化合价从+4降低到+2、化合价降低2、则二氧化
锰是氧化剂,部分浓盐酸氯中元素化合价从-1升高到0、化合价升高了1、为还原剂,得失电子数守恒,则氧化剂
与还原剂的物质的量之比是1:2;②从化学方程式知:每生成了1mol氯气、即标况下22.4L氯气,转移电子
2mol、即转移的个数为2N ,则在反应中生成了标况下2.24L氯气,则电子转移的个数是0.2N 。
A A(2)①在反应2KClO+4HCl(浓)=2KCl+2ClO ↑+Cl↑+2H O中,KClO 中氯元素化合价从+5降低到+4、化合价降低
3 2 2 2 3
1、则KClO 是氧化剂,部分浓盐酸中氯元素化合价从-1升高到0、化合价升高了1、为还原剂,得失电子数守恒,
3
则用双线桥表示上述反应中电子转移的方向和数目为 ;
②部分浓盐酸中氯元素化合价从-1升高到0、部分化合价不变,则浓盐酸在该反应中表现的性质是还原性和酸性,
答案选B;
③KClO 中氯元素化合价从+5降低到+4、则该反应的还原产物是ClO ;
3 2
④从化学方程式知:每生成了1mol氯气,转移电子2mol,则上述反应产生0.1molCl 时,转移电子的物质的量为
2
0.2mol。
17. d 有白色沉淀生成 NaCO+2HCl=2NaCl+HO+CO↑ 稀盐酸 2HClO
2 3 2 2
2HCl+O↑ 在阴凉处置于棕色试剂瓶中密封保存
2
【分析】将氯气溶于水,部分氯气与水反应生成盐酸和次氯酸,得到浅黄绿色的氯水,氯水含有HO、Cl、
2 2
HClO、Cl-、H+、OH-(极少量,水微弱电离出来的)多种微粒,其性质取决于其组成的微粒。
【详解】(1)氯水中HClO具有强氧化性,能使有机色质漂白脱色而表现漂白性,故答案为d;
(2)氯水中含有Cl-离子,能与AgNO 溶液反应生成白色的氯化银沉淀;氯水中含有酸性强于碳酸的盐酸,能与
3
NaCO 溶液发生反应生成氯化钠、二氧化碳和水,故答案为有白色沉淀生成;NaCO+2HCl=2NaCl+HO+
2 3 2 3 2
CO↑;
2
(3)氯水中HClO不稳定,见光易分解生成盐酸和氧气,溶液的颜色由浅绿色变为无色,反应的化学方程式为
2HClO 2HCl+O↑,故答案为稀盐酸;2HClO 2HCl+O↑;
2 2
(4)为防止氯水中HClO见光易分解,应将新制的饱和氯水在阴凉处置于棕色试剂瓶中密封保存,故答案为在阴
凉处置于棕色试剂瓶中密封保存。
【点睛】注意氯水的成分和性质,氯水的性质取决于其组成的微粒,久置氯水(浅黄绿色)会变成稀盐酸(无
色)失去漂白性。
18. 钠块浮在水面上,熔成一只闪亮的小球,在水面上不定向地迅速游动,发出“嘶嘶”的响
声 产生蓝色沉淀 2Na+2HO=2NaOH+H ↑ 2NaOH+CuSO =Cu(OH) ↓+Na SO
2 2 4 2 2 4
【详解】金属钠投入到硫酸铜溶液中,先与水反应:2Na+2HO=2NaOH+H ↑,因为钠的密度小于水,因此钠块浮
2 2
在水面,钠与水反应放出热量,又因为钠的熔点较低,观察到钠块熔成小球,钠与水反应产生氢气,观察到钠在
水面上此处游动,并发出“嘶嘶”的响声,产生NaOH与Cu2+反应生成Cu(OH) 蓝色沉淀,反应方程式
2
2NaOH+CuSO =Cu(OH) ↓+Na SO ;故答案为钠块浮在水面上,熔成一只闪亮的小球,在水面上不定向地迅速游动,
4 2 2 4
发出“嘶嘶”的响声;产生蓝色沉淀;2Na+2HO=2NaOH+H ↑;2NaOH+CuSO =Cu(OH) ↓+Na SO 。
2 2 4 2 2 4
19.93.2%
【详解】根据题给方程式可知,Sn与KCr O 物质的量的关系:3Sn~3SnCl ~6FeCl ~KCr O;所以存在3×119
2 2 7 2 2 2 2 7
g: 1 mol=x:0.100×0.016 mol,解之得到x=0.571 2 g,试样中锡的百分含量w(Sn)= ×100%≈93.2%。
20.(1)672
(2)76
(3) C S【解析】(1)
由方程式可知,反应前后气体体积不变,则V(O )=V(XO )+V(YO )=672mL;
2 2 2
(2)
依据质量守恒定律,有m(XY )=0.672L 2.56g·L-1-32g/mol ≈0.76g,物质的量n(XY )为
2 2
n(O )=0.01mol,所以M(XY)= =76g/mol;
2 2
(3)
由 及 可得, , ,则X、Y两元素分别为C、S。
21.(1)2NaHCO NaCO+H O+CO↑
3 2 3 2 2
(2) 球形干燥管 2NaO+2CO =2Na CO+O
2 2 2 2 3 2
(3)除去未反应的CO 气体
2
(4)O
2
【分析】A中反应为2NaHCO NaCO+H O+CO↑,B中NaO 和HO、CO 反应生成O,C中NaOH溶液除去
3 2 3 2 2 2 2 2 2 2
未反应的CO 气体,D中收集生成的O,据此解答。
2 2
(1)
A中发生反应的化学方程式为2NaHCO NaCO+H O+CO↑。
3 2 3 2 2
(2)
盛装NaO 仪器的名称为球形干燥管,B中NaO 与CO 反应生成碳酸钠和氧气,反应的化学方程式为
2 2 2 2 2
2NaO+2CO =2Na CO+O 。
2 2 2 2 3 2
(3)
根据分析,C中盛放NaOH溶液的作用为除去未反应的CO 气体。
2
(4)
根据分析,D中试管内收集到的气体是O。
2
22.(1)氧化性
(2)KMnO=K++MnO ;强电解质
4
(3)除去氯气中的氯化氢
(4)Cl +2OH-=Cl-+ClO-+H O
2 2
(5)B
【分析】装置A用KMnO 和浓盐酸反应制备Cl,浓盐酸易挥发,制备的氯气中含有氯化氢,氯化氢易溶于水,
4 2
氯气在饱和食盐水中溶解度不大,据此装置B的饱和食盐水除杂,装置C为氯气和NaOH溶液反应制取NaClO,
氯气有毒,过量的氯气直接排放到空气中能引起空气污染,应用装置D进行尾气处理,氯气能够与氢氧化钠反应,
被氢氧化钠吸收;
(1)
高锰酸钾与双氧水都具有强的氧化性,能够使蛋白质变性,可用作杀菌消毒,利用其氧化性;(2)
高锰酸钾属于钾盐,溶于水完全电离,电离方程式为KMnO =K++MnO ,它属于强电解质;
4
(3)
浓盐酸易挥发,制备的氯气中含有氯化氢,氯化氢易溶于水,氯气在饱和食盐水中溶解度不大,所以可以用装有
饱和食盐水的洗气瓶除去氯气中的氯化氢;
(4)
氯气有毒,过量的氯气直接排放到空气中能引起空气污染,应进行尾气处理,氯气能够与氢氧化钠反应,被氢氧
化钠吸收,离子反应方程式Cl+2OH-=Cl-+ClO-+H O;
2 2
(5)
除去Cl 中混有的水蒸气和氯化氢气体,氯化氢易溶于水,氯气在饱和食盐水中溶解度不大,所以可以用装有饱和
2
食盐水的洗气瓶除去氯气中的氯化氢,用浓硫酸吸收水蒸气,选用的药品及顺序正确的是B。