文档内容
必修第二册 第八章 第一节 自然资源的开发利用 测试题
榆次一中 李金虎
一、选择题(每小题只有一个正确选项,每小题4分,共40分)
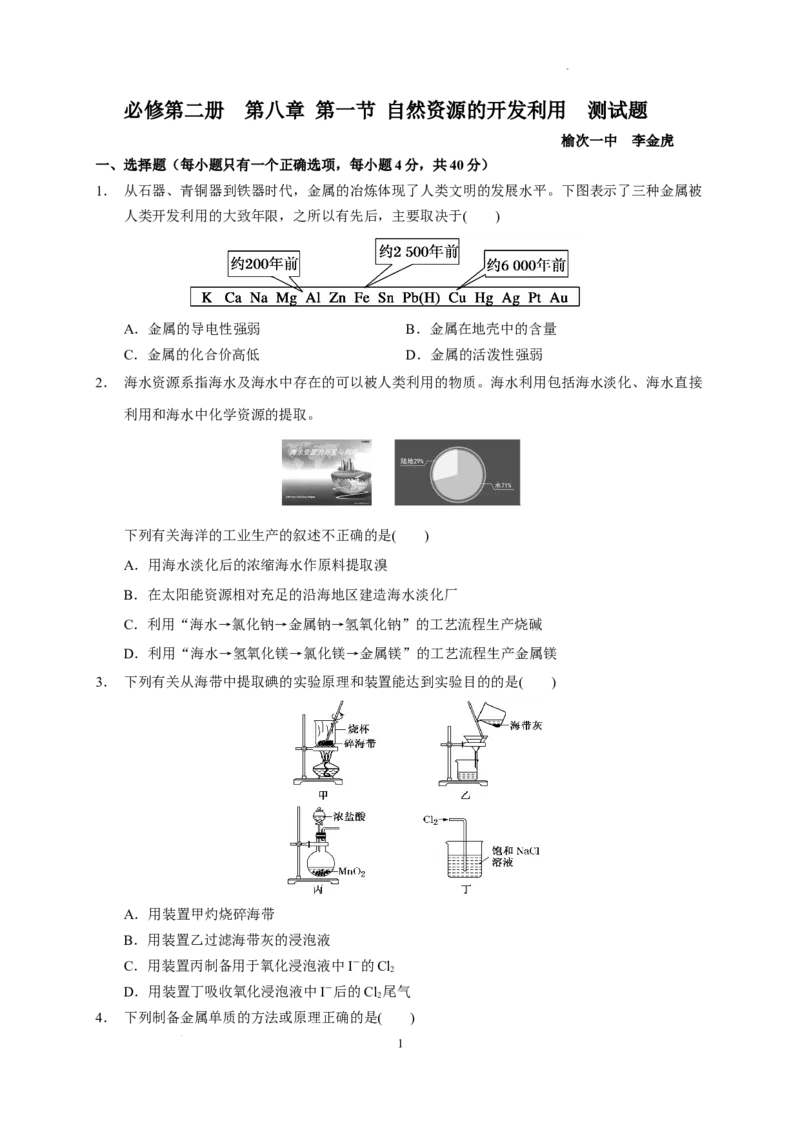
1. 从石器、青铜器到铁器时代,金属的冶炼体现了人类文明的发展水平。下图表示了三种金属被
人类开发利用的大致年限,之所以有先后,主要取决于( )
A.金属的导电性强弱 B.金属在地壳中的含量
C.金属的化合价高低 D.金属的活泼性强弱
2. 海水资源系指海水及海水中存在的可以被人类利用的物质。海水利用包括海水淡化、海水直接
利用和海水中化学资源的提取。
下列有关海洋的工业生产的叙述不正确的是( )
A.用海水淡化后的浓缩海水作原料提取溴
B.在太阳能资源相对充足的沿海地区建造海水淡化厂
C.利用“海水→氯化钠→金属钠→氢氧化钠”的工艺流程生产烧碱
D.利用“海水→氢氧化镁→氯化镁→金属镁”的工艺流程生产金属镁
3. 下列有关从海带中提取碘的实验原理和装置能达到实验目的的是( )
A.用装置甲灼烧碎海带
B.用装置乙过滤海带灰的浸泡液
C.用装置丙制备用于氧化浸泡液中I-的Cl
2
D.用装置丁吸收氧化浸泡液中I-后的Cl 尾气
2
4. 下列制备金属单质的方法或原理正确的是( )
1
学科网(北京)股份有限公司A.在高温条件下,用H 还原MgO制备单质Mg
2
B.在通电条件下,电解熔融Al O 与冰晶石(Na AlF)混合物制备单质Al
2 3 3 6
C.在通电条件下,电解饱和食盐水制备单质Na
D.加强热,使CuO在高温条件下分解制备单质Cu
5.下表中金属的冶炼原理与方法不完全正确的是( )
冶炼原理 方法
A 2HgO=====2Hg+O↑ 热分解法
2
B 2Al O(熔融)=====4Al+3O↑ 电解法
2 3 2
C Cu S+O=====2Cu+SO 热分解法
2 2 2
D Fe O+2Al=====2Fe+Al O 热还原法
2 3 2 3
6. 下列说法不正确的是( )
A.煤的干馏为化学变化
B.煤的气化和液化是物理变化,是三态间的变化
C.以煤为主要原料,可以合成甲醇
D.煤干馏得到的焦炉气可以与溴水反应而褪色
7. “煤制油”的关键技术是煤的气化,而目前煤的气化主要是煤中的碳和水蒸气的反应:C(s)
+H O(g) CO(g)+H(g),该反应是吸热反应,反应所需能量是由间歇进行的碳的燃烧(氧气用
2 2
空气代替)来提供的:C+O CO,下面关于该过程的说法不正确的是( )
2 2
A.煤的气化可以减少煤直接燃烧对环境造成的粉尘污染
B.第一个反应需要吸热,所以煤的气化从能量角度来看,得不偿失
C.煤气化后作为燃料,燃烧充分,热利用率高
D.上述两个反应后的混合气体中除去CO、CO 后主要就是合成氨的两种原料
2
8. 溴、碘主要存在于海水中,有“海洋元素”的美称。海水中的碘主要富集在海带中,我国海带
产量居世界第一位,除供食用外,大量用于制碘。提取碘的途径如下图所示:
干海带――→海带灰――→水溶液――→――→――→―→碘单质,则下列有关叙述正确的是
( )
A.碘元素在海水中也有游离态存在
B.在提取的过程中用的氧化剂可以是HO
2 2
C.操作是结晶或重结晶
D.操作是提纯,常用蒸馏或分馏
2
学科网(北京)股份有限公司9. 海水综合利用的工艺流程如图所示(粗盐中的可溶性杂质有MgCl 、CaCl 、NaSO )。下列说法
2 2 2 4
错误的是( )
A.过程①加入的药品顺序为NaCO 溶液→BaCl 溶液→NaOH溶液→过滤后加盐酸
2 3 2
B.从过程③到过程⑤的目的是浓缩富集溴
C.火力发电厂燃煤排放的含SO 的烟气经处理后可用在过程④反应中
2
D.在过程③或⑤反应中每氧化0.2 mol Br-需消耗标准状况下2.24 L Cl
2
10.海水提镁的主要流程如下:
下列说法正确的是( )
①试剂M是盐酸
②流程中的反应全部都是非氧化还原反应
③操作b只是过滤
④用海水晒盐后的饱和溶液加石灰乳制Mg(OH)
2
⑤电解熔融MgCl 比电解熔融的MgO制金属镁更节约能量
2
A.①②③④⑤ B.②③ C.④⑤ D.①④⑤
二、填空题(本题包括5个小题,共60分)
11.(8分)某市家用燃料的更新经历了如图几个过程:
历史悠久的燃料—煤 使用方便的燃料—液化石油气或管道煤气 清洁的燃料—天然气
请回答下列问题:
(1)为了使煤充分燃烧,可采取的措施是____________________________。
(2)煤的气化可产生管道煤气,其主要反应是碳与水蒸气在高温下生成两种常见的可燃性气体,
这两种气体是_____________________。
(3)液化石油气的主要成分是丙烷(C H),丙烷完全燃烧的化学方程式是___________________。
3 8
(4)天然气作燃料比煤更清洁的原因是________________________________(答一条即可)。
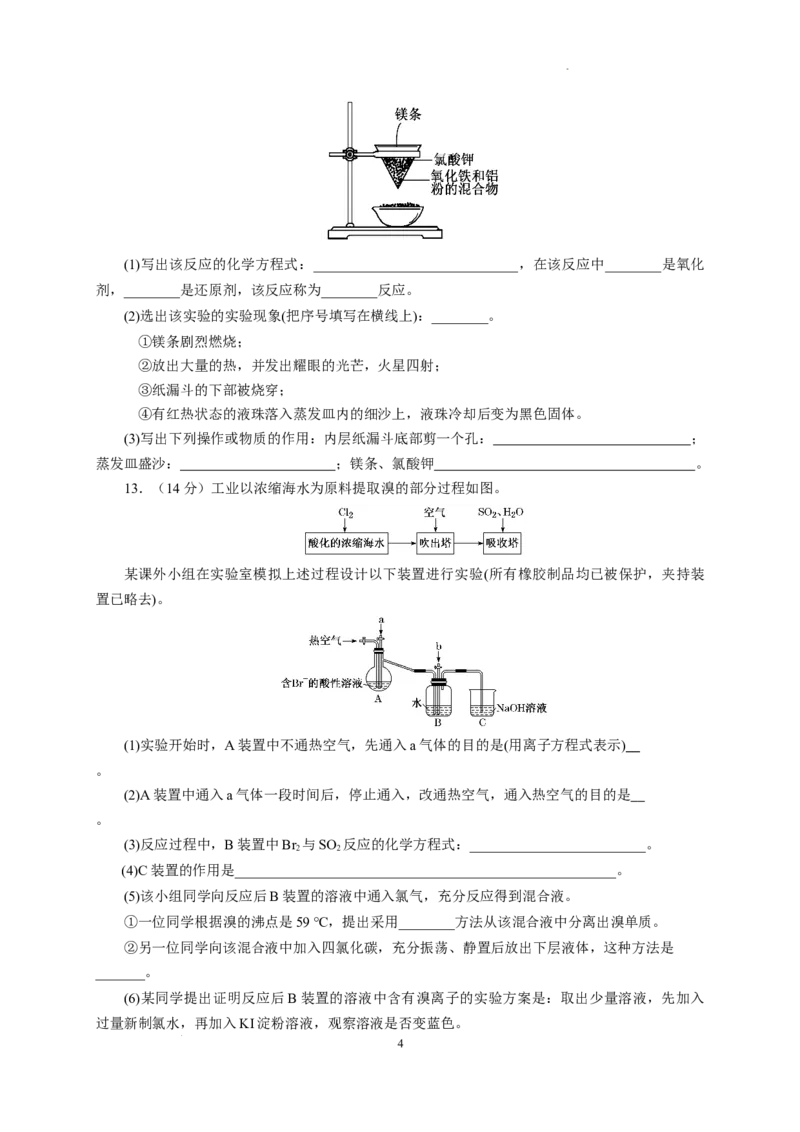
12.(12分)用如图所示的装置进行实验,回答下列问题:
3
学科网(北京)股份有限公司(1)写出该反应的化学方程式:_____________________________,在该反应中________是氧化
剂,________是还原剂,该反应称为________反应。
(2)选出该实验的实验现象(把序号填写在横线上):________。
①镁条剧烈燃烧;
②放出大量的热,并发出耀眼的光芒,火星四射;
③纸漏斗的下部被烧穿;
④有红热状态的液珠落入蒸发皿内的细沙上,液珠冷却后变为黑色固体。
(3)写出下列操作或物质的作用:内层纸漏斗底部剪一个孔: ;
蒸发皿盛沙: ;镁条、氯酸钾 。
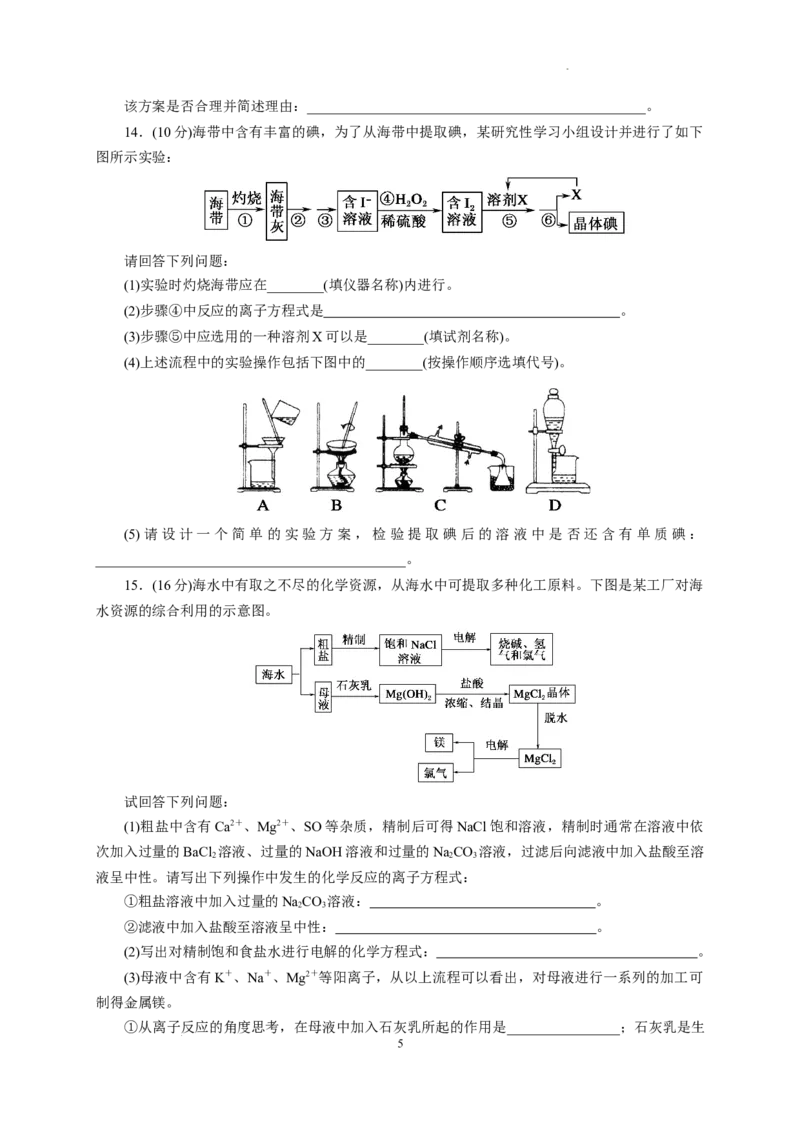
13.(14分)工业以浓缩海水为原料提取溴的部分过程如图。
某课外小组在实验室模拟上述过程设计以下装置进行实验(所有橡胶制品均已被保护,夹持装
置已略去)。
(1)实验开始时,A装置中不通热空气,先通入a气体的目的是(用离子方程式表示)
。
(2)A装置中通入a气体一段时间后,停止通入,改通热空气,通入热空气的目的是
。
(3)反应过程中,B装置中Br 与SO 反应的化学方程式:_________________________。
2 2
(4)C装置的作用是______________________________________________________。
(5)该小组同学向反应后B装置的溶液中通入氯气,充分反应得到混合液。
①一位同学根据溴的沸点是59 ℃,提出采用________方法从该混合液中分离出溴单质。
②另一位同学向该混合液中加入四氯化碳,充分振荡、静置后放出下层液体,这种方法是
_______。
(6)某同学提出证明反应后B装置的溶液中含有溴离子的实验方案是:取出少量溶液,先加入
过量新制氯水,再加入KI淀粉溶液,观察溶液是否变蓝色。
4
学科网(北京)股份有限公司该方案是否合理并简述理由:________________________________________________。
14.(10分)海带中含有丰富的碘,为了从海带中提取碘,某研究性学习小组设计并进行了如下
图所示实验:
请回答下列问题:
(1)实验时灼烧海带应在________(填仪器名称)内进行。
(2)步骤④中反应的离子方程式是 。
(3)步骤⑤中应选用的一种溶剂X可以是________(填试剂名称)。
(4)上述流程中的实验操作包括下图中的________(按操作顺序选填代号)。
(5)请设计一个简单的实验方案,检验提取碘后的溶液中是否还含有单质碘:
____________________________________________。
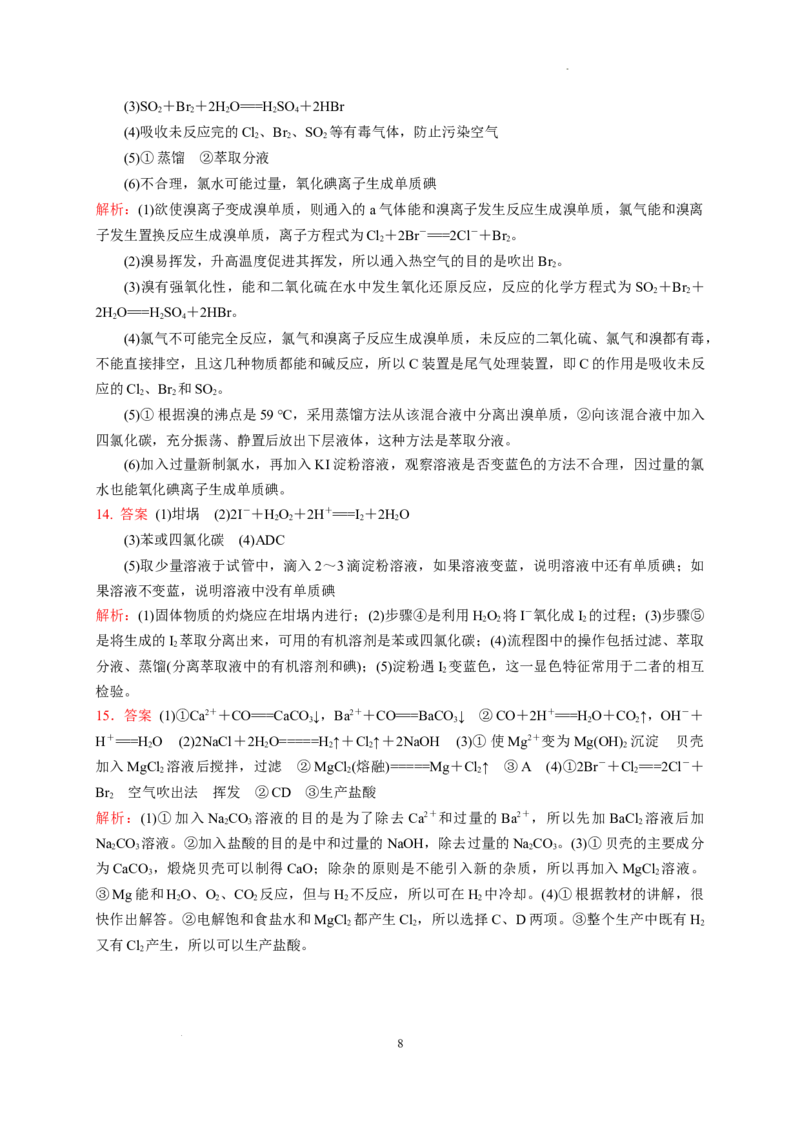
15.(16分)海水中有取之不尽的化学资源,从海水中可提取多种化工原料。下图是某工厂对海
水资源的综合利用的示意图。
试回答下列问题:
(1)粗盐中含有Ca2+、Mg2+、SO等杂质,精制后可得NaCl饱和溶液,精制时通常在溶液中依
次加入过量的BaCl 溶液、过量的NaOH溶液和过量的NaCO 溶液,过滤后向滤液中加入盐酸至溶
2 2 3
液呈中性。请写出下列操作中发生的化学反应的离子方程式:
①粗盐溶液中加入过量的NaCO 溶液: 。
2 3
②滤液中加入盐酸至溶液呈中性: 。
(2)写出对精制饱和食盐水进行电解的化学方程式: 。
(3)母液中含有K+、Na+、Mg2+等阳离子,从以上流程可以看出,对母液进行一系列的加工可
制得金属镁。
①从离子反应的角度思考,在母液中加入石灰乳所起的作用是________________;石灰乳是生
5
学科网(北京)股份有限公司石灰与水作用形成的化合物,生产生石灰的主要原料是________;若加入石灰乳后所制取的产品中
还混杂着熟石灰,那么将熟石灰从该产品中除去的方法是________________。
②电解无水氯化镁的化学方程式是 。
③电解无水氯化镁所得的镁蒸气在特定的环境里冷却后即为固体镁,下列物质中可以用作镁蒸
气的冷却剂的是______(填字母序号)。
A.H B.CO C.O D.水蒸气
2 2 2
(4)在该化工厂中,海水提取氯化钠后的母液经过提取氯化镁后又形成了新的母液,向新的母液
中加入一种常见的气态氧化剂,又抽取了重要的化工原料溴单质。
①生成溴单质的化学反应的离子方程式是______________;生产中将溴单质从化合物中分离出
来的方法是________,这种方法的成功应用是基于溴单质具有________性。
②以下是对生产溴单质所用的气态氧化剂寻找供货源的设想,其中合理的是________(填字母
序号)。
A.从外地购买 B.在当地新建生产厂
C.从本厂生产烧碱处循环 D.从本厂生产镁单质处循环
③从多种经营、综合开发、打造大而强的现代企业以及本厂生产所需要的原料等方面来看,你
认为该化工厂还可以再增加的生产项目是 。
1.解析 选D 从题给的图示,可以归纳出金属活泼性越弱的金属(如铜),越早被开发利用。
2. 解析 选C。用海水淡化后的浓缩海水作原料提取溴,A正确;在太阳能资源相对充足的沿海地区建
造海水淡化厂,B正确;工业上通过电解饱和食盐水来生产烧碱,C错误;利用“海水→氢氧化镁→氯化
镁→金属镁”的工艺流程生产金属镁,D正确。
3.解析:选B A项,灼烧碎海带应在坩埚中进行,不能用烧杯,装置甲不能达到实验目的;B项,
用装置乙过滤海带灰浸泡液能达到实验目的;C项,用浓盐酸和MnO 制取氯气需要加热,装置丙
2
不能达到实验目的;D项,吸收Cl 应用NaOH溶液,装置丁不能达到实验目的。
2
4.解析:选B A项,Mg的还原性强于H 的还原性,H 不能还原MgO;C项,制取钠应电解熔融
2 2
NaCl;D项,发生的反应为4CuO===2Cu O+O↑,得不到单质Cu。
2 2
5.解析:选C 活泼金属K、Ca、Na、Mg、Al等用电解法冶炼,中等活泼金属 Zn、Fe、Sn、
Pb、Cu等用热还原法冶炼,不活泼金属Hg、Ag等用热分解法冶炼,故A、B、D三项正确,C项
错误。
6. 解析 选B。煤的气化是把煤中的有机物转化成可燃性气体,主要原理是其中的碳元素与HO(g)反
2
应:C(s)+H O(g) CO(g)+H(g);煤的液化是把煤转化成液体燃料的过程,如将煤与氢气在一定条件下
2 2
作用生成液体燃料,也发生了化学变化,故煤的气化和液化不仅是状态上发生了变化,而且发生了化学
变化;煤干馏得到的焦炉气主要成分为氢气、甲烷、乙烯、一氧化碳,因含有乙烯故能使溴水褪色。
6
学科网(北京)股份有限公司7. 解析 选B。虽然在煤的气化过程中,会有一部分煤的潜在能量受到损失,但由于加工后得到的气态
燃料的热利用率高,且较清洁,故从总体来看煤气化或液化后使用是较合理的,B项错误,A、C项正确;
因反应C+O CO 中的氧气用空气代替,故反应后混合气体成分为 N 、CO、CO 和H 等,除去
2 2 2 2 2
CO、CO 后主要就是合成氨的原料N、H,D项正确。
2 2 2
8.解析 选B。 碘在海水中只以化合态(I-)存在,没有游离态,A项错误。操作A是萃取,操作
B是分液,然后才是利用蒸馏等操作来得到单质碘,A、C、D都是错误的。
9.【解析】选A。过程①的提纯中需除去镁离子、钙离子、硫酸根离子,碳酸钠一定在氯化钡之后,可
除去过量的钡离子,故A错误;溴离子被氧化为溴单质后,被二氧化硫吸收生成溴离子,加入氧化剂氧化
溴离子为溴单质,富集溴元素,从过程③到过程⑤的目的是浓缩富集溴,故B正确;火力发电厂燃煤排放
的含SO 的烟气经处理后可以吸收氧化得到的溴单质,发生氧化还原反应得到HBr,通入氧化剂得到
2
单质溴,起到富集溴元素作用,故C正确;过程③或⑤发生反应的离子方程式为2Br-+Cl Br +2Cl-,每
2 2
氧化0.2 mol Br-需消耗0.1 mol Cl ,0.1 mol Cl 在标准状况下的体积为2.24 L,故D正确。
2 2
10.【解析】选D。电解无水氯化镁的反应属于氧化还原反应,因此②是错误的。③操作b应是蒸发、
结晶、过滤,因此③是错误的。
11. 答案:(1)通入足量的空气或将煤粉碎 (2)CO和H
2
(3)C H+5O 3CO+4H O (4)减少了粉尘污染(答案合理即可)
3 8 2 2 2
【解析】(1)为了使煤充分燃烧,可以通入足量的空气或增大固体表面积(即将煤粉碎)。
(2)C(s)+H O(g) CO(g)+H(g),即碳与水蒸气在高温条件下反应生成CO和H。
2 2 2
(3)丙烷完全燃烧生成二氧化碳和水:C H+5O 3CO+4H O。
3 8 2 2 2
(4)天然气燃烧生成二氧化碳和水,无粉尘污染。
12.(1)Fe O+2Al=====Al O+2Fe Fe O Al 铝热 (2)①②③④ (3)使熔融物易于落下 防止
2 3 2 3 2 3
溅落物炸裂蒸发皿 反应产生高温,引发铝热反应
解析:(1)铝热反应为2Al+Fe O=====2Fe+Al O,该反应中Fe O 作氧化剂,Al作还原剂。
2 3 2 3 2 3
(2)①②③④全为该铝热反应的现象。
(3)铝热反应实验中:①为使熔融物易落下,通常在内层纸漏斗底部剪一个孔;
②为防止溅落物炸裂蒸发皿,蒸发皿内盛沙子;
③反应中镁条产生高温,引起氯酸钾分解;氯酸钾引发铝热反应。
13.答案:(1)Cl +2Br-===2Cl-+Br
2 2
(2)将溴从蒸馏烧瓶A中吹出
7
学科网(北京)股份有限公司(3)SO +Br +2HO===H SO +2HBr
2 2 2 2 4
(4)吸收未反应完的Cl、Br 、SO 等有毒气体,防止污染空气
2 2 2
(5)①蒸馏 ②萃取分液
(6)不合理,氯水可能过量,氧化碘离子生成单质碘
解析:(1)欲使溴离子变成溴单质,则通入的a气体能和溴离子发生反应生成溴单质,氯气能和溴离
子发生置换反应生成溴单质,离子方程式为Cl+2Br-===2Cl-+Br 。
2 2
(2)溴易挥发,升高温度促进其挥发,所以通入热空气的目的是吹出Br 。
2
(3)溴有强氧化性,能和二氧化硫在水中发生氧化还原反应,反应的化学方程式为 SO +Br +
2 2
2HO===H SO +2HBr。
2 2 4
(4)氯气不可能完全反应,氯气和溴离子反应生成溴单质,未反应的二氧化硫、氯气和溴都有毒,
不能直接排空,且这几种物质都能和碱反应,所以C装置是尾气处理装置,即C的作用是吸收未反
应的Cl、Br 和SO 。
2 2 2
(5)①根据溴的沸点是59 ℃,采用蒸馏方法从该混合液中分离出溴单质,②向该混合液中加入
四氯化碳,充分振荡、静置后放出下层液体,这种方法是萃取分液。
(6)加入过量新制氯水,再加入KI淀粉溶液,观察溶液是否变蓝色的方法不合理,因过量的氯
水也能氧化碘离子生成单质碘。
14. 答案 (1)坩埚 (2)2I-+HO+2H+===I +2HO
2 2 2 2
(3)苯或四氯化碳 (4)ADC
(5)取少量溶液于试管中,滴入2~3滴淀粉溶液,如果溶液变蓝,说明溶液中还有单质碘;如
果溶液不变蓝,说明溶液中没有单质碘
解析:(1)固体物质的灼烧应在坩埚内进行;(2)步骤④是利用HO 将I-氧化成I 的过程;(3)步骤⑤
2 2 2
是将生成的I 萃取分离出来,可用的有机溶剂是苯或四氯化碳;(4)流程图中的操作包括过滤、萃取
2
分液、蒸馏(分离萃取液中的有机溶剂和碘);(5)淀粉遇I 变蓝色,这一显色特征常用于二者的相互
2
检验。
15.答案 (1)①Ca2++CO===CaCO ↓,Ba2++CO===BaCO ↓ ②CO+2H+===H O+CO↑,OH-+
3 3 2 2
H+===H O (2)2NaCl+2HO=====H↑+Cl↑+2NaOH (3)①使Mg2+变为Mg(OH) 沉淀 贝壳
2 2 2 2 2
加入MgCl 溶液后搅拌,过滤 ②MgCl (熔融)=====Mg+Cl↑ ③A (4)①2Br-+Cl===2Cl-+
2 2 2 2
Br 空气吹出法 挥发 ②CD ③生产盐酸
2
解析:(1)①加入NaCO 溶液的目的是为了除去 Ca2+和过量的Ba2+,所以先加 BaCl 溶液后加
2 3 2
NaCO 溶液。②加入盐酸的目的是中和过量的NaOH,除去过量的NaCO 。(3)①贝壳的主要成分
2 3 2 3
为CaCO ,煅烧贝壳可以制得CaO;除杂的原则是不能引入新的杂质,所以再加入MgCl 溶液。
3 2
③Mg能和HO、O 、CO 反应,但与H 不反应,所以可在H 中冷却。(4)①根据教材的讲解,很
2 2 2 2 2
快作出解答。②电解饱和食盐水和MgCl 都产生Cl ,所以选择C、D两项。③整个生产中既有H
2 2 2
又有Cl 产生,所以可以生产盐酸。
2
8
学科网(北京)股份有限公司9
学科网(北京)股份有限公司