文档内容
课时作业
A篇·知识对点训练
知识点1 金属矿物的开发利用
1.下列变化过程不属于金属冶炼的是( )
A.电解氧化铝
B.铁在氧气中燃烧
C.金属氧化物与焦炭在高温下反应
D.高温下CO还原CuO
答案 B
解析 A项,电解氧化铝:2Al O (熔融)=====4Al+3O ↑;B项,铁在氧气
2 3 2
中燃烧生成四氧化三铁,不属于金属冶炼;C项,焦炭具有还原性,可以在高温
条件下把金属从金属氧化物中还原出来;D 项,高温下 CO 可还原 CuO 生成
Cu。
2.铝的活泼性较强,直到十八世纪人类才开始将铝从它的化合物中冶炼出
来,当时铝十分昂贵,拿破仑的头盔就是用铝制作的,现在还保存在大英博物馆
中。下列有关炼铝的方法正确的是( )
A.Al O ――→Al
2 3
B.Al O ――→AlCl ――→Al
2 3 3
C.Al(OH) ――→Al
3
D.Al O ――→Al
2 3
答案 A
解析 由于铝的活泼性较强,故一般不能用还原剂还原铝的化合物冶炼铝。
用电解熔融Al O 的方法,而不用电解熔融AlCl 的方法,是因为AlCl 是共价化
2 3 3 3
合物,熔融态不导电,且加热后会升华。
3.下列关于铝热反应2Al+Fe O =====Al O +2Fe的说法不正确的是( )
2 3 2 3
A.该反应中Al作还原剂
B.该反应中氧化产物与还原产物的物质的量之比为1∶2
C.该反应中冶炼1 mol Fe转移2 mol电子
D.该反应可用于焊接钢轨
答案 C
解析 Fe O 中Fe呈+3价,每冶炼1 mol Fe转移3 mol电子,故C错。
2 3
4.用铝热法还原下列化合物,若获得金属各1 mol,消耗铝最少的是( )
A.MnO B.Cr O
2 2 3
C.WO D.CuO
3
答案 D
解析 制备1 mol金属,根据氧化还原反应中得失电子数相等的原理,金属离子得电子数越多,需要铝的质量越大。而生成1 mol金属,该金属在化合物中
化合价越高,则消耗铝越多,反之则越少。在这四种化合物中只有 D项中Cu的
化合价最低,故选D。
5.把铝粉和氧化亚铁粉末配成铝热剂,分成两等份。一份在高温下恰好完
全反应后,再与足量盐酸反应;另一份直接放入足量的烧碱溶液中充分反应。前
后两种情况下生成的气体的质量比是( )
A.3∶2 B.2∶3 C.1∶1 D.28∶9
答案 C
解析 本题应分析两个过程中电子转移的数目。铝置换出铁,铁再和盐酸反
应生成H 和铝直接与烧碱反应生成H 转移的电子数目相同,化学方程式如下:
2 2
2Al+3FeO=====Al O +3Fe,Fe+2HCl===FeCl +H ↑;2Al+2NaOH+
2 3 2 2
2H O===2NaAlO +3H ↑;由此可看出两种情况下生成的气体的质量比为
2 2 2
1∶1。
知识点2 海水资源的开发利用
6.水资源非常重要,虽然地球约 70%的面积被海水所包围,但淡水的比例
只有2.5%,且其中绝大部分以冰川和其他形式存在,实际能够用来饮用的水不
足全球淡水总量的1%。下列关于水的说法错误的是( )
A.蒸馏法是海水淡化的方法之一
B.淡水的密度小于海水的密度
C.融化的雪水中矿物质含量比深井水中的少
D.0 ℃以上,温度越高,水的密度越小
答案 D
解析 海水中含有Na+、Mg2+、Cl-及SO等,这些离子所组成的物质的沸
点比水的沸点高,可用蒸馏的方法将其分离,A项正确;上述杂质的溶入使海水
的密度大于淡水,B项正确;雪与雨水成分相同,是水蒸发后凝结而成的,含矿
物质很少,而深井中的水不断与硅酸盐矿物质接触,其中溶有许多矿物质,C项
正确;由于水在4 ℃时密度最大,因此在0~4 ℃之间,温度越高水的密度越大,
而在4 ℃以上时,温度越高水的密度越小,D项错误。
7.下列关于海水知识不正确的是( )
A.海水资源的利用包括海水水资源的利用和化学资源的利用
B.海水既苦又涩,不能直接利用
C.海水中某些金属元素总储量很大,但富集程度却很低
D.海水淡化应同化工生产结合,同能源技术结合
答案 B
解析 海水资源的利用包括海水水资源的利用和海水化学资源的利用,海水水资源的利用包括海水淡化(同化工生产和能源技术相结合)和直接利用(循环冷却,
冲厕等),海水化学资源利用包括海水制盐,海水提Mg、Br 、I 等,虽然海水中
2 2
某些金属元素的总储量很大,但富集程度却很低,故A、C、D正确,B错误。
8.从海水中提取金属镁的生产步骤有:①浓缩结晶;②加熟石灰;③加盐
酸;④过滤;⑤熔融电解。其中正确的生产顺序是( )
A.①②③④⑤ B.⑤④③①②
C.②④③①⑤ D.③④②①⑤
答案 C
解析 海水中含有Mg2+,加入Ca(OH) 可生成
2
Mg(OH) 沉淀,过滤可得到Mg(OH) 固体。加盐酸将Mg(OH) 转化为MgCl
2 2 2 2
溶液,浓缩结晶得到 MgCl 固体,电解熔融的 MgCl 可得到金属镁:MgCl (熔
2 2 2
融)=====Mg+Cl ↑。
2
9.随着全球淡水资源危机日益严重,世界各国都把目光投向了占全球总水
量约97%的汪洋大海,希望从苦涩的海水中提取可以饮用的淡水。
(1)海水淡化亦称海水脱盐。该工艺过程包括海水预处理、脱盐、淡化水的
后处理等。下列属于海水预处理的是________(填序号)。
①淡水收集 ②除掉悬浮物 ③杀灭海洋生物 ④除掉海水中的盐分 ⑤水
质检测 ⑥降低海水浑浊度
(2)为了检验所收集的淡水中是否含有氯离子,通常采用的试剂是
____________________。
答案 (1)②③⑥ (2)硝酸银溶液和稀硝酸
解析 ①⑤均属于淡化水的后处理,④属于脱盐,②③⑥属于海水预处理。
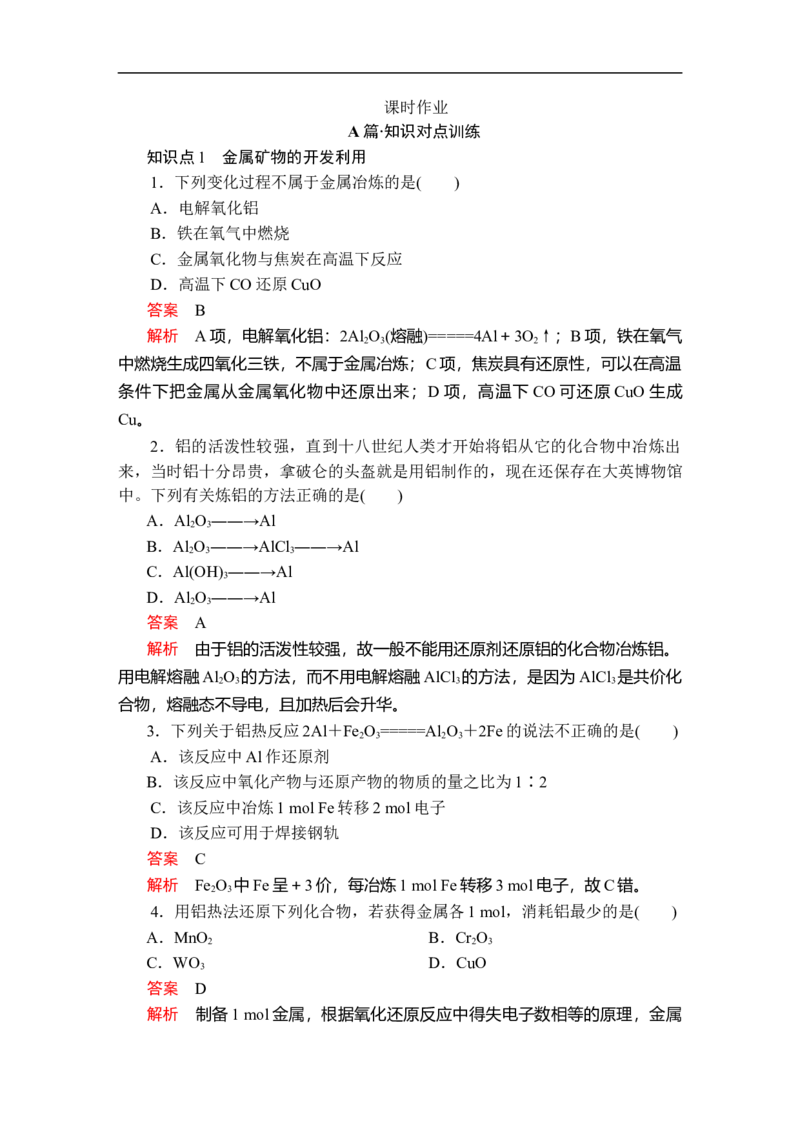
10.海带中含有丰富的碘,为了从海带中提取碘,某研究性学习小组设计并
进行了如下图所示的实验:
请回答下列问题:
(1)实验时灼烧海带应在________(填仪器名称)内进行。
(2)步骤④中反应的离子方程式是__________________________________。
(3)步骤⑤中选用的溶剂X可以是________(填试剂名称)。
(4)上述流程中的实验操作包括下列选项中的________(按操作顺序选填代号)。(5)请设计一个简单的实验方案,检验提取碘后的溶液中是否还含有单质碘:
_______________________________________________________________
_________________________________________________________________。
答案 (1)坩埚
(2)2I-+H O +2H+===I +2H O
2 2 2 2
(3)苯(或四氯化碳)
(4)BADC
(5)取少量溶液于试管中,滴入2~3滴淀粉溶液,如果溶液变蓝,说明溶液
中还有碘;如果溶液不变蓝,说明溶液中没有碘
解析 (1)固体物质的灼烧应在坩埚内进行。
(2)步骤④是利用H O 将I-氧化成I 的过程。
2 2 2
(3)步骤⑤是将生成的I 萃取分离出来,可用的有机溶剂是苯或四氯化碳。
2
(4)流程图中的操作包括灼烧、过滤、萃取分液、蒸馏(分离萃取液中的有机
溶剂和碘)。
(5)淀粉遇I 变蓝色,这一显色反应常用于二者的相互检验。
2
B篇·综合提升训练
11.海洋是一个名副其实的“聚宝盆”,下列对海洋资源开发利用的说法不
正确的是( )
A.海底如“土豆”般的金属结核矿含有铁、镁、钴等多种元素,可用铝热
法冶炼并分离得到各种金属单质
B.海水淡化工厂可与化工生产结合,如淡化后的浓海水,可用于提溴、镁
等
C.海水中的金、铀等元素储量高、浓度低,提炼时,须先富集
D.海水提镁过程中,所需的石灰乳,可用贝壳煅烧后加水得到,体现了就
地取材、降低成本的生产理念
答案 A
解析 镁比铝活泼,不能用铝热法冶炼镁。
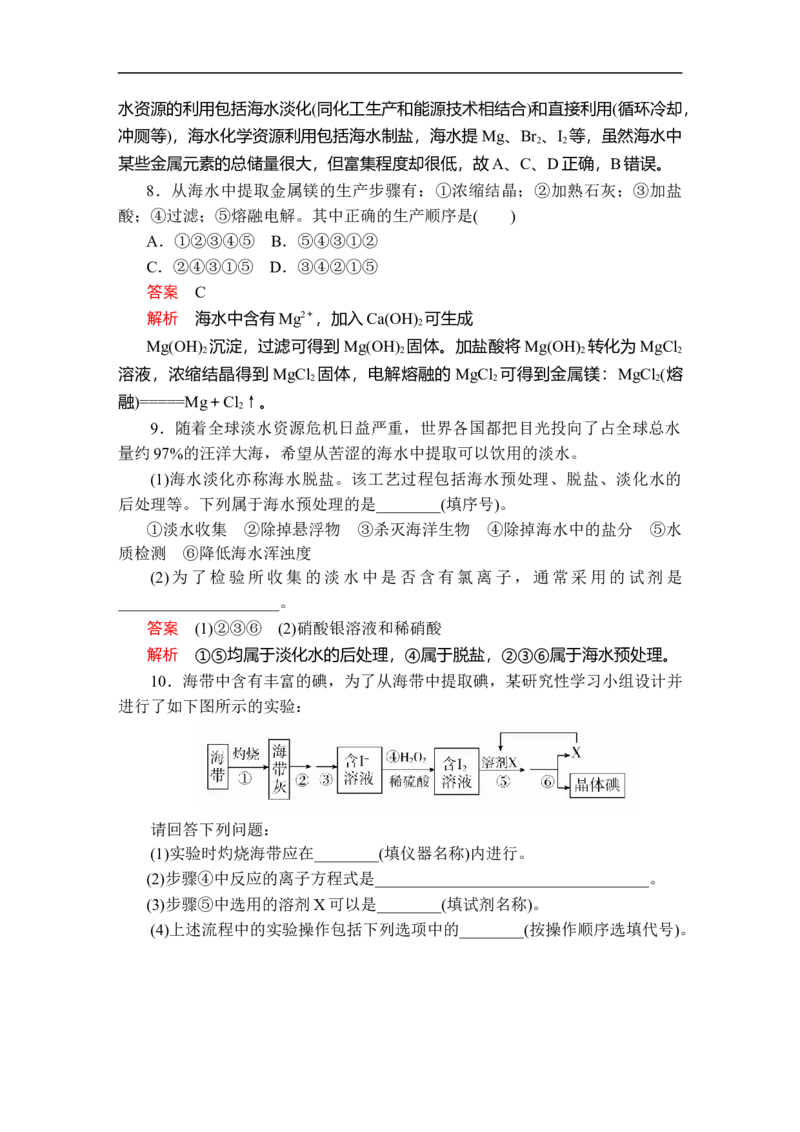
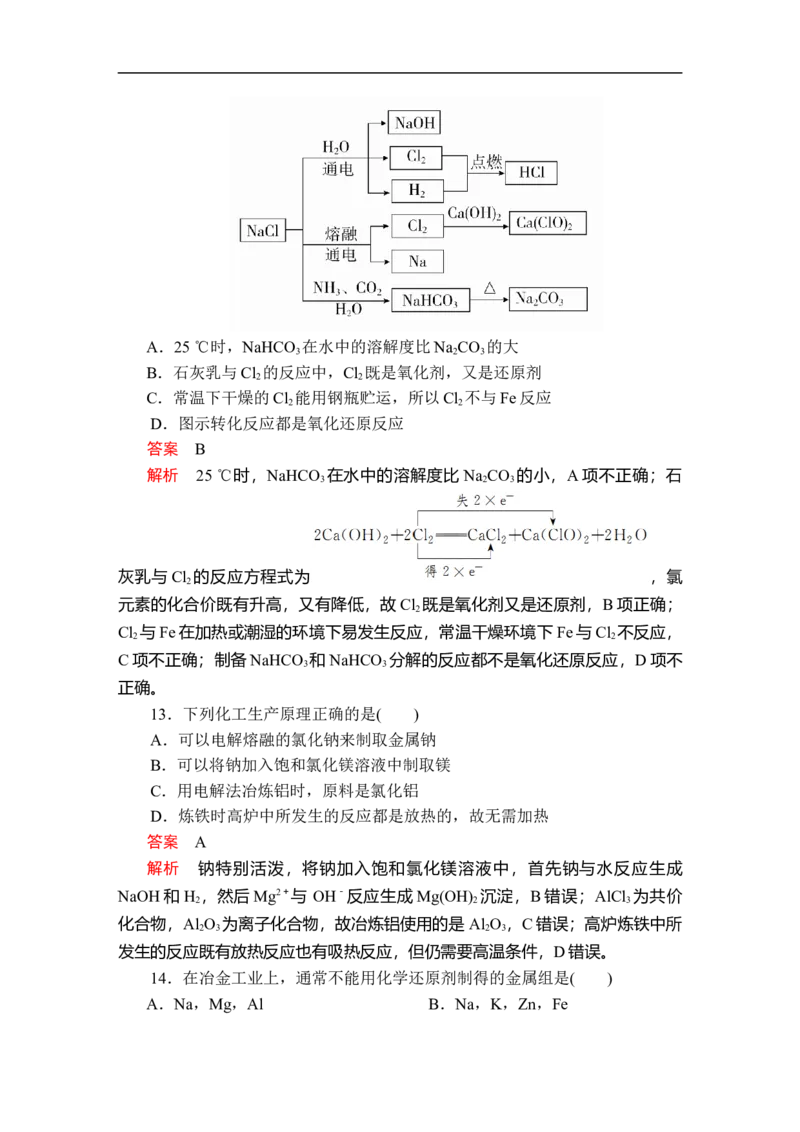
12.NaCl是一种化工原料,可以制备一系列物质,其转化关系如图所示。
下列说法正确的是( )A.25 ℃时,NaHCO 在水中的溶解度比Na CO 的大
3 2 3
B.石灰乳与Cl 的反应中,Cl 既是氧化剂,又是还原剂
2 2
C.常温下干燥的Cl 能用钢瓶贮运,所以Cl 不与Fe反应
2 2
D.图示转化反应都是氧化还原反应
答案 B
解析 25 ℃时,NaHCO 在水中的溶解度比 Na CO 的小,A项不正确;石
3 2 3
灰乳与Cl 的反应方程式为 ,氯
2
元素的化合价既有升高,又有降低,故Cl 既是氧化剂又是还原剂,B项正确;
2
Cl 与Fe在加热或潮湿的环境下易发生反应,常温干燥环境下Fe与Cl 不反应,
2 2
C项不正确;制备NaHCO 和NaHCO 分解的反应都不是氧化还原反应,D项不
3 3
正确。
13.下列化工生产原理正确的是( )
A.可以电解熔融的氯化钠来制取金属钠
B.可以将钠加入饱和氯化镁溶液中制取镁
C.用电解法冶炼铝时,原料是氯化铝
D.炼铁时高炉中所发生的反应都是放热的,故无需加热
答案 A
解析 钠特别活泼,将钠加入饱和氯化镁溶液中,首先钠与水反应生成
NaOH和H ,然后Mg2+与 OH-反应生成Mg(OH) 沉淀,B错误;AlCl 为共价
2 2 3
化合物,Al O 为离子化合物,故冶炼铝使用的是 Al O ,C错误;高炉炼铁中所
2 3 2 3
发生的反应既有放热反应也有吸热反应,但仍需要高温条件,D错误。
14.在冶金工业上,通常不能用化学还原剂制得的金属组是( )
A.Na,Mg,Al B.Na,K,Zn,FeC.Zn,Fe,Cu,Ag D.Mg,Al,Zn,Fe
答案 A
解析 根据金属活动性顺序有下列冶炼方法:①K~Al,用电解法;②Zn~
Cu用还原剂(如H ,CO等)还原法;③Hg和Ag用加热分解法。
2
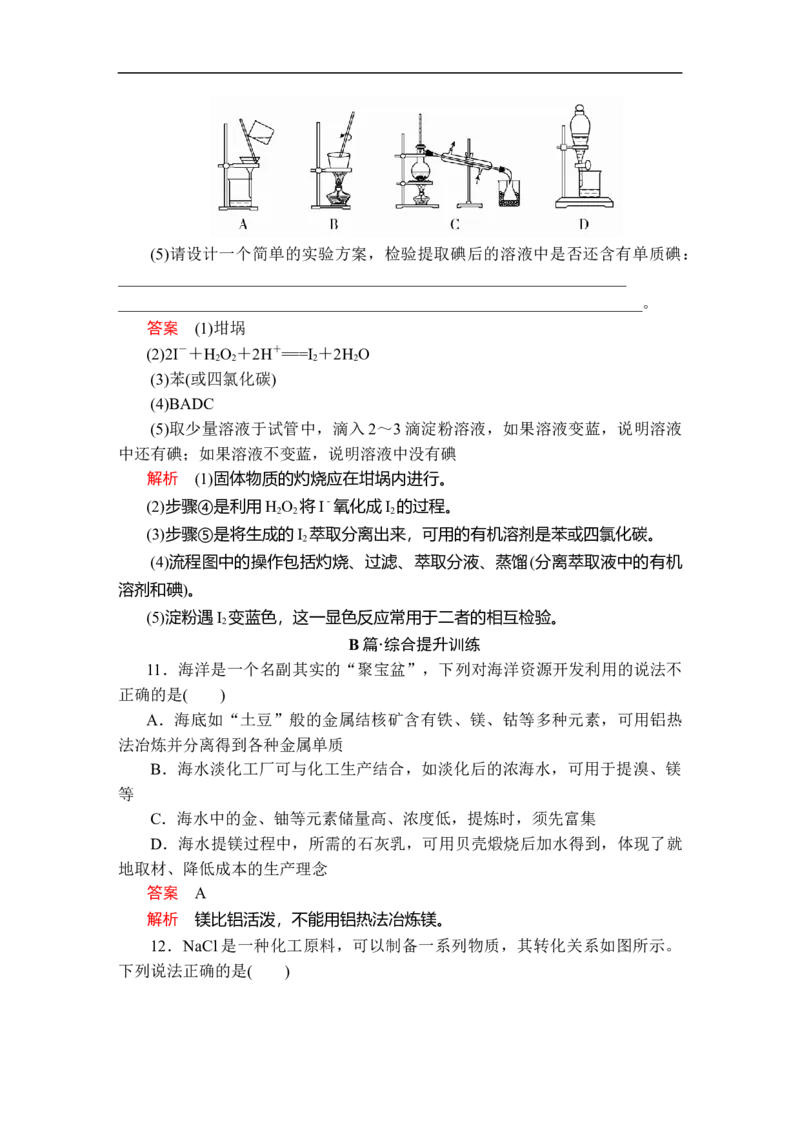
15.从海水中提取溴的流程如图所示,下列有关说法错误的是( )
A.X为SO 气体,也可将SO 换成Na SO
2 2 2 3
B.设备Y为蒸馏塔
C.在提取溴的过程中一定有Br-被氧化
D.工业上,每获得1 mol Br ,需要消耗Cl 的体积最多为44.8 L(标准状况)
2 2
答案 D
解析 由流程图可知,在提取溴的过程中发生两次反应 Cl +2Br-===Br +
2 2
2Cl-,同时过程中会有部分Cl 损耗,故工业上获得1 mol Br ,需要消耗Cl 的
2 2 2
体积大于44.8 L(标准状况),D项错误。
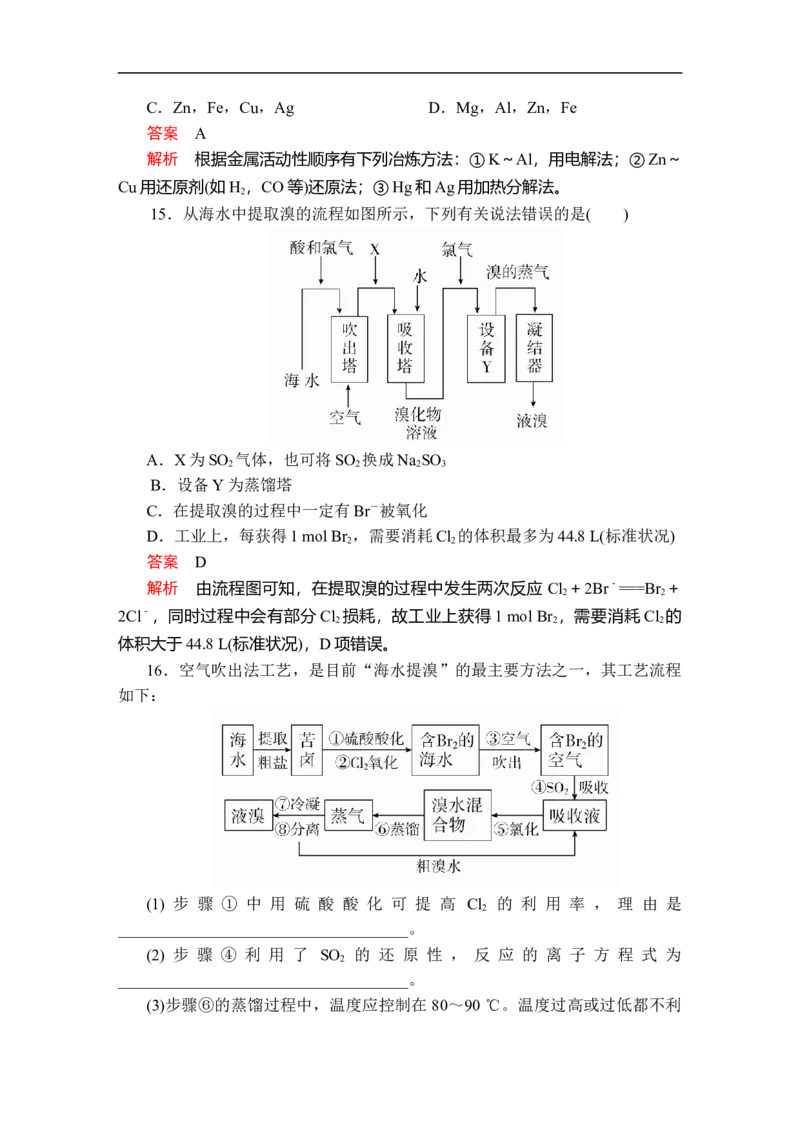
16.空气吹出法工艺,是目前“海水提溴”的最主要方法之一,其工艺流程
如下:
(1) 步 骤 ① 中 用 硫 酸 酸 化 可 提 高 Cl 的 利 用 率 , 理 由 是
2
____________________________________。
(2) 步 骤 ④ 利 用 了 SO 的 还 原 性 , 反 应 的 离 子 方 程 式 为
2
____________________________________。
(3)步骤⑥的蒸馏过程中,温度应控制在 80~90 ℃。温度过高或过低都不利于生产,请解释原因_____________________________________________。
(4)步骤⑧中溴蒸气冷凝后得到液溴与溴水的混合物,可利用它们的相对密度
相差很大的特点进行分离,分离仪器的名称是________。
(5)步骤①、②之后并未直接用“含Br 的海水”进行蒸馏得到液溴,而是经
2
过“空气吹出”“SO 吸收”“氯化”后再蒸馏,这样操作的意义是
2
______________________________________________________________________
________________________________________________________________。
答案 (1)酸化可抑制Cl 、Br 与水反应
2 2
(2)2H O+SO +Br ===4H++SO+2Br-
2 2 2
(3)温度过高,产生大量水蒸气,溴蒸气中水蒸气增加。温度过低,溴不能
完全蒸出,吸收率低
(4)分液漏斗
(5)“空气吹出”“SO 吸收”“氯化”过程实际上是一个Br 的浓缩过程,
2 2
与直接蒸馏含Br 海水相比效率更高,消耗能源少,成本降低
2
解析 (1)氯气、溴单质与水之间能发生反应,酸化可抑制它们与水的反应,
所以步骤①中用硫酸酸化可提高Cl 的利用率。
2
(2)SO 和氯气、水反应生成硫酸和氢溴酸:Br +SO +2H O===2HBr+
2 2 2 2
H SO ,离子方程式为Br +SO +2H O===4H++2Br-+SO。
2 4 2 2 2
(3)溴的沸点是58.5 ℃,水的是100 ℃,温度过高,大量水蒸气随之排出,
溴蒸气中水分增加;温度过低,溴不能完全蒸出,产率低。
(4)溴在水中达到饱和后,溴不再溶于水,液溴和溴水密度不同而分层,然
后用分液漏斗分离。
(5)海水中溴离子的含量较少,在海水提取溴之前,必须进行浓缩。