文档内容
安徽省普通高中高三春季阶段性检测
化学
考生注意:
1.答题前,考生务必将自己的姓名、考生号填写在试卷和答题卡上,并将考生号条形码粘
贴在答题卡上的指定位置。
2.回答选择题时,选出每小题答案后,用铅笔把答题卡对应题目的答案标号涂黑。加需改
动,用橡皮擦干净后,再选涂其他答案标号。回答非选择题时,将答案写在答题卡上。写在本
试卷上无效。
3.考试结束后,将本试卷和答题卡一并交回。
可能用到的相对原子质量:H1 C12 N14 O16 Ca40 Ti48 Ba137
一、选择题:本题共14小题,每小题3分,共42分。每小题只有一个选项符合题目要求。
1.“挖掘文物价值,讲好安徽故事”。下列安徽文物的主要成分属于硅酸盐的是
选项 A B C D
文物
名称 金扣玛瑙碗 吴王光剑 楚大鼎 德镇窑影青釉莲碗
2.哲学中“质量互换”规律广泛存在于化学中。下列变化中不属于量变引起质变的是
A.向 Na[Al(OH) 溶液中滴加盐酸至过量,先生成白色沉淀,后沉淀溶解变为无色溶液
4
B.向 CuSO 溶液中通人 NH 至过量,先生成蓝色沉淀,后沉淀溶解变为蓝色溶液
4 3
C.向酚酞溶液中加入足量的 Na O 粉末,溶液先变红色,后变无色
2 2
D.向 Na CO 溶液中滴加 NaHSO 溶液至过量,开始无明显现象,后产生气泡
2 3 4
3.“为国育才,五育并举”,美育是五育重要组成部分。化学美随处可见。下列叙述正确的是
A.环己烷 (C H )呈现对称美,分子中所有原子共平面
6 12
B.五光十色的霓虹灯发光变色过程属于物理变化
C.碘封管受热产生紫色蒸气,破坏了非极性共价键
D.向含甲基橙的纯碱溶液中滴加盐酸至过量,溶液由黄色变为橙色,最终变为蓝色
4.明代大儒王阳明认为,“致良知,知行合一”。劳动有利于“知行合一”。下列劳动项目与所述的化学知
识没有关联的是
选项 劳动项目 化学知识
A 帮厨活动:帮师傅炒鸡蛋 蛋白质易发生水解最终生成氨基酸
B 健康行动:用“84”消毒液喷洒教室 “84"消毒液具有强氧化性
内外
C 家务劳动:用醋酸清洗烧水壶中的 CH COOH的酸性比H CO 的强
3 2 3
水垢
D 学农活动:给农田里小麦等作物施 尿素是氮肥
尿素
5.下列化学用语错误的是
第 1 页
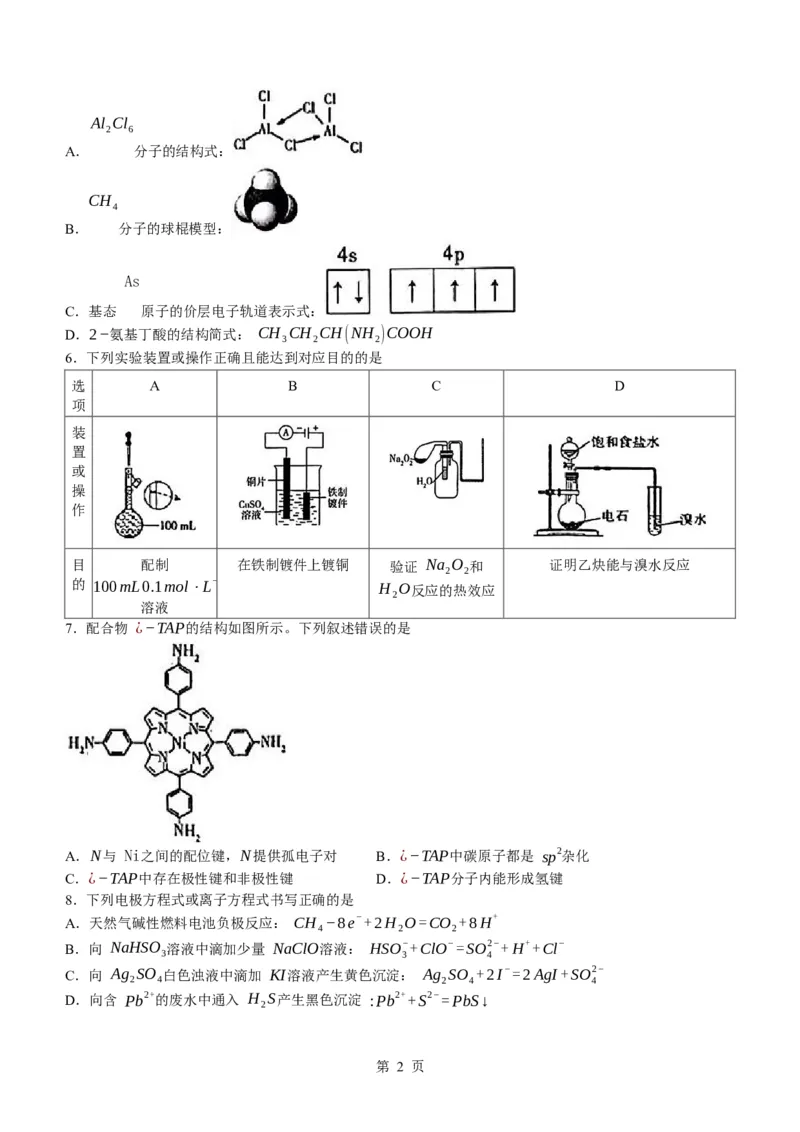
学科网(北京)股份有限公司Al Cl
2 6
A. 分子的结构式:
CH
4
B. 分子的球棍模型:
As
C.基态 原子的价层电子轨道表示式:
D.2−氨基丁酸的结构简式: CH CH CH(NH )COOH
3 2 2
6.下列实验装置或操作正确且能达到对应目的的是
选 A B C D
项
装
置
或
操
作
目 配制 在铁制镀件上镀铜 验证 Na O 和 证明乙炔能与溴水反应
2 2
的 100mL0.1mol⋅L−1NaCl
H O反应的热效应
2
溶液
7.配合物 ¿−TAP的结构如图所示。下列叙述错误的是
A.N与 Ni之间的配位键,N提供孤电子对 B.¿−TAP中碳原子都是 sp2杂化
C.¿−TAP中存在极性键和非极性键 D.¿−TAP分子内能形成氢键
8.下列电极方程式或离子方程式书写正确的是
A.天然气碱性燃料电池负极反应: CH −8e−+2H O=CO +8H+
4 2 2
B.向 NaHSO 溶液中滴加少量 NaClO溶液: HSO−+ClO−=SO2−+H++Cl−
3 3 4
C.向 Ag SO 白色浊液中滴加 KI溶液产生黄色沉淀: Ag SO +2I−=2AgI+SO2−
2 4 2 4 4
D.向含 Pb2+的废水中通入 H S产生黑色沉淀 :Pb2++S2−=PbS↓
2
第 2 页
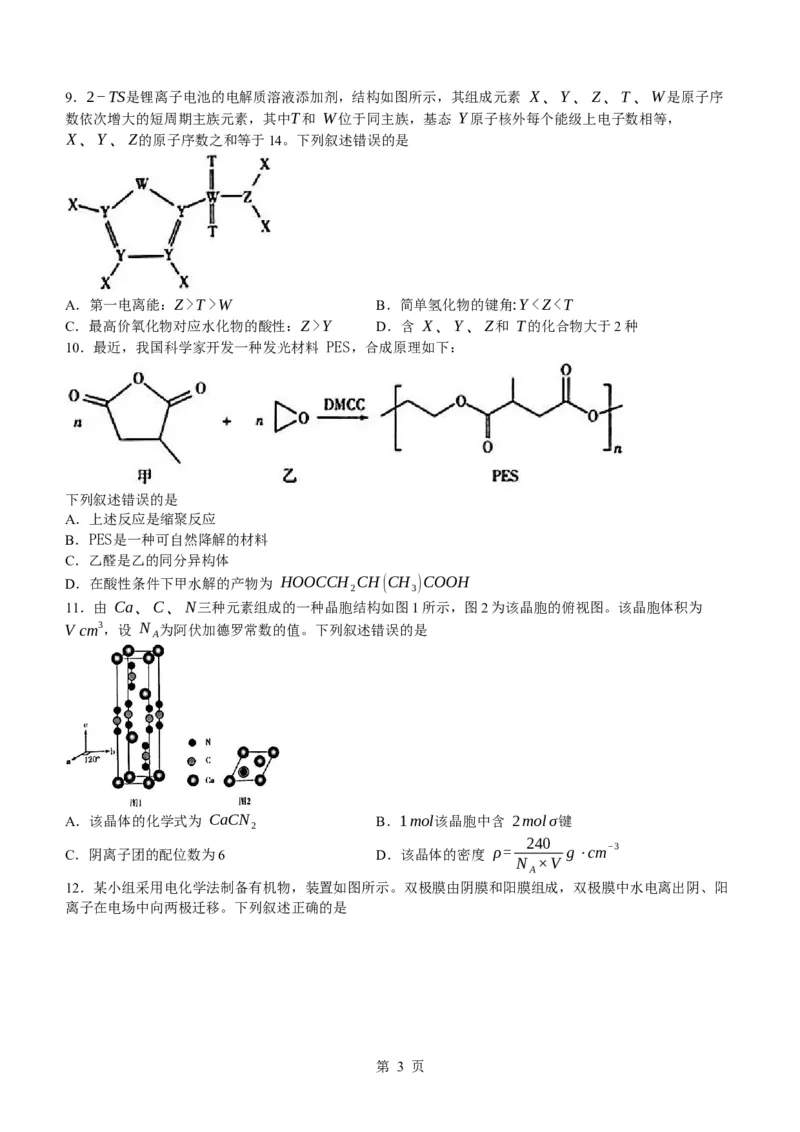
学科网(北京)股份有限公司9.2−TS是锂离子电池的电解质溶液添加剂,结构如图所示,其组成元素 X、Y、Z、T、W是原子序
数依次增大的短周期主族元素,其中T和 W位于同主族,基态 Y原子核外每个能级上电子数相等,
X、Y、Z的原子序数之和等于14。下列叙述错误的是
A.第一电离能:Z>T>W B.简单氢化物的键角:YY D.含 X、Y、Z和 T的化合物大于2种
10.最近,我国科学家开发一种发光材料 PES,合成原理如下:
下列叙述错误的是
A.上述反应是缩聚反应
B.PES是一种可自然降解的材料
C.乙醛是乙的同分异构体
D.在酸性条件下甲水解的产物为 HOOCCH CH(CH )COOH
2 3
11.由 Ca、C、N三种元素组成的一种晶胞结构如图1所示,图2为该晶胞的俯视图。该晶胞体积为
V cm3,设 N 为阿伏加德罗常数的值。下列叙述错误的是
A
A.该晶体的化学式为 CaCN B.1mol该晶胞中含 2molσ键
2
240
C.阴离子团的配位数为6 D.该晶体的密度 ρ= g⋅cm−3
N ×V
A
12.某小组采用电化学法制备有机物,装置如图所示。双极膜由阴膜和阳膜组成,双极膜中水电离出阴、阳
离子在电场中向两极迁移。下列叙述正确的是
第 3 页
学科网(北京)股份有限公司A.a极与电源负极连接
H O 34g
2
B.制备 时双极膜内 质量减少
C.b极反应式为 2CO +10H++10e−=C H +4H O
2 2 2 2
D.a极、 b极产物的物质的量之比为 1:5
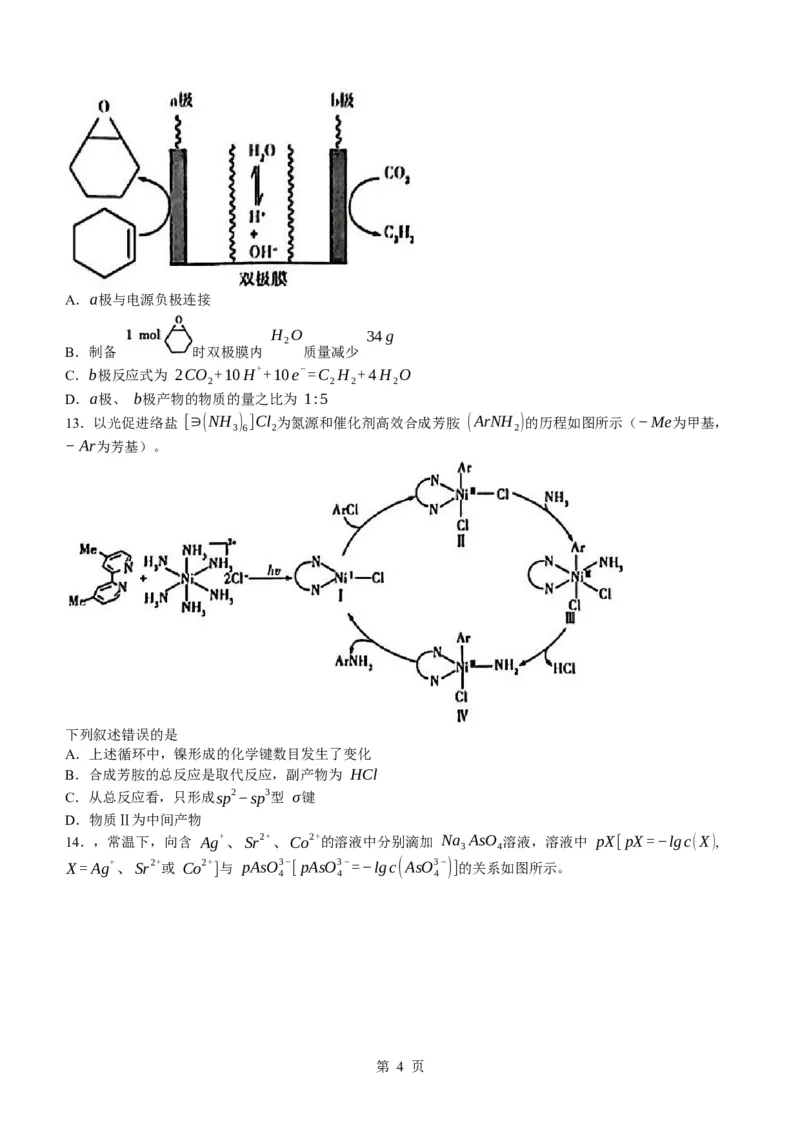
13.以光促进络盐 [∋(NH ) ]Cl 为氮源和催化剂高效合成芳胺 (ArNH )的历程如图所示(−Me为甲基,
3 6 2 2
−Ar为芳基)。
下列叙述错误的是
A.上述循环中,镍形成的化学键数目发生了变化
B.合成芳胺的总反应是取代反应,副产物为 HCl
C.从总反应看,只形成sp2−sp3型 σ键
D.物质Ⅱ为中间产物
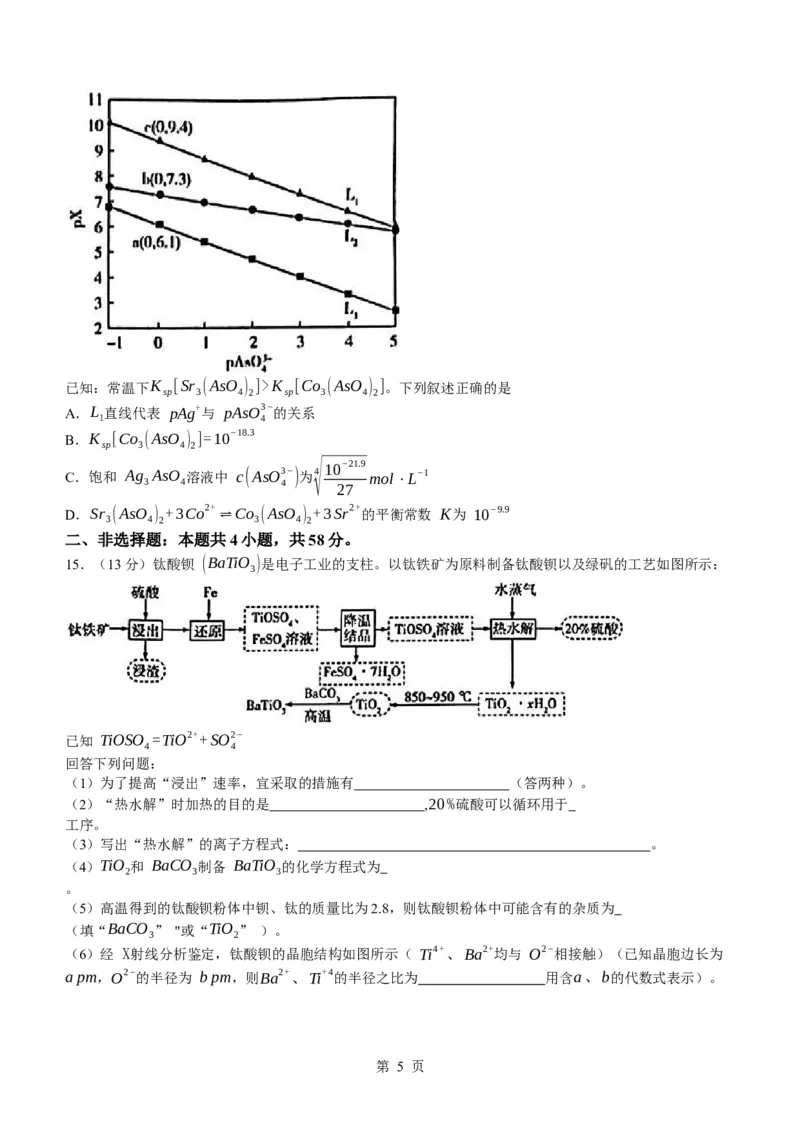
14.,常温下,向含 Ag+、Sr2+、Co2+的溶液中分别滴加 Na AsO 溶液,溶液中 pX[pX=−lgc(X),
3 4
X=Ag+、Sr2+或 Co2+ ]与 pAsO3− [pAsO3−=−lgc(AsO3−)]的关系如图所示。
4 4 4
第 4 页
学科网(北京)股份有限公司已知:常温下K [Sr (AsO ) ]>K [Co (AsO ) ]。下列叙述正确的是
sp 3 4 2 sp 3 4 2
A.L 直线代表 pAg+与 pAsO3−的关系
1 4
B.K [Co (AsO ) ]=10−18.3
sp 3 4 2
√10−21.9
C.饱和 Ag AsO 溶液中 c(AsO3−)为4 mol⋅L−1
3 4 4
27
D.Sr (AsO ) +3Co2+ ⇌Co (AsO ) +3Sr2+ 的平衡常数 K为 10−9.9
3 4 2 3 4 2
二、非选择题:本题共4小题,共58分。
15.(13分)钛酸钡 (BaTiO )是电子工业的支柱。以钛铁矿为原料制备钛酸钡以及绿矾的工艺如图所示:
3
已知 TiOSO =TiO2++SO2−
4 4
回答下列问题:
(1)为了提高“浸出”速率,宜采取的措施有 (答两种)。
(2)“热水解”时加热的目的是 ,20%硫酸可以循环用于
工序。
(3)写出“热水解”的离子方程式: 。
(4)TiO 和 BaCO 制备 BaTiO 的化学方程式为
2 3 3
。
(5)高温得到的钛酸钡粉体中钡、钛的质量比为2.8,则钛酸钡粉体中可能含有的杂质为
(填“BaCO ” "或“TiO ” )。
3 2
(6)经 X射线分析鉴定,钛酸钡的晶胞结构如图所示( Ti4+、Ba2+均与 O2−相接触)(已知晶胞边长为
apm,O2−的半径为 bpm,则Ba2+、Ti+4的半径之比为 用含a、b的代数式表示)。
第 5 页
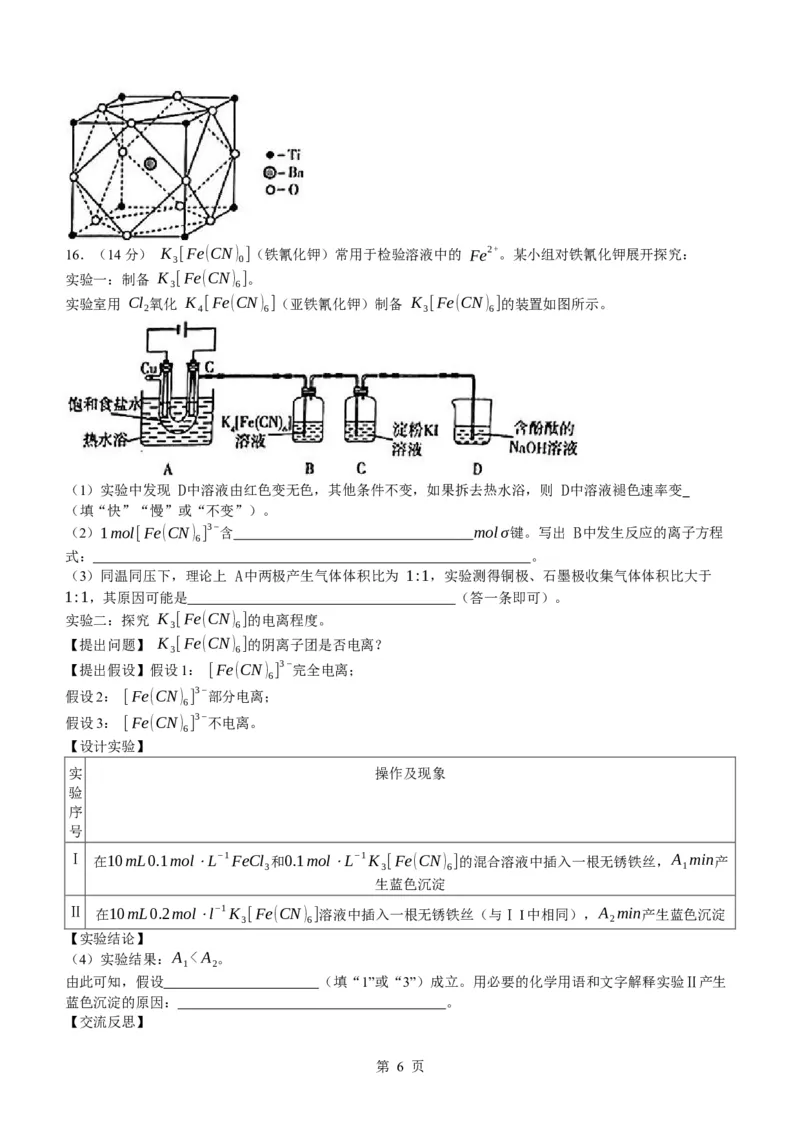
学科网(北京)股份有限公司16.(14分) K [Fe(CN) ](铁氰化钾)常用于检验溶液中的 Fe2+。某小组对铁氰化钾展开探究:
3 0
实验一:制备 K [Fe(CN) ]。
3 6
实验室用 Cl 氧化 K [Fe(CN) ](亚铁氰化钾)制备 K [Fe(CN) ]的装置如图所示。
2 4 6 3 6
(1)实验中发现 D中溶液由红色变无色,其他条件不变,如果拆去热水浴,则 D中溶液褪色速率变
(填“快”“慢”或“不变”)。
(2)1mol[Fe(CN) ] 3−含 molσ键。写出 B中发生反应的离子方程
6
式: 。
(3)同温同压下,理论上 A中两极产生气体体积比为 1:1,实验测得铜极、石墨极收集气体体积比大于
1:1,其原因可能是 (答一条即可)。
实验二:探究 K [Fe(CN) ]的电离程度。
3 6
【提出问题】 K [Fe(CN) ]的阴离子团是否电离?
3 6
【提出假设】假设1: [Fe(CN) ] 3−完全电离;
6
假设2: [Fe(CN) ] 3−部分电离;
6
假设3: [Fe(CN) ] 3−不电离。
6
【设计实验】
实 操作及现象
验
序
号
Ⅰ 在10mL0.1mol⋅L−1FeCl 和0.1mol⋅L−1K [Fe(CN) ]的混合溶液中插入一根无锈铁丝,A min产
3 3 6 1
生蓝色沉淀
Ⅱ 在10mL0.2mol⋅l−1K [Fe(CN) ]溶液中插入一根无锈铁丝(与ⅠI中相同),A min产生蓝色沉淀
3 6 2
【实验结论】
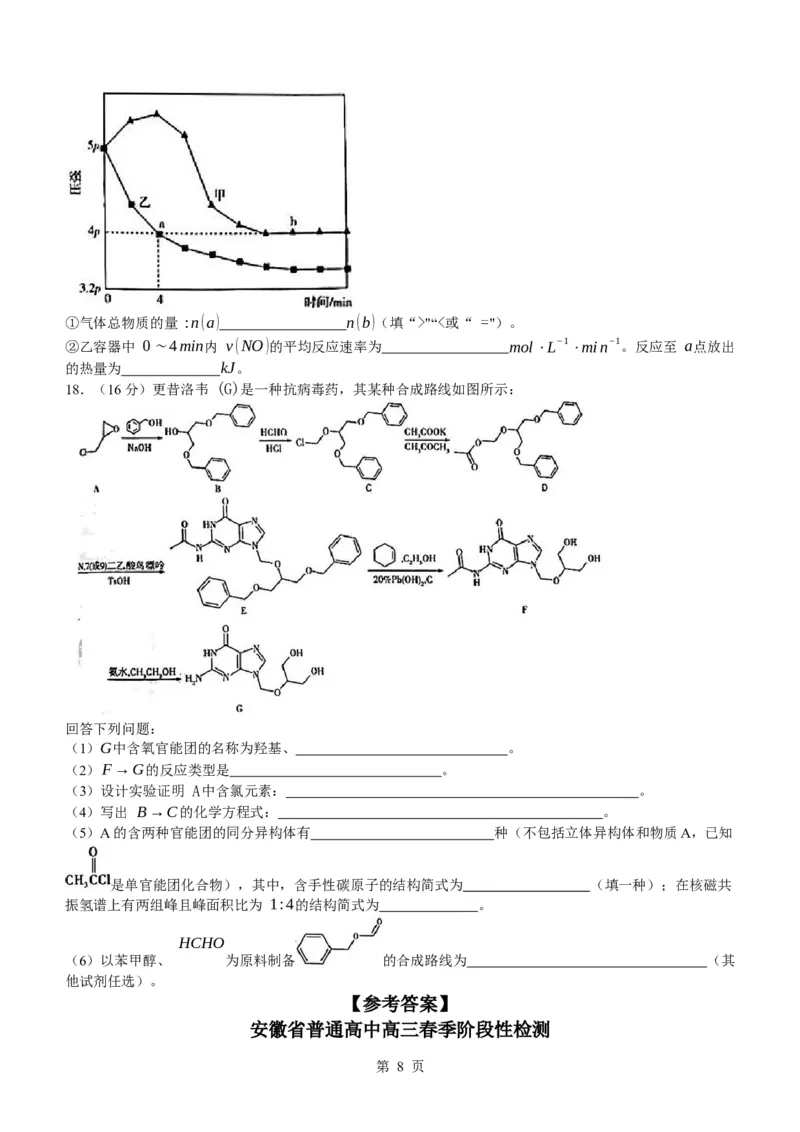
(4)实验结果:A "“<或“ =")。
②乙容器中 0∼4min内 v(NO)的平均反应速率为 mol⋅L−1 ⋅min−1。反应至 a点放出
的热量为 kJ。
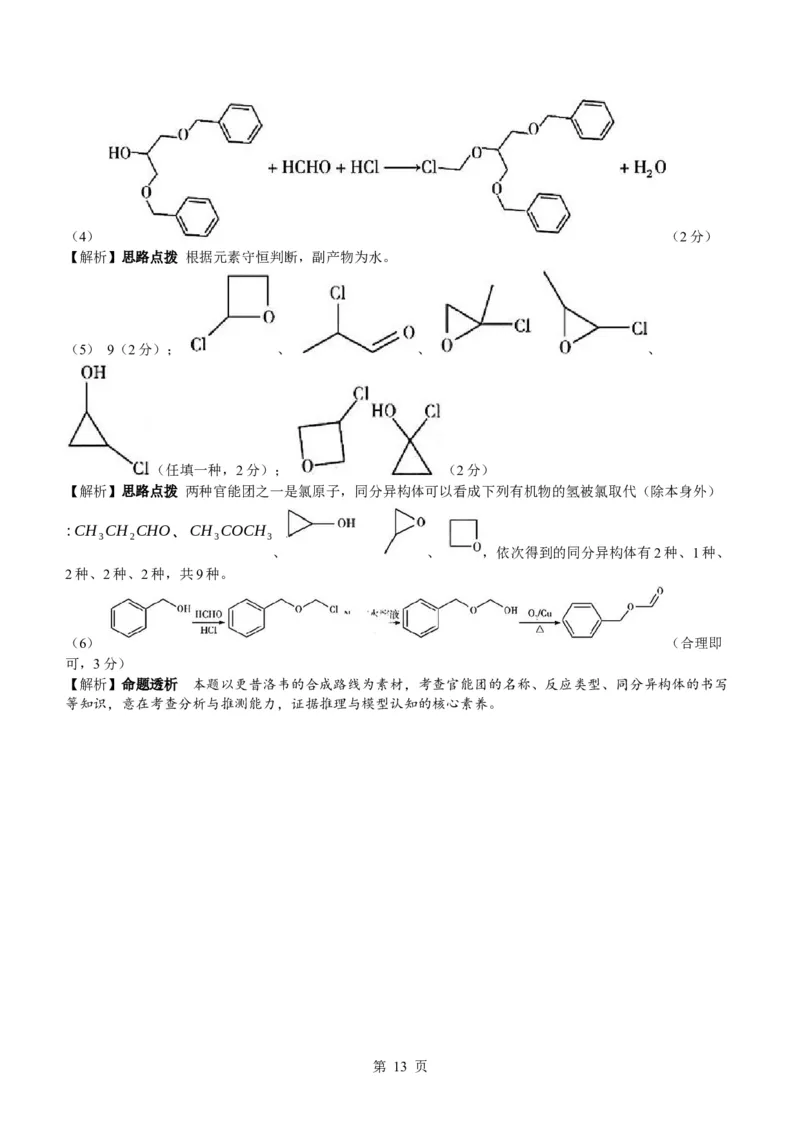
18.(16分)更昔洛韦 (G)是一种抗病毒药,其某种合成路线如图所示:
回答下列问题:
(1)G中含氧官能团的名称为羟基、 。
(2)F→G的反应类型是 。
(3)设计实验证明 A中含氯元素: 。
(4)写出 B→C的化学方程式: 。
(5)A的含两种官能团的同分异构体有 种(不包括立体异构体和物质A,已知
是单官能团化合物),其中,含手性碳原子的结构简式为 (填一种);在核磁共
振氢谱上有两组峰且峰面积比为 1:4的结构简式为 。
HCHO
(6)以苯甲醇、 为原料制备 的合成路线为 (其
他试剂任选)。
【参考答案】
安徽省普通高中高三春季阶段性检测
第 8 页
学科网(北京)股份有限公司化学
一、选择题:本题共14小题,每小题3分,共42分。每小题只有一个选项符合题目要求。
1.D 2.C 3.B 4.A 5.B 6.C 7.D 8.C 9.B 10.A 11.B 12.C
13.C 14.C
【解析】命题透析 本题以文物为素材,考查物质组成与分类知识,意在考查分析与推测能力,科学态度与
社会责任的核心素养。
思路点拨 金扣玛瑙碗的主要成分是 SiO ,A项不符合题意;吴王光剑、楚大鼎的主要成分为青铜,B、C
2
项不符合题意;陶瓷的主要成分是硅酸盐,D项符合题意。
【解析】命题透析 本题以量变引起质变的哲学规律为情境,考查化学反应与量的关系等知识,意在考查分
析与推测能力,宏观辨识与微观探析的核心素养。
思路点拨 Na[Al(OH) ]+HCl=NaCl+Al(OH) ↓+H O,Al(OH) +3HCl=AlCl +3H O,符合量变
4 3 2 3 3 2
引起质变规律,A项不符合题意;
CuSO +2NH ⋅H O=Cu(OH) ↓+(NH ) SO ,Cu(OH) +4NH =[Cu(NH ) ](OH) ,符合量变引起
4 3 2 2 4 2 4 2 3 3 4 2
质变规律,B项不符合题意; Na O +2H O=2NaOH+H O ,NaOH使酚酞溶液变红色,H O 氧化了
2 2 2 2 2 2 2
酚酞使之褪色,与量变无关,C项符合题意;
Na CO +NaHSO =Na SO +NaHCO ,NaHCO +NaHSO =Na SO +CO ↑+H O,符合量变引起质
2 3 4 2 4 3 3 4 2 4 2 2
变规律,D项不符合题意。
【解析】命题透析 本题以化学美为情境,考查物质结构与性质、化学反应相关知识,意在考查理解与辨析
能力,宏观辨识与微观探析的核心素养。
思路点拨 环已烷中 C采用 sp3杂化,所有原子不可能共平面,A项错误;霓虹灯发光原理为焰色试验,属
于物理变化,B项正确;碘晶体是分子晶体,受热易升华,克服了分子间作用力,化学键没有变化,C项错
误;甲基橙在盐酸中最终变为红色,D项错误。
【解析】命题透析 本题以“知行合一”为情境,考查化学知识与应用,意在考查理解与辨析能力,科学态
度与社会责任的核心素养。
思路点拨 炒鸡蛋即蛋白质在高温下变性,与蛋白质水解无关,A项错误;“84”消毒液的主要成分是次氯酸
钠,具有强氧化性,利用其氧化性杀菌消毒,B项正确;醋酸的酸性比碳酸的强,醋酸与碳酸钙反应,C项正
确;尿素的化学式为 CO(NH ) ,是一种高效氮肥,D项正确。
2 2
【解析】命题透析 本题以化学用语为素材,考查结构式、球棍模型、轨道表示式和结构简式等知识,意在
考查理解与辨析能力,宏观辨识与微观探析的核心素养。思路点拨 Al Cl 分子中每个原子达到8电子结
2 6
A CH B As
4
构,存在2个配位键, 项正确; 的球棍模型为 项错误; 原子的价层有3个未成
对电子,C项正确;2-氨基丁酸分子中氨基与丁酸分子上的2号碳原子相连,D项正确。
【解析】命题透析 本题以实验装置或操作为素材,考查实验设计与评价等知识,意在考查探究与创新能
力,科学探究与创新意识的核心素养。
思路点拨 定容时仰视刻度线读数,溶液体积偏大,配制溶液浓度偏低,A项错误;在铁制镀件上铜,将镀
件放在阴极上,如果将铁制镀件放在阳极上,镀件溶解,B项错误;将过氧化钠倒入水中,若 U形管内左侧
低,右侧高,说明 Na O 和H O反应是放热反应,C项正确;电石中含有 CaS、Ca P等杂质,与水反应
2 2 2 3
生成的 H S、PH 能与溴水反应,干扰了 C H 与溴水反应,D项错误。
2 3 2 2
【解析】命题透析 本题以配合物为素材,考查物质结构与性质知识,意在考查分析与推测能力,证据推理
与模型认知的核心素养。
第 9 页
学科网(北京)股份有限公司思路点拨 N原子是配位原子,N原子向 Ni提供孤电子对形成配位键,A项正确;该分子中碳原子均采用
sp2杂化,B项正确; Ni - TAP中存在碳氢键(极性键)、碳氮键(极性键)和碳碳键(非极性键),C项
正确; Ni - TAP中氨基相距较远,能形成分子间氢键,不能形成分子内氢键,D项错误。
【解析】命题透析 本题以方程式的正误判断为情境,考查电极反应式和离子方程式书写等知识,意在考查
理解与辨析能力,宏观辨识与微观探析的核心素养。
思路点拨 在碱性介质中负极反应式为 CH −8e−+10OH−=CO2−+7H O,A项错误 ;NaHSO 过量,产
4 3 2 3
物中酸继续反应,正确的离子方程式为 2HSO−+ClO−=SO2−+Cl−+SO ↑+H O,B项错误;黄色沉淀是
3 4 2 2
碘化银,硫酸银是白色沉淀,C项正确;硫化氢是弱酸,正确的离子方程式为 Pb2++H S=PbS↓+2H+,D
2
项错误。
【解析】命题透析 本题以电解质的添加剂为素材,考查原子结构与周期律等知识,意在考查分析与推测能
力,证据推理与模型认知的核心素养。
思路点拨 Y原子电子排布式为 1s22s22p2,Y为 C元素。由 2−TS结构可知,W原子最外层有6个电子,
又因为T和 W位于同主族,所以,T为 O元素,W为 S元素。 X原子能形成1个键,Z原子能形成3个键,
说明 Z是N元素,由 X、Y、Z的原子序数之和等于14可知,X的原子序数为 1,X为 H元素。由此推
知,X为 H,Y为 C,Z为 N,T为 O,W为 S。第一电离能 N、O、S依次减小,A项正确
;CH 、NH 、H O的中心原子杂化类型相同,孤电子对数依次增多,故其键角依次减小,B项错误
4 3 2
HNO 的酸性比 H CO 的强,C项正确 ;C、H、O、N除组成NH HCO 、(NH ) CO 外,还可以组
3 2 3 4 3 4 2 3
成有机物,如各类氨基酸等,D项正确。
【解析】命题透析 本题以发光材料 PES为素材,考查有机物结构与性质知识,意在考查分析与推测能力,
证据推理与模型认知的核心素养。
思路点拨 上述反应中断裂2个环,得到高分子化合物,没有小分子生成,不是缩聚反应,A项错误; PES
含酯基,在酸、碱性条件下都能发生水解反应,实现自然降解,B项正确;乙醛和乙的分子式相同,结构不
同,它们互为同分异构体,C项正确;在酸性条件下,甲水解的产物为HOOCCH CH(CH )COOH, D
2 3
项正确。
【解析】命题透析 本题以晶胞结构为素材,考查晶体结构与计算等知识,意在考查分析与推测能力,宏观
辨识与微观探析的核心素养。
1 1
思路点拨 观察晶胞可知,底面有两种角度: 120∘和 60∘,顶点上钙原子对晶胞贡献率分别为 、 ,
12 6
1 1 1 1
同理,棱上 CN2− 贡献率分别 和 ,故1个晶胞中钙的个数为 2+4× +4× =3,CN2− 的个数为
2 3 6 6 12 2
1 1
2+2× +2× =3,其化学式为 CaCN ,A项正确;阴离子团的结构式为 [N=C=N] 2− ,1个晶胞中含3个
3 6 2
阴离子、6个σ键,B项错误;以晶胞中右下方的 CN2−进行分析,距离最近的钙离子个数为6,其配位数为
2
80×3 240
6,C项正确;该晶体的密度 ρ= g⋅cm−3= g⋅cm−3 ,D项正确。
N ×V N ×V
A A
【解析】命题透析 本题以有机物制备为素材,考查电解原理的应用知识,意在考查分析与推测能力,证据
推理与模型认知的核心素养。
思路点拨 观察物质转化可知,环已烯被氧化,CO 被还原,所以 a极为阳极,与电源正极连接,A项错
2
1mol
误;阳极反应式为 ,制备 氧化产物,双极膜内向
左侧迁移 2molOH−,向右侧迁移 2molH+,共减少 36g,B项错误; b极上 CO 发生还原反应制备乙
2
第 10 页
学科网(北京)股份有限公司炔,遵守电子守恒、电荷守恒,C项正确;若制备 1molC H 时得到 10mol电子,阳极失去 10mol电子,
2 2
生成氧化产物 5mol,a极、 b极产物的物质的量之比为 5:1,D项错误。
【解析】命题透析 本题以合成芳胺的历程为素材,考查物质结构与性质等知识,意在考查分析与推测能
力,变化观念与平衡思想的核心素养。
思路点拨 从上述循环图看出,镍原子分别形成的共价键数目有3、5、6,A项正确; ArCl和 NH 反应生成
3
ArNH 和 HCl,发生了取代反应,B项正确;芳基中碳原子采用 sp2杂化,氨基中 N原子采取 sp3杂化,
2
而 HCl中氯原子不采取杂化,HCl中存在 p−s型 σ键,C项错误;Ⅱ为中间产物,D项正确。
【解析】命题透析 本题以溶度积为情境,考查难溶电解质的溶解平衡与计算知识,意在考查归纳与论证能
力,变化观念与平衡思想的核心素养。
思路点拨 分析三种难溶盐可知,Sr (AsO ) 、Co (AsO ) 的组成相同,对应的直线成平行线,故 L 代
3 4 2 3 4 2 2
表pAg+与 pAsO3− 的关系,A项错误;由 a、b、c点数据可计算
4
:K (Ag AsO )=10−21.9,K [Sr (AsO ) ]=10−18.3 ,K [Co (AsO ) ]=10−28.2,B项错误;饱和 Ag AsO
sp 3 4 sp 3 4 2 sp 3 4 2 3 4
溶液中存在平衡 :Ag
3
AsO
4
⇌3Ag++AsO3
4
− ,饱和 Ag
3
AsO
4
溶液中
c(AsO3−)=
√
4
K
sp
(Ag
3
AsO
4
)
=
√
4
10−21.9
mol⋅L−1,C项正确;根据平衡常数表达式计算
4 27 27
K [Sr (AsO ) ] 10−18.3
K:K= sp 3 4 2 = =109.9,D项错误。
K [Co (AsO ) ] 10−28.2
sp 3 4 2
二、非选择题:本题共4小题,共58分。
15.(1) 粉碎矿石、适当加热、搅拌等(任填两种,合理即可,2分)
(2) 提高水解速率,提高产率(合理即可,2分); 浸出(1分)
(3) ¿(2分)
(4) ¿(2分)
(5) TiO C(2分)
2
【解析】思路点拨 BaTiO 中m(Ba):m(Ti)=2.854>2.8,说明杂质中含有钛元素,可能是 TiO 。
3 2
√2a−2b
(6) (2分)
a−2b
【解析】思路点拨 依题意可知,钛离子、钡离子分别与氧离子相切,但钛离子、钡离子不一定相切。已知
晶胞边长为 apm,O2−的半径为 bpm,根据图示可知,晶胞边长 =2r(Ti4+)+2r(O2−)=apm,则
a−2r(O2−)
a−2b
r(Ti4+)= = pm;晶胞面对角线的长度
2 2
√2a−2r(O2−)
√2a−2b
=2r(O2−)+2r(Ba2+)=√2apm,r(Ba2+)= = pm,故 Ba2+、Ti4+的半径之比
2 2
√2a−2b
。
a−2b
【解析】命题透析 本题以钛酸钡为素材,考查元素化合物转化以及晶胞计算知识,意在考查理解与辨析能
力,科学态度与社会责任、宏观辨识与微观探析的核心素养。
16.(1) 慢(2分)
(2) 12(2分); 2[Fe(CN) ] 4−+Cl =2Cl−+2[Fe(CN) ] 3−(2分)
6 2 6
【解析】思路点拨 1个 [C≡N] −离子含有1个 σ键,能形成1个配位键(也是 σ键)。
(3) 部分 Cl 与 NaOH或水反应或随着 Cl−浓度减小,c(OH−)增大,OH−在阳极反应(合理即可,2
2
分)
第 11 页
学科网(北京)股份有限公司【解析】思路点拨 从两个角度分析,一是阴极生成了碱,氯气溶于水,与碱反应;二是从离子浓度对放电顺
序的影响角度分析,一段时间后,c(OH−)增大,c(Cl−)减小,放电能力可能出现OH−>Cl−,阳极产生 O
2
,阴极仍然产生 H ,导致V(H )>V(Cl )。
2 2 2
(4) 2(2分); [Fe(CN) ] 3−部分电离出
6
Fe3+,2Fe3++Fe=3Fe2+,K++Fe2++[Fe(CN) ] 3−=KFe[Fe(CN) ]↓(蓝色)(合理即可,2分)
6 6
【解析】思路点拨 比较实验Ⅰ和Ⅱ,利用控制变量分析,Ⅰ和Ⅱ中含铁粒子总浓度相同,Ⅰ中产生蓝色沉淀
较快,而Ⅱ较慢,说明 [Fe(CN) ] 3− 只部分电离。若完全电离,则 A =A ;若不电离,则Ⅱ中不产生蓝色
6 1 2
沉淀。
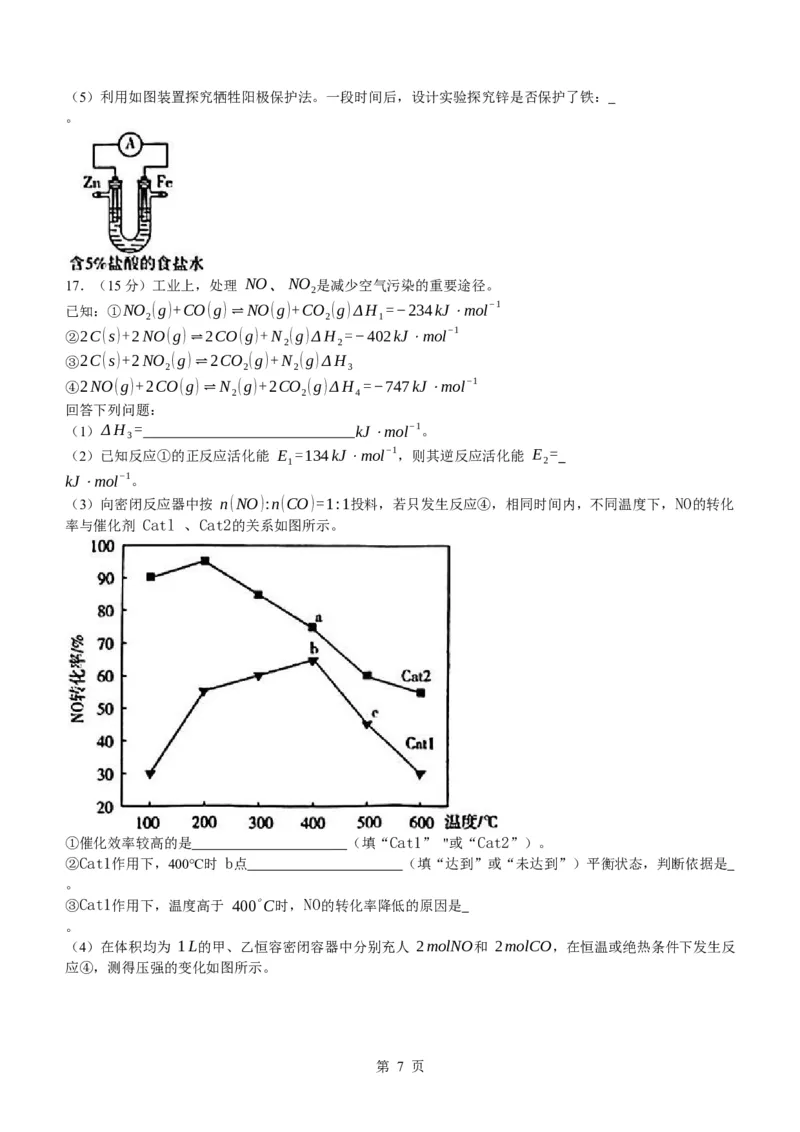
(5) 取铁极附近溶液于试管中,滴加 K [Fe(CN) ]溶液,若没有现象,则锌保护了铁;若产生蓝色沉
3 6
淀,则锌没有保护铁(合理即可,2分)
【解析】思路点拨 检验铁是否被腐蚀,需取出铁极附近溶液进行实验。
【解析】命题透析 本题以铁氰化钾为情境,考查实验基本操作与实验探究等知识,意在考查探究与创新能
力,科学探究与创新意识的核心素养。
17.(1) −870(2分)
命题透析 本题以氮的氧化物为情境,考查热化学和化学反应速率与平衡的知识,意在考查分析与推测能
力,变化观念与平衡思想的核心素养。
【解析】思路点拨 根据盖斯定律可知,②+①×2得目标反应的 ΔH =−870kJ⋅mol−1 。
3
(2) 368(2分)
【解析】思路点拨 反应热等于正、逆反应活化能之差,E =368kJ⋅mol−1 。
2
(3) ① Cat2(1分)
【解析】思路点拨 相同温度下,NO的转化率越高,催化效率越高,所以,Cat2的催化效率较高。
② 未达到(1分); 相同温度时,不同催化剂下 NO的转化率不等(合理即可,2分)
【解析】a、b点对应的温度相同,催化剂不同,转化率不同,说明未达到平衡,因为平衡点只与温度有
关,与催化剂无关。
③ 催化剂活性降低(合理即可,2分)
【解析】b→c点催化效率降低,可能是催化剂活性降低。
(4) ① >(1分)
【解析】思路点拨 正反应是放热反应,气体分子数减小,甲容器启动反应过程中,压强增大,说明甲为绝
热过程,乙为恒温过程。温度: ab。
② 0.4(2分); 597.6(2分)
【解析】根据三段式法可得:
2NO(g) + 2CO(g) ⇌ N (g) + 2CO (g)
2 2 ¿2x¿¿x¿¿2x¿a点物质的量/mol:¿(2−2x)¿¿(2−2x)¿¿x¿¿2x¿
起始物质的量/mol: 2 ¿2 ¿0 ¿ 变化物质的量/mol: ¿
恒温恒容下,气体压强与气体总物质的量成正比。 4:(4−x)=5:4,x=0.8。
1.6mol 1.6
v(NO)= =0.4mol⋅L−1 ⋅min−1 。反应至 a点放出的热量为 747kJ× =597.6kJ。
4min×1L 2
18.(1) 醚键、酰胺基(2分)
(2) 水解(或取代)反应(1分)
(3) 取少量样品,加入 NaOH溶液并煮沸一会儿,待冷却后,滴加稀硝酸酸化,再滴加 AgNO ,溶
3
液,产生白色沉淀(合理即可,2分)
第 12 页
学科网(北京)股份有限公司(4) (2分)
【解析】思路点拨 根据元素守恒判断,副产物为水。
(5) 9(2分); 、 、 、
(任填一种,2分); (2分)
【解析】思路点拨 两种官能团之一是氯原子,同分异构体可以看成下列有机物的氢被氯取代(除本身外)
:CH CH CHO、CH COCH
3 2 3 3
、 、 ,依次得到的同分异构体有2种、1种、
2种、2种、2种,共9种。
(6) (合理即
可,3分)
【解析】命题透析 本题以更昔洛韦的合成路线为素材,考查官能团的名称、反应类型、同分异构体的书写
等知识,意在考查分析与推测能力,证据推理与模型认知的核心素养。
第 13 页
学科网(北京)股份有限公司