文档内容
人教版(2019)必修第二册第八章第三节 环境保护与绿色化学
课时训练一
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.化学与人体健康及环境保护息息相关。下列叙述正确的是
A.食品加工时不可添加任何防腐剂
B.掩埋废旧电池不会造成环境污染
C.天然气不完全燃烧会产生有毒气体
D.使用含磷洗涤剂不会造成水体污染
2.化学与人体健康及环境保护息息相关。下列叙述正确的是
A.食品加工时不可添加任何防腐剂
B.掩埋废旧电池不会造成环境污染
C.工业废气中的SO 可采用石灰法进行脱除
2
D.金属钠、镁等活泼金属着火时,可以使用泡沫灭火器来灭火
3.硫和氮及其化合物对人类生存和社会发展意义重大,但硫氧化物和氮氧化物造成的
环境问题也日益受到关注,下列说法正确的是
A.NO 和SO 均为红棕色且有刺激性气味的气体,是酸雨的主要成因
2 2
B.汽车尾气中的主要大气污染物为NO、SO 和PM2.5
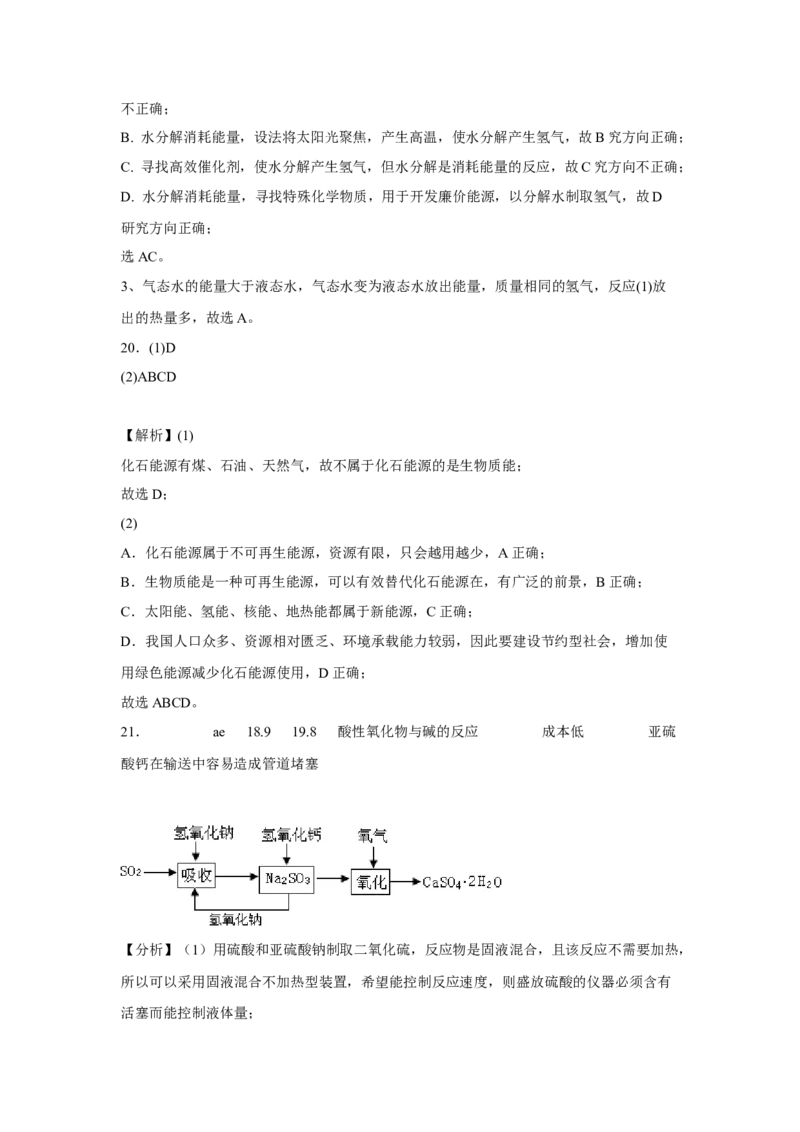
2
C.植物直接吸收利用空气中的NO和NO 作为肥料,实现氮的固定
2
D.工业废气中的SO 可采用石灰法进行脱除
2
4.下列有关湘江流域的治理和生态修复的措施中,没有涉及到化学变化的是
A.定期清淤,疏通河道
B.化工企业“三废”处理后,达标排放
C.利用微生物降解水域中的有毒有害物质
D.河道中的垃圾回收分类后,进行无害化处理
5.下列说法不正确的是
A.用明矾可消除水中Cu2+等重金属离子污染
B.用撒熟石灰的方法可改良酸性土壤
C.汽车尾气的大量排放是造成雾霾天气的因素之一
D.赤潮是水体富营养化,藻类大量繁殖,消耗了大量氧气,造成水体缺氧的现象
6.化学与生活、环境密切相关。下列有关说法正确的是
A.夏天雷雨过后空气清新的主要原因是放电时N 和O 合成了NO
2 2B.绿色净水消毒剂NaFeO 具有强氧化性,其氧化产物为Fe3+
2 4
C.可向海水中加入明矾使海水淡化以解决淡水供应危机
D.用活性炭为糖浆脱色和用臭氧漂白纸浆的原理不相同
7.化学是材料科学的基础。下列说法错误的是
A.制造5G芯片的氮化铝晶圆属于无机非金属材料
B.制造阻燃或防火线缆的橡胶不能由加聚反应合成
C.制造特种防护服的芳纶纤维属于有机高分子材料
D.可降解聚乳酸塑料的推广应用可减少“白色污染”
8.化学与生活、生产密切相关。下列做法正确的是
A.将单质碘加入食盐中获得加碘食盐
B.使用 合成聚碳酸酯类可降解塑料
C.大量使用化肥、农药提高粮食产量
D.利用工业废水灌溉农作物实现“水循环”
9.全国实行垃圾分类,体现了环境保护。下列有关说法正确的是
A.废弃的聚乙烯塑料属于白色垃圾,不可降解,能使溴水褪色
B.可回收的易拉罐中含金属铝,可通过电解氯化铝制取
C.废旧电池中含有镍、镉等重金属,不可用填埋法处埋
D.含棉、麻、丝、毛及合成纤维的废旧衣物燃烧处理时都只生成CO 和HO
2 2
10.下列措施有利于环境保护的是
A.将煤做成蜂窝煤 B.将电池进行深埋处理
C.大力发展火力发电 D.对燃料脱硫脱硝处理
11.“天问一号”着陆火星,“嫦娥五号”采回月壤。腾飞中国离不开化学,长征系
列运载火箭使用的燃料有液氢和煤油等化学品。下列有关说法正确的是
A.煤油是可再生能源
B. 燃烧过程中热能转化为化学能
C.火星陨石中的 质量数为20
D.月壤中的 与地球上的 互为同位素
12.中央经济工作会议将碳达峰和碳中和列为主要任务之一,在此背景下,“新能
源”、“低碳”、“节能减排”、“绿色化学”等概念愈来愈受到人们的重视。下列
说法不正确的是
试卷第2页,共3页A.太阳能、地热能、氢能均属于“新能源”
B.“低碳”是指采用含碳量低的烃类作为燃料
C.图中HCl的循环使用体现了“节能减排”思想
D.用乙烷和氯气光照制取氯乙烷不是最理想的“原子经济性反应”
13.2020年9月22日,中国国家主席习近平在第七十五届联合国大会一般性辩论上发
表重要讲话指出,中国将提高国家自主贡献力度,采取更加有力的政策和措施,二氧
化碳排放力争于2030年前达到峰值,努力争取2060年前实现碳中和。下列说法错误
的是
A.减少碳排放有利于缓解全球变暖,减少极端天气发生的频率
B.大力支持风电、光伏发电、生物质发电等行业健康有序发展
C.鼓励农村居民燃烧农作物秸秆用于做饭、冬季取暖
D.大力发展电动汽车、氢燃料电池汽车等新能源汽车
14.下列关于能源和作为能源的物质的叙述中,不正确的是
A.化石能源物质内部蕴藏着大量的能量
B.绿色植物进行光合作用时,将太阳能转化为化学能“贮存”起来
C.物质的化学能可以在不同条件下转为热能、电能为人类所利用
D.吸热反应没有利用价值
15.化学与生活、环境和能源密切相关,下列过程没有涉及化学变化的是
A.垃圾焚烧发电,废物利用 B.风力发电,发展新能源
C.环境消毒杀菌,阻断病毒传播 D.稻草发酵肥田,发展绿色农业
二、填空题
16.氢能是一种理想的绿色能源。有科学家预言,氢能有可能成为人类未来的主要能
源。
(1)为什么说氢能是一种理想的绿色能源?___________
(2)请根据本书后附录Ⅰ所提供的燃烧热数据,计算相同质量的氢气、甲烷、乙醇在
25℃和101kPa时完全燃烧放出的热量,据此说明氢气作为能源的优点。___________
(3)查阅资料,了解氢能在利用过程中需要解决的技术难题,以及氢能利用的发展前景。___________
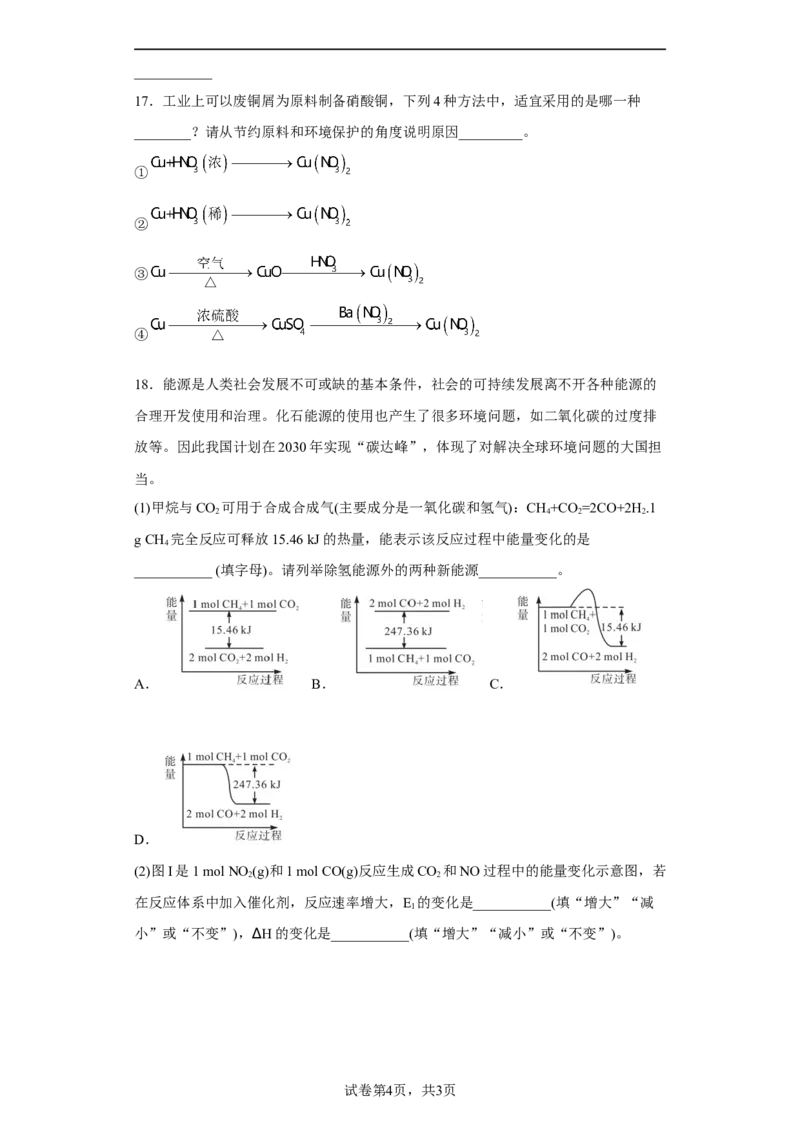
17.工业上可以废铜屑为原料制备硝酸铜,下列4种方法中,适宜采用的是哪一种
________?请从节约原料和环境保护的角度说明原因_________。
①
②
③
④
18.能源是人类社会发展不可或缺的基本条件,社会的可持续发展离不开各种能源的
合理开发使用和治理。化石能源的使用也产生了很多环境问题,如二氧化碳的过度排
放等。因此我国计划在2030年实现“碳达峰”,体现了对解决全球环境问题的大国担
当。
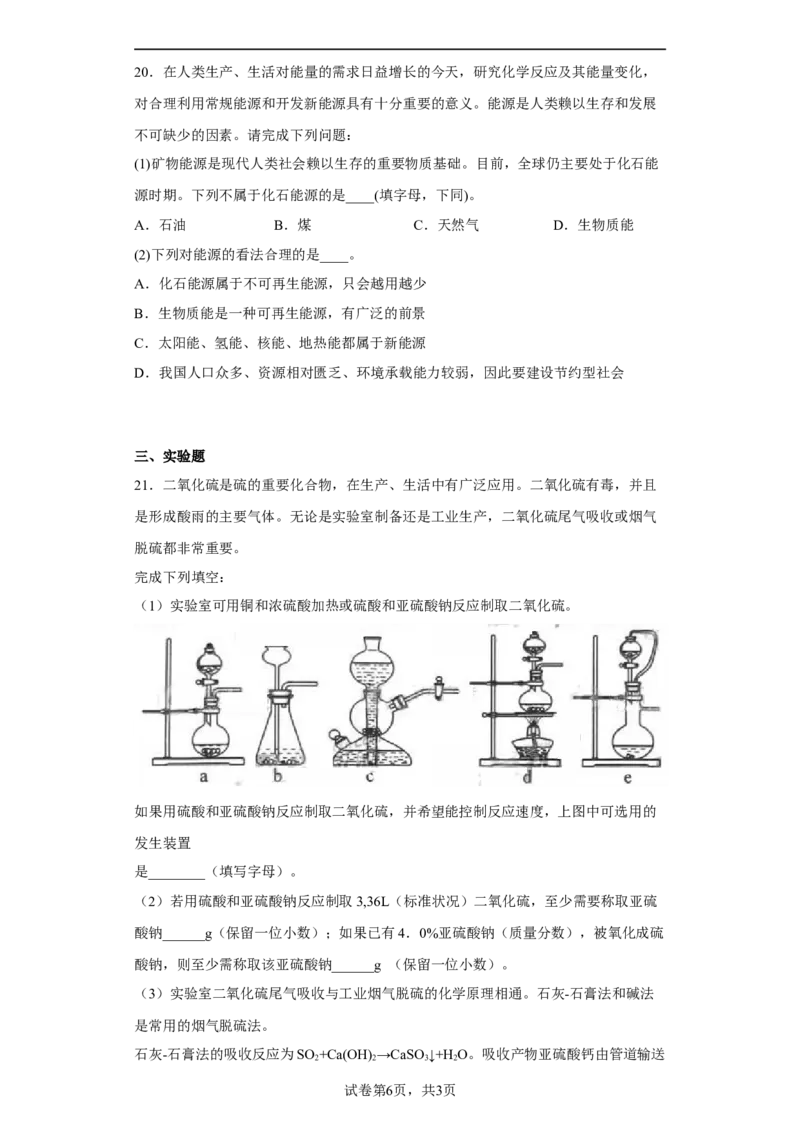
(1)甲烷与CO 可用于合成合成气(主要成分是一氧化碳和氢气):CH+CO =2CO+2H .1
2 4 2 2
g CH 完全反应可释放15.46 kJ的热量,能表示该反应过程中能量变化的是
4
___________ (填字母)。请列举除氢能源外的两种新能源___________。
A. B. C.
D.
(2)图I是1 mol NO (g)和1 mol CO(g)反应生成CO 和NO过程中的能量变化示意图,若
2 2
在反应体系中加入催化剂,反应速率增大,E 的变化是___________(填“增大”“减
1
小”或“不变”),∆H的变化是___________(填“增大”“减小”或“不变”)。
试卷第4页,共3页(3)已知反应2NO(g)+2H (g) N(g)+2HO(g) ∆H=-752 kJ/mol的反应机理如下:
2 2 2
①2NO(g) NO(g)(快)
2 2
②N O(g)+H(g) NO(g)+H O(g)(慢)
2 2 2 2 2
③NO(g)+H (g) N(g)+HO(g)(快)
2 2 2 2
请比较:反应②的活化能___________(填“大于”或“小于”)反应③的的活化能。
(4)捕碳技术(主要指捕获CO)在降低温室气体排放中具有重要的作用。目前NH 和
2 3
(NH )CO 已经被用作工业捕碳剂,它们与CO 可发生如下可逆反应:
4 2 3 2
①2NH (l)+H O(l)+CO (g)=(NH )CO(aq) ∆H
3 2 2 4 2 3 1
②NH (l)+H O(l)+CO (g)=NH HCO (aq) ∆H
3 2 2 4 3 2
③(NH )CO(aq)+H O(l)+CO (g)=2NH HCO (aq) ∆H
4 2 3 2 2 4 3 3
∆H 和∆H、∆H 之间的关系是∆H=___________。
3 1 2 3
19.根据以下叙述回答下列小题
能源可划分为一级能源和二级能源,自然界中以现成形式提供的能源称为一级能源,
需依靠其他能源间接制取的能源称为二级能源。氢气是一种高效而没有污染的二级能
源,它可以由自然界中大量存在的水来制取:2HO(1)= 2H (g)+O(g)
2 2 2
1. 下列叙述正确的是___
A.电能是二级能源 B.水力是二级能源
C.天然气是一级能源 D.干馏煤气是一级能源
2. 关于用水制取二级能源氢气,以下研究方向不正确的是___
A.构成水的氢和氧都是可以燃烧的物质,因此可研究在水不分解的情况下,使氢成
为二级能源
B.设法将太阳光聚焦,产生高温,使水分解产生氢气
C.寻找高效催化剂,使水分解产生氢气,同时释放能量
D.寻找特殊化学物质,用于开发廉价能源,以分解水制取氢气
3. 质量相同的氢气,分别与足量的氧气点燃充分反应,在(1)生成液态水,(2)生成水蒸
气两种情况下___
A.反应(1)放出的热量多 B.反应(2)放出的热量多
C.(1)、(2)放出的热量一样多 D.无法比较两个反应放出的热量20.在人类生产、生活对能量的需求日益增长的今天,研究化学反应及其能量变化,
对合理利用常规能源和开发新能源具有十分重要的意义。能源是人类赖以生存和发展
不可缺少的因素。请完成下列问题:
(1)矿物能源是现代人类社会赖以生存的重要物质基础。目前,全球仍主要处于化石能
源时期。下列不属于化石能源的是____(填字母,下同)。
A.石油 B.煤 C.天然气 D.生物质能
(2)下列对能源的看法合理的是____。
A.化石能源属于不可再生能源,只会越用越少
B.生物质能是一种可再生能源,有广泛的前景
C.太阳能、氢能、核能、地热能都属于新能源
D.我国人口众多、资源相对匮乏、环境承载能力较弱,因此要建设节约型社会
三、实验题
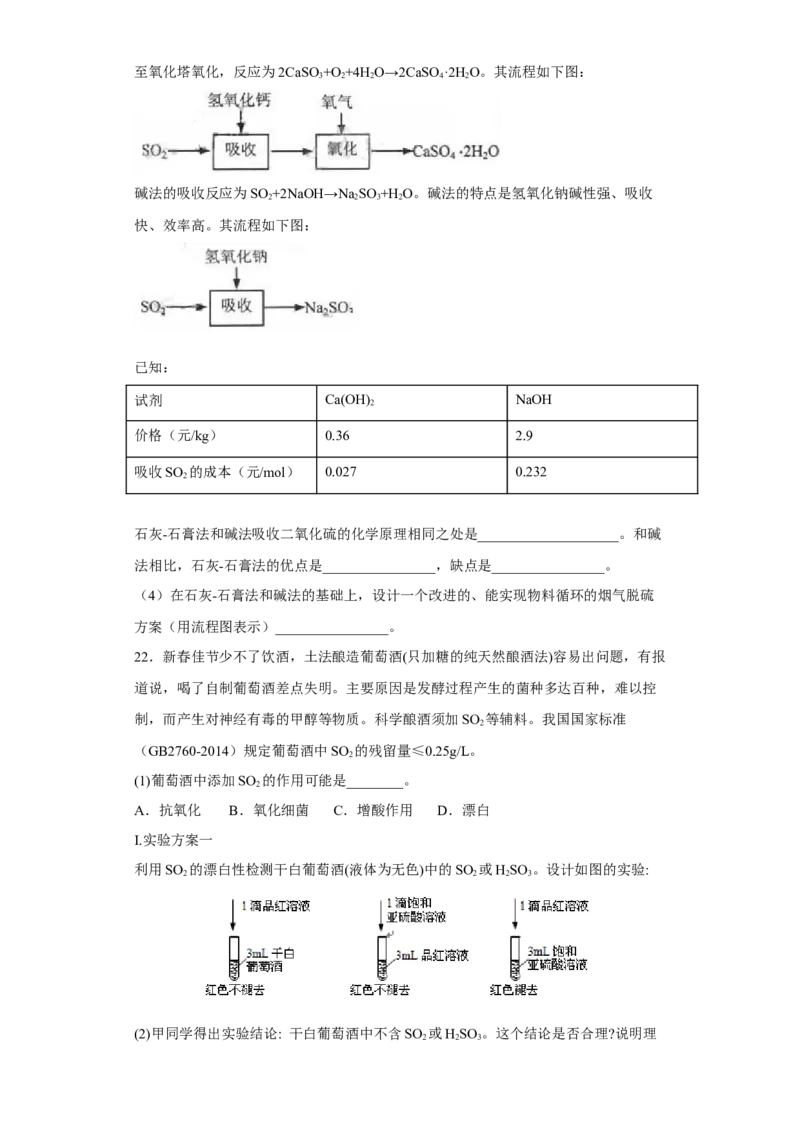
21.二氧化硫是硫的重要化合物,在生产、生活中有广泛应用。二氧化硫有毒,并且
是形成酸雨的主要气体。无论是实验室制备还是工业生产,二氧化硫尾气吸收或烟气
脱硫都非常重要。
完成下列填空:
(1)实验室可用铜和浓硫酸加热或硫酸和亚硫酸钠反应制取二氧化硫。
如果用硫酸和亚硫酸钠反应制取二氧化硫,并希望能控制反应速度,上图中可选用的
发生装置
是________(填写字母)。
(2)若用硫酸和亚硫酸钠反应制取3,36L(标准状况)二氧化硫,至少需要称取亚硫
酸钠______g(保留一位小数);如果已有4.0%亚硫酸钠(质量分数),被氧化成硫
酸钠,则至少需称取该亚硫酸钠______g (保留一位小数)。
(3)实验室二氧化硫尾气吸收与工业烟气脱硫的化学原理相通。石灰-石膏法和碱法
是常用的烟气脱硫法。
石灰-石膏法的吸收反应为SO +Ca(OH) →CaSO↓+H O。吸收产物亚硫酸钙由管道输送
2 2 3 2
试卷第6页,共3页至氧化塔氧化,反应为2CaSO+O +4H O→2CaSO ·2H O。其流程如下图:
3 2 2 4 2
碱法的吸收反应为SO +2NaOH→Na SO +H O。碱法的特点是氢氧化钠碱性强、吸收
2 2 3 2
快、效率高。其流程如下图:
已知:
试剂 Ca(OH) NaOH
2
价格(元/kg) 0.36 2.9
吸收SO 的成本(元/mol) 0.027 0.232
2
石灰-石膏法和碱法吸收二氧化硫的化学原理相同之处是____________________。和碱
法相比,石灰-石膏法的优点是________________,缺点是________________。
(4)在石灰-石膏法和碱法的基础上,设计一个改进的、能实现物料循环的烟气脱硫
方案(用流程图表示)________________。
22.新春佳节少不了饮酒,土法酿造葡萄酒(只加糖的纯天然酿酒法)容易出问题,有报
道说,喝了自制葡萄酒差点失明。主要原因是发酵过程产生的菌种多达百种,难以控
制,而产生对神经有毒的甲醇等物质。科学酿酒须加SO 等辅料。我国国家标准
2
(GB2760-2014)规定葡萄酒中SO 的残留量≤0.25g/L。
2
(1)葡萄酒中添加SO 的作用可能是________。
2
A.抗氧化 B.氧化细菌 C.增酸作用 D.漂白
I.实验方案一
利用SO 的漂白性检测干白葡萄酒(液体为无色)中的SO 或HSO 。设计如图的实验:
2 2 2 3
(2)甲同学得出实验结论: 干白葡萄酒中不含SO 或HSO 。这个结论是否合理?说明理
2 2 3由___________。
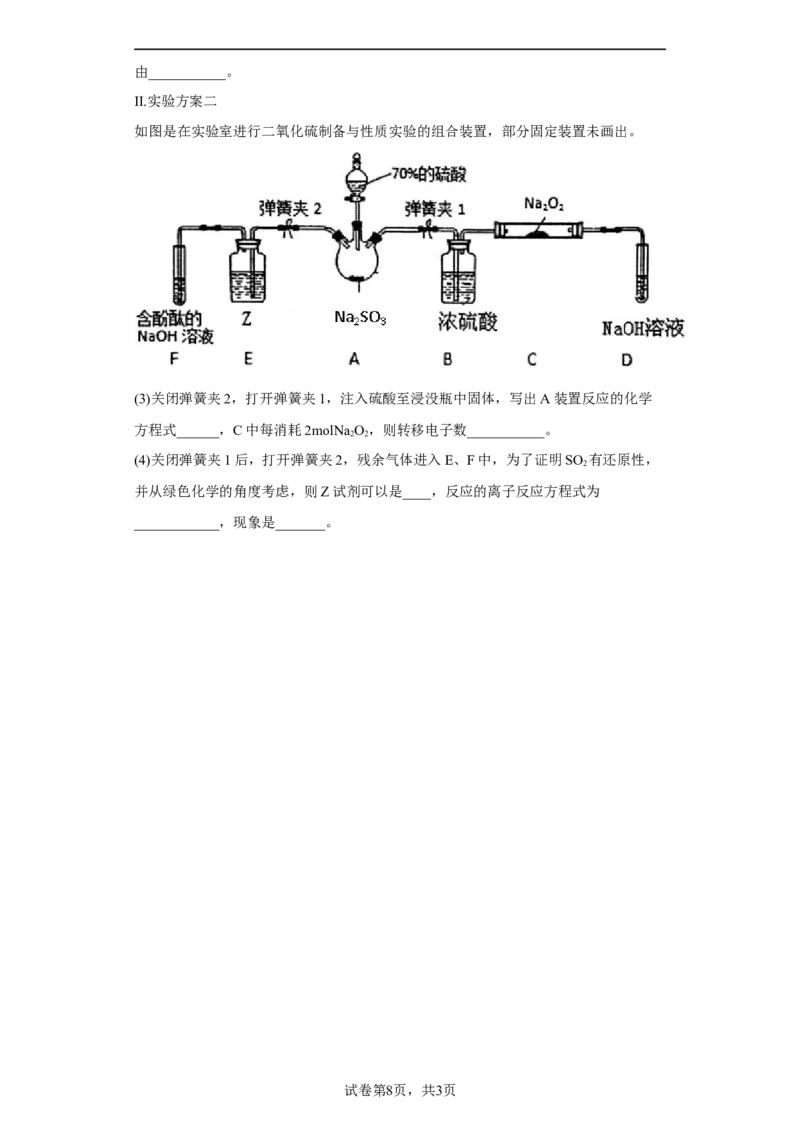
Ⅱ.实验方案二
如图是在实验室进行二氧化硫制备与性质实验的组合装置,部分固定装置未画出。
(3)关闭弹簧夹2,打开弹簧夹1,注入硫酸至浸没瓶中固体,写出A装置反应的化学
方程式______,C中每消耗2molNa O,则转移电子数___________。
2 2
(4)关闭弹簧夹1后,打开弹簧夹2,残余气体进入E、F中,为了证明SO 有还原性,
2
并从绿色化学的角度考虑,则Z试剂可以是____,反应的离子反应方程式为
____________,现象是_______。
试卷第8页,共3页参考答案:
1.C
【详解】A.食品加工时,可适当添加食品添加剂和防腐剂等,如苯甲酸钠,故A错误;
B.废旧电池中含有重金属等金属离子,会造成土壤污染,水体污染等,故B错误;
C.天然气主要成分为甲烷,不完全燃烧会产生一氧化碳等有毒气体,故C正确;
D.含磷洗涤剂的排放,使水中磷过多,造成水中藻类疯长,消耗水中溶解的氧,水体变
浑浊,故D错误;
故选C。
2.C
【详解】A.只要按规定合理添加防腐剂,可以提高食物保存时间,因此食品加工可以添
加防腐剂,但要注意在要求范围之内,故A错误;
B.掩埋废旧电池,会造成电解液流出,里面的重金属离子会对土壤造成污染,故B错误;
C.工业废气中的SO 属于酸性氧化物,能与CaO反应生成CaSO,故可采用石灰法进行
2 3
脱除,故C正确;
D.镁可以与二氧化碳反应,钠能和水反应,所以用泡沫灭火器,可以用沙子灭火,故D
错误。
故选:C。
3.D
【详解】A. 是红棕色且有刺激性气味的气体,而 是无色有刺激性气味的气体,A
错误;
B.汽车尾气的主要大气污染物为C与N的氧化物,如NO 和CO等,B错误;
x
C.氮的固定是指将游离态的氮元素转化为化合态,且植物可吸收土壤中的铵根离子或硝
酸根离子作为肥料,不能直接吸收空气中的氮氧化物,C错误;
D.工业废气中的 可采用石灰法进行脱除,如加入石灰石或石灰乳均可进行脱硫处理,
D正确;
故选D。
4.A
【详解】A.定期清淤,疏通河道,保证河流畅通,没有涉及化学变化,A符合题意;
B.工业生产中得到产品的同时常产生废气、废水和废渣(简称“三废”),常涉及化学
方法进行处理,如石膏法脱硫、氧化还原法和沉淀法等处理废水,废渣资源回收利用等过程均有新物质生成,涉及化学变化,B不符合题意;
C.可通过微生物的代谢作用,将废水中有毒有害物质尤其复杂的有机污染物降解为简单
的、无害物质,所以微生物法处理废水有新物质的生成,涉及的是化学变化,C不符合题
意;
D.河道中的垃圾回收分类,适合焚化处理的垃圾,利用现代焚化炉进行燃烧,消灭各种
病原体,把一些有毒、有害物质转化为无害物质,同时可回收热能,用于供热和发电等,
此过程涉及化学变化,D不符合题意;
故选A。
5.A
【详解】A. 明矾水解后产生氢氧化铝胶体,吸附水中悬浮的杂质,不能消除水中Cu2+等
重金属离子污染,故A错误;
B. 熟石灰是碱可中和土壤中的酸,用撒熟石灰的方法可改良酸性土壤,故B正确;
C. 大量燃烧化石燃料可产生有害气体和烟尘,汽车尾气的大量排放是造成雾霾天气的因
素之一,故C正确;
D. 赤潮是含氮、磷的废水大量排放,导致水体富营养化,藻类大量繁殖,消耗了大量氧
气,造成水体缺氧的现象,故D正确。
故选A。
6.D
【详解】A. 放电条件下O 转化为O,净化空气、使空气清新,故A错误;
2 3
B. NaFeO 具有强氧化性,净水消毒时发生还原反应,还原产物为氢氧化铁,故B错误;
2 4
C. 明矾净水原理是铝离子水解生成吸附性强的氢氧化铝胶体,吸附水中的悬浮物形成沉
淀,但不能除去可溶性离子,所以加入明矾不能使海水淡化,故C错误;
D. 活性炭有吸附作用,臭氧有强氧化性,有漂白作用,漂白原理不同,故D正确;
故选D。
7.B
【详解】A.氮化铝是一种高温结构陶瓷,属于新型的无机非金属材料,A正确;
B.天然橡胶的单体为异戊二烯,合成橡胶的单体如顺丁烯等中均含有碳碳双键,通过加
聚反应合成制得橡胶,B错误;
C.“涤纶”“锦纶”“腈纶”“丙纶”“维纶”“氯纶”“芳纶”等均为合成纤维,属
于有机高分子材料,C正确;
D.可降解聚乳酸塑料的推广应用,可以减少难以降解塑料的使用,从而减少“白色污
答案第2页,共2页染”,D正确;
故答案为:B。
8.B
【详解】A.碘的性质不稳定,有毒,加碘食盐中 碘元素以碘酸钾的形式存在,A项错误;
B. CO 合成可降解塑料既能减缓温室效应,又能减少白色污染,B项正确;
2
C. 大量使用化肥、农药,会导致粮食中含有有损人体健康的物质,C项错误;
D. 工业废水中含有有害物质,会对地下水或土壤造成污染,D项错误;
故选B。
9.C
【详解】A.聚乙烯中没有不饱和键,不能使溴水褪色、难以降解,废弃的聚乙烯塑料属
于白色垃圾,A错误;
B.铝可通过电解氧化铝制取,氯化铝是共价化合物、没有离子、不能电解,B错误;
C. 废旧电池中含有镍、镉等重金属,如果填埋会引起重金属污染,故不可用填埋法处埋,
C正确;
D. 含棉、麻及合成纤维的废旧衣物燃烧处理时都只生成CO 和HO,丝、毛属于蛋白质,
2 2
含碳、氢、氧和氮等元素,燃烧产物除了CO 和HO外,还有别的产物,D错误;
2 2
答案选C。
10.D
【详解】A.将煤做成蜂窝状,提高了煤与空气的接触面积,煤燃烧更充分,但煤燃烧时
也会产生对环境有污染的气体及粉尘,A不符合题意;
B.电池中含有许多重金属化合物,将电池深埋会污染土壤及水资源,不利于环境保护,B
不符合题意;
C.火力发电会产生大量污染环境的气体,不利用保护环境,C不符合题意;
D.对燃料脱硫脱硝处理,这种煤燃烧时就不会产生SO 、NO 等大气污染物,有利于环境
2 2
保护,D符合题意;
故合理选项是D。
11.C
【详解】A.煤油来源于石油,属于不可再生能源,故A错误;
B.氢气的燃烧过程放出热量,将化学能变为热能,故B错误;
C.元素符号左上角数字为质量数,所以火星陨石中的20Ne 质量数为20,故C正确;D.同位素须为同种元素,3He 和 3H的质子数不同,不可能为同位素关系,故D错误;
故选C。
12.B
【详解】A.太阳能、地热能、氢能、生物能以及核能均属于“新能源”,故A正确;
B.“低碳”主要是指二氧化碳的排放量,故B错;
C.图中HCl的循环利用,排除的水无污染,符合“节能减排”思想,故C正确;
D.用乙烷和氯气光照制取氯乙烷,会有副反应发生,生成二氯乙烷等副产物,所以导致
C原子利用率低,即用乙烷和氯气光照制取氯乙烷不是最理想的“原子经济性反应”,而
应用乙烯与氯化氢加成制取,故D正确;
答案选B。
13.C
【详解】A.减少二氧化碳向大气的排放,有利于降低大气中二氧化碳的浓度,从而减少
温室效应的产生,缓解全球变暖,延缓南北极冰川的熔化,减少极端天气发生的频率,A
正确;
B.风电、光伏发电、生物质发电等行业健康有序发展,可减少含碳物质的燃烧,从而减
少二氧化碳向大气的排放,降低大气中二氧化碳的浓度,B正确;
C.农村居民燃烧农作物秸秆,会增大二氧化碳气体的排放,从而增加大气中温室气体的
浓度,导致地球的变暖,C错误;
D.大力发展电动汽车、氢燃料电池汽车等新能源汽车,可减少含碳燃料的使用,从而降
低大气中二氧化碳的浓度,D正确;
故选C。
14.D
【详解】A.化石能源物质内部蕴含的最初能量来源于太阳能,具有大量能量,A项正确;
B.植物光合作用通过一系列生理变化,将太阳能转化为化学能储存在植物体内,B项正确;
C.能量可以相互转化,因此物质的化学能在不同的条件下可以转化为热能,电能等,C项
正确;
D.任何反应都有其存在价值,吸热反应可以降低周围的温度,如利用氯化铵和氢氧化钙来
降温,D项错误;
故选D。
15.B
【详解】A.垃圾焚烧发电过程,生成新物质,涉及化学变化,故A不选;
答案第4页,共2页B.风力发电,依靠风的动力将风能转化为电能,没有新物质生成,不涉及化学变化,故B
选;
C.环境消毒杀菌,利用物质的强氧化性,使细菌蛋白质变性,有新物质生成,涉及化学
变化,故C不选;
D.稻草发酵的过程,有新物质生成,涉及化学变化,故D不选;
故选:B。
16.(1)氢气本身无毒,极易燃烧,燃烧产物为水,对环境无污染,由水制得的氢气,具有
再生性
(2)氢气的燃烧热285.8kJ/mol,甲烷的燃烧热为:890.3 kJ/mol,乙醇的燃烧热为1366.8
kJ/mol,M(H )=2g/mol,M(CH )=16g/mol,M(CH CHOH)=46g/mol;假设m(H)= m(CH)=
2 4 3 2 2 4
m(CH CHOH)=1g,则1g氢气燃烧放出的热量为0.5×285.8kJ=142.9 kJ;1g甲烷燃烧放出的
3 2
热量为 ×890.3 kJ =55.6 kJ;1g乙醇燃烧放出的热量为 ×1366.8kJ=29.7 kJ;所以氢气作
为能源的优点:清洁,燃烧放出的热量较高;
(3)降低制取氢气的成本,安全、大量地贮存氢气;氢气可以作为未来广泛使用的一种新能
源
【解析】(1)
氢气本身无毒,极易燃烧,燃烧产物为水,对环境无污染,由水制得的氢气,具有再生性,
所以氢气属于绿色能源;
(2)
氢气的燃烧热285.8kJ/mol,甲烷的燃烧热为:890.3 kJ/mol,乙醇的燃烧热为1366.8
kJ/mol,M(H )=2g/mol,M(CH )=16g/mol,M(CH CHOH)=46g/mol;假设m(H)= m(CH)=
2 4 3 2 2 4
m(CH CHOH)=1g,则1g氢气燃烧放出的热量为0.5×285.8kJ=142.9 kJ;1g甲烷燃烧放出的
3 2
热量为 ×890.3 kJ =55.6 kJ;1g乙醇燃烧放出的热量为 ×1366.8kJ=29.7 kJ;所以氢气作
为能源的优点:清洁,燃烧放出的热量较高;
(3)
应该解决的技术难题:降低制取氢气的成本,安全、大量地贮存氢气;一旦解决了以上问
题,氢气可以作为今后广泛使用的新能源。
17. ③ ③先将铜单质氧化得到氧化铜,再与稀硝酸反应得到硝酸铜和水,没有浪费原料,也没有生成其它有害物质;①、②和④铜单质与浓稀硝酸或浓硫酸反
应都会生成氮氧化物或硫氧化物气体,浪费了原料,还需后续处理,不然会污染环境。
【详解】工业上可以废铜屑为原料制备硝酸铜,方法①和方法②铜单质与浓稀硝酸反应都
会生成氮氧化物气体,浪费了原料,还需后续处理,不然会污染环境;方法④用到浓硫酸,
与铜单质反应生成了二氧化硫气体,浪费原料,污染环境;最优方案是方法③,先将铜单
质氧化得到氧化铜,再与稀硝酸反应得到硝酸铜和水,没有浪费原料,也没有生成其它有
害物质。
18.(1) D 太阳能、地热能、风能、潮汐能、生物质能
(2) 减小 不变
(3)大于
(4)2∆H -∆H
2 1
【分析】(1)
1 g CH 完全反应释放15.46 kJ的热量,则1 mol CH 完全反应放出的热量为247.36 kJ,故
4 4
D项符合题意,除氢能源外的新能源太阳能、地热能、风能、潮汐能、生物质能;
(2)
加入催化剂能降低反应所需的活化能,则E 和E 都减小,催化剂不能改变反应物的总能量
1 2
和生成物的总能量之差,即反应热不改变,所以催化剂对反应热无影响;
(3)
一般活化能越大反应速率越慢,根据反应快慢,反应②的活化能大于反应③的的活化能;
(4)
根据盖斯定律,①2NH (l)+H O(l)+CO (g)=(NH )CO(aq) ∆H ②NH (l)+H O(l)
3 2 2 4 2 3 1 3 2
+CO (g)=NH HCO (aq) ∆H ,由②×2-①可得③(NH )CO(aq)+H O(l)
2 4 3 2 4 2 3 2
+CO (g)=2NH HCO (aq) ,故 ∆H=2∆H -∆H ;
2 4 3 3 2 1
19. AC AC A
【详解】1、A. 电能是依靠煤炭、风力、太阳能、水能等一级能源间接获得的能源,属于
是二级能源,故A正确;
B. 水力是自然界中以现成形式提供的能源,属于一级能源,故B错误;
C. 天然气是自然界中以现成形式提供的能源,属于一级能源,故C正确;
D. 干馏煤气是煤炭隔绝空气加强热获得的能源,属于二级能源,故D错误;
2、A.水不分解也就是物质不变化,物质不变化也就不会产生新物质氢气.故A研究方向
答案第6页,共2页不正确;
B. 水分解消耗能量,设法将太阳光聚焦,产生高温,使水分解产生氢气,故B究方向正确;
C. 寻找高效催化剂,使水分解产生氢气,但水分解是消耗能量的反应,故C究方向不正确;
D. 水分解消耗能量,寻找特殊化学物质,用于开发廉价能源,以分解水制取氢气,故D
研究方向正确;
选AC。
3、气态水的能量大于液态水,气态水变为液态水放出能量,质量相同的氢气,反应(1)放
出的热量多,故选A。
20.(1)D
(2)ABCD
【解析】(1)
化石能源有煤、石油、天然气,故不属于化石能源的是生物质能;
故选D;
(2)
A.化石能源属于不可再生能源,资源有限,只会越用越少,A正确;
B.生物质能是一种可再生能源,可以有效替代化石能源在,有广泛的前景,B正确;
C.太阳能、氢能、核能、地热能都属于新能源,C正确;
D.我国人口众多、资源相对匮乏、环境承载能力较弱,因此要建设节约型社会,增加使
用绿色能源减少化石能源使用,D正确;
故选ABCD。
21. ae 18.9 19.8 酸性氧化物与碱的反应 成本低 亚硫
酸钙在输送中容易造成管道堵塞
【分析】(1)用硫酸和亚硫酸钠制取二氧化硫,反应物是固液混合,且该反应不需要加热,
所以可以采用固液混合不加热型装置,希望能控制反应速度,则盛放硫酸的仪器必须含有
活塞而能控制液体量;(2)由硫守恒可得:NaSO ~SO ,根据关系式及二氧化硫的物质的量计算出需要亚硫酸
2 3 2
钠的质量;设没有变质的亚硫酸钠为100g,根据变质的质量计算出变质后溶液中亚硫酸钠
的质量分数,再计算出需要变质后的亚硫酸钠的质量;
(3)根据石灰-石膏法和碱法吸收二氧化硫的原理分析相同之处;利用题中已知信息及反
应原理判断石灰-石膏法的优点和缺点;
(4)将亚硫酸钠和氢氧化钙发生复分解反应生成NaOH,然后再将亚硫钙氧化得到二水硫
酸钙,这样NaOH能循环利用。
【详解】(1)用硫酸和亚硫酸钠制取SO 的试剂为固态和液态,反应条件不需加热,可通过
2
控制添加硫酸的速率来控制反应速率,结合装置可知a、e可达到目的;
(2) H SO +Na SO =Na SO +SO+H O
2 4 2 3 2 4 2 2
126g 22.4L
m 3.36L
m=18.9g
4g亚硫酸钠被氧化为硫酸钠后的质量变为4.5g,则有4.0%亚硫酸钠被氧化为硫酸钠的样品
中,亚硫酸钠的质量分数为95.5%,因此称取样品的质量为19.8g。
(3)石灰-石膏法与碱法吸收SO 都是利用SO 是酸性氧化物可与碱反应的性质来吸收SO 的;
2 2 2
利用题中已知和有关信息可知采用石灰-石膏法所用原料易得、成本低等,但因Ca(OH) 碱
2
性弱,导致吸收速率慢、效率低;
(4)依据上述流程操作存在的缺点,能实现物料循环的烟气脱硫方案
22. AC 不合理;实验对比说明浓度低的亚硫酸不能使品红褪色,葡萄酒中的
SO 含量很低,所以也不能使品红褪色 NaSO +H SO = Na SO +SO↑+H O
2 2 3 2 4 2 4 2 2
4N 酸性KMnO 2MnO —+5SO+2H O=2Mn2++5SO2—+4H+(或FeCl 溶液,SO +2Fe3+
A 4 4 2 2 4 3 2
+2H O=2Fe 2++SO2—+4H+) 红色溶液变浅或褪色(或溶液由棕黄色变为浅绿色)
2 4
【分析】(1)A.二氧具有还原性,能够被氧气氧化;
B.二氧化硫还原性较强,不能氧化细菌;
C.二氧化硫溶于水生成亚硫酸,溶液呈酸性;
答案第8页,共2页D.葡萄酒仍然是有色的,说明二氧化硫没有漂白葡萄酒;
I.(2)图1实验中,通过对比说明浓度低的亚硫酸不能使品红褪色,葡萄酒中的SO2含量
很低,所以也不能使品红褪色;
Ⅱ.(3)A中制备二氧化硫,据此写出反应方程式;B中干燥二氧化硫,C中SO2与Na2O2
反应,二氧化硫具有还原性,过氧化钠具有氧化性,所以二氧化硫与过氧化钠反应生成硫
酸钠,据此书写化学方程式;过氧化钠中O元素从-1价降低为-2价,据此计算每消耗
1molNa2O2转移的电子数;
(4)从绿色化学的角度考虑,则Z应该为无污染、无毒的氧化剂,且与二氧化硫反应不能
生成有污染的物质,则Z可以为酸性KMnO4或FeCl3溶液;
【详解】(1)二氧化硫具有较强的还原性,可以防止葡萄酒被氧化,二氧化硫的水溶液显
酸性,可以增强葡萄酒的酸性,二氧化硫有漂白性,但二氧化硫的含量很少,没有将葡萄
酒漂白,故选AC;
I.(2)1滴饱和亚硫酸溶液滴入3mL品红溶液中不褪色,而1滴品红溶液滴入3mL饱和亚
硫酸溶液中褪色,说明二氧化硫或亚硫酸的含量会影响漂白效果,干白葡萄酒不能使品红
溶液褪色,原因为:干白中二氧化硫或亚硫酸含量太少,故答案为不合理,实验对比说明
浓度低的亚硫酸不能使品红褪色,葡萄酒中的SO 含量很低,所以也不能使品红褪色;
2
实验方案二:装置A中制备二氧化硫,B装置用来干燥二氧化硫,C中为SO 与NaO 反应,
2 2 2
D中氢氧化钠溶液吸收剩余的二氧化硫,防止污染空气;E装置验证二氧化硫的还原性,F
装置验证二氧化硫为酸性气体,并吸收二氧化硫,防止污染空气。
Ⅱ.(3)关闭弹簧夹2,打开弹簧夹1,注入硫酸至浸没瓶中固体,A装置中亚硫酸钠与
浓硫酸反应放出二氧化硫,反应的方程式:NaSO +H SO =Na SO +SO↑+H O;由于过氧
2 3 2 4 2 4 2 2
化钠具有强氧化性,所以二氧化硫被干燥后与过氧化钠反应生成硫酸钠,反应的方程式为
SO +Na O=Na SO ,根据方程式可知,氧由-1价降低到-2价,所有每消耗2molNa O,转
2 2 2 2 4 2 2
移4mol电子,数目为4N ;
A
故答案为:NaSO +H SO =Na SO +SO↑+H O;4N ;
2 3 2 4 2 4 2 2 A
(4)关闭弹簧夹1后,打开弹簧夹2,残余气体进入E、F中,为了证明SO 有还原性,并
2
从绿色化学的角度考虑,则Z试剂选择酸性KMnO ,高锰酸钾具有强氧化性,被二氧化硫
4
还原褪色,发生反应的离子方程式为2MnO — +5SO +2H O = 2Mn2+ +5SO2— + 4H+(或
4 2 2 4
FeCl 溶液,SO +2 Fe3+ +2H O =2Fe 2+ + SO 2— +4H+);
3 2 2 4
故答案为:酸性KMnO ;2MnO — + 5SO +2 H O = 2Mn2+ + 5SO 2— + 4H+(或FeCl 溶液,
4 4 2 2 4 3SO +2 Fe3+ +2H O =2 Fe 2+ +SO2— + 4H+);红色溶液变浅或褪色(或溶液由棕黄色变为浅
2 2 4
绿色)。
答案第10页,共2页